微生物蛋白MCP测定方法
- 格式:doc
- 大小:41.00 KB
- 文档页数:1
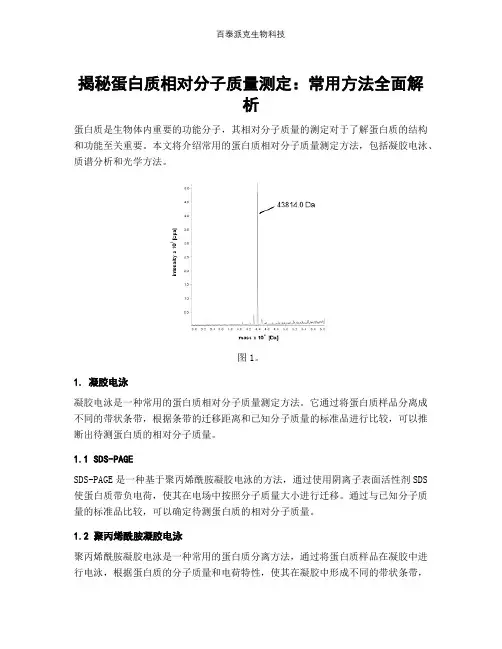
揭秘蛋白质相对分子质量测定:常用方法全面解析蛋白质是生物体内重要的功能分子,其相对分子质量的测定对于了解蛋白质的结构和功能至关重要。
本文将介绍常用的蛋白质相对分子质量测定方法,包括凝胶电泳、质谱分析和光学方法。
图1。
1. 凝胶电泳凝胶电泳是一种常用的蛋白质相对分子质量测定方法。
它通过将蛋白质样品分离成不同的带状条带,根据条带的迁移距离和已知分子质量的标准品进行比较,可以推断出待测蛋白质的相对分子质量。
1.1 SDS-PAGESDS-PAGE是一种基于聚丙烯酰胺凝胶电泳的方法,通过使用阴离子表面活性剂SDS 使蛋白质带负电荷,使其在电场中按照分子质量大小进行迁移。
通过与已知分子质量的标准品比较,可以确定待测蛋白质的相对分子质量。
1.2 聚丙烯酰胺凝胶电泳聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离方法,通过将蛋白质样品在凝胶中进行电泳,根据蛋白质的分子质量和电荷特性,使其在凝胶中形成不同的带状条带,从而推断出蛋白质的相对分子质量。
2. 质谱分析质谱分析是一种高灵敏度的蛋白质相对分子质量测定方法。
它通过将蛋白质样品离子化,并在质谱仪中进行分析,根据离子的质荷比和丰度,可以推断出蛋白质的相对分子质量。
2.1 MALDI-TOF质谱MALDI-TOF质谱是一种常用的质谱分析方法,它通过将蛋白质样品与基质混合后,通过激光脱附离子化,然后通过飞行时间质谱仪进行分析。
根据离子的质荷比和丰度,可以推断出蛋白质的相对分子质量。
2.2 ESI-MS质谱ESI-MS质谱是一种常用的质谱分析方法,它通过将蛋白质样品在电喷雾离子源中离子化,然后通过质谱仪进行分析。
根据离子的质荷比和丰度,可以推断出蛋白质的相对分子质量。
3. 光学方法光学方法是一种非常便捷的蛋白质相对分子质量测定方法。
它通过测量蛋白质在特定波长下的吸光度,根据比色法或比浊法,可以推断出蛋白质的相对分子质量。
3.1 比色法比色法是一种常用的光学方法,通过测量蛋白质在特定波长下的吸光度,根据已知浓度的标准品和比色曲线,可以推断出待测蛋白质的相对分子质量。

测定蛋白质含量的方法有凯氏定氮法、双缩脲法、考马斯亮蓝法等。
1、凯氏定氮法:准备4个50mL凯氏烧瓶并标号,向1、2号烧瓶中加入定量的蛋白质样品,另外两个烧瓶作为对照,在每个烧瓶中加入硫酸钾-硫酸铜混合物,再加入浓硫酸,将4个烧瓶放到消化架上进行消化,之后进行蒸馏。
全部蒸馏完毕后用标准盐酸滴定各烧瓶中收集的氨量,直至指示剂混合液由绿色变回淡紫红色,即为滴定终点,结算出蛋白质含量。
2、双缩脲法:是一种用于鉴定蛋白质的分析方法。
双缩脲试剂呈蓝色,是一种碱性含铜测试溶液,它由几滴1%硫酸铜,1%氢氧化钾和酒石酸钾钠制成。
3、考马斯亮蓝法:基本原理是基于蛋白质可以与考马斯亮蓝G-250定量结合。

常见蛋白检测方法常见蛋白检测方法的新表述引言:蛋白质是细胞内最重要的生物大分子之一,它们在调控细胞功能和生物过程中扮演着关键的角色。
因此,准确地检测和定量蛋白质对于研究生物学和医学领域的科学家和医生来说至关重要。
在过去的几十年里,有许多蛋白质检测方法被广泛使用,但是随着技术的发展和创新,我们现在可以提出一些新的表述和方法来更好地满足研究的需求。
一、免疫测定法的新变革传统的免疫测定法如酶联免疫吸附法(ELISA)已经被广泛应用于蛋白质检测中。
然而,这些方法存在一些局限性,例如需要复杂的实验步骤、较长的操作时间和高成本。
在这方面,新兴的技术例如单分子荧光扩增技术(SuperNova)和荧光标记纳米颗粒技术(NanoFlare)等提供了一种更灵敏和快速的替代方案。
这些方法利用了纳米颗粒、荧光信号放大以及高通量技术,极大地提高了蛋白质检测的灵敏度和准确性。
二、质谱分析的创新应用质谱分析是一种重要的蛋白质检测方法,通过测量蛋白质片段的质荷比来鉴定和定量蛋白质。
随着技术的进步,质谱分析在检测上的应用也在不断创新。
例如,代谢组学质谱分析可以通过测量细胞或生物体液中的代谢物来评估蛋白质的功能和代谢网络。
此外,新兴的方法如并行反应监测技术(PRM)和靶向代谢组学(TMA)也可以提供更高的检测速度和准确度。
三、蛋白质芯片技术的发展蛋白质芯片技术是一种高通量蛋白质检测方法,通过将蛋白质固定在芯片上,实现对数百个甚至数千个蛋白质的同时检测。
这个领域的最新发展是将蛋白质芯片与质谱分析相结合,从而实现了高通量的蛋白质定量和鉴定。
这种技术的优势在于能够同时检测多个蛋白质,并提供高度准确的结果。
结论:随着技术的不断发展,我们现在可以提出一些新的表述和方法来改进蛋白质检测。
新兴的技术如SuperNova、NanoFlare、代谢组学质谱分析、PRM、TMA以及蛋白质芯片技术的发展,提供了更加灵敏、准确和快速的蛋白质检测方法。
这些新方法的应用将有助于我们更全面、深入地理解蛋白质的功能和其在生物过程中的作用。

上海笃玛生物科技有限公司本试剂盒只能用于科学研究,不得用于医学诊断人(Human)单核细胞趋化蛋白1(MCP-1)ELISA 检测试剂盒使用说明书检测原理试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。
往预先包被单核细胞趋化蛋白1(MCP-1)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。
用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的单核细胞趋化蛋白1(MCP-1)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),计算样品浓度。
样品收集、处理及保存方法1.血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。
2.血浆:EDTA、柠檬酸盐或肝素抗凝。
3000转离心30分钟取上清。
3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。
4.组织匀浆:将组织加入适量生理盐水捣碎。
3000转离心10分钟取上清。
5.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。
自备物品1.酶标仪(450nm)2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL3.37℃恒温箱操作注意事项1.试剂盒保存在2-8℃,使用前室温平衡20分钟。
从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。
2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。
3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。
4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。
上海笃玛生物科技有限公司5.所有液体组分使用前充分摇匀。
试剂盒组成名称96孔配置48孔配置备注微孔酶标板12孔×8条12孔×4条无标准品0.3mL*6管0.3mL*6管无样本稀释液6mL 3mL 无检测抗体-HRP 10mL 5mL 无20×洗涤缓冲液25mL 15mL 按说明书进行稀释底物A 6mL 3mL 无底物B 6mL 3mL 无终止液6mL 3mL 无封板膜2张2张无说明书1份1份无自封袋1个1个无注:标准品(S0-S5)浓度依次为:0、20、40、80、160、320pg/mL试剂的准备20×洗涤缓冲液的稀释:蒸馏水按1:20稀释,即1份的20×洗涤缓冲液加19份的蒸馏水。


蛋白质的定量测定——微量凯氏定氮法(microKjeldahlmethod) 生物材料的含氮量测定在生物化学研究中具有一定的意义,如蛋白质的含氮量约为16%,测出含氮量则可推知蛋白含量。
生物材料总氮量的测定,通常采用微量凯氏定氮法。
凯氏定氮法由于具有测定准确度高,可测定各种不同形态样品等两大优点,因而被公认为是测定食品、饲料、种子、生物制品、药品中蛋白质含量的标准分析方法.实验原理生物材料的含氮量测定在生物化学研究中具有一定的意义,如蛋白质的含氮量约为16%,测出含氮量则可推知蛋白含量。
生物材料总氮量的测定,通常采用微量凯氏定氮法。
凯氏定氮法由于具有测定准确度高,可测定各种不同形态样品等两大优点,因而被公认为是测定食品、饲料、种子、生物制品、药品中蛋白质含量的标准分析方法。
其原理如下:1.消化:有机物与浓硫酸供热,使有机氮全部转化为无机氮——硫酸铵。
为加快反应,添加硫酸铜和硫酸钾的混合物;前者为催化剂,后者可提高硫酸沸点。
这一步约需30min至1h,视样品的性质而定。
2.加碱蒸馏:硫酸铵与NaOH(浓)作用生成(NH4)OH,加热后生成NH3,通过蒸馏导入过量酸中和生成NH4Cl而被吸收。
3.滴定:用过量标准HCl吸收NH3,剩余的酸可用标准NaOH滴定,由所用HCl摩尔数减去滴定耗去的NaOH摩尔数,即为被吸收的NH3摩尔数。
此法为回滴法,采用甲基红卫指示剂。
HCl+NaOHNaCl+H2O本法适用于0.2~2.0mg的氮量测定。
1.热源2.烧瓶3.玻璃管4.橡皮管5.玻璃杯6.棒状玻塞7.反应室8.反应室外壳9.夹子10.反应室中插管11.冷凝管12.锥形瓶13.石棉网微量凯氏蒸馏装置示意图试剂和器材一、试剂浓硫酸;30%过氧化氢溶液;10M氢氧化钠;0.01M的标准盐酸;标准硫酸铵(0.3mg氮/mL)催化剂:硫酸铜:硫酸钾=1:4混合,研细。
指示剂:0.1%甲基红乙醇溶液。
二、测试样品牛血清白蛋白。

3.1.1 蛋白质含量第一法紫外吸收法(见EPO)用4g/L的碳酸氢铵溶液将供试品稀释至0.5~2mg/ml,作为供试品溶液。
以4g/L的碳酸氢铵溶液作为可被,测定供试品溶液在320nm、325nm、330nm、335nm、340nm、345nm 和350nm的吸光度。
用读出的吸光度的对数与其对应波长的对数作直线回归,求得回归方程。
紫外-可见分光光度法,在波长276~280nm处,测定供试品的溶液最大吸光度A max,将A max对应波长代入回归方程,求得供试品溶液由于光散射产生的吸光度A光散色。
计算供试品蛋白质含量,应不低于0.5mg/ml。
蛋白质含量(mg/ml)=(A max -A光散色)/ 7.43 x 供试品稀释倍数x 10。
1.仪器的校正和鉴定1)波长允许误差:紫外光区±1nm,500nm附近±2nm2)吸光度的准确度可用重铬酸钾的硫酸溶液检定。
3)杂散光碘化钠、亚硝酸钠2.测定法,1)对照品比较法(c x)= (A x/A R) c R,其中c x为供试品浓度;A x 为供试品溶液的吸光度c R为对照品浓度;A R为对照品溶液的吸光度。
2)吸收系数法通常吸收系数大于1003)计算分光光度法4)比色法第二法Lowry法本法用于微量蛋白质的含量測定。
蛋白质在碱性溶液中可形成铜-蛋白质复合物,此复合物加入酚试剂后,产生蓝色化合物,该蓝色化合物在波长650nm处的吸光度与蛋白质含量成正比,根据供试品的吸光度,计算供试品的蛋白质含量。
试剂1〉酚试剂称取钨酸钠(Na2WO4·2H2O)100g、钼酸钠(Na2MnO4·2H2O)25g,置1500ml蒸馏瓶中,加入700ml水、85%磷酸50ml、盐酸100ml,上连回流管(使用木塞或锡纸包裹的橡皮塞)微沸回流10小时。
取下回流管,加入硫酸锂150g 、水50ml、溴液几滴,煮沸约15分钟,驱除过量的溴,冷却,加水至1000ml,过滤,为酚试剂贮备液。

蛋白浓度测定的方法蛋白质是生物体内的重要物质,对于许多实验室研究和临床诊断都有着重要的意义。
因此,准确测定蛋白质的浓度是非常关键的。
目前,常用的蛋白质浓度测定方法主要有生物学素法、分光光度法、BCA法、Lowry法、Bradford法和尿素法等。
下面将分别介绍这些方法的原理和操作过程。
1.生物学素法:生物学素法是一种通过测定蛋白质与棒状素之间的结合来确定蛋白质浓度的方法。
这种方法主要应用于血浆、血清和尿液等样品的蛋白质测定。
实验方法如下:a.准备一组具有不同浓度的棒状素溶液。
b.将待测蛋白质溶液与棒状素一起孵育一段时间。
c.通过酸甲醛试剂对母液进行反应,并测量光密度。
d.制作标准曲线,并根据待测样品的光密度与标准曲线的关系计算蛋白质浓度。
2.分光光度法:分光光度法是一种通过测定蛋白质对特定波长的紫外光吸收量来计算浓度的方法。
这种方法适用于纯度较高的蛋白质样品。
实验方法如下:a. 准备一组蛋白质标准溶液,并使用光度计测量其在280nm波长处的吸光度。
b.将待测蛋白质样品的吸光度值与标准溶液的吸光度值进行比较,并计算浓度。
3.BCA法:BCA法是一种通过测定蛋白质与巴氏试剂之间的反应产生的紫色络合物的吸光度来计算蛋白质浓度的方法。
该方法对于各种类型的蛋白质样品都适用。
实验方法如下:a.准备一组蛋白质标准溶液,并加入BCA试剂。
b.将待测蛋白质样品与BCA试剂孵育一段时间。
c.使用光度计测量吸光度,并通过标准曲线计算浓度。
4. Lowry法:Lowry法是一种经典的蛋白质浓度测定方法,通过低里试剂和碱式铜试液与蛋白质样品反应,产生紫色或蓝色化合物,并通过比色计测量光密度来计算蛋白质浓度。
实验方法如下:a.准备一组蛋白质标准溶液,并加入低里试剂和碱式铜试液。
b.将待测蛋白质样品与低里试剂和碱式铜试液反应一段时间。
c.使用比色计测量吸光度,并通过标准曲线计算浓度。
5. Bradford法:Bradford法是一种快速、敏感且广泛应用的蛋白质浓度测定方法,通过考虑到蛋白质在酸性溶液中与染料试剂环氧化苏丹蓝的特异性作用来计算浓度。

蛋白质的定量测定——微量凯氏定氮法(microKjeldahlmethod) 生物材料的含氮量测定在生物化学研究中具有一定的意义,如蛋白质的含氮量约为16%,测出含氮量则可推知蛋白含量。
生物材料总氮量的测定,通常采用微量凯氏定氮法。
凯氏定氮法由于具有测定准确度高,可测定各种不同形态样品等两大优点,因而被公认为是测定食品、饲料、种子、生物制品、药品中蛋白质含量的标准分析方法.实验原理生物材料的含氮量测定在生物化学研究中具有一定的意义,如蛋白质的含氮量约为16%,测出含氮量则可推知蛋白含量。
生物材料总氮量的测定,通常采用微量凯氏定氮法。
凯氏定氮法由于具有测定准确度高,可测定各种不同形态样品等两大优点,因而被公认为是测定食品、饲料、种子、生物制品、药品中蛋白质含量的标准分析方法。
其原理如下:1.消化:有机物与浓硫酸供热,使有机氮全部转化为无机氮——硫酸铵。
为加快反应,添加硫酸铜和硫酸钾的混合物;前者为催化剂,后者可提高硫酸沸点。
这一步约需30min至1h,视样品的性质而定。
2.加碱蒸馏:硫酸铵与NaOH(浓)作用生成(NH4)OH,加热后生成NH3,通过蒸馏导入过量酸中和生成NH4Cl而被吸收。
3.滴定:用过量标准HCl吸收NH3,剩余的酸可用标准NaOH滴定,由所用HCl摩尔数减去滴定耗去的NaOH摩尔数,即为被吸收的NH3摩尔数。
此法为回滴法,采用甲基红卫指示剂。
HCl+NaOHNaCl+H2O本法适用于0.2~2.0mg的氮量测定。
1.热源2.烧瓶3.玻璃管4.橡皮管5.玻璃杯6.棒状玻塞7.反应室8.反应室外壳9.夹子10.反应室中插管11.冷凝管12.锥形瓶13.石棉网微量凯氏蒸馏装置示意图试剂和器材一、试剂浓硫酸;30%过氧化氢溶液;10M氢氧化钠;0.01M的标准盐酸;标准硫酸铵(0.3mg氮/mL)催化剂:硫酸铜:硫酸钾=1:4混合,研细。
指示剂:0.1%甲基红乙醇溶液。
二、测试样品牛血清白蛋白。

大口黑鲈溃疡综合征病毒MCP基因序列分析及PCR快速检测方法的建立马冬梅;白俊杰;邓国成;李胜杰;叶星;江小燕【摘要】为了早期快速诊断近年来流行于广东省养殖大口黑鲈(Micropterus salmoides)中的病毒性溃疡综合征,本研究用基因组步移的方法获得了大口黑鲈溃疡综合征病毒(Largemouth bass ulcerative syndrome virus,LBUSV)主要衣壳蛋白(MCP)基因,该基因编码区全长1392bp.通过序列比较分析,在MCP基因内确定了一段241bp的特异性较强的片段作为靶序列,设计并合成引物,经过优化PCR反应条件,建立了可以快速检测大口黑鲈溃疡综合征病毒的PCR方法.实验表明,在PCR进行到30个循环反应时可以榆测到的质粒最小浓度是104拷贝数/Μl,相当于104个病毒粒子.利用该方法,从天然感染LBUSV的大口黑鲈脾脏组织DNA可扩增出241bp的片段,而健康大口黑鲈和感染了传染性脾肾坏死病毒样病毒的大口黑鲈脾脏组织则没有扩增条带.本研究建立的PCR检测方法具有检测快速、成本低、准确性高的特点,适用于大范围早期病害诊断的推广应用.【期刊名称】《中国水产科学》【年(卷),期】2010(017)006【总页数】8页(P1149-1156)【关键词】大口黑鲈溃疡综合症病毒;大口黑鲈;虹彩病毒;主要衣壳蛋白;序列分析;PCR检测【作者】马冬梅;白俊杰;邓国成;李胜杰;叶星;江小燕【作者单位】中国水产科学研究院,珠江水产研究所,中国水产科学研究院热带亚热带鱼类选育与养殖重点开放实验室,广东,广州,510380;中国水产科学研究院,珠江水产研究所,中国水产科学研究院热带亚热带鱼类选育与养殖重点开放实验室,广东,广州,510380;中国水产科学研究院,珠江水产研究所,中国水产科学研究院热带亚热带鱼类选育与养殖重点开放实验室,广东,广州,510380;中国水产科学研究院,珠江水产研究所,中国水产科学研究院热带亚热带鱼类选育与养殖重点开放实验室,广东,广州,510380;中国水产科学研究院,珠江水产研究所,中国水产科学研究院热带亚热带鱼类选育与养殖重点开放实验室,广东,广州,510380;中国水产科学研究院,珠江水产研究所,中国水产科学研究院热带亚热带鱼类选育与养殖重点开放实验室,广东,广州,510380【正文语种】中文【中图分类】S94大口黑鲈(Micropterus salmoides), 俗名加州鲈, 具有生长快、耐低温、肉质鲜美和容易起捕等特点, 从 20世纪 70年代开始推广到世界各地, 中国目前大口黑鲈的年产量约为10万t[1-2]。

微生物常见检测方法大全微生物的检测,无论在理论研究还是在生产实践中都具有重要的意义。
常见的检测方法有:生长量测定法、微生物计数法、生理指标法和商业化快速微生物检测等。
微生物生长意味着原生质含量的增加,所以测定的方法也都直接或间接的以次为根据,而测定繁殖则都要建立在计数这一基础上。
微生物生长的衡量,可以从其重量,体积,密度,浓度,做指标来进行衡量。
生长量测定法1、体积测量法:又称测菌丝浓度法。
原理:通过测定一定体积培养液中所含菌丝的量来反映微生物的生长状况。
菌丝浓度测定法是大规模工业发酵生产上微生物生长的一个重要监测指标。
这种方法比较粗放,简便,快速,但需要设定一致的处理条件,否则偏差很大,由于离心沉淀物中夹杂有一些固体营养物,结果会有一定偏差。
2、称干重法:原理:利用离心或过滤法测定。
一般干重为湿重的10-20%。
称干重发法较为烦琐,通常获取的微生物产品为菌体时,常采用这种方法,如活性干酵母(activity dry yeast, ADY),一些以微生物菌体为活性物质的饲料和肥料。
3、比浊法:原理:微生物的生长引起培养物混浊度的增高。
通过紫外分光光度计测定一定波长下的吸光值,判断微生物的生长状况。
该法主要用于发酵工业菌体生长监测。
4、菌丝长度测量法:方法:对于丝状真菌和一些放线菌,可以在培养基上测定一定时间内菌丝生长的长度。
微生物计数法1、血球计数板法:这种方法简便,直观,快捷,但只适宜于单细胞状态的微生物或丝状微生物所产生的孢子进行计数,并且所得结果是包括死细胞在内的总菌数。
2、染色计数法:为了弥补一些微生物在油镜下不易观察计数,而直接用血球计数板法又无法区分死细胞和活细胞的不足,人们发明了染色计数法。
3、比例计数法:将已知颗粒(如霉菌孢子或红细胞)浓度的液体与一待测细胞浓度的菌液按一定比例均匀混合,在显微镜视野中数出各自的数目,即可得未知菌液的细胞浓度。
4、液体稀释法:对未知菌样做连续十倍系列稀释,根据估计数,从最适宜的三个连续的10倍稀释液中各取5毫升试样,接种1毫升到3组共15只装培养液的试管中,经培养后记录每个稀释度出现生长的试管数,然后查最大或然数表MPN(most probably number)得出菌样的含菌数,根据样品稀释倍数计算出活菌含量。
人单核细胞趋化蛋白-1(MCP-1)ELISA试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中人单核细胞趋化蛋白-1(MCP-1)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人单核细胞趋化蛋白-1(MCP-1)水平。
用纯化的人单核细胞趋化蛋白-1(MCP-1)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入单核细胞趋化蛋白-1(MCP-1)再与HRP标记的单核细胞趋化蛋白-1(MCP-1)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的单核细胞趋化蛋白-1(MCP-1)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人单核细胞趋化蛋白-1(MCP-1)浓度。
样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
生理实验方法总结酶提取液制备称取干净叶片0.5g于预冷研钵中,加2ml的提取介质﹙PH7.8的50 mmol·L-1磷酸缓冲液﹚,充分研磨后,加提取介质冲洗钵体,并使最终体积为5ml,6000rpm离心30min,上清液即为提取液。
供SOD、CAT、POD、MDA和蛋白质含量测定。
1、叶片相对含水量:先求叶片鲜重Wf,然后将叶片浸入蒸馏水中数小时(要48h左右叶片质量才不会增加),使叶片吸水成饱和状态。
取出用吸水纸吸取表面的水分,立即放入已知重量的称瓶中称重,再放入蒸馏水中一段时间后取出吸干外面水分,再称重,直至重量不再增加为止。
此时即为叶片吸水饱和时的重量Wt,再将样品烘干,求得组织干重Wd,即得相对含水量=(Wf-Wd)/(Wt-Wd)×100%注:Wf——叶片鲜重(g);Wd——叶片干重(g);Wt——叶片饱水重(g)。
2、比叶重:单位面积的叶片的干重,避开主脉。
3、相对电导率:取大小相当的植物叶片(尽量保证叶片的完整性,少含茎节),用自来水洗净后再用蒸馏水冲洗3次,用滤纸吸干表面水分,将叶片剪成适宜长度的长条(避开主脉),快速称取鲜样3份,每份0.1g,分别置于10ml去离子水的刻度试管中,盖上玻璃塞置于室温下浸泡处理12h.用电导仪测定浸提液电导(R1),然后沸水浴加热30min,冷却至室温后摇匀,再次测定浸提液电导(R2).相对电导率=R1/R2!100% 4、叶绿素含量:将采回的样叶快速洗净擦干,去中脉,称取0.1g,加10ml95%的乙醇,在黑暗中泡45h(直到叶片发白)。
于721分光光度计测定在波长D470nm、645nm 和663nm下的光密度(OD值),按照Arnon公式,计算出每克叶片的叶绿素a,b和叶绿素总的含量:叶绿素a(mg/g鲜重)=(12.7D663-2.69D645)*[V/(1000*W)]叶绿素b(mg/g鲜重)=(22.9D645-4.63D663)*[V/(1000*W)]叶绿素总含量(mg/g鲜重)=(20.2D645+8.2D663)*[V/(1000*W)]类胡萝卜素含量(mg/g鲜重)=(1000D470-2.05Ca-114.8Cb)/245式中:D---光密度读数V---叶绿素提取液总体积(10ml)W---所用叶片鲜重(g)5、MDA含量的测定:用硫代巴比妥酸法:取干净试管,加入酶提取液1mL,然后再加入3ml10%的TCA和1ml 0.6%的TBA,摇匀,混合液在95℃水浴中保温30min,迅速冷却后,4000rpm下离心10min,取上清液分别于600nm,532nm,450nm波长下测定吸光度值。
MCP测定方法(修改)1.试剂: 1) 0.25N的NaOH溶液==0.25mol/LNaOH==40g/mol×0.25mol/L==10g/L2) 0.1mg/mL的牛血清蛋白(BSA)3) 考马斯亮蓝溶液(G250,95%乙醇,85%磷酸溶液,双蒸水)2.考马斯亮蓝的配制:100 mg考马斯亮蓝G250,溶于50 mL95%乙醇(保证充分溶解)然后加入100 mL85%磷酸溶液(w/v)(浓磷酸),最后用双蒸水定容到1 L过滤后使用,4℃避光保存,保质期为1周。
(看准是G250还是R250)3.步骤:1. 样品解冻2. 涡旋振荡45 s-1 min,将微生物和食糜分离3. 取2.0 ml混合液,4℃离心1,000-800 rpm,8 min,4. 吸取上清液1 mL于1.5 mL离心管中,13,000转,4℃离心20 min5. 弃上清,底物中加入1 mL 0.25 N NaOH混匀后吸取到10mL离心管中(重复三次),6. 100℃水浴10 min7. 吸取1mL液体样品于4℃离心13,000转,35 min8. 吸取上清液500 uL于10 mL离心管中,加入5 mL考马斯亮蓝,混匀(上清液要稀释,否则读数超出标准曲线的范围,稀释方式比如500 ul=60 + 440 ul H2O。
)10. 于波长595 nm处用722分光光度计比色11. 比色杯用95%乙醇洗净,再用水洗3次4.制作标准曲线:1、从-20℃取出0.1 mg / mLBSA,室温融化后,备用2、取21个10 mL离心管,3个一组,分别标记为0 ug,2.5 ug,5.0 ug,10.0 ug,20 ug,40ug,50 ug。
3、按下表在各管中加入各种试剂5、混匀后,室温放置2 min.在生物分光光度计(Bio-Photometer, Eppendoff) 上比色(595 nm)分析。
蛋白质含量的测定方法实验原理:蛋白质含量测定法,是生物化学研究中最常用、最基本的分析方法之一。
目前常用的有四种古老的经典方法,即定氮法、双缩尿法(Biuret 法)、Folin-酚试剂法(Lowry法)和紫外吸收法。
另外还有一种近十年才普遍使用起来的新的测定法,即考马斯亮蓝法(Bradford法)。
其中Bradford法和Lowry法灵敏度最高,比紫外吸收法灵敏10~20倍,比Biuret法灵敏100倍以上。
定氮法虽然比较复杂,但较准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。
值得注意的是,这后四种方法并不能在任何条件下适用于任何形式的蛋白质,因为一种蛋白质溶液用这四种方法测定,有可能得出四种不同的结果。
每种测定法都不是完美无缺的,都有其优缺点。
在选择方法时应考虑:①实验对测定所要求的灵敏度和精确度;②蛋白质的性质;③溶液中存在的干扰物质;④测定所要花费的时间。
考马斯亮蓝法(Bradford法),由于其突出的优点,正得到越来越广泛的应用。
一、微量凯氏(Kjeldahl)定氮法样品与浓硫酸共热。
含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。
经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。
若以甘氨酸为例,其反应式如下:CH2COOH-NH2+3H2SO4=2CO2+3SO2+4H2O+NH3 (1)2NH3+H2SO4=(NH4)2SO4(2)(NH4)2SO4+2NaOH=2H2O+Na2SO4+2NH3(3)反应(1)、(2)在凯氏瓶内完成,反应(3)在凯氏蒸馏装置中进行。
为了加速消化,可以加入CuSO4作催化剂,K2SO4以提高溶液的沸点。
收集氨可用硼酸溶液,滴定则用强酸。
实验和计算方法这里从略。
计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白氮即得。
如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。
微量蛋白测定方法
一、微量蛋白测定方法
1.仪器介绍
微量蛋白测定方法是指利用特定仪器进行微量蛋白测定的方法。
通常,利用光度法、比色法、电泳法、放射免疫法等来测定微量蛋白的含量。
2.原理
微量蛋白的测定是指测定微量蛋白含量的一种方法。
这一方法利用特殊的仪器,如光度计、比色计、电泳仪等,根据样品中微量蛋白的吸光度、比色值或电泳形态来测定其含量。
3.程序
(1)准备:准备好各种仪器、试剂、样品等;
(2)操作:根据实验方法和步骤,运用仪器进行微量蛋白测定;
(3)计算:根据测定的数据,计算微量蛋白的含量;
(4)记录:将测定结果记录在实验报告上。
4.注意事项
(1)根据实验方法和步骤进行操作,避免实验过程中的错误;
(2)注意实验环境,要保持室温恒定;
(3)计算前应核对计算参数的准确性;
(4)记录结果时要精确,以免出现偏差。
MC—ELISA表面涂抹法定量计数大肠菌群颓防医学情报杂志1998革南18卷第4期由咿水镱磷Me彦幻而捕衰3四川居民人均日摄入汞量'比较根据本次监测我省六类食品汞的含量.参考1992年全国营养调查四川城乡人口的每人每日六类主要食糖的消费量-估算我省居民每人每日从六类食品中汞的平均摄八量为6,44/.~g,低于1992年全国六大娄食品中居民凡均日摄入汞量7.25pg和WHO规定的每人每日允许摄入量43pg的水平,但高于日本1989年调查居民人均日摄人汞量4.06.a8的水平,表明我省六类食品汞污染状况与发选国家相比仍有一定差距.夸后应继续加强食街中录音量的监渊工作,以便进一步观察我省食物中汞污染的最新水平及其捕长趋势.并为政府棚订公众健康和贸易决策提供依据.(收蕾,l99卜一l2一l6)2.3四门l居民^均日摄^量的估计及与国内外水平(责任簟辑t廖冬}I责任控对I 事田云)一,刍MC---ELISA表面涂抹法定量计数大肠菌群.粜琦l俞树葛插波R粜琦l俞树葛插波l¨一在水质厦食品加工中.大腑茸群的出现是请清后和加工后(巴氏消毒)污染的一十有用的指示菌.本文试用MC--ELISA裹面棘抹仕同步定性定量益嚣承质,食品等标本中的戈腑苗群..现报告鲰下.1材辩与方法1.1材1.1.1菌株致病性大脑轩薏'A他,44155--9.购自北京静种保存中心),盹j眨克雷伯氏苗,弗劳地氏枸替酸杆菌,产气扦苗,阴掏杆菌(ATCC,聃自福建省骑疫站细菌科),变形杆菌<~TCC.49103,卫生都药品检定所),绿脓杆菌,大骺杆菌,痢疾杆苗,鼠伤寒杆菌(本室保存1.1.2生物试剂r1.12.}'鼠抗大脑菌群混合血清的1啪备..用无菌生理盐水分剐从昔通琼脂平板上洗下肺炎克雷伯氏苗,弗劳地氏拘替酸杆苗,致病性大脑杆*皇篇为江苏省科羹9122瞥助嘈目部分工作I福建压科大学基础擞免室(辐州350004)菌,普通六肠杆菌,明掏杆菌,产气扦茸的蓉苔,配制成}黾台菌{瞳,加人2.5的甲醛进行灭菌.特无菌生长时,取此混合苗液稀释至5O亿/ml的浓度免疫&m,c小鼠.4周后,将小鼠斯疆取血,l析出血清, ~ooorpm1分.离心19分钟.经饱和硫馥诬沉淀,透析脱盐岳,用DEAE纤维素(DE矗)层析过桂.再用纳氏试剂涓定并收集IgG.加人仉0lNaN,,经与伤寒杆菌,痢疾杆葛等做变X啜牧后用试管鼍集反宜澍定该血清与大脑菌群混台苗藏的凝象效价为1- 10240.再经蔗糖淮缩至40ml.经紫外分光光度仪测定抗血精中蛋白含量为22~g/m1.分装小安瓿.豫冻干爆..--20"C保存备用.1.1.2,2蕊谴致病性大蝻艾希氏售诊断血滑(o…B?.卫生部成都生物翻品所)fHRP一羊抗鼠IgG,DAB糟荆(Sigma公司产品);DAB麝暂印用型,链霉菌抗生物素蛋白一过氯化爵试荆z盒(S~-kh,MAXIM BIOTECH,INC,U.S.A).2方法将各试验菌的内汤培养物经麦氏比浊或经751一紫外分光光度仪(波长540rim.氘灯)测量选用菌藏浓度为10CFU/ml进行实验.1.2.1MC.ELISA表面撩抹法.1.2.2常规国家标准检验法.2结果2.1定性试验暑1.1.1鼠抗大脑菌群多价血清特异性试验选用大腑菌群中的代表菌(Ecoli.EPEC,拘棒蘸杆菌,克香怕氏菌,阴沟杆菌,变形杆菌)作为试验苗,用非大肠菌群的l细菌(伤寒杆菌,痢戎杆菌)作为对照曹,同时在醋奸赓上进行l攮营落培葬后用鼠抗大肠菌群多价血清进行ELISA法染色.重复谈实验l5次.结果显示:大肠菌群徽菌落的阳性着色率为87.经检验,纯化后的鼠抗大肠菌群多价血清有高度特异性(P<o.OOS)而杂菌即对照菌对于该特异性反应的干扰性甚徽(P>O.OS)2.2定量试验.2.2.1徽菌毒计妯西{击检验相关性求迁将普通大肠肝菌,致病性大腑杆菌,枸撩酸杆菌,胡内柠~营,产白c杆菌,克雷伯氏杆菌分别接种子3ml内饧申. 37c,24小日于振荡培葬后,攻日将各甚按麦氏比浊管露成1.5×l0.(CFUtm1)菌藏,分别定量啜各菌液腥合,擅撼台菌藏的细菌浓度达9×IOIC_..FU/ml一再用n5毒菌Ns配戚不的组菌浓度.分别周国标法和蠢蕾藩法定量测定其中的大脑菌群敦.对其效据经对敦(计数/ml+10)变换后进行相差分析,得t直线回归方程一L麝Y58+0.:241gX,(r=0.776?P<0.005).2.2.2MC--ELISA法可否代替Plate{击的求证用两种方法同时检测不同浓度混合苗藏中的大肠苗群值.双盲计效}再将徽苗落的计数值代入直线回归方程.隶出目标法的预测值,将此预测值与国标法所测得的实际值相比较(表1).3讨论'3.1由于本实验中徽菌落计数与国标法检验的直线相关系数较低,r=0.776,为了确保实验的可靠性,本JPreMedInf.Nov.1998,V o1.14,No.4实验室进行了Mc—EusA法可否代替国标{击的求征.即将不同样车经MC--ELISA法测得的数据分别先代入直线回归方程中,求出Y值,即通过该方程求出国标法的预计值.然后再将该值和样本经国标法检验所铡出的实铡值相比较.采用配对t检验.得P>0.20.因此,凡经Mc—ELIsA法检测的标本,在报告时可先将徽菌落值代入直线回归方程中便可求出国标法的预计值.所以报告方式嵌然可以用MPN值来表示.从而证明MC--ELISA法可以替代国标法.表1国标法预测值与实铡值的比较(CFU/m1)经配对t检验.l=0.144.P>0.2O.说明徽菌落计效后经回归直线方程推算的国标法预测值与国标_法实测值羌明显差异.3.2本实验申之所以采用大肠苗群中每个类型的l株葺作为代表.制备免疫血清.是基于它们均有晒道杆菌共同抗原(EEC).获得的血清通过层析过柱后与交夏菌反复暖收均分别达26~31次.井经在醋纤膜上实验证实其特异性稳定后方才用于正式试验.3.3众所周知,经典.发酵法耗时(3~5无),耗力,耗财.现国内外均在寻找各种快捷便利准确的方法取而代之.MC--ELISA表面撩抹法是将酶标抗体的高度特异性和斑点ELISA的精细灵敏度相结合,再利用徽曹落生长的快速性将标本定量均匀辣布于醋纤膜上.既克服了上述各种缺点又清除了样品抽滤或点样后的边缘效应.整个试验只需8一l8小时,见一块直径6cm的琼脂平板上可同时贴4-5张膜,抗体用量亦甚徽.(收蔫l998一o3—02)(责任墒辑廖冬棒责任校对t李国云)。
MCP测定方法(修改)
1.试剂: 1) 0.25N的NaOH溶液==0.25mol/LNaOH==40g/mol×0.25mol/L==10g/L
2) 0.1mg/mL的牛血清蛋白(BSA)
3) 考马斯亮蓝溶液(G250,95%乙醇,85%磷酸溶液,双蒸水)
2.考马斯亮蓝的配制:
100 mg考马斯亮蓝G250,溶于50 mL95%乙醇(保证充分溶解)
然后加入100 mL85%磷酸溶液(w/v)(浓磷酸),最后用双蒸水定容到1 L
过滤后使用,4℃避光保存,保质期为1周。
(看准是G250还是R250)
3.步骤:
1. 样品解冻
2. 涡旋振荡45 s-1 min,将微生物和食糜分离
3. 取3.0 ml混合液,4℃离心1,000-800 rpm,8 min,
4. 吸取上清液1 mL于1.5 mL离心管中,13,000转,4℃离心20 min
5. 弃上清,底物中加入1 mL 0.25 N NaOH混匀后吸取到7mL或者10mL离心管中(重复三次),
6. 100℃水浴10 min
7. 吸取1mL液体样品于4℃离心13,000转,35 min
8. 吸取上清液500 uL于7 mL离心管中,加入5 mL考马斯亮蓝,混匀
(上清液要稀释,否则读数超出标准曲线的范围,稀释方式比如500 ul=60 + 440 ul H2O。
)
10. 于波长595 nm处用722分光光度计比色
11. 比色杯用95%乙醇洗净,再用水洗3次
4.制作标准曲线:
1、从-20℃取出0.1 mg / mLBSA,室温融化后,备用
2、取21个7 mL离心管,3个一组,分别标记为0 ug,2.5 ug,5.0 ug,10.0 ug,20 ug,40 ug,
50 ug。
3、按下表在各管中加入各种试剂
5、混匀后,室温放置2 min.
在生物分光光度计(Bio-Photometer, Eppendoff) 上比色(595 nm)分析。