实验琼脂糖凝胶电泳的原理和方法
- 格式:ppt
- 大小:1.90 MB
- 文档页数:45

DNA的琼脂糖凝胶电泳实验原理和操作步骤DNA的琼脂糖凝胶电泳是一种常用的分子生物学技术,用于分析DNA 的大小和纯度,以及进行DNA分子的分离和纯化。
凝胶电泳实验可以帮助我们确定DNA样本的大小和获得纯化的DNA片段供进一步研究使用。
下面是DNA琼脂糖凝胶电泳实验的原理和操作步骤。
【原理】DNA琼脂糖凝胶电泳是根据DNA分子在电场中的不同迁移速率来分离大小不同的DNA片段。
琼脂糖凝胶是一种凝胶状物质,其孔隙大小能够将DNA分子限制在一定范围内,较大的DNA分子迁移速率较慢,而较小的DNA分子迁移速率较快。
琼脂糖凝胶通常是在平均浓度为1%至2%之间的范围内制备,以便在不同大小的DNA分子之间提供适当的分辨率。
实验中,DNA样品通过切割酶或PCR等方法获得,样品经过核酸电泳缓冲液稀释,并在琼脂糖凝胶板上进行电泳。
凝胶板两侧连接电源,DNA 的带电粒子将在电场的作用下从负极迁移到正极,迁移过程中形成DNA的“条带”,条带的位置和长度反映了DNA的大小。
通常,DNA条带由荧光染料或核酸染料标记,以便在电泳结束后进行可视化。
【操作步骤】以下是DNA琼脂糖凝胶电泳实验的一般操作步骤:1.制备琼脂糖凝胶板:a.准备琼脂糖粉末和核酸电泳缓冲液(通常为TAE或TBE缓冲液)。
b.按照说明书将琼脂糖粉末溶解于核酸电泳缓冲液中。
c.将溶液加热至沸腾并搅拌,使琼脂糖完全溶解。
d.将溶液倒入预先准备好的电泳仓中,插入梳子或制备好的孔板,使其凝固。
2.样品制备:a.提取DNA样品并测定其浓度。
b. 将DNA样品稀释到适当浓度,通常为10-50 ng/μL。
c. 添加适当的加载缓冲液,通常是一些染料和甘胺酸(glycine)或其他添加剂。
3.DNA加载和电泳:a.打开琼脂糖凝胶仓盖,将DNA样品负载于凝胶孔内。
b.将DNA负载区域和样品标注在电泳仓中,以便在电泳结束后可以准确识别DNA带。
c.关闭盖子,将电泳仓放入电泳设备中。
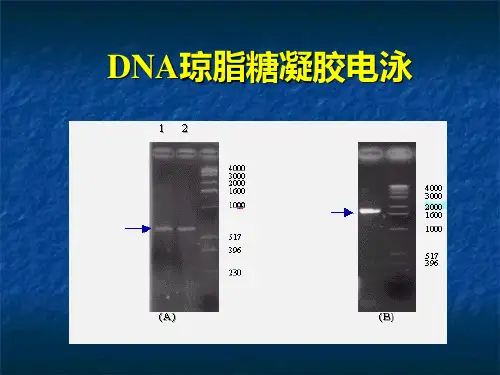

琼脂糖凝胶电泳实验原理和实验方法琼脂糖凝胶电泳实验原理和实验方法[实验原理]电泳是现在用于分离和纯化DNA片段的最常用技术。
包含电解质的多孔支持介质----“胶”并把它置于静电场中。
则DNA分子将向阳极移动,这是因为DNA分子沿其双螺旋骨架两侧带有含负电荷的磷酸根残基。
当DNA长度增加时,来自电场的驱动力和来自凝胶的阻力之间的比率就会降低,不同长度的DNA片段就会表现出不同的迁移率。
因而就可依据DNA分子的大小来使其分离。
该过程通过把示踪染料(Purple Loading Dye)或分子量标准参照物(Ladder)和样品(DNA&RNA)一起进行电泳而得到检测。
分子量标准参照物也可以提供一个用于确定DNA片段大小的标准。
琼脂糖凝胶适用于分离大小在0.2-50Kb范围内的DNA片段。
[实验用品]1.琼脂糖 1.0%1.0g琼脂糖+100ml电泳缓冲液(TAE),微波炉中火30秒至沸腾,熔化的琼脂物冷却至60℃时可加入10mg/ml溴化乙锭10μl,充分混匀,将温热的凝胶倒入已置好梳子(鉴定胶用细密点的梳子;回收胶用粗稀的梳子)的胶膜中在室温下放置30-45min后现进行电泳。
1.5%:琼脂糖1.5g。
2.电泳缓冲液50×TAE Tris 乙酸 Tris 242g 终2 mol/L乙酸57.1ml 终1mol/L0.5M EDTA200ml pH8.0 终100mmol/LdH2O 补足至1000ml使用时稀释1×TAE。
5×TBE Tris 硼酸 Tris 54g 终445mmol/L硼酸27.5g 终445mmol/L0.5M EDTA20ml pH8.0 终10mmol/LdH2O 补足至1000ml使用时稀释10倍成0.5倍如50ml贮存液+450ml水→500ml工作液。
[实验内容与方法]1.移取适量的琼脂糖(如制备1%的琼脂糖胶液就移1g的琼脂糖溶于100ml TAE缓冲液中)微波炉加热使其溶于TAE缓冲液中。


实验琼脂糖凝胶电泳的原理和方法实验琼脂糖凝胶电泳(Agarose gel electrophoresis)是一种常用的分离DNA和RNA分子的技术。
它基于琼脂糖凝胶电泳原理,利用琼脂糖凝胶的孔隙大小和电泳电场的力对DNA和RNA分子进行分离。
琼脂糖是一种高分子多糖,当加热溶解后冷却凝固时,形成一个多孔的凝胶网络。
这个凝胶网络中的孔隙大小是可以调控的,通过改变琼脂糖的浓度可以得到不同孔隙大小的凝胶。
1.制备琼脂糖凝胶:按照实验需要,称取适量琼脂糖加入缓冲液中,搅拌使其溶解,然后加热至溶解。
等溶液冷却至约50℃时,在一个电泳板间夹两块玻璃片或塑料片,将琼脂糖凝胶溶液倒入电泳板中,并将梳子插入凝胶中,让凝胶固化。
2.样品制备:将要检测的DNA或RNA分子提取和纯化,并用缓冲液稀释合适浓度。
添加适量的DNA荧光染料或核酸染色剂,使其在紫外光下可见。
3.样品加载:将样品加入琼脂糖凝胶的凝胶孔口中,注意不要将样品推到凝胶中。
4.电泳分离:将凝胶板放入电泳槽中,加入适量缓冲液,注意保证电泳液中缓冲液位置高于凝胶。
然后将负极电极和正极电极分别连接到电泳槽的两端,开启电源,施加适当电压使DNA或RNA分子在电场力的作用下进行电泳分离。
5.染色和可视化:电泳结束后,取出凝胶板,并用染色剂对DNA或RNA分子进行染色。
染色剂与DNA或RNA结合后,用紫外光照射凝胶,通过相应设备观察凝胶上的条带形成。
实验琼脂糖凝胶电泳的原理是基于DNA和RNA分子在电场下按照大小进行分离的特性。
在电场作用下,DNA或RNA分子荷负性被引向正极(阴极)方向移动。
琼脂糖凝胶的孔隙大小可以根据需要调控,大分子难以通过,小分子易于通过。
因此,DNA或RNA分子根据其大小不同,通过孔隙大小的限制,从而形成条带,完成了对DNA或RNA的分离。



一、实验目的琼脂糖凝胶电泳是常用的检测核酸的方法,学习DNA琼脂糖凝胶电泳的使用技术,掌握有关的技术和识读电泳图谱的方法.二、实验原理琼脂糖凝胶电泳是常用的用于分离、鉴定DNA、RNA分子混合物的方法,这种电泳方法以琼脂凝胶作为支持物,利用DNA分子在泳动时的电荷效应和分子筛效应,达到分离混合物的目的。
DNA分子在高于其等电点的溶液中带负电,在电场中向阳极移动。
在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应,即分子本身的大小和构型是主要的影响因素。
DNA分子的迁移速度与其相对分子量成反比。
不同构型的DNA分子的迁移速度不同。
如环形DNA分子样品,其中有三种构型的分子:共价闭合环状的超螺旋分子(cccDNA)、开环分子(ocDNA)、和线形DNA分子(IDNA).这三种不同构型分子进行电泳时的迁移速度大小顺序为:cccDNA>IDNA>ocDNA核酸分子是两性解离分子,pH3。
5是碱基上的氨基解离,而三个磷酸基团中只有一个磷酸解离,所以分子带正电,在电场中向负极泳动;而pH8。
0-8。
3时,碱基几乎不解离,而磷酸基团解离,所以核酸分子带负电,在电场中向正极泳动.不同的核酸分子的电荷密度大致相同,因此对泳动速度影响不大.在中性或碱性时,单链DNA与等长的双链DNA的泳动率大致相同。
影响核酸分子泳动率的因素主要是:1、样品的物理性状即分子的大小、电荷数、颗粒形状和空间构型。
一般而言,电荷密度愈大,泳动率越大。
但是不同核酸分子的电荷密度大致相同,所以对泳动率的影响不明显。
对线形分子来说,分子量的常用对数与泳动率成反比,用此标准样品电泳并测定其泳动率,然后进行DNA分子长度(bp)的负对数——泳动距离作标准曲线图,可以用于测定未知分子的长度大小。
DNA分子的空间构型对泳动率的影响很大,比如质粒分子,泳动率的大小顺序为:cDNA>I DNA>ocDNA但是由于琼脂糖浓度、电场强度、离子强度和溴化乙锭等的影响,会出现相反的情况.2、支持物介质核酸电泳通常使用琼脂糖凝胶和聚丙烯酰胺凝胶两种介质,琼脂糖是一种聚合链线性分子.含有不同浓度的琼脂糖的凝胶构成的分子筛的网孔大小不同,是于分离不同浓度范围的核酸分子。

实验二琼脂糖凝胶电泳实验【实验目的】(1)学习琼脂糖凝胶电泳的基本原理;(2)掌握使用水平式电泳仪的方法;(3)学习在含有甲醛的凝胶上进行RNA电泳的方法。
【实验原理】琼脂糖凝胶电泳是基因工程实验室中分离鉴定核酸的常规方法。
核酸是两性电解质,其等电点为pH2-2.5,在常规的电泳缓冲液中(pH约8.5),核酸分子带负电荷,在电场中向正极移动。
核酸分子在琼脂糖凝胶中泳动时,具有电荷效应和分子筛效应,但主要为分子筛效应。
因此,核酸分子的迁移率由下列几种因素决定:(1)DNA的分子大小。
线状双链DNA分子在一定浓度琼脂糖凝胶中的迁移速率与DNA分子量对数成反比,分子越大则所受阻力越大,也越难于在凝胶孔隙中移动,因而迁移得越慢。
(2)DNA分子的构象。
当DNA分子处于不同构象时,它在电场中移动距离不仅和分子量有关,还和它本身构象有关。
相同分子量的线状、开环和超螺旋质粒DNA在琼脂糖凝胶中移动的速度是不一样的,超螺旋DNA移动得最快,而开环状DNA移动最慢。
如在电泳鉴定质粒纯度时发现凝胶上有数条DNA带难以确定是质粒DNA不同构象引起还是因为含有其他DNA引起时,可从琼脂糖凝胶上将DNA带逐个回收,用同一种限制性内切酶分别水解,然后电泳,如在凝胶上出现相同的DNA图谱,则为同一种DNA。
(3)电源电压。
在低电压时,线状DNA片段的迁移速率与所加电压成正比。
但是随着电场强度的增加,不同分子量的DNA片段的迁移率将以不同的幅度增长,片段越大,因场强升高引起的迁移率升高幅度也越大,因此电压增加,琼脂糖凝胶的有效分离范围将缩小。
要使大于2kb 的DNA 片段的分辨率达到最大,所加电压不得超过5v/cm。
(4)离子强度影响。
电泳缓冲液的组成及其离子强度影响DNA的电泳迁移率。
在没有离子存在时(如误用蒸馏水配制凝胶),电导率最小,DNA几乎不移动;在高离子强度的缓冲液中(如误加10×电泳缓冲液),则电导很高并明显产热,严重时会引起凝胶熔化或DNA变性。

琼脂糖凝胶电泳琼脂糖凝胶电泳是一种凝胶电泳方法,用于生物化学、分子生物学、遗传学和临床化学,以分离琼脂糖基质中的大分子混合群,例如DNA、RNA 或蛋白质。
琼脂糖是从海藻中提取的天然线性聚合物,当在缓冲液中加热并冷却时,通过氢键形成凝胶基质。
它们是分离中、大型核酸最常用的介质,分离范围广。
琼脂糖凝胶电泳实验常用以DNA 切胶回收,DNA 分离和用于佐证DNA 是否重组、质粒等是否切开。
今天我们就来聊聊琼脂糖凝胶电泳实验的一些小技巧小细节。
第一步:胶液的制备称取0.4g 琼脂糖,置于200ml 锥形瓶中,加入50ml 0.5×TBE 稀释缓冲液,放入微波炉里加热,直到琼脂糖全部熔化,取出摇匀,此为0.8%琼脂糖凝胶液。
总液体量不宜超过锥瓶的50%容量。
否则会溢出来的。
毛博就吃过这个亏。
还要擦洗微波炉。
加热过程中要不时摇动,使附于瓶壁上的琼脂糖颗粒进入溶液。
加热时应盖上封口膜,以减少水份蒸发。
第二步:胶板的制备倒胶时的温度不可太低,否则凝固不均匀。
东一块西一块的。
果冻做出来就不好看啦。
速度也不可太快,否则容易出现气泡。
果冻做出来里面都是气泡。
怎么吃呀?待胶完全凝固后拨出梳子,注意不要损伤梳底部的凝胶。
第三步:加样注意上样时要小心操作,避免损坏凝胶或将样品槽底部凝胶刺穿。
果冻下面被戳个窟窿,还怎么吃呀?第四步:电泳加完样后,合上电泳槽盖,立即接通电源。
控制电压保持在60-80V,电流在40mA 以上。
当溴酚蓝条带移动到距凝胶前沿约2cm 时,停止电泳。
第五步:染色未加EB 的胶板在电泳完毕后移入0.5μg/ml 的EB 溶液中,室温下染色20-25 分钟。
第六步:观察和拍照在波长为254nm 的长波长紫外灯下观察染色后的或已加有EB的电泳胶板。
DNA 存在处显示出肉眼可辨的桔红色荧光条带。
紫光灯下观察时应戴上防护眼镜或有机玻璃面罩,以免损伤眼睛。
除这些细节之外,还有一些注意事项:1. 酶切时所加的DNA 溶液体积不能太大,否则DNA 溶液中其他成分会干扰酶反应。

DNA琼脂糖凝胶电泳介绍DNA琼脂糖凝胶电泳是一种常用的生物技术实验方法,用于分离DNA分子并确定其大小。
它基于DNA分子的电荷和大小不同,通过应用电场使DNA分子在琼脂糖凝胶中迁移,从而实现分离。
原理DNA琼脂糖凝胶电泳的基本原理是:DNA分子带负电荷,当置于电场中后,电场将使DNA分子向正电极移动。
然而,DNA分子在琼脂糖凝胶中的迁移速度取决于它的大小。
较长的DNA分子由于受阻力较大,迁移速度较慢,而较短的DNA分子迁移速度较快。
因此,琼脂糖凝胶电泳可以将DNA分子根据大小进行分离。
实验步骤1. 样品处理将待测DNA样品与凝胶电泳缓冲溶液混合,并加入负荷样品的染料来增加样品的重量和使其可见。
一般使用表现著名的溴化乙锭(Ethidium Bromide)来染色DNA分子。
2. 准备琼脂糖凝胶制备琼脂糖凝胶液,并根据实验需要将其倒入电泳槽中,并形成一个凝胶。
此过程需要使用琼脂糖凝胶制备缓冲液,一般为Tris–醋酸–EDTA缓冲液,简称TAE缓冲液。
3. 样品加载使用微量吸管或特殊的样品加载微孔将样品加载到琼脂糖凝胶上。
每个微孔能够承载一定量的样品,因此要根据样品的数量进行安排。
通常还会在凝胶上加载一个DNA分子大小标记(Marker)作为参考,以便确定未知样品的大小。
4. 电泳将凝胶放入电泳槽中,并将正负电极接入电源。
通过给定的电流和时间来进行电泳实验。
电流的选择取决于琼脂糖凝胶的密度和样品的大小范围。
5. 可视化和分析凝胶电泳完成后,通过紫外线照射或荧光成像系统来观察结果。
DNA分子在凝胶上能够与染料结合产生发光,从而可在琼脂糖凝胶上看到DNA分子的大小分布。
通过与已知DNA分子大小标记的对比,可以确定未知样品DNA分子的大小。
应用领域1. 分子生物学在分子生物学研究中,DNA琼脂糖凝胶电泳是一种常用的手段。
它可以用于检测DNA分子的大小、评估PCR反应的效果、验证基因敲除和插入等分子操作的成功性等。
DNA琼脂糖凝胶电泳实验原理及超详细步骤实验原理:琼脂糖凝胶电泳是利用DNA分子的电荷和大小差异来分离DNA分子的一种方法。
DNA分子在电场作用下,会向阳极移动,移动速度与DNA分子的大小呈反比。
琼脂糖凝胶是一种聚合物,可以形成一种网络结构,在凝胶中进行电泳分离。
DNA分子在凝胶孔隙中相互碰撞,分子大小不同的DNA分子会在不同的速度下向阳极移动,从而实现了DNA分子的分离。
实验步骤:1.实验前的准备:a.制备琼脂糖凝胶:取一定量的琼脂糖粉末加入缓冲液中,加热溶解后冷却至大约50℃左右,倒入琼脂糖凝胶板中,插入梳子,待凝固。
b.缓冲液的制备:根据需要准备TAE缓冲液或TBE缓冲液。
2.DNA样品制备:a.将待测DNA样品加入试管中,用适当的缓冲液稀释样品。
b.使用嵌入剂将DNA样品加入琼脂糖凝胶中,通常将样品加入凝胶中的槽道。
3.凝胶电泳操作:a.将琼脂糖凝胶板放入电泳槽中,加入足够的缓冲液,使凝胶完全浸泡在缓冲液中。
b.将阴极和阳极电极连接到电泳槽中。
c.将样品和一些DNA分子大小标准物质分别加入凝胶中,用以测量DNA的大小。
d.打开电源,设定电流和电压,并进行电泳分离。
4.凝胶染色和成像:a.完成电泳分离后,关闭电源,取出琼脂糖凝胶板。
b.将琼脂糖凝胶板放入DNA染色剂中,染色一段时间后,取出凝胶板。
c.在紫外灯下观察琼脂糖凝胶板,可以看到DNA分子的条带。
5.数据分析:a.使用图像分析软件或标尺对琼脂糖凝胶板上的DNA条带进行测量,得到DNA分子的大小。
b.根据标准物质的条带大小,将待测DNA分子的大小与标准物质进行对比,计算DNA分子的大小。
c.根据DNA条带的强度和大小,可以估算DNA的浓度。
需要注意的是,具体的实验步骤可能因实验设备和试剂的不同而有所差异,所以在进行实验之前最好仔细阅读实验操作手册,并参考实验室老师或资深研究人员的指导。
琼脂糖凝胶电泳技术的原理和方法一、原理:琼脂糖凝胶电泳是一种常用的分离和分析生物大分子的方法。
其原理是利用琼脂糖凝胶作为固定相,通过电场作用将待分离物质在凝胶中进行分离。
琼脂糖凝胶是一种具有多孔结构的凝胶介质,可以根据待分离物质的尺寸和电荷特性进行分离。
二、方法:1. 准备琼脂糖凝胶:首先,按照所需的凝胶浓度和体积配制琼脂糖溶液。
然后,在琼脂糖溶液中加入缓冲液,并搅拌均匀。
将混合液倒入凝胶板中,待其凝固后,准备好使用的琼脂糖凝胶。
2. 样品制备:将待分离的样品进行处理,如蛋白质样品可以经过蛋白质提取和纯化步骤,DNA样品可以进行酶切等处理。
3. 样品加载:将处理好的样品加载到琼脂糖凝胶中。
可以使用样品井或样品孔进行加载,确保每个样品均匀地加载到凝胶中。
4. 电泳条件设置:根据待分离物质的特性和需求,设置适当的电泳条件。
包括电场强度、电泳时间和缓冲液pH值等。
5. 电泳分离:将凝胶板放入电泳槽中,连接电源,进行电泳分离。
在电场的作用下,待分离物质会在凝胶中进行迁移,根据其尺寸和电荷特性进行分离。
6. 结果分析:电泳结束后,可以通过染色等方法观察凝胶板上的带状图案。
根据不同的染色方法,可以观察到不同的待分离物质,如蛋白质带、DNA带等。
三、应用:琼脂糖凝胶电泳技术在生物科学研究中具有广泛的应用。
其中,常见的应用有以下几个方面:1. 蛋白质分离与鉴定:可以通过琼脂糖凝胶电泳技术对蛋白质进行分离和鉴定。
蛋白质在电泳过程中根据其分子量的不同而分离成多个带状条带,通过染色或Western blotting等方法可以对目标蛋白质进行定性或定量分析。
2. DNA分析:琼脂糖凝胶电泳技术在DNA分析中也有重要应用。
可以通过电泳分离来检测DNA片段的长度和纯度,如测序片段、PCR产物等。
3. RNA分析:琼脂糖凝胶电泳技术也可以用于RNA的分析。
通过电泳分离可以检测RNA的大小、纯度和相对含量等。
4. 蛋白质-核酸相互作用研究:通过琼脂糖凝胶电泳技术,可以研究蛋白质与核酸之间的相互作用。
DNA的琼脂糖凝胶电泳实验原理和方法步骤脂糖凝胶泳是用于分别、定和提DNA 片段的准方法。
脂糖是从脂中提取的一种多糖,具水性,但不荷,是一种很好的泳支持物。
DNA 在碱性条件下〔pH8 0 的冲液〕荷,在中通凝胶介向正极移,不同样 DNA 分子片段由于分子和构型不同样,在中的泳速率液不同样。
溴化乙〔 EB〕可嵌入 DNA分子碱基形成光合物,紫外照射后,可分出不同样的区,到达分别、定分子量,重子的目的。
⋯一、实验目的学习和掌握琼脂糖电泳法判断DNA 的原理和方法。
二、实验原理琼脂糖凝胶电泳是用于分别、判断和提纯DNA 片段的标准方法。
琼脂糖是从琼脂中提取的一种多糖,具亲水性,但不带电荷,是一种很好的电泳支持物。
DNA 在碱性条件下〔的缓冲液〕带负电荷,在电场中经过凝胶介质向正极搬动,不同样DNA 分子片段由于分子和构型不同样,在电场中的泳动速率液不同样。
溴化乙锭〔EB〕可嵌入 DNA 分子碱基对间形成荧光络合物,经紫外线照射后,可分出不同样的区带,到达分别、判断分子量,精选重组子的目的。
三、实验资料实验 14 提取的 DNA 样品,四、器具及药品电泳仪,电泳槽,紫外透射反射仪,恒温水浴锅,微波炉,微量进样器,三羟甲基氨基甲烷,盐酸,醋酸钠, EDTA,琼脂糖,溴酚蓝,溴化乙锭。
五、实验步骤1、安装电泳槽将有机玻璃的电泳凝胶床洗净,晾干,用胶带将两端的张口封好,放在水平的工作台上,插上样品梳。
2、琼脂糖凝胶的制备称取琼脂糖溶解在电泳缓冲液中,〔按的琼脂糖含量,1-25kb 大小的 DNA 用1%的凝胶,20-100kb 的 DNA 用%的凝胶, 200-2000bp 的 DNA 用 %的凝胶〕置微波炉或沸水浴中加热至完好溶化〔不要加热至沸腾〕,取出摇匀。
3、灌胶将冷却到60℃的琼脂糖溶液轻轻倒入电泳槽水平板上。
4、待琼脂糖胶凝固后,在电泳槽内参加电泳缓冲液,尔后拔出梳子。
5、加样将 DNA 样品与加样缓冲液〔 loading buffer 〕按 4: 1 混匀后,用微量移液器将混杂液加到样品槽中,每槽加 10-20μl,记录样品的点样次序和加样量。
实验三琼脂糖凝胶电泳一、实验原理琼脂糖凝胶电泳是分离和纯化DNA 片段的常用技术。
把DNA样品加入到一块包含电解质的多孔支持介质(琼脂糖凝胶)的样品孔中,并置于静电场上。
由于DNA分子的双螺旋骨架两侧带有含负电荷的磷酸根残基,因此在电场中向正极移动。
在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应。
具有不同的相对分子质量的DNA片段泳动速度不一样,因而可依据DNA分子的大小来使其分离。
凝胶电泳不仅可分离不同分子质量的DNA,也可以分离相对分子质量相同,而构型不同的DNA分子。
在电泳过程中可以通过示踪染料或相对分子质量标准参照物和样品一起进行电泳而得到检测。
相对分子质量标准参照物相对可以提供一个用于确定DNA片段大小的标准。
在凝胶中加入少量溴化乙锭(ethidium bromide, EB),其分子可插入DNA的碱基之间,形成一种络合物,在254~365nm波长紫外光照射下,呈桔红色荧光,因此也可对分离的DNA 进行检测。
一般琼脂糖凝胶电泳适用于大小在0.2kb~50kb范围内的DNA片段。
本实验介绍琼脂糖凝胶的制备以及琼脂糖凝胶电泳在DNA片段分离中的应用方法。
二、仪器及试剂1.仪器及耗材:水平电泳槽、电泳仪、凝胶成像分析系统、微波炉、微量移液器、透明胶带、点样板或parafilm、100 ml或250 ml锥形瓶、量筒、吸头等。
2.试剂及配制:50×TAE缓冲液的配制:2 mol/L Tris-乙酸,0.05 mol/L EDTA(pH8.0)配制1000 mlTris 242 g冰乙酸 57.1 ml0.5 mol/L EDTA 100 ml加入600 ml去离子水后搅拌溶解,将溶液定容至1 L后。
高温高压灭菌,室温保存。
琼脂糖凝胶电泳的原理和关键操作一、原理琼脂糖凝胶电泳是一种常用的生物分子分离和分析技术。
其原理基于琼脂糖凝胶的特性和电泳的原理。
琼脂糖是一种多糖类物质,具有高分子量和黏性。
在电泳过程中,琼脂糖凝胶能够形成一种网状结构,通过这种结构可以筛选分离不同大小和电荷的生物分子。
琼脂糖凝胶电泳是在一定浓度的琼脂糖溶液中进行的。
琼脂糖溶液被加热并冷却后形成凝胶。
凝胶中的孔隙大小与琼脂糖的浓度有关,浓度越高,孔隙越小。
在电泳过程中,样品被加载到琼脂糖凝胶中的孔隙中。
然后,在电场的作用下,样品中的带电分子会向电极方向移动。
由于琼脂糖凝胶的筛选作用,分子的迁移速度将与其大小和电荷有关。
大分子迁移速度较慢,小分子迁移速度较快。
二、关键操作1. 准备琼脂糖凝胶:将适量的琼脂糖加入缓冲液中,加热溶解后冷却形成凝胶。
凝胶的浓度应根据分离物的大小来选择,一般可选用0.5-2%的琼脂糖。
2. 加载样品:将待分析的生物样品加入琼脂糖凝胶中的孔隙中。
可以使用微量吸管或微量注射器等工具,尽量避免产生气泡。
3. 设置电场:将琼脂糖凝胶放置在电泳槽中,并加入适量的缓冲液。
然后,将电泳槽连接到电源上,设置适当的电压和电流。
4. 进行电泳:打开电源,开始进行电泳。
根据需要,可以选择常规电泳或脉冲电泳等不同的电泳方式。
5. 分析结果:根据分子的大小和电荷,不同的分子将在琼脂糖凝胶中以不同的速度迁移。
经过一定时间后,可以停止电泳,取出琼脂糖凝胶进行染色或进一步分析。
通过琼脂糖凝胶电泳,可以实现DNA、RNA、蛋白质等生物分子的分离和定量分析。
在实验室中,琼脂糖凝胶电泳被广泛应用于基因测序、蛋白质分析、病毒检测等领域。
总结:琼脂糖凝胶电泳是一种基于琼脂糖凝胶和电泳原理的生物分子分离和分析技术。
关键操作包括准备琼脂糖凝胶、加载样品、设置电场、进行电泳和分析结果。
该技术在生物学研究和临床诊断中具有重要的应用价值。