9. 3 平衡蒸馏和简单蒸馏
- 格式:doc
- 大小:422.50 KB
- 文档页数:4

化工原理陈敏恒第三版上册答案【篇一:化工原理答案第三版思考题陈敏恒】lass=txt>传质是体系中由于物质浓度不均匀而发生的质量转移过程。
3.在传质理论中有代表性的三个模型分别为双膜理论、溶质渗透理论、表面更新理论。
5. 根据双膜理论两相间的传质阻力主要集中在相界面两侧的液膜和气膜中,增加气液两相主体的湍流程度,传质速率将增大。
8、操作中精馏塔,保持f,q,xf,d不变,(1)若采用回流比r小于最小回流比rmin,则xd减小,xw增大(2)若r增大,则xd增大, xw减小 ,l/v增大。
9、连续精馏塔操作时,增大塔釜蒸汽用量,而回流量及进料状态f,xf,q不变,则l/v变小,xd变小,xw变小。
10、精馏塔设计时采用的参数f,q,xf,d,xd,r均为定值,若降低塔顶回流液的温度,则塔内实际下降液体量增大,塔内实际上升蒸汽量增大,精馏段液汽比增大,所需理论板数减小。
11、某精馏塔的设计任务:原料为f,xf,要求塔顶为xd,塔底为xw,设计时若已定的塔釜上升蒸汽量v’不变,加料热状况由原来的饱和蒸汽改为饱和液体加料,则所需理论板数nt 增加,精馏段上升蒸汽量v 减少,精馏段下降液体量l 减少,提馏段下降液体量l’ 不变。
(增加、不变、减少)不变,增大xf,,则:d 12、操作中的精馏塔,保持f,q,xd,xw,v’,变大,r变小,l/v变小(变大、变小、不变、不确定)1.何种情况下一般选择萃取分离而不选用蒸馏分离?萃取原理: 原理利用某溶质在互不相溶的溶剂中的溶解度利用某溶质在互不相溶的溶剂中的溶解度互不相溶的溶剂中的不同,用一种溶剂(溶解度大的)不同,用一种溶剂(溶解度大的)把溶质从另一种溶剂(溶解度小的)中提取出来,从另一种溶剂(溶解度小的)中提取出来,再用分液将它们分离开来。
分液将它们分离开来再用分液将它们分离开来。
萃取适用于微溶的物质跟溶剂分离,蒸馏原理:利用互溶的液体混合物中各组分的沸点不同,利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再给液体混合物加热,冷凝成液体,从而达到分离提纯的目的。

平衡蒸馏的特点
平衡蒸馏,也被称为闪蒸,是一种单级蒸馏操作。
当在单极釜内进行平衡蒸馏时,釜内液体混合物被部分汽化,并使气相与液相处于平衡状态,然后将汽液两相分开。
这种操作既可以间歇又可以连续方式进行。
以下是平衡蒸馏的一些主要特点:
1. 稳态过程:平衡蒸馏是一个稳定、连续的过程。
在操作过程中,塔顶和塔釜的组成不会随时间发生变化。
2. 气液平衡:在平衡蒸馏中,气液两相处于平衡状态,即两相温度相同,组成互为平衡。
这意味着,无论在塔顶还是塔釜,气液两相的组成都会保持不变。
3. 生产能力大:平衡蒸馏由于其连续稳定的特点,具有较大的生产能力。
4. 不能得到高纯产物:由于其分离效果相对较弱,平衡蒸馏通常不能用于得到高纯度的产物。
它常用于只需粗略分离的物料,如在石油炼制及石油裂解分离的过程中,多组分溶液的平衡蒸馏是常见的应用场景。
5. 应用广泛:除了在石油工业中的应用,平衡蒸馏还广泛应用于其他领域,如化学工业、食品工业等,用于各种物料的分离和提纯。
总的来说,平衡蒸馏是一种高效、稳定的分离技术,适用于需要大量粗略分离的情况。
如需更多信息,建议查阅化学工程书籍或咨询化学工程专家。


《化工原理》简答题:1-9.伯努利方程的应用条件是什么?答:伯努利方程的应用条件是:(1)理想流体;(2)重力场;(3)不可压缩;(4)定态流动;1-12.层流与湍流的本质区别是什么?对圆形直管内的流体流动,当2000<Re<4000时,其流动类型是什么?答:(1)两种流型的本质区别在于:层流时,流体质点作直线运动,即流体分层流动,层次分明,彼此互不混杂;湍流时,流体在总体上是沿管道轴向流动,同时,还在各个方向作随机的脉动。
(2)当2000<Re<4000时,其流动类型可能是层流,也可能是湍流,两者必居其一;即不是层流,就是湍流。
1-13.雷诺数的物理意义是什么?答:物理意义是它表征了流动流体惯性力与粘性力之比。
2-5.影响离心泵特性曲线的主要因素有哪些?答:主要影响因素有:(1)液体粘度:泵厂提供的特性曲线是用常温清水测定的,实际输送的液体粘度与清水粘度差别不大时可直接采用,若差别大时需重新测定;(2)转速:泵厂提供的特性曲线是在一定的转速下测定的,如转速变化不大(≤±20%)时,可依照流量与转速成正比换算,差别大时需要重新测定。
2-6.离心泵的工作点是如何确定的?有哪些调节流量的方法?各有何优缺点?答:(1)离心泵的工作点,是指管路中泵的实际工作情况(流量、压头)。
是由管路特性和泵的特性共同决定的,这两个特性曲线的交点即为泵的工作点。
(2)流量调节方法:a、改变管路的特性:在泵出口管路上安装调节阀,改变阀门开度即改变管路阻力系数,进而改变了管路特性曲线。
这种方法操作简单、灵活,对于调节幅度不大当需时常改变流量时尤为适用。
缺点是在阀门关小时,管路阻力损失增加,泵的工作效率降低。
b、改变泵的特性曲线:常见的是改变泵的转速。
这种方法可使泵保持在高效率区工作,能量损失小,但只能在小范围内改变流量,对于非蒸汽机驱动的泵,改变转速操作不便c、泵的组合操作:当需要大幅度增加流量或压头时,可考虑并联(大幅度增加流量)或串联(大幅度增加压头)。


4.什么是传质简要说明传质有哪些方式传质是体系中由于物质浓度不均匀而发生的质量转移过程。
3.在传质理论中有代表性的三个模型分别为双膜理论、溶质渗透理论、表面更新理论。
5. 根据双膜理论两相间的传质阻力主要集中在相界面两侧的液膜和气膜中,增加气液两相主体的湍流程度,传质速率将增大。
8、操作中精馏塔,保持F,q,xF,D不变,(1)若采用回流比R小于最小回流比Rmin,则x D减小,xW增大(2)若R增大,则xD增大, xW减小 ,L/V增大。
9、连续精馏塔操作时,增大塔釜蒸汽用量,而回流量及进料状态F,xF,q不变,则L/V变小,xD变小,xW变小。
10、精馏塔设计时采用的参数F,q,xF,D,xD,R均为定值,若降低塔顶回流液的温度,则塔内实际下降液体量增大,塔内实际上升蒸汽量增大,精馏段液汽比增大,所需理论板数减小。
11、某精馏塔的设计任务:原料为F,xF,要求塔顶为xD,塔底为xW,设计时若已定的塔釜上升蒸汽量V’不变,加料热状况由原来的饱和蒸汽改为饱和液体加料,则所需理论板数N T 增加,精馏段上升蒸汽量V 减少,精馏段下降液体量L 减少,提馏段下降液体量L’不变。
(增加、不变、减少)12、操作中的精馏塔,保持F,q,xD,xW,V’,不变,增大xF,,则:D变大,R变小,L/V变小(变大、变小、不变、不确定)1.何种情况下一般选择萃取分离而不选用蒸馏分离萃取原理: 原理利用某溶质在互不相溶的溶剂中的溶解度利用某溶质在互不相溶的溶剂中的溶解度互不相溶的溶剂中的不同,用一种溶剂(溶解度大的)不同,用一种溶剂(溶解度大的)把溶质从另一种溶剂(溶解度小的)中提取出来,从另一种溶剂(溶解度小的)中提取出来,再用分液将它们分离开来。
分液将它们分离开来再用分液将它们分离开来。
萃取适用于微溶的物质跟溶剂分离,蒸馏原理:利用互溶的液体混合物中各组分的沸点不同,利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再给液体混合物加热,冷凝成液体,从而达到分离提纯的目的。


第9章 精馏 典型例题例1:逐板法求理论板的基本思想有一常压连续操作的精馏塔用来分离苯-甲苯混合液,塔顶设有一平衡分凝器,自塔顶逸出的蒸汽经分凝器后,液相摩尔数为汽相摩尔数的二倍,所得液相全部在泡点下回流于塔,所得汽相经全凝器冷凝后作为产品。
已知产品中含苯0.95(摩尔分率),苯对甲苯的相对挥发度可取为2.5 。
试计算从塔顶向下数第二块理论板的上升蒸汽组成。
解: 884.095.05.15.295.05.115.20000=⨯-=→=+=x x x x y DR=L/D=2905.03/95.0884.0323/95.032:11=+⨯=+=+y x y n n 精馏段方程845.03/95.0793.032793.0905.05.15.2905.05.15.22111=+⨯==⨯-=-=y y y x例2:板数较少塔的操作型计算拟用一 3 块理论板的(含塔釜)的精馏塔分离含苯50%(摩尔分率,下同)的苯-氯苯混合物。
处理量F=100 Kmol/h ,要求 D=45 Kmol/h 且 x D >84%。
若精馏条件为:回流比R=1 ,泡点进料,加料位置在第二块理论板,α=4.10 ,问能否完成上述分离任务? 解:W=55kmol/h精馏段操作线方程:y n+1=0.5x n +0.42提馏段的操作线方程:Fq D R Wx x F q D R qFRD y w )1()1()1()1(--+---++=将相关数据代入得提馏段操作线方程:134.061.1-=x y 逐板计算:y 1=x D =0.84y 2=0.5×0.56+0.42=0.7057.0134.036.061.13=-⨯=y.22.05584.04550=⨯-=-=WDx Fx x Df w ()56.084.01.31.484.01111=⨯-=--=y y x αα36.07.01.31.470.02=⨯-=x22.024.057.01.31.457.03≥=⨯-=x所以不能完成任务。
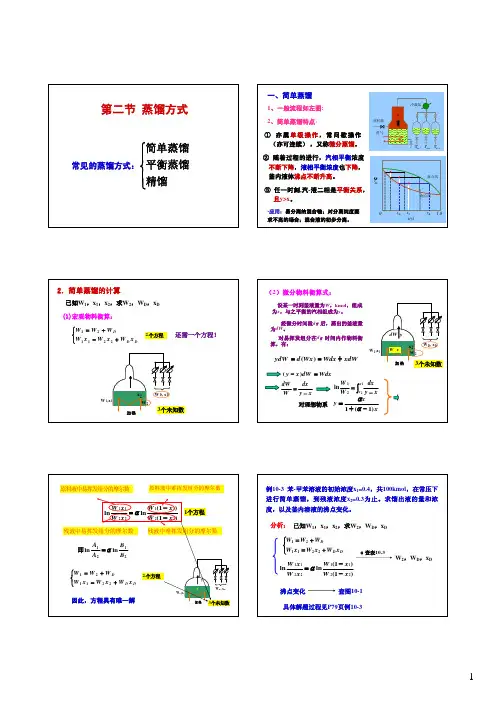
第1章蒸馏 内容小结复习题1 蒸馏概述蒸馏操作是借混合液中各组分挥发性的差异而到达别离目的。
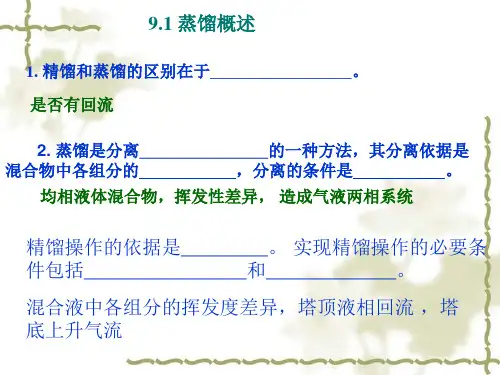
轻组分:混合物中的易挥发组分;重组分:混合物中的难挥发组分例:蒸馏是别离的一种方法,其别离依据是混合物中各组分的,别离的条件是。
答:均相液体混合物,挥发性差异,造成气液两相系统精馏操作压力的选择减压蒸馏:降低了液体的沸点。
应用场合:别离沸点较高的热敏性混合液,混合物沸点过高的物系〔防止采用高温载热体〕。
加压蒸馏:提高冷凝温度防止使用冷冻剂。
应用场合:别离常压下呈气态的物系,馏出物的冷凝温度过低的物系。
举例:脱丙烷塔操作压力提高到1 765kPa时,冷凝温度约为50℃,便可使用江河水或循环水进行冷却,石油气常压呈气态,必须采用加压蒸馏。
2 双组分溶液的气液相平衡例:当混合物在t-x-y图中的气液共存区内时,气液两相温度,但气相组成液相组成,而两相的量可根据来确定。
答: 相等,大于,杠杆规那么例:当气液两相组成相同时,那么气相露点温度液相泡点温度。
答:大于例:双组分溶液的相对挥发度α是溶液中的挥发度对的挥发度之比,假设α=1表示。
物系的α值愈大,在x-y图中的平衡曲线愈对角线。
答:易挥发组分,难挥发组分,不能用普通蒸馏方法别离,远离理想溶液的含义例:理想溶液满足拉乌尔定律,也满足亨利定律;非理想稀溶液满足亨利定律,但不满足拉乌尔定律;服从亨利定律并不说明溶液的理想性,服从拉乌尔定律才说明溶液的理想性例:精馏塔别离某二元物系,当操作压强降低时,系统的相对挥发度 ( ),溶液的泡点( ),塔顶蒸汽冷凝温度( )。
答:增大,减小,减小3 平衡蒸馏与简单蒸馏4 精馏例:精馏塔的作用是。
答:提供气液接触进行传热和传质的场所。
例:在连续精馏塔内,加料板以上的塔段称为,其作用是;加料板以下的塔段〔包括加料板〕称为_____,其作用是。
答:精馏段提浓上升蒸汽中易挥发组分提馏段提浓下降液体中难挥发组分例:离开理论板时,气液两相到达状态,即两相相等,____互成平衡。
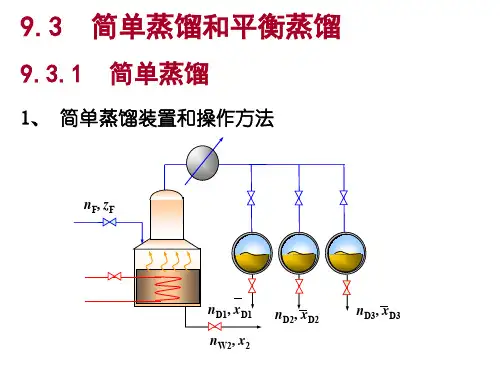
三、平衡蒸馏与简单蒸馏平衡蒸馏(闪蒸)是液体的一次部分气化的蒸馏操作。
1、流程2. 原理:将原料液加热到泡点温度以上,再经节流阀减压后进入闪蒸室,因压力下降原料液变为过热而使液体发生部分气化,形成气液两相,气化耗热使得液体温度下降,最后气、液两相温度趋于一致,两相组成趋于平衡。
简单蒸馏也称微分蒸馏,在蒸馏过程中系统的温度和气液相组成均随时间而改变,属于间歇非定态操作。
闪蒸罐塔顶产品yAxA加热器原料液塔底产品Q减压阀1. 流程2. 原理:原料液一次加入釜中,将其加热至泡点,使之不断的气化,产生的蒸气由釜顶连续引入冷凝器得馏出液产品。
釜内任一时刻的气液两相组成互成平衡。
由于 y ,随着蒸气的不断引出,釜液中易挥发组分的组成不断减少,泡点逐渐升高,与之相应的气化蒸气中的易挥发组分的含量也不断降低,故常设有几个接受器,按时间的先后,分别得到不同组成的馏出液。
四、精馏精馏:把液体混合物进行多次部分气化,同时把产生的蒸气多次部分冷凝,使混合物分离为所要求组分的操作过程称为精馏 1. 精馏流程y原料液x蒸气xD1xD2xD3冷凝器预热到一定温度的原料液送入精馏塔的进料板,在每层塔板上, 回流液体与上升蒸气互相接触, 进行热和质的传递.塔顶冷凝器的作用: 获得塔顶产品及保证有适宜的液相回流。
再沸器的作用: 提供一定量的上升蒸蒸气。
精馏段:加料板以上的塔段.上升气相中重组分向液相传递,液相中轻组分向气相传递,完成上升蒸气轻组分精制。
提馏段:加料板及其以下的塔段.下降液体中轻组分向气相传递,气相中重组分向液相传递,完成下降液体重组分提浓。
2. 精馏原理任意第n 块塔板上的精馏过程混合蒸汽多次部分冷凝,蒸汽组成沿 t-x(y) 相图的露点线变化,可得到易挥发组分含量很高而难挥发组分含量很低的蒸汽。
混合液体多次部分汽化,釜液组成沿 t-x(y) 相图的泡点线变化,可得难挥发组分含量很高而易挥发组分含量很低的釜液。
9.3平衡蒸馏和简单蒸馏 9.3.1平衡蒸馏1.过程的数学描述蒸馏过程的数学描述不外为物料衡算式、热量衡算式及反映具体过程特征的方程,现分述如下。
(1)物料衡算式:对连续定态过程做物料衡算可得 总物料衡算: W D F += 易挥发组分的物料衡算: Wx Dy Fx F += 两式联立可得xy x x F D F --=式中: F x F ,——加料流率,kmol/s 及料液组成摩尔分数;y D ,——气相产物流率,kmol/s 及组成摩尔分数;x W ,——液相产物流率,kmol/s 及组成摩尔分数; 设液相产物占总加料量F 的分率为q ,气化率为()q FD -=1,代入上式整理可得11-=-=q x q qx y F显然,将组成为F x 的料液分为任意两部分时必须满足此物料衡算式。
以上计算中各股物料流率的单位也可用kg/s ,但各组成均须相应用质量分数表示。
(2)热量衡算加热炉的热流量Q 为()F p m t T Fc Q -=,节流减压后,物料放出显热即供自身的部分气化,故()()Fr q t T Fc F p m -=-1,由此式可求得料液加热温度为()pm e c r q t T ,1-+=式中: T t F ,——分别为料液温度与加热后的液体温度;K;e t ——闪蒸后气、液两相的平衡温度;K ;p m C ,——混合液的平均摩尔热容,KJ/(kmol •K);r —— 平均摩尔气化热,KJ/kmol 。
(3)过程特征方程式。
平衡蒸汽中可设气、液两相处于平衡状态,即两相温度相同,组成互为平衡。
因此,y 与x 应满足相平衡方程式()x f y =若为理想溶液应满足xx y )1(1-+=αα平衡温度e t 与组成x 应满足泡点方程,即()x t e φ=上述几个式子都是平衡蒸馏过程特征的方程式。
2.平衡蒸馏过程的计算当给定气化率()q -1,可依照下图所示的方法图解求出所求的气、液相组成。
9.3.2简单蒸馏1.简单蒸馏过程的数学描述描述简单蒸馏过程的物料衡算、热量衡算方程与平衡蒸馏并无本质区别,但简单蒸馏是个时变过程,而平衡蒸馏为定态过程。
因此,对简单蒸馏必须选取一个时间微元τd ,对该时间微元的始末作物料衡算。
设 W ——某瞬间釜中的液体量,它随时而变,由初态1W 变至终态2W ;x ——某瞬间釜中液体的组成,它由初态1x 降至终态2x ;y ——瞬间由釜中蒸出的气相组成,随时间而变。
若τd 时间内蒸出物料量为dW ,釜内液体组成相应地由x 降为()dx x -,对该时间微元作易挥发组分的物料衡算可得()()dx x dWW ydW Wx --+=略去二阶无穷小量,上式可写为xy dx WdW -=将此时积分得xy dx W W x x -=⎰1221ln简单蒸馏过程的特征时任一瞬间的气、液相组成y 与x 互为平衡,故描述此过程的特征方程仍未相平衡方程,即 ()x f y =联立上述两式可得: ⎪⎪⎭⎫ ⎝⎛--+-=12212111ln ln 11lnx x x x W W αα 2.简单蒸馏的过程计算原料量1W 及原料组成1x 一般已知,当给定2x 即可联立上述两式求出2W 。
由于釜液组成x 随时变化,每一瞬间的气相组成y 也相应变化。
若将全过程的气相产物冷凝后汇集一起,则馏出液的平均组成y 及数量可对全过程的始末作物料衡算而求出。
全过程易挥发组分的物料衡算式为()221121W x W x W W y -=-()212121x x W W W x y --+=例题:例9-1 理想溶液简单蒸馏时,某时刻釜残液量2W (kmol )与易挥发组分组成2x (摩尔分率)之间有如下关系式⎪⎪⎭⎫⎝⎛--+⎥⎦⎤⎢⎣⎡---=1212212111ln )1()1(ln 11ln x x x x x x W W α 式中:1W (kmol )为初始料液量,1x (摩尔分率)为初始浓度,α为平均相对挥发度。
对苯—甲苯溶液,6.01=x ,101=W kmol ,5.2=α,在1atm 下进行简单蒸馏。
试求:(1)蒸馏到残液浓度5.02=x 为止,馏出液的量D W (kmol )和平均浓度D x ;(2)若蒸馏至残液量为原加料的一半时,残液的浓度。
解:(1)将已知数据代入题给方程得4934.06.015.01ln )6.01(5.0)5.01(6.0ln 15.2110ln 2=⎪⎭⎫⎝⎛--+⎥⎦⎤⎢⎣⎡-⨯-⨯-=W 解得 11.6)4934.0ex p(102==W kmol89.311.61021D =-=-=W W W kmol7571.089.35.011.66.010D2211D =⨯-⨯=-=W x W x W x(2)依题意 2/12W W =,将有关数据代入题给方程⎪⎭⎫ ⎝⎛--+⎥⎦⎤⎢⎣⎡-⨯-⨯-=6.011ln )6.01()1(6.0ln 15.212/ln22211x x x W W 整理后得07402.0ln )1ln(5.222=+--x x上式为非线性方程,可用试差法求2x ,但收敛速度慢。
采用牛顿迭代法求可快速收敛,为此将上式写成7402.0)ln()1ln(5.2)(222+--=x x x f将上式求导得 222/1)1/(5.2)(x x x f ---='取初值 4.002=x ,则3794.0)4.0(=f ,6666.6)4.0(-='f4569.0)6666.6/(3794.04.0)(/)(02020212=--='-=x f x f x x再次迭代 0003.0)(12=x f ,7919.6)('12-=x f 45694.0)7919.6/(0003.04569.0)(/)(12121222=--='-=x f x f x x取精度410-=ε,则45694.02=x 即满足精度要求。
由本题结果可知,当非线性方程一阶导数可求时,采用牛顿迭代法求根收敛速度快。
例9-2 苯-甲苯溶液的初始料液量和初始浓度均与上题相同,在1atm 下进行平衡蒸馏(闪蒸),试求:(1)汽化率389.0=f 时离开闪蒸塔的汽相组成D y 和液相组成W x ,并与上题(1)的结果进行比较,说明什么问题?(2)定性分析,其他条件不变,原料加热温度t 升高时D y 、W x 、D 及闪蒸后汽液两相的平衡温度e t 的变化趋势。
解:(1)如图16-17所示,离开闪蒸塔的汽相组成D y 、液相组成W x 既要满足物料衡算关系又要满足相平衡关系。
总物料衡算 W D F += (a )挥发组分衡算 W D F Wx Dx Fx += (b )塔顶为全凝器,则D V =,D D x y =,将以上关系和由式(a )解出的W 一并代入式(b )并整理,得WD W F x y x x F D F V --== (c )令F W q /=表示液相的残留率,则q F W F F D F V f -=-===1/)(//。
将上 述关系代入式(c )整理得11F ---=q x x q q y (d )相平衡方程 WWD )1(1x x y -+=αα (e )将389.0=f ,611.0389.011=-=-=f q ,6.0F =x ,5.2=α分别代入式(d )和式(e )得5424.15707.11611.06.01611.0611.0W W D +-=-+--=x x y()WW WWD 1.512.515.215.2x x x x y +=-+=联立解以上两式得一元二次方程06546.07458.0W 2W =-+x x解一元二次方程得 5180.0W =x ,2638.1W -=x (舍去) 所以 7288.05180.05.115180.05.2D =⨯+⨯=y图16-15 例16-2附图本题结果与上题简单蒸馏(1)的结果比较:简单蒸馏馏出率(相当于闪蒸汽化率)为389.010/89.3/1D ==W W 与本题汽化率f 相同,但简单蒸馏馏出液平均浓度(7571.0D =x )大于平衡蒸馏汽相组成(7288.0D =y ),简单蒸馏残液浓度(45694.02=x )小于平衡蒸馏液相组成(5180.0W =x ),说明在汽化率相同的情况下,简单蒸馏分离效果比平衡蒸馏好。
其原因在于简单蒸馏的汽相组成多是与开始阶段较高的液相组成(在5180.06.0≤≤x 范围内简单蒸馏W x x ≥,只在5180.045694.0<≤x 范围内W x x ≤)成平衡的,而平衡蒸馏汽相组成只能与最终较低的液相组成5180.0W =x 成平衡。
(2)定性分析采用图解法比较方便,且图解法对非理想溶液也适用。
将式(d )中D y 、W x 的下标略去得到与连续精馏q 线方程式(16-16)相同的方程,将该方程标绘在y x -图上与相平衡曲线有一交点(如图16-16 所示),交点坐标即为D y 、W x 。
分析:其它条件不变,即原料液流量F ,原料液组成F x ,闪蒸塔压强p 均不变,原料液加热温度t 升高,F x 不变,式(f )与对角线交点F 不变,p 不变,相平衡曲线不变。
t 升高,料液在闪蒸塔内放出的显热增加,因而汽化量V (即D )增加,汽化率f 变大,液相残留率q 变小。
由图16-16可看出D y 、W x 均减少。
平衡温度e t 与液相组成W x 应满足泡点方程,图16-16示意画出了泡点线(x t ~e ),由图16-16可看出e t 升高。
结论:其它条件不变,t 升高,则D y 、W x 均减小,D 增加,e t 升高。
上式中10<<q 。
显然,将组成为F x 的原料液分为汽、液两相时,其组成y 、x 必满足物料衡算式(g )也应满足相平衡方程。
式(g )与连续精馏q 线方程的形式相同。
当连续精馏为汽液混合物进料时,即10<<q ,q 线方程实际上就是平衡蒸馏的物料衡算方程式(g ),故连续精馏汽、液混合物进料其组成y 、x 既满足q 线方程也应满足相平衡方程。
图16-16 t 改变时平衡蒸馏图解示意图。