摩尔折光度
- 格式:docx
- 大小:27.54 KB
- 文档页数:4


实验十四摩尔折光度的测定一、实验目的1.了解阿贝折光仪的结构和工作原理,正确掌握其使用方法。
2.测定某些化合物的折光率和密度,求算化合物、基团和原子。
二、实验原理摩尔折光度(R)是由于在光的照射下分子中电子云相对于分子骨架的相对运动的结果。
R可以作物为分子中电子极华率的量度。
R=(n2-1)M/(n2+2)ρN――折光度M――摩尔质量ρ――密度摩尔折光度有体积的因次,通常为cm3表示。
实验表明,摩尔折光度具有加和性。
三、仪器和药品阿贝折光仪;四氯化碳;乙醇;乙酸乙酯;乙酸甲酯;二氯乙烷。
四、实验步骤1.折光度的测定使用阿贝折光仪测定实验要求的几种物质的折光率。
2.用密度管法测定上述物质的密度。
阿贝折射仪的原理和操作方法阿贝折射仪是能测定透明、半透明液体或固体的折射率n D 和平均色散的n f -n c 仪器(其中以测透明液体为主),如仪器接上恒温器,则可测定温度为0~70℃内的折射率n D 。
折射率和平均色散是物质的重要光学常数之一,能借以了解物质的光学性能、 纯度、浓度及色散大小等。
(一)工作原理图5 图6 图7阿贝折射仪的基本原理即为折射定律:sin 1n α1=2n sin α2 1n 、2n 为交界面两侧的两种介质之折射率(图5)α1为入射角 , α2为折射角若光线从光密介质进入光疏介质,入射角小于折射角,改变入射角可以使折射角达到900,此时的入射角称为临界角,本仪器测定折射率就是基于测定临界角的原理。
图6中当不同的角度光线射入AB 面时。
其折射角都大于i ,如果用一望远镜对射出光线观察,可以看到望远镜视场被分为明暗两部分,二者之间有明显的分界线。
见图7所示,明暗分界线为临界角的位置。
图7中ABCD 为一折射棱镜,其折射率n 2。
为AB 面上面是被测物体。
(透明固体或液体)其折射率为n 1,由折射定律得:sin 1n 90℃=2n sin α (1)2n sin β=sini (2)Ф=α+β则 α=Ф-β代入(1)式得1n =2n sin (Ф-β)=2n (sin Фcos β-cos Фsin β) (3)由(2)式得:222sin n β=sin 2i 22n (1-cos 2β) =sin 2i 22n -22n cos 2β=sin 2i cos β=22222/)sin (n i n -代入(3)式得:1n =sin Фi n 222sin --cos Фsini棱镜折射角Ф与折射率n 2均已知。
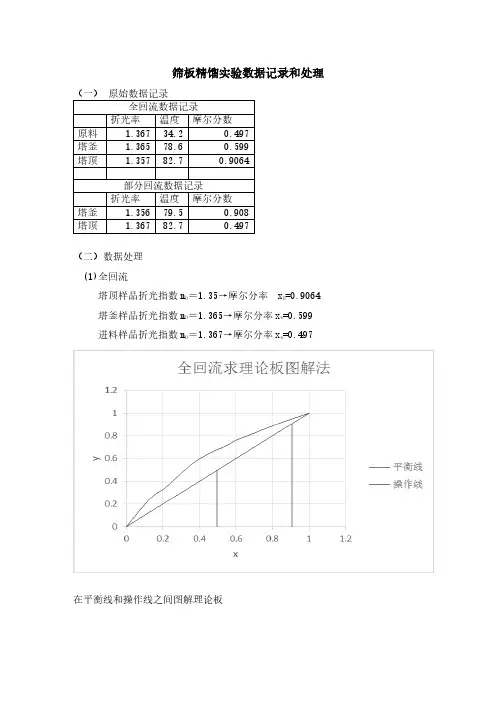
筛板精馏实验数据记录和处理(二)数据处理(1)全回流塔顶样品折光指数nD =1.35→摩尔分率xD=0.9064塔釜样品折光指数nD =1.365→摩尔分率xw=0.599进料样品折光指数nD =1.367→摩尔分率xw=0.497在平衡线和操作线之间图解理论板全塔效率η=⨯=%100Pt N N (2)部分回流(R=4)塔顶样品折光指数n D =1.367塔釜样品折光指数n D =1.356进料样品折光指数n D =1.367计算得摩尔浓度:X D =0.497 ;X w =0.908;X f =0.497进料温度t f =34.2℃;在X f =0.497下泡点温度85.62℃精馏段方程:1816.08.011+=+++=x R x x R Ry D进料热状况q :根据xF 在t —x (y )相图中可分别查出露点温度t V =89.38℃;和泡点温度t L =85.62℃。
在xF=0.497组成、露点tV=89.38℃下,饱和蒸汽的焓;乙醇和正丙醇在定性温度t=(t V +0)/2=89.38/2=44.69℃下的比热C PA =2.51KJ/Kmol·K ;C PB =2.54KJ/Kmol·K乙醇和正丙醇在露点温度t V 下的汽化潜热r A = 815.79kJ /kg ;r B = 708.20kJ /kg在x F =0.497组成、泡点t L =85.62℃下,饱和液体的焓;C PA 、C PB :乙醇和正丙醇在定性温度t=(t L +0)/2=85.62/2=42.8℃下的比热 C PA =2.58KJ/Kmol·K ;C PB =2.52KJ/Kmol·K在x F =0.497组成、实际进料温度t F =34.2℃下,原料实际的焓根据实验,进料是常温下(冷液)进料,有t F <t L乙醇和正丙醇在定性温度t=(t F +0)/2=34.2/2=17.1℃下的比热C PA =2.86KJ/Kmol·K ;C PB =2.77KJ/Kmol·K混合液体比热Cpm=46×0.497×2.51+60×(1-0.497)×2.54=134.04(kJ/kmol.℃) 混合液体汽化潜热rpm=46×0.497×815.79+60×(1-0.497)×708.2=40024(kJ/kmol )所以18.14002440024)2.3438.89(04.134)(=+-⨯=+-⨯=m m F B r r t t Cpm q b. q 线方程(进料线方程):76.2-56.611q Fq q x q x x q qy =---=q 线斜率=-=1q q 6.56 q 线方程与精馏段方程交点计算得:(0.51,0.59)在平衡线和精馏段操作线、提馏段操作线之间图解理论板板数: 全塔效率η=⨯=%100P t N N。

溶液法测定极性分子偶极矩实验报告一、实验目的1.测定乙酸乙酯在四氯化碳中的介电常数和偶极矩,了解偶极矩与分子电性质的关系。
2,测定某些化合物的折光率和密度,求算化合物、基团和原子的摩尔折光度,判断化合物的分子结构。
二、实验原理分子是由带正电荷的原子核和带负电荷的电子组成的。
分子呈电中性,但因空间构型的不同,正负电荷中心可能重合,也可能不重合,前者为非极性分子,后者称为极性分子,分子极性大小用偶极矩“来度量,其定义为"=qd (1)式中:a为正、负电荷中心所带的电荷虽,单位是C; d是正、负电荷中心的距离,单位是m。
“是偶极矩,单位是(SI制)库[仑]米(C-m)o而过去习惯使用的单位是德拜(D):1D=1X 10-18静电单位・厘米=3. 338X1。
-%・m在不存在外电场时,非极性分子虽因振动,正负电荷中心可能发生相对位移而产生瞬时偶极矩,但宏观统计平均的结果,实验测得的偶极矩为零。
极性分子具有永久偶极矩,由于分子热的运动,偶极矩在空间各个方向的取向几率均等,统计值等于零。
若将极性分子置于均匀的外电场中,分子将沿电场方向转动,同时还会发生电子云对分子骨架的相对移动和分子骨架的变形,称为极化。
极化的程度用摩尔极化度户来度量。
分子因转向而极化的程度用摩尔转向极化度户明来表示,因变形而极化的程度用摩尔变形极化度户安形来表示。
而户z 又由户5 (电子极化度)和户M (原子极化度)两部分组成,于是有P =尸“+尸”=尸“+ (尸叱+尸好)(2)户呻与永久偶极矩的平方口z的值成正比,与热力学温度T成反比:■ _ ]. 4 ”. NP啪-满'5 A 3kf⑶式中:乩为阿佛加德罗(Avogadro)常数:人为玻耳兹曼(Boltzmann)常数。
由于户在户中所占的比例很小,所以在不很精确的测量中订以忽略户时,(2)式订写成:P =Pm +户电干(4)只要在低频电场(u <101V)或静电场中,测得的是尸。

04分子的对称性【4.1】HCN和CS2都是直线型分子,写出该分子的对称元素。
解:HCN : C::f ;CS2:C::,C2 ,i【4.2】写出H3C CI分子中的对称元素。
解:C3,G3【4.3】写出三重映轴S和三重反轴1 3的全部对称操作。
解:依据三重映轴S3所进行的全部对称操作为:s3=<ih C3 &=町s3 = c3 s3 s3 = E依据三重反轴1 3进行的全部对称操作为:I3=Q3, ifI34二c3, i3s4 =Oh C;,S4 =C2,s^=^h C43,s4 = E依据|4进行的全部对称操作为:1 1 214 =0,丨4【4.5】写出二xz和通过原点并与轴重合的C2轴的对称操作C2的表示矩阵。
【4.6】用对称操作的表示矩阵证明:(a)C2 z 匚=i (匕)C2 x C2 y = C2 z (C)L=C2 z解:(a)■x lj y =C=C3 , 13 = i =iC; , I3 =E【4.4】写出四重映轴S4和四重反轴1 4的全部对称操作。
解:依据S4进行的全部对称操作为:解:-10 0〕■100〕^xz =0—1 0_1100 1_卫0T」C 2 z;「xy 云 1 1推广之,有, C 2n z ;「xy = ;「xy C 2n z =i即:一个偶次旋转轴与一个垂直于它的镜面组合,必定在垂足上出现对称中心。
C 2轴,则其交点上必定出现垂直于这两个 C 2轴的第三个C 2轴。
推广之,交角为2二/2n 的两个轴组合,在其交点上必定出现一个垂直于这两个 C 2轴C n 轴,在垂直于C n 轴且过交点的平面内必有 n 个C 2轴。
进而可推得,一个C n 轴与垂 直于它的C 2轴组合,在垂直于 C n 的平面内有n 个C 2轴,相邻两轴的夹角为 2二/2n 。
这说明,两个互相垂直的镜面组合, 可得一个C 2轴,此C 2轴正是两镜面的交线。
推而广之, 若两个镜面相交且交角为 2- /2n ,则其交线必为一个 n 次旋转轴。



物理化学实验思考题物理化学实验思考题实验1燃烧热的测定1.影响本实验结果的主要因素有哪些?2.加入铜水桶中的水的水温为什么要比室温低?3.在使用氧气钢瓶及氧气减压阀时,应注意哪些规则?4. 文献手册的数据是标准燃烧热,本实验条件偏离标准态。
请估算由此引入的系统误差有多少?实验2 反应热量计的应用1.为什么要进行电能标定?2.在求算反应体系的真实(绝热)温升时,为什么要对温度信号进行校正?实验3 凝固点降低法测定分子量1.在冷却过程中,凝固点管内液体有哪些热交换存在?它们对凝固点的测定有何影响?2.为什么要用空气夹套?3. 溶质在溶液中有离解、缔合的现象,对分子量的测定值有何影响?实验4 液体饱和蒸气压的测定1.停止抽气前为什么要使机械泵与大气相通?2.本实验产生系统误差的原因何在?如何消除?实验5双液系的气液平衡相图的绘制1.沸点仪中的小球D的体积过大对测量有何影响?2.如何判定气-液相已达平衡?实验6 差热分析1.影响差热分析结果的主要因素有哪些?2.升温过程与降温过程所做的差热分析结果相同吗?为什么?3.测温点在样品内或在其它参考点上,所绘得的升温线相同吗?为什么?实验7 气相反应平衡常数的测定1.进行下一个温度反应,是否需要再充CO2原料气并将体系的气体赶出去?为什么?2.为什么CO2气体进入反应体系前要预先进行干燥?3.反应体系为什么要恒定在101325Pa的压力下?测量平衡混合气总体积和CO体积时,下口瓶III液面为什么要与量气管液面比平?4.测量CO体积时,如何扣除气体吸收瓶液面上的气体体积?实验8 原电池电动势的测定1.补偿法测电动势的基本原理是什么?为什么不能采用伏特表来测定电池电动势?2.标准电池和工作电池有什么不同7在使用标准电池时应注意什么?3.检流计的光点总向某个方向偏移,你估计是由什么原因引起?实验9 氢超电势的测定1. 在测量极化曲线时为什么要用三个电极?各起什么作用?实验10 离子迁移数的测定——希托夫法1.为什么要对阴极区的溶液称重?2.在通电情况相同时,希托夫管的容积是大好还是小好?实验11 电导法测定醋酸电离平衡常数1. DDS –11型电导率仪使用的是直流电源还是交流电源?2.电导池常数(即电极常数)是怎样确定的?本实验仍安排了0.0100M 的KCl 的测定,用意何在?3. 将实验测定的Kc 值与文献值比较,试述误差的主要来源。

摩尔折射率
摩尔折射率(Molar Refractivity)也称“比折射率”,是物质的一种物理性质,它
反映了某种物质在光的作用下的折射效应的强度,是衡量物质的光学属性的重要指标之一。
摩尔折射率是物质折射率的定义及单位,因为折射率表达中包含两个指标:折射比例
和折射率。
折射比例是两种光相对应的分贝值,而折射率则是物质的光谱折射比例单位。
二者之比故名“摩尔折射率”,单位是摩尔折射率单位(m-1)。
在物理学中,摩尔折射率是由折射率和光谱折射比例综合考虑而得出,表示为百分数。
摩尔折射率反映物质可以在特定压强、温度条件下将光线折射和反射的能力,既受温度变
化的影响较大,也受温度变化的影响较小。
摩尔折射率的测量可分为彩色折射和单色折射两种方式。
彩色折射把物体的折射率作
为其能量变化的响应函数,测量出物体在不同波长上的折射和反射比例;而单色折射则把
折射率看作光源和物体交互作用的比值,考虑物体对不同强度的单色光源的反射率。
若以量子效应解释摩尔折射率,一般认为,摩尔折射率实际上是物质的气体量子振动
的综合反映程度,以电子、原子、分子等介质的使质子生成磁偶极子传输能力及能量流动
作为基础,认为物质对光线的强烈磁偶极作用造成了折射和反射。
摩尔折射率在物理学和工程领域都有广泛应用,尤其是长波长波项检测,非常重要。
举例来说,由于摩尔折射率可以让物质表示出传热性能,因此经常应用于热性能的检测,
以及暗室、隔热衣等特种衣物的检测中。
此外,摩尔折射率也用于分析凝胶的护肤性、涂
料的阻湿性和耐热性以及药品的流变性等,从而提高其附加值。

结构化学实验物质摩尔折射度的测定实验目的1. 掌握阿贝折射仪的使用方法。
2. 测定化合物的折射率和密度,求算化合物、基团和原子的摩尔折射度,判断各化合物的分子结构。
摩尔折射度摩尔折射度可以作为分子中电子极化的度量,用R 表示,其定义为:221R=2n M n ρ−×+n :物质的折射率;M :物质的摩尔质量g/mol ;ρ:物质的密度g/cm 3;R :摩尔折射率cm 3/mol 实验原理实验原理摩尔折射度摩尔折射度具有加和性,等于分子中各原子的折射度以及形成化学键时折射度的增量之和。
利用这种加和性,就可以根据物质的化学式算出其各种同分异构体的摩尔折射度并于实验测量相比较,进而推断其化学键及分子结构。
仪器与试剂WAY型阿贝折光仪、比重瓶、滴管;纯水、四氯化碳、乙醇、乙酸甲酯、乙酸乙酯、二氯乙烷;实验步骤折射率的测定:使用阿贝折光仪测量每种液体的折射率。
密度的测定:用比重瓶测量上述每种液体的密度。
HO220H O 0=m m m m ρρ−×−m :待测液体与比重瓶的总质量;m 0:比重瓶的质量;m H 20:水与比重瓶的总质量实验步骤数据记录及结果处理1. 列表记录实验数据。
2. 求算和液体的密度和合折射率并求出其摩尔折射度。
3.根据实验数据求出CH2,Cl,C,H等官能团的摩尔折射度。
思考题1.按实验书上表格6.1-1和6.1-2数据计算各化合物摩尔折射度的理论值,并与实验值相比较。
2. 试验中有哪些操作会引起测量结果的误差?结构化学实验结构化学实验。
2020年6月16 日评定室温:25 ℃大气压:101kpa一、实验名称:偶极矩的测定二、实验目的1.用溶液法测定正丁醇的偶极矩2.了解偶极矩与分子电性质的关系3.掌握溶液法测定偶极矩的实验技术三、实验原理1、偶极矩与极化度分子结构中电子云分布造成正负电荷中心可能重合,也可能不重合,分别称为极性分了和非极性分子。
德拜提出以偶极矩u来衡量分子极性的大小,偶极矩的大小为正负电荷所带电荷量与正负电荷中心距离的乘积,它的大小反映了分子结构中电子云的分布和分子对称性等情况,还可以用它来判断几何呆构体和分子的立体结构。
如反式结构对称性比顺式结构的对称性来得大,偶极矩就比较小。
极性分子具有永久偶极矩,但由于分子的热运动,偶极矩的统计值等于零,如将极性分子置于均匀电场中,则偶极矩在电场的作用下趋向于电场方向排列,称分了被极化,极化程度用摩分转向极化度P转向来衡量。
它的大小与永久偶极矩的平方成正比,与热力学温度成反比: L为阿伏伽德罗常数,k为玻兹曼常数。
在外电场作用下,分子中的电子云会发生相对移动,分了骨架也会变形,这种情况称为诱导极化或变形极化。
用摩尔诱导极化度P诱导来衡量。
它分为电子极化度和原子极化度两部分,大小与外电场强度成正比,而与温度无关。
P诱导=P电子+P原子对于交变电场,分子极化情况与交变电场的频率有关,在频率较低时,极性分子的摩尔极化度为转向极化度、电子极化度、取极化度的总和。
P=P转向+P电子+P原子当交变电场频率达到1012-1014s-1(红外线频率)时,极性分子来不及沿电场定向,则P转向=0此时摩尔极化度等于摩尔诱导极化度,当交变电场频率达到1015s-1(可见、紫外光频率)时外子的转向和外子骨架变形都跟不上电场的变化,此时的摩尔极化度等于电子极化度,测定出程性分子的摩尔极化度,再测出它的诱导极化度,相减后得到转向极化度,就可以求由分子的偶格矩了2、极度化的测定摩尔极度化与介电常数有关1 2MPεερ-=+但这个关系式是假定分子间无相互作用时推导而得的,必须使物质处于气相才能适用,而这是比较困难的。
实验9. 偶极矩的测定一、实验目的:1. 测定氯仿在环己烷中的介电常数和偶极矩,了解偶极矩与分子电性质的关系。
2. 了解Clansius-Mosotti-Debye 方程的意义及公式的适用条件二、实验原理:1、偶极矩:分子结构可以近似地被石成是由电子。
和对于骨架(原子核及内层电子)所构成的。
由于分子空间构型的不同,其正、负电荷中心可能是重合的,也可能不重合,前者称为非极性分子,后者称为极性分子。
偶极矩”μ”是来度量分子极性的大小的概念,其定义是d q ⋅=μ式中 q 是正、负电荷中心所带的电荷量,d 为正、负电荷中心之间的距离,μ是一个向量,其方向规定从正到负。
因分子中原子间距离的数量级为1010-m ,电荷的数量级为2010-C ,所以偶极矩的数量级是3010-C·m 。
通过偶极矩的测定可以了解分子结构中有关电子云的分布和分子的对称性等情况,还可以用来判别几何异构体和分子的立体结构等。
克劳修斯、莫索蒂和德拜(Clausius -Mosotti -Debye )从电磁理论得到了摩尔极化度P 与介电常数ε之间的关系式ρεεMP ⋅+-=21 式中,M 为被测物质的摩尔质量,ρ是该物质的密度,ε可以通过实验测定。
海德斯特兰(Hedestran )首先利用稀溶液的近似公式()211x αεε+=溶()211x βρρ+=溶再根据溶液的加和性,推导出无限稀释时溶质摩尔极化度的公式()11211112112022123lim 2ρβεερεαεM M M P P P x -⋅+-+⋅+===→∞ 上述(5)、(6)、(7)式中,溶ε、溶ρ是溶液的介电常数和密度,2M 、2x 是溶质的摩尔质量和摩尔分数,1ε、1ρ和1M 分别是溶剂的介电常数、密度和摩尔质量,α、β在是分别与溶ε-2x 和溶ρ-2x 直线斜率有关的常数。
同时,可以推导得无限稀释时溶质的摩尔折射度的公式电子P ()122112111221212022621lim 2ργρβ++-⋅+-===→∞n M n M M n n R R x γ满足稀溶液近似公式:n aq =n 1(1+γx 2), 溶n 是溶液的折光率,n 1是溶剂的折光率,γ是与溶n -2x 直线斜率有关的常数。
一.实验目的1.用溶液法测定及性物质的分子偶极矩,了解偶极矩与分子电性质的关系。
2.了解溶液法测定偶极矩的实验原理,掌握实验方法。
二.实验原理1、偶极矩与极化度分子的结构可以近似地看成是由电子云和分子骨架(原子核和内层电子)所构成。
由于其空间构型的不同,其正负电荷中心可以是重合的(此时为非极性分子),也可以是不重合的(此时为极性分子)。
图1 偶极矩示意图1912年Debye 提出“偶极矩”μ的概念来度量分子极性的大小,如图1所示,其定义是:qd =μ (1)式中 q 为正、负电荷中心所带的电荷量;d 为正、负电荷中心间的距离;μ为向量,其方向规定为从正到负,单位为Debye 或C ·m (10-30)。
通过偶极矩的测定,可以了解分子结构中有关电子云的分布,分子的对称性,还可以用来判别几何异构体和分子的立体结构等。
极性分子具有永久偶极矩,在没有外电场存在时,由于分子热运动,偶极矩在各个方向上的取向机会均等,故其偶极矩的统计值为零。
若将极性分子置于均匀的外电场中,分子会沿电场方向作定向转动,同时分子中的电子云对分子骨架发生相对移动,分子骨架也会变形,这叫分子极化,极化的程度可由摩尔极化度(Pm )来衡量。
因转向而极化称为摩尔极化度(P 转向)。
由变形所致的为摩尔变形极化度(P 变形)。
而P 变形又是电子极化度(P 电子)和原子极化度(P 原子)之和。
显然:Pm =P 转向+P 变形=P 转向+(P 电子+P 原子) (2)已知P 转向与永久偶极矩μ的平方成正比,与绝对温度成反比。
即KTN 2转向94p μπ= (3)式中 K 为Boltzmann 常数;N 为Avogadro 常数。
对于非极性分子,因其永久偶极矩μ=0,分子不能沿电场方向作定向转动,图2 电容电桥原理图图3 电容池的结构1、外电极2、内电极3、恒温室4、样品室5、绝缘板6、池盖7、外电极接线8、内电极接线电容池的结构如图3所示,由于在电桥法测量电路中被测电容Cx二端都不能接地,因此恒温介质不能用水,本实验用介电常数很小的变压器油为介质或不加介质,电容池外壳兼作屏蔽之用,这样就可以避免人体对测量的影响。
研究•开发2018, 32 (3):188-191 SILICONE MATERIAL化学键贡献法计算硅烷及硅氧烷的摩尔折射度丁晓林,王香娣,程大海",陈世龙,张春晖,张宝华(浙江凌志新材料有限公司,杭州311305)摘要:以化学键贡献法为基础研究方法,对?烷和?氧烷分子结构进行分析并拆分,构建摩尔折射度与化学键之间的函数关系,基于110种硅烷和硅氧烷样本的分子结构和实测值,采用“麦夸特法+通用全局优化法”计算得到各化学键的摩尔折射度贡献值,并对另外15种样本的摩尔折射度进行计算,计算值与实验值之间的平均绝对误差、平均相对误差及均方根误差分别为0.220 cm V mol、0.397%及0.272 cm V mol,计算值和实验值偏差较小。
化学键贡献法不仅弥孙了基团贡献法适用范围小的缺点,且准确度高,有望成为研究已知结构的硅烷、取代硅烷、硅氧烷及聚硅氧烷摩尔折射度的有效工具。
关键词:化学键贡献法,摩尔折射度,预测,硅烷,硅氧烷中图分类号:TQ264. 1 文献标识码:A doi:10. 11941/j. issn. 1009 -4369. 2018. 03. 006随着化学工业的迅速发展,需要依靠大量物 质的热力学数据进行生产设计,尽管研究人员耗 费大量精力进行测量工作,但仍然无法完全满足 工业生产与设计的需求。
物质分子结构与其热力 学性能之间的关系一直以来都备受关注,国内外 学者作了大量工作,提出了许多研究物质分子结 构与热力学性能之间定量关系的方法[1]。
这些 方法按照物质结构组成要素大致可分为原子贡献 法、基团贡献法、化学键贡献法三大类[2],这 些方法的提出解决了很多实际问题。
利用这3种 方法预测物质性能有3个关键因素:一是物质分 子结构要合理拆分;二是数学模型的提出要有热 力学理论基础;三是用以拟合原子、基团或化学 键对热力学性质贡献值的实验数据要准确可 靠[3-4]。
目前对于碳系化合物的沸点、摩尔折射 度、摩尔体积、临界参数等热力学性能与其微观 结构定量关系的研究已有诸多文献报道。
摩尔吸光系数的单位
g/l。
摩尔吸光系数,也称摩尔消光系数,是指浓度为1摩尔/升时的吸光系数,ε表示,当浓度用克/升表示时,摩尔吸光系数在数值上等于吸光系数(a)与物质的分子量(m)之积,ε=am。
ε值的大小反映吸收介质对光吸收的程度,对在可见光区有选择性吸收的介质来说表示某一显色反应灵敏度的大小,对同一被测元素而言,ε值越大,该显色反应越灵敏,对同一显色反应而言,ε值与测量浓度有关。
通常所说的摩尔吸光系数,指的是在最大吸收波长时的摩尔吸光系数。