(化学实验课件)三草酸合铁_III_酸钾的制备
- 格式:ppt
- 大小:865.50 KB
- 文档页数:3


实验二十五、三草酸合铁(Ⅲ)酸钾的合成和组成分析[实验目的]1. 了解三草酸合铁(III )酸钾的合成方法。
2. 掌握确定化合物化学式的基本原理和方法。
3. 巩固无机合成、滴定分析和重量分析的基本操作[实验原理]制备:(1) (NH 4)2Fe(SO 4)2+H 2C 2O 4=FeC 2O 4(S)+(NH 4)2SO 4+H 2SO 4(2) 过量K 2C 2O 4情况下,用H 2O 2氧化FeC 2O 46FeC 2O 4+ 6H 2O 2 +6K 2C 2O 4=4K 3[Fe(C 2O 4)3]+2Fe(OH)3(s)(3) 反应过程中生成的Fe(OH)3可加入适量的H 2C 2O 4将其转化为产物Fe(OH)3+3H 2C 2O 4+3K 2C 2O 4=K 3[Fe(C 2O 4)3]+6H 2O 2组成分析:(1)用重量分子法测定结晶水含量将一定量产物在110℃下干燥,根据失重可以计算结晶水含量。
(2)用高锰酸钾法测定草酸根含量5C 2O 42-+2MnO 4-+16H +=2Mn 2++10CO 2+8H 2O (3)用高锰酸钾法测定铁含量Zn 粉还原Fe 3+为Fe 2+,然后用KMnO 4标准溶液滴定Fe 2+MnO 4-+5Fe 2++8H+=5Fe 3++Mn 2++4H 2O (4)确定钾含量配合物减结晶水、C 2O 42- ,Fe 3+含量即为K +含量 [实验内容与步骤](一)三草酸合铁(III )酸钾的合成(1)Fe C 2O 4的合成 (NH 4)2Fe(SO 4)2.6H 2O (5g) 溶液静置 FeC 2O 4(二) K 3[Fe(C 2O 4)3].3H 2O 的合成20ml H 2O 5d H 2SO4酸化,△ 25ml 饱和K 2C 2O 4, 搅拌 △至沸倾去清液 洗涤沉淀FeC 2O 410ml 饱和K 2C 2O 4 水浴△ 40℃滴加12ml H 2O 2 搅拌棕色Fe (OH )3沉淀水浴△ 75℃-85℃ 8ml H 2C 2O 4 亮绿色透明溶液(2)组成分析1.结晶水称量产物在110℃下干燥,根据失重可以计算结晶水含量。
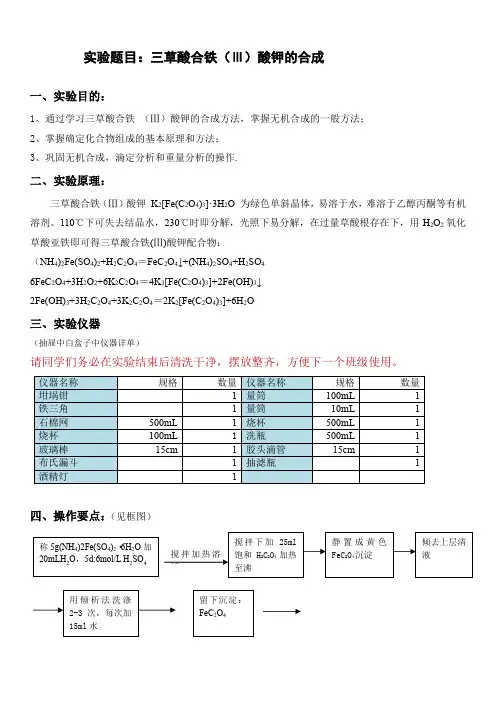
实验题目:三草酸合铁(Ⅲ)酸钾的合成一、实验目的:1、通过学习三草酸合铁(Ⅲ)酸钾的合成方法,掌握无机合成的一般方法;2、掌握确定化合物组成的基本原理和方法;3、巩固无机合成,滴定分析和重量分析的操作.二、实验原理:三草酸合铁(Ⅲ)酸钾K2[Fe(C2O4)3]·3H2O 为绿色单斜晶体,易溶于水,难溶于乙醇丙酮等有机溶剂。
110℃下可失去结晶水,230℃时即分解,光照下易分解,在过量草酸根存在下,用H2O2氧化草酸亚铁即可得三草酸合铁(Ⅲ)酸钾配合物:(NH4)2Fe(SO4)2+H2C2O4=FeC2O4↓+(NH4)2SO4+H2SO46FeC2O4+3H2O2+6K2C2O4=4K3[Fe(C2O4)3]+2Fe(OH)3↓2Fe(OH)3+3H2C2O4+3K2C2O4=2K2[Fe(C2O4)3]+6H2O三、实验仪器(抽屉中白盒子中仪器详单)请同学们务必在实验结束后清洗干净,摆放整齐,方便下一个班级使用。
仪器名称规格数量仪器名称规格数量坩埚钳1量筒100mL1铁三角1量筒10mL1石棉网500mL1烧杯500mL1烧杯100mL 1 洗瓶500mL1玻璃棒15cm1胶头滴管15cm1布氏漏斗1抽滤瓶1酒精灯1四、操作要点:(见框图)搅拌加热溶解搅拌下加25ml饱和H2C2O4加热至沸静置成黄色FeC2O4沉淀倾去上层清液用倾析法洗涤2-3次,每次加15ml水留下沉淀:FeC2O4称5g(NH4)2Fe(SO4)2·6H2O加20mLH2O,5d:6mol/L H2SO4五、注意事项①火柴棍、纸屑、碎玻璃等杂物严禁倒入水池中; ②产品回收,严禁倒入边台盒中; ③称量纸不扔,继续使用。
④饱和草酸和饱和草酸钾千万不要加错!⑤冰水浴时千万注意液面高度,冰水不能进入小烧杯。
六、思考题1、制备该化合物时,加完H 2O 2后为什么要煮沸溶液?2、在合成的最后一步,加入95%乙醇的作用是什么?能否用蒸干溶液的办法来提高产率?为什么?3、根据三草酸合铁(Ⅲ)酸钾的性质,应如何保存该化合物?七、值日生职责1.将去离子水下口瓶打满,去离子水龙头在黑板对面的墙上一侧;2.将试剂瓶溶液加满;3.将抽屉按照上面详单整理好;4.将实验台,包括边台擦干净;5.拖地,垃圾倒到卫生间大桶!边滴加 边搅拌 12ml : 5% H 2O 2加毕, 加热至沸 至变为亮绿色透明溶液若混浊趁热过滤,留滤液控制沸点,充分搅拌下:分两批加8ml 饱和H 2C 2O 4(先加5ml 再慢慢滴加3ml )边沉淀中加10ml 饱和K 2C 2O 4水浴40℃下加热滤液中加10ml 95%乙醇,若混浊小烧杯用大烧杯进行冰水浴,置于暗处冷却结晶待结晶完全后,抽滤,用95%乙醇少量(约10ml )洗涤晶体2次抽干,取出后用方滤纸压干称净重;算产率,产品置于回收盒中加毕, 加热至沸。


三草酸合铁酸钾的制备[实验目的]1.掌握三草酸合铁(III)酸钾的制备方法。
2. 练习倾析法、水浴加热、常压过滤、减压过滤等基本操作。
2.加深3价铁和2价铁的化合物重要性质的了解。
[实验原理]三草酸合铁(Ⅲ)酸钾K3[Fe(C2O4)3]·3H2O是一种翠绿色的单斜晶体,溶于水而不溶于乙醇等有机溶剂,光照易分解。
是一些有机反应很好的催化剂,也是制备负载型活性铁催化剂的主要原料,因而在工业生产中具有应用价值。
沉淀(NH4)2Fe(SO4)2·6H2O+H2C2O4=== FeC2O4·2H2O↓+(NH4)2 SO4+ H2SO4+4H2O氧化配位6FeC2O4 + 3H2O2 + 6K2C2O4 (过量)=== 4K3[Fe(C2O4)3] + 2Fe(OH)3(s)酸溶配位2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 === 2K3[Fe(C2O4)3] + 6H2O后两步总反应式为2FeC2O4·2H2O+ H2O2+3K2C2O4+ H2C2O4===2K3[Fe(C2O4)3]·3H2O[实验步骤]1.草酸亚铁的制备将 5 g (NH4)2Fe(SO4)2·6H2O (s)溶于20 mL 经6 mol/LH2SO4(5 滴)酸化的水中,加热使其溶解在不断搅拌下加入25 mL 饱和H2C2O4溶液,然后将其加热至沸30 s后静置。
黄色沉淀完全沉降后,倾去上层清夜,用热水(400C以上)洗涤沉淀3 次(每次约25 mL)至溶液呈中性(用pH 试纸检验)。
2.三草酸合铁(III)酸钾的制备在上述沉淀中加入10mL饱和K2C2O4溶液,水浴恒温维持40 0C 左右,(或恒温磁力搅拌器),缓慢滴加12 mL H2O2(质量分数为0.05)溶液(气泡未出现前保持1 d/s,出现气泡后,每加一滴H2O2搅拌至无气泡后再滴加),此时溶液有棕色的Fe(OH)3沉淀生成。

实验一三草酸合铁(III)酸钾的制备及组成测定一、实验目的1. 了解三草酸合铁(Ⅲ)酸钾的制备方法。
2. 掌握确定化合物化学式的基本原理和方法。
3. 巩固减压抽滤等的基本操作。
4. 掌握三草酸合铁(Ⅲ)酸钾各组成测定的原理和方法。
二、实验原理1. 三草酸合铁(III)酸钾的制备三草酸合铁(Ⅲ)酸钾为亮绿色单斜晶体,易溶于水而难溶于乙醇、丙酮等有机溶剂。
受热时,在110︒C下可失去结晶水,到230︒C即分解。
该配合物为光敏物质,光照下易分解。
利用(NH4)2Fe(SO4)2和H2C2O4反应制取FeC2O4:(NH4)2Fe(SO4)2 + H2C2O4 = FeC2O4↓ + (NH4)2SO4 + H2SO4在过量K2C2O4存在下,用H2O2氧化FeC2O4即可制得产物:6FeC2O4 + 3H2O2 + 6K2C2O4 = 2Fe(OH)3↓ + 4K3[Fe(C2O4)3]反应中产生的Fe(OH)3可加入适量的H2C2O4也将其转化为产物:2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O2. 三草酸合铁(III)酸钾组成分析(1) 用重量分析法测定结晶水含量将一定量K3[Fe(C2O4)3]产物在110︒C下干燥,根据失重情况可计算出结晶水的含量。
(2) 用高锰酸钾法测定草酸根含量5C2O42- + 2MnO4- + 16H+ = 2Mn2+ + 10CO2 + 6H2O 用已知浓度的KMnO4标准溶液滴定C2O42-,由所消耗的KMnO4的量计算出C2O42-的含量。
(3) 用高锰酸钾法测定铁含量Zn + Fe3+ = Zn2+ + Fe2+5Fe2+ + MnO4- + 8H+ = Mn2+ + 5Fe3+ + 4H2O由消耗的的KMnO4的量计算出Fe3+的含量。
(4) 确定钾含量钾含量由配合物总量减去结晶水、C2O42-和Fe3+的含量得到的。


实验三草酸合铁酸钾的制备、组成测定及性质一、实验目的1. 了解利用沉淀、氧化还原、配位等反应制取K3Fe[(C2O4)3]·3H2O方法。
2. 加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解3. 掌握容量分析等基本操作二、实验原理三草酸合铁(Ⅲ)酸钾,即K3Fe[(C2O4)3]·3H2O,为翠绿色单斜晶体,溶于水,难溶于乙醇。
110℃下失去三分子结晶水而成为K3Fe[(C2O4)3],230℃时分解。
该配合物对光敏感,光照下即发生分解。
三草酸合铁(Ⅲ)酸钾是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂,因而具有工业生产价值。
目前,合成三草酸合铁(Ⅲ)酸钾的工艺路线有多种。
例如,可以铁为原料制得硫酸亚铁胺,加草酸钾制得草酸亚铁后经氧化制得三草酸合铁(Ⅲ)酸钾;或以硫酸亚铁加草酸钾形成草酸亚铁经氧化结晶得三草酸合铁(Ⅲ)酸钾,亦可以三氯化铁、硫酸铁或硝酸铁与草酸钾直接合成三草酸合铁(Ⅲ)酸钾。
本实验以硫酸亚铁铵为原料,与草酸在酸性溶液中先制得草酸亚铁沉淀,然后再用草酸亚铁在草酸钾和草酸的存在下,以过氧化氢为氧化剂,得到铁(Ⅲ)草酸配合物。
改变溶剂极性并加少量盐析剂,可析出绿色单斜晶体纯的三草酸合铁(Ⅲ)酸钾。
用KMnO4标准溶液在酸性介质中滴定测得草酸根的含量,可以确定配离子的组成。
先用过量锌粉将Fe3+还原为Fe2+,然后再用KMnO4标准溶液滴定。
反应式为:5C2O42- + 2MnO4- + 16H+ = 10CO2↑ + 2Mn2+ + 8H2O5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O(NH4)2Fe(SO4)2 + H2C2O4 + 2H2O = FeC2O4·2H2O↓ + (NH4)2SO4 + H2SO42 FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 = 2K3[Fe(C2O4)3]·3H2O三、仪器和药品普通电子天平,精密电子天平,抽滤装置,烧杯(100 mL),电炉,3个锥形瓶(250 mL),酸式滴定管(50mL),表面皿,称量瓶,温度计,量筒(50 mL,100 mL)。

三草酸合铁(Ⅲ)酸钾的制备【教学目的】1. 使学生掌握由自制的硫酸亚铁铵制备三草酸合铁(III)酸钾的方法。
2. 使学生进一步练习称量、溶解、倾析法、水浴加热、常压过滤、减压过滤等基本操作。
【教学重点】使学生掌握根据目标化合物在不同溶剂中的溶解性和不同温度下的溶解度设计析出晶体的方案。
本次实验没有新的操作,一方面使学生进一步熟练掌握称量、溶解、倾析法、水浴加热、常压过滤、减压过滤的基本操作,另一方面,训练学生独立实验能力。
【教学内容】一、实验原理三草酸合铁(III)酸钾是一种绿色的单斜晶体,溶于水,不溶于乙醇。
0°C时,在水中的溶解度为4.7g,100°C时的溶解度是117.7g。
该物质见光易分解为黄色的草酸亚铁:2K3[Fe(C2O4)3]·3H2O = 3K2C2O4 + 2FeC2O4·2H2O+ 2CO2 + 2H2O 本实验以自制的硫酸亚铁铵为原料,通过沉淀,氧化还原,配位反应多步转化制得。
首先利用硫酸亚铁铵与草酸反应,制备草酸亚铁:(NH4)2Fe(SO4)2·6H2O + H2C2O4 = FeC2O4·2H2O↓+ (NH4)2SO4 + H2SO4 + H2O 然后在草酸钾存在下,用过氧化氢将草酸亚铁氧化为草酸合铁(III)酸钾配合物。
同时有氢氧化铁生成,反应为:6FeC2O4·2H2O + 3H2O2 + 6K2C2O4 = 4K3[Fe(C2O4)3] + 2Fe(OH)3↓+ 8H2O 加入适量草酸可使Fe(OH)3转化为三草酸合铁(III)酸钾,反应为:2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O加入乙醇避光放置,由于三草酸合铁(III)酸钾在乙醇中的溶解度很小,可析出绿色晶体。
后两步总反应式为:FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 = 2K3[Fe(C2O4)3]·3H2O + H2O二、实验步骤1. 草酸亚铁的制备称取 5.0g自制的硫酸亚铁铵于100mL烧杯中,加入15mL蒸馏水和几滴3mol·L−1的H2SO4,加热溶解后加入25mL饱和H2C2O4溶液,加热至沸,有黄色浑浊,倾析法弃去上层清液,用20mL热的蒸馏水分2~3次洗涤沉淀。


三草酸合铁(III)酸钾的制备、性质和组成分析(设计性实验)姓名:小土豆实验日期:2012-11-05三草酸合铁(III)酸钾的制备、性质和组成分析引言:三草酸合铁(III)酸钾合成工艺有多种,例如,可采用氢氧化铁和草酸氢钾反应;也可用硫酸亚铁铵与草酸反应得到草酸亚铁,再在过量草酸根存在下用过氧化氢氧化。
K3[Fe(C2O4)3]·3H2O为亮绿色晶体,溶于水(0℃时4.7g/100g水,100℃时117.7g/100g 水),难溶于乙醇、丙酮等有机溶剂。
110℃失去结晶水,230℃分解。
该配合物对光敏感;可进行下列光反应:2 K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2因此,在实验室中可用碱草酸根含铁(III)酸钾作成感光纸;进行感光实验。
另外,由于它具有光的化学性质,能定量进行化学反应,常用作化学光量计材料。
一、实验目的1.掌握三草酸合铁(III)酸钾的制备方法。
2.加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解;3.掌握容量分析等基本操作。
4.学习用高锰酸钾法测定C2O2-4与Fe3+的原理和方法。
二、实验原理本实验采用三氯化铁和草酸钾直接反应制备。
FeCl3 +3K2C2O4== K3[Fe(C2O4)3] +3KCl用稀H2SO4可使三草酸合铁﹝III﹞酸钾分解产生Fe3+和C2O42-,用高锰酸钾标准溶液滴定试样中的C2O2-4,此时Fe3+不干扰测定,滴定后的溶液用锌粉还原。
2Fe3+ +Zn==Zn2+ +2Fe2+过滤除去过量的锌粉,使用高锰酸钾标准溶液滴定Fe2+通过消耗高锰酸钾标准溶液的体积及浓液计算得到C2O42-和Fe3+的含量。
5Fe2+ + MnO4- + 8H+==5Fe3+ +Mn2+ +4H2O三、主要仪器和试剂台秤,抽滤瓶,布氏漏斗循环水泵,棕色容量瓶,烧杯,量筒,草酸钾(K2C2 O4 H2O,化学纯),三绿化铁(FeCl3·6H2O,化学纯),H2SO4(2mol/L,0.2mol/L) ,KMnO4标准溶液(0.0200mol/L),锌粉(分析纯),丙酮。