湿法磷酸生产原料 指标
- 格式:doc
- 大小:179.50 KB
- 文档页数:3

磷酸⼯艺磷酸⼯艺知识讲解第⼀讲⼆⽔湿法磷酸⼯艺原理⼀、湿法磷酸⽣产化学反应原理1、反应⽅程式:Ca5(PO4)3F + 5H2SO4+ 5n?H2O = 5CaSO4?nH2O + 3H3PO4+ HF↑磷矿⽯硫酸磷⽯膏(副产品) 磷酸(产品) 尾⽓其中,未定变量n有三种值,分别为0、1/2、2,则对应的副产品也分为三种,分别为⽆⽔物、半⽔物与⼆⽔物。
同时对应的⽣产⽅法也分别叫:⽆⽔法、半⽔法与⼆⽔法。
在实际的国内乃⾄国际⼯业⽣产中,⼆⽔法磷酸的⽣产⼯艺占80%以上。
2、⼆⽔法磷酸⼯艺原理:当n=2时,1中的⽅程式为:Ca5(PO4)3F + 5H2SO4 + 10H2O = 5CaSO4?2H2O + 3H3PO4+ HF↑3、硫酸分解中磷矿分两步完成①磷矿⾸先被磷酸分解:Ca5(PO4)3F+7H3PO4=5Ca(H2PO4)2+HF② Ca(H2PO4)2与硫酸反应⽣成磷酸:5Ca(H2PO4)2 + 5H2SO4 + 10H2O = 5CaSO4?2H2O + 10 H3PO4由上可知,磷矿在反应槽中⾸先与槽内的磷酸反应,所以⼯艺上应将硫酸加⼊点放在磷矿加⼊点的后⾯位置。
4、什么叫⼆⽔湿法磷酸⼯艺?磷酸的⼯业⽣产⽅法分为热法⽣产与湿法⽣产两类。
从⼴义上讲,凡是⽤酸分解磷矿制成的磷酸,称为湿法磷酸,通常⽤硫酸分解磷矿,所以上述⽤硫酸分解磷矿,且副产品是⼆⽔物的磷酸⽣产⼯艺称为⼆⽔湿法磷酸⼯艺。
5、⼆⽔法⼯艺技术主要特点:(与半⽔法或其它⽅法相⽐较)①流程简单、操作稳妥可靠;②装置建⼚数量最多,且单系列⽣产规模最⼤,居各种⼯艺之⾸;③对磷矿适应性强,特别对我国磷矿品位低,杂质含量⾼的情况尤为适⽤;④在较低的酸温和较低的酸浓度下操作,使得衬胶设备和不锈钢设备使⽤寿命延长;⑤⼆⽔⽯膏过滤不受过滤机类型限制,转台式、翻盘式及带式均可使⽤;⑥⼯业化磷酸装置P2O5收率⼀般在94%——96%之间。
⼆、湿法磷酸⽣产的原料湿法磷酸⽣产的主要原料是磷矿与硫酸。

湿法磷酸的浓缩湿法磷酸的浓缩字体大小:大| 中| 小2010-07-28 09:43 -阅读:237 -评论:0一、浓缩的工艺原理和方法采用二水法生产得到的磷酸,其质量分数只有20%~24%P2O5,而生产重钙时,磷酸的质量分数要求在45% P2O5以上,因此稀磷酸必须通过浓缩处理。
磷酸的浓缩被认为是一种困难的操作,这是因为湿法磷酸中含有约2%的H2SO4和约2%的H2SiF6(以F计),具有很强的腐蚀性,同时在加热浓缩的过程中,稀磷酸中已处于过饱和或饱和状态的杂质,随磷酸浓度的不断升高而析出,并沉积在器壁表面,另外还存在着浓缩过程中废气的处理问题。
磷酸的浓缩的方法以其加热方式可分为两类,即直接加热和间接加热蒸发。
1、直接加热蒸发直接加热蒸发是最简单的方式进行浓缩,磷酸与热气体直接触,就其设备而言,直接加热蒸发可以克服中间传热蒸发所引起的腐蚀和结垢问题。
广泛应用于磷酸浓缩的直接加热器有鼓泡浓缩流程浸没燃烧蒸发器及湿壁蒸发器等。
但是在过去的二十几年里,这类装置的使用已逐步减少,主要是燃料费用太高和达不到环保要求的废气排放标准。
2、间接加热蒸发间接加热蒸发是加热蒸汽通过传热介质(如列管的管壁)向磷酸传热,由于磷酸浓缩时,随着P2O5浓度的提高,传热表面上淤渣结垢和设备管道服饰问题,影响传热性能和结构材料。
广泛应用于磷酸浓缩的间接加热器有强制循环真空蒸发列管换热器。
湿法磷酸采用蒸汽间接加热蒸发浓缩,磷酸的质量分数在0~76% P2O5时,其沸腾平衡气相中只存在水蒸气,理论上可以将磷酸浓缩到很高浓度,但是随着磷酸浓度的提高,同时稀磷酸溶液中某些杂质组分由于溶解度降低而析出沉淀,结果磷酸的黏度上升,是磷酸操作变得很困难。
实际生产中,磷酸黏度上升到70MPa·s以上,浓缩操作就难于进行。
二、磷酸浓缩工艺流程1、工艺流程图及简介来自稀磷酸贮槽的稀磷酸经计量后加入石墨列管换热器出口,与经过加热后的循环酸混合并进入蒸发室内蒸发其中的水份。

硅钼蓝分光光度法测定湿法磷酸中的二氧化硅硅钼蓝分光光度法是一种广泛应用于化学分析中的方法,特别适用于测定磷酸盐中的二氧化硅。
本文将介绍硅钼蓝分光光度法的原理、实验步骤和注意事项,以及其在湿法磷酸中测定二氧化硅的应用。
一、硅钼蓝分光光度法原理硅钼蓝是一种蓝色染料,它可以与磷酸盐中的二氧化硅形成复合物,形成的复合物在400nm附近有一个吸收峰。
通过测量这个吸收峰的强度,可以计算出样品中的二氧化硅含量。
二、实验步骤1. 样品制备:将待测样品称取一定量,加入适量的去离子水,用磁力搅拌器搅拌均匀,过滤掉杂质,取滤液备用。
2. 标准曲线制备:取一系列二氧化硅浓度不同的标准溶液,分别加入硅钼蓝试剂,测量吸光度,绘制标准曲线。
3. 光度计校准:将光度计调至400nm处,用去离子水进行零点校准。
4. 测定样品吸光度:将样品溶液加入硅钼蓝试剂,混合均匀,放置10分钟后,测量吸光度。
根据标准曲线,计算出样品中的二氧化硅含量。
三、注意事项1. 样品制备和测量过程中要注意洁净卫生,避免杂质的干扰。
2. 标准曲线制备时要注意标准溶液的准确浓度,以及试剂的使用量和混合均匀程度。
3. 测量样品吸光度时,要保证样品与试剂充分混合,并且放置时间要一致。
四、应用硅钼蓝分光光度法在湿法磷酸中测定二氧化硅的应用非常广泛。
湿法磷酸是一种重要的化学原料,在农业、化工、医药等领域都有广泛的应用。
其中,二氧化硅是湿法磷酸生产过程中的一个重要指标。
利用硅钼蓝分光光度法可以快速、准确地测定湿法磷酸中的二氧化硅含量,为生产和质量控制提供了可靠的依据。
总之,硅钼蓝分光光度法是一种简单、快速、准确的化学分析方法,特别适用于测定磷酸盐中的二氧化硅。
在湿法磷酸生产中,它具有重要的应用价值。
通过本文的介绍,相信读者已经对硅钼蓝分光光度法有了更深入的了解。

湿法磷酸一段综合控制指标1.磷酸浓度控制:湿法磷酸生产过程中,磷酸的浓度是一个关键的控制指标。
过高的磷酸浓度会增加设备堵塞的风险,过低的磷酸浓度则会影响产品质量。
因此,需要通过调节输入原料的含磷量、调整稀酸磷酸阀门开度等措施,保持磷酸浓度在合适的范围内。
2.温度控制:湿法磷酸生产过程中,温度是一个重要的控制参数。
过高或过低的温度都会对生产过程产生不利影响。
过高的温度会引起磷酸氧化反应的进行过快,导致磷酸质量下降;而过低的温度则会导致反应速度过慢,降低生产效率。
因此,需要通过控制冷却水的流量和温度、调节加热装置的功率等措施,维持合适的反应温度。
3.pH值控制:湿法磷酸生产过程中,pH值是一个关键的控制指标。
过低的pH值会使得磷酸反应速率降低,无法达到预期的产量和质量;而过高的pH值会引起磷酸的分解和氧化,同样会影响产品质量。
因此,需要通过适当控制稀酸进料速率、定期补加酸液等措施,保持适当的pH值。
4.硫酸浓度控制:湿法磷酸生产过程中,硫酸是一个常用的催化剂,但过高的硫酸浓度会增加磷酸生产过程中产生的酸性废水量,对环境造成负面影响。
因此,需要通过调整硫酸加入量、控制磷酸的分解程度等措施,维持适当的硫酸浓度。
5.搅拌速度控制:湿法磷酸生产过程中,搅拌速度对反应速率和产物分布有重要影响。
过高的搅拌速度会增加能耗和设备磨损,过低的搅拌速度会导致反应不充分。
因此,需要通过调整搅拌电机的转速、选择合适的搅拌装置等措施,控制搅拌速度。
6.物料流量和质量控制:湿法磷酸生产过程中,物料的流量和质量是生产效率和产品质量的重要影响因素。
因此,需要对物料进出料口进行定期检查和校准,确保流量和质量的准确控制。
以上是湿法磷酸一段综合控制指标的一些方面,通过对这些指标的合理控制,可以提高湿法磷酸生产过程的效率和产品质量,降低能耗和环境污染。



一、实验目的1. 了解湿法磷酸的制备原理和工艺流程。
2. 掌握湿法磷酸的制备方法和操作步骤。
3. 通过实验验证湿法磷酸制备过程中的关键参数对产品质量的影响。
二、实验原理湿法磷酸制备原理:以磷矿石为原料,通过硫酸或盐酸等无机酸浸出,得到粗磷酸,再经过净化、浓缩等步骤,最终得到湿法磷酸。
三、实验材料与仪器1. 实验材料:- 磷矿石(P2O5含量≥30%)- 硫酸(浓度98%)- 碳酸钠(纯度≥99%)- 硫酸铵(纯度≥99%)- 氢氧化钠(纯度≥99%)- 活性炭- 滤纸- 实验用水2. 实验仪器:- 磷矿石浸出装置- 磷酸浓缩装置- 蒸馏装置- pH计- 电热恒温水浴锅- 电子天平- 磷酸滴定仪- 离心机四、实验步骤1. 磷矿石浸出- 将磷矿石破碎至小于10mm的颗粒。
- 将破碎后的磷矿石与硫酸按一定比例混合,放入浸出装置中。
- 控制浸出温度和浸出时间,使磷矿石充分浸出。
- 浸出液经过滤,得到粗磷酸。
2. 净化- 将粗磷酸与活性炭混合,进行吸附净化。
- 吸附后的磷酸通过滤纸过滤,去除活性炭。
- 调节pH值至6.5-7.5,使磷酸中的杂质离子沉淀。
3. 浓缩- 将净化后的磷酸放入浓缩装置中,加热浓缩。
- 控制浓缩温度和浓缩时间,使磷酸浓度达到要求。
4. 脱水- 将浓缩后的磷酸通过蒸馏装置进行脱水,得到湿法磷酸。
5. 检测与分析- 对制备的湿法磷酸进行P2O5含量、pH值、杂质离子含量等指标的检测。
- 分析实验数据,探讨关键参数对产品质量的影响。
五、实验结果与分析1. P2O5含量:实验制备的湿法磷酸P2O5含量达到(以P2O5计)≥40%。
2. pH值:实验制备的湿法磷酸pH值在6.5-7.5范围内。
3. 杂质离子含量:实验制备的湿法磷酸中,铁、镁、铝等杂质离子含量均低于国家标准。
4. 实验数据分析:通过实验数据可以看出,影响湿法磷酸制备质量的关键参数有浸出温度、浸出时间、净化温度、净化时间、浓缩温度、浓缩时间等。

我国磷矿湿法制磷酸和磷铵的物化数据测试磷酸和磷铵是我国广泛应用的化学品,具有广泛的用途,例如作
为肥料、工业原料、医药原料等等。
为了保证其质量,需要对其物化
数据进行测试。
首先是磷酸的物化数据。
磷酸是一种无机化合物,化学式为H3PO4。
其外观为无色、无臭的水溶性固体,密度为1.88 g/cm3。
磷酸在0℃时,其溶解度为14%,在100℃时,其溶解度达到85%。
磷酸的pH值为2.0左右,具有较强的酸性。
其熔点为42℃,沸点为158℃。
在空气中加热分解温度高达213℃,放出有毒气体O2、P2O5和H2O。
磷铵是一种在工业上广泛使用的化合物,是由磷酸和铵盐反应而成,其化学式为(NH4)3PO4。
磷铵为白色晶体,具有易溶于水的性质,
其密度为1.62 g/cm3。
磷铵的pH值为9.0左右,具有弱碱性。
磷铵通常用于制造化肥和清洁剂,还被应用于皮革、纺织、可乐和枪铅弹的
生产中。
在磷矿湿法制磷酸和磷铵的工业生产过程中,需要对其物化数据
进行测试,确保产品质量。
其中,有一些重要的参数需要测试,如酸
度、密度、含量等等。
在测试过程中,需要使用特殊的仪器和设备,如电子天平、比重计、pH计等等。
总的来说,磷酸和磷铵作为我国广泛应用的化学品,需要进行详细的物化数据测试,以保证其质量和安全。
在磷矿湿法制磷酸和磷铵的工业生产中,这些物化数据的测试显得格外重要。

湿法磷酸的生产广泛采用二水物流程,它具有操作控制容易、设备材质要求较低和对磷矿适应性强等特点,因而得到广泛采用。
但二水物法制得的产品酸浓度较低,通常为22%-28% P2O5。
需将其浓缩到40%-50% P2O5后才能用于磷铵和重钙等高浓度复合肥料的生产,因此需增加一套浓缩装置,能耗高;另外P2O5的收率较低,即使在最好条件下也很少超过96%,因为要维持水平衡,要想洗涤石膏滤饼达到完全回收可溶性P2O5是不可能的,为提高P2O5回收率和磷酸浓度,近年来开发出了半水一二水流程法,其产品酸浓度可达40%-45%P205以上,这种产品酸可以不经浓缩而直接用于生产磷铵及重钙等磷肥产品,并且P2O5的回收率可达98%,比二水物流程节能10%左右,得到的磷石膏质量较好,易于综合利用。
但该种流程对磷矿的质且有较高要求,腐蚀性较大,技术要求较高,但该种工艺流程的先进合理,应成为湿法磷酸的又一主要生产方法。
半水-二水法:此法特点是先使用硫酸钙形成半水物结晶,然后再水化重结晶为二水物。
这样可使硫酸钙晶格所含的P2O5释放出来,P2O5的总收率可达98%-98.5%以上,同时也提高了磷石膏的质量,扩大它的应用范围。
半水-二水法又分为一次过滤的稀酸流程(H法流程)和两次过滤的浓酸流程(C法流程)。
C法流程的特点是两次过滤。
H发改为C发后,产品酸由30%P2O5提高到了40%-45%P2O5 ,而且P2O5 工艺磷回收由97%提高到了98%以上。
虽然增加了一台过滤机,但是省去了浓酸设备,投资还是相当的。
总体生产所得磷石膏相对含水量偏高。

湿法磷酸的浓缩一、浓缩的工艺原理和方法采用二水法生产得到的磷酸,其质量分数只有20%~24%P2O5,而生产重钙时,磷酸的质量分数要求在45%P2O5以上,因此稀磷酸必须通过浓缩处理。
磷酸的浓缩被认为是一种困难的操作,这是因为湿法磷酸中含有约2%的H2SO4和约2%的H2SiF6(以F计),具有很强的腐蚀性,同时在加热浓缩的过程中,稀磷酸中已处于过饱和或饱和状态的杂质,随磷酸浓度的不断升高而析出,并沉积在器壁表面,另外还存在着浓缩过程中废气的处理问题。
磷酸的浓缩的方法以其加热方式可分为两类,即直接加热和间接加热蒸发。
1、直接加热蒸发直接加热蒸发是最简单的方式进行浓缩,磷酸与热气体直接触,就其设备而言,直接加热蒸发可以克服中间传热蒸发所引起的腐蚀和结垢问题。
广泛应用于磷酸浓缩的直接加热器有鼓泡浓缩流程浸没燃烧蒸发器及湿壁蒸发器等。
但是在过去的二十几年里,这类装置的使用已逐步减少,主要是燃料费用太高和达不到环保要求的废气排放标准。
2、间接加热蒸发间接加热蒸发是加热蒸汽通过传热介质(如列管的管壁)向磷酸传热,由于磷酸浓缩时,随着P2O5浓度的提高,传热表面上淤渣结垢和设备管道服饰问题,影响传热性能和结构材料。
广泛应用于磷酸浓缩的间接加热器有强制循环真空蒸发列管换热器。
湿法磷酸采用蒸汽间接加热蒸发浓缩,磷酸的质量分数在0~76%P2O5时,其沸腾平衡气相中只存在水蒸气,理论上可以将磷酸浓缩到很高浓度,但是随着磷酸浓度的提高,同时稀磷酸溶液中某些杂质组分由于溶解度降低而析出沉淀,结果磷酸的黏度上升,是磷酸操作变得很困难。
实际生产中,磷酸黏度上升到70MPa·s以上,浓缩操作就难于进行。
二、磷酸浓缩工艺流程1、工艺流程图及简介来自稀磷酸贮槽的稀磷酸经计量后加入石墨列管换热器出口,与经过加热后的循环酸混合并进入蒸发室内蒸发其中的水份。
浓缩后的部分浓磷酸从蒸发室溢流口流出,用浓磷酸泵送至浓磷酸贮槽。
大量循环酸用浓缩循环泵送入酸加热器,用经过减温减压后的低压饱和蒸汽加热,在浓缩循环回路中继续循环。
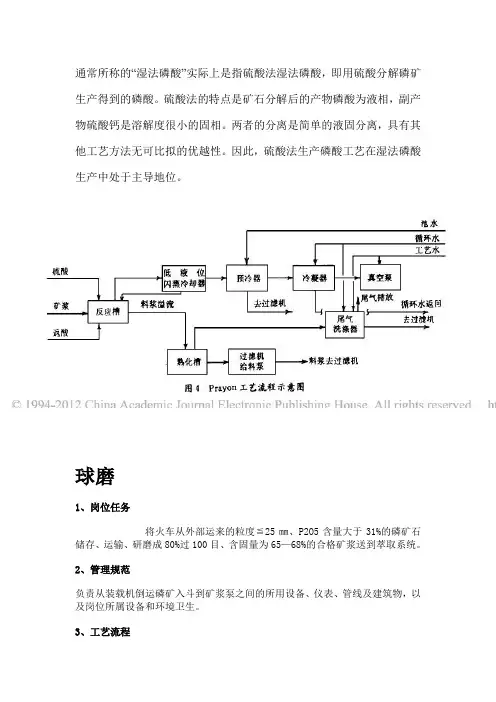
通常所称的“湿法磷酸”实际上是指硫酸法湿法磷酸,即用硫酸分解磷矿生产得到的磷酸。
硫酸法的特点是矿石分解后的产物磷酸为液相,副产物硫酸钙是溶解度很小的固相。
两者的分离是简单的液固分离,具有其他工艺方法无可比拟的优越性。
因此,硫酸法生产磷酸工艺在湿法磷酸生产中处于主导地位。
球磨1、岗位任务将火车从外部运来的粒度≦25㎜、P2O5含量大于31%的磷矿石储存、运输、研磨成80%过100目、含固量为65—68%的合格矿浆送到萃取系统。
2、管理规范负责从装载机倒运磷矿入斗到矿浆泵之间的所用设备、仪表、管线及建筑物,以及岗位所属设备和环境卫生。
3、工艺流程3.1、工艺流程简图装载机→磷矿储斗→皮带输送机→皮带运输机→魔头仓→电子皮带称→球磨机→滚筒筛→地下矿浆泵→矿浆槽→矿浆泵→萃取系统。
3.2、工艺描述运至厂内的粒度≦25㎜、含水量﹤10%的磷矿石储存于堆场,由装载机加入磷矿磷矿储斗,经过皮带机送入磨头仓内,磷矿通过电子皮带秤称重计量后加入球磨机,进行研磨。
所需水量,由电磁流量计与调节阀组成的用水计量系统根据磷矿含水量和加入矿量的多少,按一定比例把水加入磨机内。
其中极大部分水从磨机头加入,小部分水根据密度测定结果,从滚筒筛中加入适量的水,以控制矿浆含水量在32—35%,磨好的矿浆经过滚筒筛筛出大颗粒矿石,由手推车外运,筛下合格矿浆流入地坑内,用地下矿浆泵送至磷矿浆储槽内,在由矿浆给料泵送至萃取槽,系统内产生的污水储存在污水地坑内,由污水泵打至磨机头部,循环使用。
3.2、工艺指标(1)矿浆含固量65-68%(2)矿浆含粒度 80%过100目(3)矿浆储槽液位 60-80%(不超过90%)浓密将来自磨矿系统的低浓度矿浆,经过重力沉降浓密至含固量为60—68%的合格矿浆送到萃取系统。
2、管理规范负责从矿浆管近浓密系统矿浆出口到送入萃取装置之间的所有设备、仪表、管线及建筑物,以及岗位所属设备和环境卫生。
3、工艺流程3.1、工艺流程简图原料矿浆储槽→浓密机喂料泵→浓密机出料泵→陈品矿浆储槽→萃取喂料泵→萃取系统。
湿法磷酸工艺设计一、工艺流程湿法磷酸工艺是一种将磷矿经过浸出、净化、结晶等工序,制成高纯度的磷酸盐产品的方法。
其主要流程包括:1. 破碎:将原料磷矿经过粗碎和细碎,使颗粒度达到要求。
2. 浸出:将破碎后的磷矿放入浸出槽中,加入稀硫酸进行浸出反应。
3. 净化:通过过滤、沉淀等净化手段,去除杂质和不纯物质。
4. 结晶:将净化后的液体通过蒸发、冷却等方式进行结晶,制得高纯度的磷酸盐产品。
二、工艺参数湿法磷酸工艺中需要控制的主要参数包括:1. 硫酸用量:硫酸用量对浸出效果和产品质量有重要影响。
一般情况下,硫酸用量为原料重量的2-3倍。
2. 浸出时间:浸出时间对浸出效率有直接影响。
通常情况下,浸出时间为6-8小时左右。
3. 净化方式:净化方式包括过滤、沉淀、离子交换等多种方法。
不同的净化方式对产品质量和生产成本有不同的影响。
4. 结晶条件:结晶条件包括温度、浓度、冷却速率等。
不同的结晶条件会影响产品的结晶形态和纯度。
三、工艺优化为了提高湿法磷酸工艺的效率和产品质量,需要进行以下优化措施:1. 优化浸出反应条件:通过控制硫酸用量、浸出时间等参数,提高浸出效率和产品纯度。
2. 优化净化方式:选择合适的净化方式,如离子交换技术,可以大幅度提高产品纯度。
3. 优化结晶条件:通过调整结晶温度、浓度等参数,使产品结晶形态更加均匀,提高产品质量。
4. 优化能源利用:通过采用余热回收等技术手段,降低生产成本并减少环境污染。
四、安全措施湿法磷酸工艺中存在一定的安全风险,在生产过程中需要采取以下安全措施:1. 严格控制硫酸用量,避免产生有害气体。
2. 严格控制浸出温度和时间,避免发生爆炸事故。
3. 加强现场管理,保证设备正常运行,防止泄漏和事故发生。
4. 做好应急预案,提高应急处置能力。
五、总结湿法磷酸工艺是一种重要的化工生产方法。
通过优化工艺参数和安全措施,可以提高产品质量和效率,并保证生产过程的安全。
未来,随着科技的不断进步,湿法磷酸工艺将会得到更加广泛的应用和发展。
湿法磷酸标准一、湿法磷酸简介湿法磷酸,也称为硫酸法磷酸或化学法磷酸,是一种通过化学反应将磷矿石转化为磷酸的方法。
它是磷酸生产的主要方式之一,与热法磷酸(也称为热力学磷酸)和萃取法磷酸(也称为冷法磷酸)并列。
二、湿法磷酸生产工艺湿法磷酸的生产工艺主要包括以下几个步骤:1.磷矿石的粉碎和干燥:将磷矿石进行粉碎和干燥,以提供良好的反应条件。
2.硫酸与磷矿石的反应:将硫酸与磷矿石在高温高压条件下进行反应,生成磷酸和硫酸钙。
3.过滤分离:通过过滤器将生成的磷酸和硫酸钙分离,得到粗磷酸。
4.粗磷酸的精制:通过加热、蒸发、结晶等工艺,将粗磷酸提纯为成品磷酸。
5.废水处理:对生产过程中产生的废水进行处理,以防止环境污染。
三、湿法磷酸质量标准湿法磷酸的质量标准主要包括以下几个方面:1.纯度:湿法磷酸应具有高纯度,一般要求其纯度在97%以上。
2.密度:湿法磷酸的密度应符合相关标准要求,一般密度在1.65~1.70 g/cm³之间。
3.酸度:湿法磷酸的酸度应符合相关标准要求,一般酸度在75%~80%之间。
4.杂质含量:湿法磷酸中应严格控制杂质含量,如铁、砷、铅等元素含量应符合相关标准要求。
5.水份:湿法磷酸中水份含量应符合相关标准要求,一般水份在10%~20%之间。
四、湿法磷酸应用领域湿法磷酸作为一种重要的化工原料,被广泛应用于以下领域:1.肥料行业:湿法磷酸是制造磷肥的主要原料,特别是生产高浓度磷肥的主要原料。
它还可以与其他物质混合制备各种复合肥料。
2.食品行业:湿法磷酸在食品行业中主要用于制作食品添加剂和强化剂,如磷酸钙等。
它还可以用于制作一些食品包装材料。
3.医药行业:湿法磷酸在医药行业中可用于制备一些药物成分和药物中间体,如磷酸盐类药物等。
4.电子行业:湿法磷酸在电子行业中可用于制备一些电子化学品和材料,如磷酸盐玻璃等。
5.其他领域:湿法磷酸还可应用于涂料、颜料、催化剂等行业。
五、湿法磷酸生产安全湿法磷酸生产过程中存在一定的安全隐患,需采取以下措施进行防范:1.设备安全:应定期对设备进行检查和维护,确保设备运行正常,防止设备故障对生产过程产生影响。
湿法磷酸生产工艺技术1. 产品性质、规格及用途:湿法磷酸生产技术采用湿法二水物流程,主要产品为44—46%P2O5的磷酸,副产品为12—18%H2SiF6的氟硅酸。
磷酸为五价磷的含氧酸,有正磷酸、偏磷酸、焦磷酸三种,通常所说的磷酸指正磷酸(H3PO4)。
纯磷酸在常温下呈透明的单斜晶体,比重为1.88g/ml,熔点为42.4℃,含P2O5 72.4%。
一般商品磷酸是含有75%或85%H3PO4的液体,溶液的冰点分别为-20℃及21℃,低于此温度时将析出半水物结晶,磷酸对皮肤有腐蚀性,能吸收空气中的水份,为中强酸。
磷酸的用途很广。
湿法磷酸主要用于生产肥料,如磷酸一铵、磷酸二铵、重过磷酸钙、沉淀磷肥、过磷酸、液体肥料等。
其次用于工业磷酸盐的生产,如磷酸一钙、磷酸二钙、磷酸三钙、磷酸一钠、磷酸二钠、磷酸三钠等。
副产品氟硅酸的无水物是无色气体,不稳定,易分解为四氟化硅和氟化氢。
氟硅酸水溶液呈无色,具有强酸性,有腐蚀性,能腐蚀玻璃。
氟硅酸有消毒性能,主要用于生产氟硅酸盐和冰晶石,并用于电镀、啤酒消毒、木材防腐等。
2、生产原理湿法磷酸生产技术采用湿法二水物流程,单槽单浆、表面冷却、干法排渣、强制循环真空蒸发浓缩生产工艺。
2.1磷矿与硫酸反应1 反应原理磷矿的主要成分为氟磷酸钙Ca5F(PO4)3,另外还含有铁盐、镁盐、铝盐、钠盐、钾盐、碳酸盐、活性二氧化硅、酸不溶物等物质。
⑴磷矿与硫酸在反应槽内主要发生下列反应:Ca5F(PO4)3+5H2SO4+溶液5CaSO4 ·2H2 O+3H3PO4+HF+溶液生成的氢氟酸进一步与活性二氧化硅反应,得到氟硅酸:6HF+SiO2H2SiF6+2H2O当活性SiO2过量存在时,将继续发生下列反应:H2SiF6+SiO23SiF4+2H2OH2SiF6不稳定,受热易发生分解:H2SiF62HF+SiF4因此反应槽排出的尾气中含有HF和SiF4气体。
⑵磷矿中含有的碳酸盐与硫酸反应,产生二氧化碳气体,在反应槽液面上形成泡沫:CaCO3·MgCO3+2H2SO4CaSO4·2H2O+MgSO4+2CO2↑泡沫的产生会影响反应过滤正常运行,应设法消除。
湿法磷酸用矿质量评价磷酸是重要的中间产品,主要用于生产磷肥工业磷酸盐、饲料磷酸盐和食品磷酸盐等。
磷酸有湿法磷酸及热法磷酸。
湿法磷酸与相同质量的热法磷酸相比,其成本约低20 —25%,能耗约低20%。
目前国内外多以磷矿和硫酸为原料生产湿法磷酸,因此磷矿石的质量是制取磷酸的关键因素,评价磷矿质量好坏有下列几方面。
1、磷矿的品位磷矿的品位是指磷矿中P2O5 的含量,我国习惯以P2O5 计。
国际上则常用磷酸三钙(Triphos phate of lime,简称TPL)和骨质磷酸盐(Bonephos phateof lime,简称BPL)来表示含量,它们的关系是:80%BPL=80%TPL=36.6% P2O5=16%P;按上述关系换算则有:P2O5 x 2.185=BPL=TPL 或BPL x0.485= P2O5.此外,我国经常将P2O5含量为30%的矿石称为标矿。
用于湿法磷酸的磷矿,一般情况下是希望力求提高P2O5的品位。
然而,受矿石类型、杂质含量、选矿难易程度和后续产品方案等条件的制约,故而其含量要求也有所不同。
如当生产普钙时,制肥原料矿石中的円05含量要根据最终普钙产品所要求的最低P2O5含量而定。
对于湿法生产高浓度磷肥时,在原料其它杂质的含量(如:MgO、R2O3、SiO2等)不超过允许范围条件下,其p2O5含量随加工方法不同而有相应要求。
对于湿法磷酸生产,磷矿品位高低主要影响经济效益。
品位越低,生产单位质量P2O5的经济效益也越低,例如反应槽的容积利用系数,过滤机的生产强度将降低,这样工厂的产量将降低。
在磷酸生产中,磷酸P2O5的品位是决定系统水平衡的重要因素,当生产磷酸浓度恒定时,磷矿品位越低,按物料平衡计算允许加入过滤系统的洗涤水量也愈少,废渣的洗涤程度就会受到影响。
当洗涤水量减少到一定限度,不足以洗净滤渣中游离磷酸时,就只能降低生产磷酸的浓度,其结果将使以后的料浆浓缩或磷酸浓缩装置生产能力降低。
湿法磷酸净化制工业磷酸分析方法
一、重金属离子的测定
1.原理:重金属离子常以溶液的形式存在于湿法磷酸中,主要有铜、铅、锌等,这些重金属对磷酸的质量和产品的质量有很大影响。
因此,需要对湿法磷酸中的重金属离子进行测定。
2.步骤:
(1)取适量样品溶液,加入适量稀盐酸使其酸化。
(2)用氢硫化钠溶液使样品中的重金属离子沉淀为相应的硫化物。
(3)离心沉淀后,将上清液倒掉,沉淀用稀盐酸溶解。
(4)用硫化氢气体酸化后的甲基橙进行配比滴定,测出重金属离子的含量。
二、有机酸的测定
1.原理:有机酸是湿法磷酸中的主要杂质之一,通过对其含量进行测定,可以评估湿法磷酸的纯度。
2.步骤:
(1)采用酸碱滴定法,取适量样品溶液。
(2)加入适量酸式高锰酸钾溶液,进行滴定。
(3)根据滴定结果计算有机酸的含量。
三、铁离子的测定
1.原理:湿法磷酸中铁离子的含量直接影响到产品的质量,需对其进
行测定。
2.步骤:
(1)取适量样品溶液,加入鞣酸铵溶液和鞣酸溶液。
(2)用过硫酸铵氧化试剂进行氧化处理。
(3)用硫过硫酸亚铁标准溶液进行滴定。
(4)根据滴定结果计算铁离子的含量。
这些分析方法既可用于湿法磷酸原料的分析,也可以用于产品的分析,对于磷酸生产过程中的质量控制具有重要意义。
湿法磷酸生产原料硫酸的分子式
硫酸的分子式是:H2SO4,由此可知道它由2个氢原子、1个氧原子组成。
它的分子量是:2个氢原子量+1个硫原子量+4个氧原子量=分子量用分子式及符号经平衡后表示的化学反应过程叫化学方程式。
硫酸分子量98.08
不过硫酸通常不会是纯的,所以应该还有水的成分,所以在其后面按稀释程度加上MH2SO4·NH2O (M和N分别是比例系数)
磷矿石
磷是重要的化工原料,也是农作物生长的必要元素,工业用磷必须大量从磷
矿中提取,用于制造黄磷、赤磷、磷酸、磷肥、磷酸盐。
英文名为PHOSPHATE ROC
K 。
分子式:3Ca3(PO4)2CaR2。
磷矿石多产于沉积岩,也有产于变质岩和火成岩,除个别情况外,矿物中的磷总是
以正磷酸盐形态存在,磷的主要矿物为磷灰石。
磷灰石根据所含化学成分的不同,常分为:
碳氟磷灰石3Ca3(PO4)2CaF2,分子量:294;
氟磷灰石3Ca3(PO4)2CaF2,分子量:388;
氯磷灰石3Ca3(PO4)2CaCl2,分子量:421;
氢氧磷灰石Ca5(PO4)3OH,分子量346;
碳磷灰石Ca10(PO4)6(CO3),分子量1030;
磷的物理性质: 游离态磷有白磷、红磷和黑磷三种同素异型体.
白磷: 分子是由四个磷原子构成的正四面体. 键角60. 白色蜡状, 因常带有黄色
, 有叫黄磷. 难溶于水, 易溶于非极性溶剂如CS2,有剧毒(0.01g―0.06g致命),
着火点40℃所以少量的白磷保存在冷水;
红磷: 复杂的大分子, 结构尚未完全清楚, 但已知其结构中有磷原子构成的环和
链,棕红色粉末,基本无毒,常压下加热则升华为磷蒸汽, 遇冷凝结为白磷,难溶
于水和二硫化碳等;
黑磷: 黑色有金属光泽的晶体, 它是用白磷在很高压强和较高温度下转化而磷成
的, 使用价值不大。
我国磷矿资源比较丰富,已探明的资源储量仅次于摩洛哥和美国,居世界第3位。
云南、贵州、四川、湖北和湖南5省是我国主要磷矿资源储藏地区,储量达98.6亿
t,占全国总储量的74.5%。
磷化工包括磷肥工业、黄磷及磷化物工业、磷酸及磷酸盐工业、有机磷化
物工业、含磷农药及医药工业等等。
世界上磷矿石的消费结构中约80%左右用于农
业,其余的用于提取黄磷、磷酸及制造其它磷酸盐系列产品。
磷化工产品在工业、
国防、尖端科学和**生活中已被普遍应用。
除了在农业中用作磷肥、含磷农药、
家禽和牲畜的饲料以外,在洗涤剂、冶金、机械、选矿、钻井、电镀、颜料、涂料
、纺织、印染、制革、医药、食品、玻璃、陶瓷、搪瓷、水处理、耐火材料、建筑
材料、日用化工、造纸、弹药、阻燃及灭火等方面广泛使用。
随着科技的发展,高
纯度及特种功能磷化工产品在尖端科学、国防工业等方面被进一步的推广应用,出
现了大量新产品,如:电子电气材料、传感元件材料、离子交换剂、催化剂、人工
生物材料、太阳能电池材料、光学材料等等。
由于磷化工产品不断向更多的产业部
门渗透,特别是在尖端科学和新兴产业部门中的应用,使磷化工成为国民经济中的
一个重要的产业。
磷化工产品在人们的衣、食、住、行各个领域,发挥着越来越重
要的作用。
石灰石的分子式
CaCO3碳酸钙
生石灰和熟石灰以及石灰石是Ca的主要化合物。
它们的主要成分是
生石灰:CaO氧化钙
熟石灰:Ca(OH)2氢氧化钙
石灰石:CaCO3碳酸钙
碳酸钙【分子式】CaCO3 【分子量】100.09
生石灰氧化钙化学【分子式】CaO【分子量】56.08比重:3.25-3.38熔点:2580℃-沸2850℃
石灰石CaCO3是由矿山开采出来的一种矿石
石灰是一种俗称,是包括生石灰和熟石灰
生石灰CaO是由石灰石煅烧而成
熟石灰Ca(OH)2是由生石灰加水反应而成
石膏有二种:生石膏也叫石膏(CaSO4·2H2O)也是矿山开采出来的一种矿石
熟石膏CaSO4·1/2H2O是由石膏煅烧而成
石灰石主要成分是碳酸钙CaCO3,而生石灰主要成分是CaO。
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑摩氏硬度值(MOH):3
化学成分:CaCO3
晶系:六方晶系
分子量100.09
化学分析:
二氧化硅0.07%、三氧化二铝0.02%、三氧化二铁0.03%、氧化钙55.22%、氧化镁0.08%、
石灰石块状/粉状:烧失量40.79%,硅4.62%,铝1.21%,铁0.52%,钙50.16%,镁1.10%
白云石粉/块:硅0.19%,铝0.15%,铁0.17%,钙32.1%,镁21.19%
高温煅烧
CaCO3 ====== CaO + CO2
CaO+H2O = Ca(OH)2 (这是一个剧烈的化学反应,能够烧熟鸡蛋)
Ca(OH)2+CO2=CaCO3(沉淀)+H2O (CO2不过量。
)
CaCO3+H2O+CO2=Ca(HCO3)2 (继续通CO2过量)
以上两式是检验碳酸根离子的化学方程式。
以上是它们的分子式。
石灰石是一种天然存在的石头,主要成分是
CaCO3碳酸钙,把石灰石放入窑炉中高温煅烧以后,就成了CaO氧化钙,俗叫生石灰,一般成较脆的块状,生石灰能够吸收湿气,用来做干燥剂。
把生石灰放入水中,经过一段时间,就成了Ca(OH)2氢氧化钙,俗叫熟石灰,在这个过程中,将放出大量的热,熟石灰成松软状态,它的粘性大,建筑上可用来作砖石的粘合剂,属建材之一。
石膏有二种:生石膏也叫石膏(CaSO4·2H2O)含水硫酸钙,也是天然形成的一种矿石,属单斜晶系,化学成分:CaSO42H2O 特性:为一种含水硫酸钙矿物,硬度2,密度2.32,发育良好的晶体呈透明的称为透石膏。
纤维状、块状变种具绢丝光泽为纤维石膏,细粒块状称为雪花石膏。
生石膏开采后也是在窑炉中高温煅烧后生成熟石膏CaSO4·1/2H2O,生石膏的特征是,煅烧后失去部分所含的水,成为熟石膏;而熟石膏再和水混合则会硬化。
中药采用纤维状生石膏(Gypsum)炮制后入药。
性味归经: 辛、甘,大寒。
归肺、胃经。
功效: 清热泻火,除烦止渴,收敛生肌。
熟石膏也是一种建材,可以做成石膏粉、石膏板、石膏线等等。
医药上用它做成石膏绷带,用于外科临床。