第六章 化学平衡
- 格式:doc
- 大小:118.00 KB
- 文档页数:6

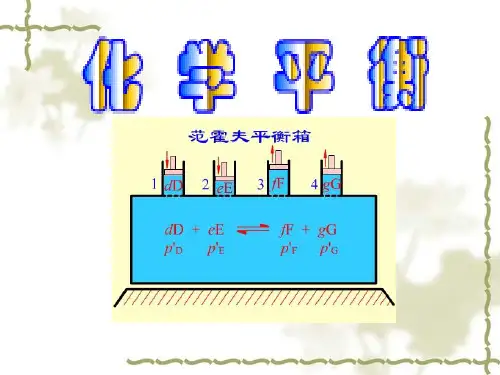





第6章 化学平衡1. 化学平衡: 是指可逆反应在一定条件下,正反应速率等于逆反应速率时,反应体系所处的状态,称为“化学平衡”。
化学平衡是一种动态平衡。
2. 平衡常数: 在一定温度下,可逆反应达到平衡时,产物浓度的方程式计量系数次方乘积与反应物计量系数次方的乘积之比为一常数,称为“平衡常数”.这一规律称为“化学平衡定律”.符号为K 。
3. 经验平衡常数(、)与标准平衡常数c K p K θK()()[]平衡j i c c p p K j i νθνθθ//∏•∏=()∑=νRT K K c p 4.平衡常数的意义: 表示在一定条件下,可逆反应所能进行的极限。
K ↑,正反应彻底↑。
通常:K >107,正反应单向; K <10-7,逆反应单向; K = 10-7 ∼107,可逆反应。
5.多重平衡原理如 2个方程式相加,则: K = K 1 × K 2如2个方程式相减,则: K = K 1 /K 26. Van ’t Hoff 化学反应等温式:△G = △G ø + RT ln J p r (封闭体系、等温、不做非体积功)它表明了任意状态的△G 与△G ø和T 的关系,提供了任意状态下判断反应自发性的依据。
7. 影响化学平衡的因素 (1) 浓度△GJp r 与K r 关系 反应自发性 0Jp r = K r 平衡状态 < 0Jp r < K r 正反应自发 >0Jp r > K r 逆反应自发(2) 温度ln (K ø2 /K ø1 )= (△H ø/R ) [(T 2 -T 1)/(T 2T 1)]△H ø > 0 吸热, T 2 > T 1 : K 2r > K 1r△H ø < 0 放热, T 2 < T 1 : K 2r > K 1r(3) 压强无气体反应物和产物,改变总压力,对平衡几乎无影响。
n (g) = 0 的反应,在一定温度下改变总压力,平衡不移动。



第六章 化学平衡【复习题】【1】请判断下列说法是否正确,为什么? (1)某一反应的平衡常数是一个不变的常数;(2)r m G θ∆是平衡状态时,Gibbs 自由能的变化值,因为ln r m pG RT K θθ∆=-; (3)反应222CO g H O CO g +H g +()(g )()(),因为反应前后气体分子数相等,所以无论压力如何变化,对平衡均无影响;(4)在一定的温度和压力下,某反应的 0r mG θ∆,所以要寻找合适的催化剂,使反应得以进行;(5)某反应的0r mG θ∆,所以该反应一定能正向进行;(6)平衡常数值改变了,平衡一定会移动;反之,平衡移动了,平衡常数值也一定改变。
【解析】(1)不正确;因为平衡常数是温度的函数,温度改变,平衡常数也改变;(2)不正确;r m G θ∆是标准状态时Gibbs 自由能的变化值。
(3)不正确;因为=0B ν,若气体为理想气体,则x c p K K K ==,p K 与压力无关;若气体为非理想气体,则KK K fr pθθ=,由于压力对K r有影响,所以压力对pK 也有影响。
(4)不正确;因为催化剂只能改变反应速率,不能改变反应方向。
因为0r m G θ∆,故无论用什么催化剂都不会改变反应方向。
(5)不正确;因为ln r m r m a G G RT Q θ∆=∆+,0r m G θ∆,r G ∆却不一定小于零,所以不能由反应的r m G θ∆来判断反应的方向。
(6)不正确;平衡常数值改变了,平衡不一定会移动,而平衡移动了,平衡常数不一定发生改变,故题中说法不正确。
【2】化学反应的r m G ∆的下标“m”的含义是什么?若用下列两个化学计量方程式来表示合成氨的反应,问两者的r m G θ∆,p K θ之间的关系如何? (1)()()()22332H g N g NH g + ,1,1,r m p G K θθ∆(2)()()()2233122H g N g NH g + ,2,2,r m p G K θθ∆答:r m G ∆的下标“m”的含义是反应进度为1mol 。
第六章 化学平衡一、选择题1、在恒温恒压下,某一化学反应达到平衡时,一定成立的关系式是( )(A)Δr G m >0 (B)Δr G m <0 (C)Δr G m =0 (D)Δr G m ø>02、当产物的化学势之和小于反应物的化学势之和时一定是( )(A)Δr G m (ξ)<0 (B)Δr G m (ξ)>0(C)Δr G m ø=0 (D)Δr G m (ξ)=(∂G/∂ξ)T ,p3、对于理想混合物反应体系,标准反应自由能与平衡常数之间的关系,不正确的是:( )(A) K RT G ln m r -=∆ (B) x K RT G ln m r -=∆(C) a K RT G ln m r -=∆ (D) c K RT G ln m r -=∆4、在恒温恒压下,化学反应 a A + b B = l L + m M 的ΔrGm 所代表的意义在下列说法中哪种是错误的? ( )(A)Δr G m 表示有限物系中反应进行时产物与反应物间的吉氏自由能之差(即终态与始态的自由能之差)(B)Δr G m 表示有限的反应物系处于该反应进度a 时的反应倾向(C)Δr G m 表示若维持各反应物化学势不变时发生一个单位反应时的吉布斯自由能变化(D)Δr Gm 代表变化率(∂G/∂a)T,p ,即表示在 G-a 图上反应进度为a 时的曲率线斜率5、已知1000K 时,(1)CO(g)+1/2 O 2(g)=CO 2(g) K ø⑴=1.659×1010(2)C(s)+CO 2(g)=2CO(g) K ø⑵=1.719则反应C(s)+1/2 O 2(g)=CO(g)的K ø⑶为( )(A)9.651×1010 (B) 1.036×1010(C)4.731×1010 (D)2.852×10106、在298K 时N 2O 4(g)=2NO 2(g)的K ø =0.142,当p(N 2O 4)=101.325kPa ,p(NO 2)=10.133kPa 时,判断反应的方向为( )(A)Q a <K ø,自发 (B) Q a > K ø,非自发(C)Q a = K ø,平衡 (D)Q a < K ø,非自发7、平衡常数与温度的关系为dlnK ø/dT=Δr H m ø/RT 2,对于任一反应( )(A)K ø必然随温度升高而加大 (B) K ø必然随温度升高而减小(C)K ø不随温度而变 (D)随温度升高K ø可增大、减小或不变8、某温度时,NH4Cl(s)分解压力是标准压力,则分解反应的平衡常数K0为:( )(A) 1 (B) 1/2 (C) 1/4 (D) 1/89、已知下列反应的平衡常数:H2(g) + S(s) = H2S(g) ①K1;S(s) + O2(g) = SO2(g) ②K2。
则反应 H2(g) + SO2(g) = O2(g) + H2S(g) 的平衡常数为:()(A) K1 + K2 (B) K1 - K2 (C) K1·K2 (D) K1/K210、某反应的Δr G mø=a-bT(a,b均大于零),下列说法中正确的是( )(A)升高温度有利于反应正向进行(B)降低温度,Kø增大(C)温度对平衡的影响不能确定(D)降低温度,有利于反应正向进行11、设反应a A + b B = g G + h H,在p下,300K时的转化率是600K的2倍,在300K下,总压力为p时的转化率是总压力2p的2倍,可推测该反应:()(A) 平衡常数与温度、压力成正比(B) 平衡常数与温度成正比,与压力成反比(C) 该反应是一个体积增加的放热反应(D) 该反应是一个体积增加的吸热反应12、在某温度下,一密闭的刚性容器中的 PCl5(g) 达到分解平衡,若往此容器中充入N2(g) 使体系压力增大二倍(此时体系仍可按理想气体处理),则PCl5(g) 的离解度将:()(A) 增大 (B)减小 (C)不变 (D)视温度而定13、反应 2NaHCO3(s)=Na2CO3(s)+H2O(g)+CO2(g) 在温度T时的标准平衡常数为90,该反应的压力平衡常数是( )(A)9119.25(kPa) (B)924008(kPa)2(C)9119.25 (D) 92400814、若反应气体都是理想气体,反应平衡常数之间有K a=K p=K x的反应是:()(1) 2HI(g) = H2(g) + I2(g);(2) N2O4(g) = 2NO2(g);(3) CO(g) + H2O(g) = CO2(g) + H2(g);(4) C(s) + CO2(g) = 2CO(g)(A)(1)(2) (B) (1)(3) (C) (3)(4) (D) (2)(4)15、理想气体反应CO(g) + 2H2(g)=CH3OH(g)的r mG∆与温度T的关系为: 0r mG∆=-21660+52.92T,若要使反应的平衡常数K>1,则应控制的反应温度: ( ) (A) 必须低于409.3℃ (B) 必须高于409.3 K(C) 必须低于409.3 K (D) 必须等于409.3 K16、已知反应 C(s)+H2O(g)→H2(g)+CO(g) 在1000K时,Kø=2.472,Δr H mø=1.36×105J·mol-1,ΔC p=0,则1200K时Kø的值( )(A)10.94 (B)3.758 (C)1.631 (D)37.5817、放热反应 2NO(g)+O2(g)→2NO2(g) 达平衡后若分别采取以下措施⑴增加压力;⑵减小NO2的分压;⑶增加O2的分压;⑷升高温度;⑸加入催化剂,能使平衡向产物方向移动的是( )(A)⑴ ⑵ ⑶ (B)⑷ ⑸ (C)⑴ ⑶ ⑷ (D)⑴ ⑷ ⑸18、假设各反应中的气体都是理想气体,则Kø=K p=K x=K n的反应是( )(A)CaCO3(s)= CaO(s)+CO2(g)(B)N2O4(g)= 2NO2(g)(C)2ZnS(s)+3O2(g)=2ZnO(s)+2SO2(g)(D)CO(g)+H2O(g)= CO2(g)+H2(g)19、反应 CH3COOH(l) + C2H5OH(l) = CH3COOC2H5(l) + H2O(l) 在25℃时平衡常数K为4.0,今以 CH3COOH 及 C2H5OH 各1mol混合进行反应,则达平衡最大产率为: ( )(A) 0.334% (B) 33.4% (C) 66.7% (D) 50.0%20、根据某一反应的r mG∆值,下列何者不能确定: ( )(A) 标准状态下自发变化的方向(B) 在r mG∆所对应的温度下的平衡位置(C) 在标准状态下体系所能作的最大非膨胀功(D) 提高温度反应速率的变化趋势21、某实际气体反应,用逸度表示的平衡常数Kf 随下列哪些因素而变: ( )(A) 体系的总压力 (B) 催化剂 (C) 温度 (D) 惰性气体的量22、在20℃时气相反应 A+B= 2L+M ,当达到平衡时应( )(A)Kø=1 (B)Kø>K p (C)Kø<K p (D)Kø=K p23、现有四个化学反应,在标准状态下,反应的自由能变化分别为Δr G mø⑴,Δr G mø⑵,Δr G mø⑶,Δr G mø⑷,且有Δr G mø⑴=Δr G mø⑵-Δr G mø⑶+2Δr G mø⑷,则这四个反应的平衡常数之间的关系为( )(A)K1ø=K2 ø·(K4 ø)2/K3ø (B)K1ø=K2ø-K3ø+2K4ø(C)K 1ø=2K 2ø·K 3ø/K 4ø (D)lnK 1ø=(K 2ø-K 3ø+2K 4ø)24、当温度T 时,将纯NH 4HS(s)置于抽空的容器中,则NH 4HS(s)发生分解:NH 4HS(s)= NH 3(g)+H 2S(g)测得平衡时物系的总压力为p ,则平衡常数K p 为( )(A)p 2/4 (B) p/4 (C)p 2 (D)p 2/225、298K 时,反应 CaCO 3(s)→CaO(s)+CO 2(g)的Δr G m ø=130.17kJ·mol -1,为了使CaCO 3顺利分解,可采取的最合适的措施是( )(A)增加CaCO 3的量 (B)降低CO 2的压力,减少CaO 的量(C)降低CO 2的压力和温度 (D)升高温度,降低CO 2的压力二、判断题1、因为θθp m K RT G ln -=∆,而θp K 是由平衡时的组成表示的,所以θm G ∆表示平衡时产物的吉布斯自由能与反应物的吉布斯自由能之差。
( )2、某一反应的平衡常数, 一定是一个不变的常数。
( )3、下列反应的平衡常数0K 为22CO O C =+为01k ;222CO O CO =+为02K ;CO O C =+221为03K ,则三个平衡常数间的关系为:020103/k k k =。
( ) 4、某化学反应00<∆m r H ,00<∆m r S ,则反应的标准平衡常数10>K ,且随温度升高而减小。
( )5、对于反应前后气体分子数减少的体系,保持温度不变,增加总压,θp K 将增大。
( )6、反应)(2)(3)(322g NH g H g N =+,00>∆m r H ,达到平衡后增加H 2的压力,能使平 衡的相对大小为:0K =P 。
( )7、对反应)()()(523g PCl g Cl g PCl =+,减小总压能提高3PCl 的转化率。
( )8、复分解反应如有沉淀、气体生成,容易进行完全,,因为不断析出沉淀或不断放出气体,反应始终达不到平衡因而能进行到底。
( )9、反应)()()()(222323g CO g O H s CO Na s NaHCO ++=的平衡常数p K 与分解压力P 的关系为P/2。
( )10、已达平衡时的化学反应,只有当温度改变时平衡才会移动。
( )三、计算题1、合成氨时所用氢和氮的比例为3:1,在400℃和105Pa 时,平衡混合物中氨的摩尔百分 数为3.85%,求:(1)反应 N 2(g)+3H 2(g)=2NH 3(g) 的K p ;(2)在此温度下,若要得到5%的氨,总压应为多少。