无机及分析化学习题无机化学基本知识图文稿
- 格式:docx
- 大小:285.63 KB
- 文档页数:7





第九章 配位化合物与配位滴定法习题1.是非判断题1-1中心离子的未成对电子数越多,配合物的磁矩越大。
1-2配合物由内界和外界组成。
1-3配位数是中心离子(或原子)接受配位体的数目。
1-4配位化合物K 3[Fe(CN)5CO]的名称是五氰根·一氧化碳和铁(Ⅱ)酸钾。
1-5一般说来,内轨型配合物比外轨型配合物稳定。
1-6配合物中由于存在配位键,所以配合物都是弱电解质。
1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。
1-8配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
1-9电负性大的元素充当配位原子,其配位能力强。
1-10在螯合物中没有离子键。
1-11配位物中心离子所提供杂化的轨道,其主量子数必须相同。
1-12配合物的几何构型取决于中心离子所采用的杂化类型。
1-13外轨型配离子磁矩大,内轨型配合物磁矩小。
1-14配离子的配位键越稳定,其稳定常数越大。
1-15氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH 3)4]2+,使铜溶解。
1-16在配离子[Cu(NH 3)4]2+解离平衡中,改变体系的酸度,不能使配离子平衡发生移动。
1-17已知[HgI 4]2-的4θβ=K 1,[HgCl 4]2-的4θβ=K 2,,则反应[HgCl 4]2-+4I -=[HgI 4]2-+4Cl -的平衡常数为K 1/K 2。
1-18 [Cu(NH 3)3]2+ 的积累稳定常数β3是反应[Cu(NH 3)2]2+ + NH 3⇔[Cu(NH 3)3]2+的平衡常数。
1-19已知θϕ[Fe 3+/Fe 2+]=0.77V ,电极反应[Fe(C 2O 4)3]3-+ e=[Fe(C 2O 4)2]2-+ C 2O 42-,在标准状态时,θϕ的计算式为:θθθθθϕϕc O C c c O C Fe c c O C Fe c Fe F /)(/])([/])([lg 0592.0)/e 2422242334223---+⋅++(= 。


第一章分散体系1-1 3%Na2CO3溶液的密度为1.03g·ml-1,配制此溶液200ml,需用Na2CO3·10H2O多少g?溶液的物质的量浓度是多少?解:设所需Na2CO3m克,则m=ρ·V·3%=1.03 g·ml-1×200 ml×3%=6.18gm(Na2CO3·10H2O) = 6.18 ×286 / 106 = 16.7 (g)c(Na2CO3)=m/[M(Na2CO3)·V]=6.18÷(106×0.200)=0.292(mol·L-1)1-2 为了防止500ml水在268K结冰,需向水中加入甘油(C3H8O3)多少克?解:设需加入甘油x克,根据题意ΔT f=273-268=5(K)ΔT f=K f·b(B)5K=1.86K·kg·mol-1×[x÷M(C3H8O3)÷0.5]x=(92g·mol-1×5K×0.50kg)÷1.86K·kg·mol-1x=123g1-3某水溶液,在200g水中含有12.0g蔗糖(M=342),其密度为1.022g·ml-1,,试计算蔗糖的摩尔分数,质量摩尔浓度和物质的量浓度。
解:x(蔗糖)=n(蔗糖)/[n(蔗糖)+n(水)]=(12.0÷342)÷[(12.0÷342)+ (200÷18.0)]=0.035÷[0.035+11.1]=0.035÷11.15=0.00314 b(蔗糖)= n(蔗糖)/m(水)=0.035÷(200×10-3)=0.175mol·kg-1c(蔗糖)= n(蔗糖)/V(溶液)=0.035÷[(200+12.0)/1.022]=0.169 mol·L-1 1-4 101mg胰岛素溶于10.0ml水中,该溶液在298K时的渗透压为4.34kPa,求胰岛素的摩尔质量。

无机及分析化学课后习题答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一、选择题1.等压下加热5%的下列水溶液,最先沸腾的是()A. 蔗糖(C12H22O11)溶液 B. 葡萄糖(C6H12O6)溶液C. 丙三醇(C3H8O3)溶液 D. 尿素( (NH2)2CO)溶液解:选A。
在等压下,最先沸腾就是指溶液的蒸气压最低。
根据难挥发非电解质稀溶液的依数性变化规律,溶液质量摩尔浓度增大,溶液的蒸气压下降。
这里,相同质量分数下,溶质的摩尔质量越小,质量摩尔浓度越大。
选项D中非电解质尿素的摩尔质量最小,尿素溶液的质量摩尔浓度最大,蒸气压最低,在等压下最先沸腾。
2.0.1mol·kg-1下列水溶液中凝固点最低的是()A. NaCl溶液B. C12H22O11溶液 C. HAc溶液 D. H2SO4溶液解:选D。
电解质溶液的依数性虽然不能用拉乌尔定律进行统一的定量计算,但仍然可以参照难挥发非电解质稀溶液的依数性进行定性描述。
即溶质的粒子数目增大,会引起溶液的蒸气压降低,沸点升高,凝固点下降和溶液的渗透压增大。
此题中,在相同质量摩尔浓度下,溶液中的粒子数目估算出来是H2SO4溶液最多,所以其凝固点最低。
3.胶体溶液中,决定溶胶电性的物质是()A. 胶团B. 电位离子C. 反离子D. 胶粒解:选D。
根据胶团结构,胶核和吸附层的整体称为胶粒,胶粒中反离子数比电位离子数少,故胶粒所带电荷与电位离子符号相同。
即胶粒带电,溶胶电性由胶粒决定。
4.溶胶具有聚结不稳定性,但经纯化后的Fe(OH)3溶胶可以存放数年而不聚沉,其原因是()A. 胶体的布朗运动B. 胶体的丁铎尔效应C. 胶团有溶剂化膜D. 胶粒带电和胶团有溶剂化膜解:选D。
溶胶具有动力学稳定性和聚结稳定性,而聚结稳定性是溶胶稳定的根本原因,它包含两个方面,胶粒带有相同电性的电荷,当靠近时会产生静电排斥,阻止胶粒聚结合并;而电位离子和反离子形成的溶剂化膜,也会阻隔胶粒的聚结合并。


无机及分析化学习题无机化学基本知识
集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
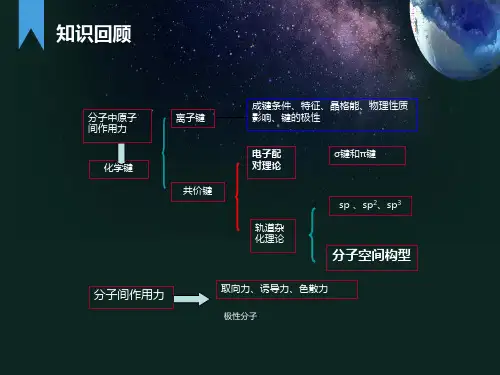
第一章无机化学基本知识
(一)填空题
中,决定原子轨道形状的是______,觉得原
1.在4个量子数n,l,m,m
s
子轨道在空间伸展方向的是______。
2.我国化学家提出能及的相对高低与主量子数n和角量子数l的关系是______,其值越大,轨道能量越高。
3.核外电子排布遵循的三个原则是________,________,________。
4.分散系是指____________________的体系。
NaCl、碘酒和泥浆都是分散系,他们分别是______、______、______。
5.与溶液溶质的性质无关,仅取决于____________的性质成为稀溶液的依数性,包括________,________,________,________。
6.丁达尔效应能够证明溶胶具有________性质,其动力学性质可以有________实验证明,电泳和电渗实验证明溶胶具有________性质。
7.常压下,海水的沸点________100℃.(填<,>,=)
8.人类不能饮用海水,吃冰激凌不如喝水解渴,以及海生生物不能在淡水中生存等现象都是与溶液的依数性之一________密切相关。
9.在寒冷的冬天施工是,常在混凝土中添加外加剂如CaCl、NaCl防冻,依据的化学原理为________________。
10.溶液产生渗透现象应具备的条件是_______和_______。
11.溶胶具有聚结稳定性的原因是有二,一是__________;二是
__________。
12.胶粒带电的原因有二,一是_______带电;二是_______带电。
13.当把直流电源两极插到由FeCI3水解制备的氢氧化铁溶胶中,通电后,在____极附近颜色逐渐变深,这种现象称为_______。
14.当溶剂中溶解了溶质以后,溶剂的部分表面被_______所占据,使蒸发的机会减少,所以达到平衡时溶液的_______低于_______的蒸气压。
15.胶体溶液中,决定溶胶典型的物质是________。
(二)判断题
16.在60.0mL质量浓度为1.065g/L、质量分数为58.0%的乙酸溶液,含有37.1g的乙酸。
( )
17.稀溶液的依数性规律是由溶液的沸点升高而引起的。
( ) 18.电解质溶液的蒸气压也要降低,但表现出的规律性没有非电解质溶液的强。
( )
19.蒸气压下降是溶液的通性。
( )
20.相同温度下,渗透压相等的两种非电解质溶液,其浓度也相同。
( )
21.在溶胶电泳实验中,胶粒恒向电场的正极一方移动。
( )
22.电子云密度大的地方,电子出现的概率也大。
()
(三)选择题(下列各题只有一个正确答案,请将正确答案填在括号内)
23.市售浓盐酸的浓度为( ) mol/L。
A.6
B.12
C.18
D.36
24. 2.0gH
2和14gN
2
混合,N
2
的物质的量分数是()
A.1/4
B.1/2
C.1/5
D.1/3
25. 土壤中养分的保持和释放与离子交换吸收有密切的关系,当土壤施铵态氮肥时,土壤中的Ca2+被()交换。
A.Na+
B.NH4+
C.NH3
D.酸根离子
26. 施肥过多时引起烧苗是由于土壤溶液的()比植物细胞液高。
A.蒸气压
B.冰点
C.沸点
D.渗透压
27. 一密闭容器内有一杯纯水和一杯糖水,若外界条件不改变,久置后这两个杯中( )。
A. 照旧保持不变 B糖水一半转移到纯水杯中
C.纯水一半转移到糖水杯中 D.纯水几乎都能转移到糖水杯中
28. 浮在海面上的冰,其中含盐的量( )。
A.比海水多 B.和海水一样 c.比海水稍少 D.极少
29.天气干旱时,植物会自动调节增大细胞液可溶物含量,以降低( )。
A.冰点 B.沸点 c.蒸气压 D.渗透压
30.气候变冷时,植物会自动调节细胞液的浓度,使冰点降低,细胞液浓度将( )。
A.增大 R减小 c.不变 D.都不是
31. 输液用5%的葡萄糖溶液或0.9%的生理盐水与人体血液的( )相等。
A.血压 R大气压 c.渗透压 D.蒸气压
32.真溶液的粒子直径比入射光的波长小得多,但看不到丁达尔效应,其原因是( )。
A.光发生了反射 B.发生了光的透射
c.发生了光的干涉 D.发生了光的折射
33.胶体溶液是动力学稳定体系,因为它有( )。
A.丁铎尔效应 B.电泳 c.电渗 D.布朗运动
34.决定溶胶胶粒带电的离子叫( )。
A.吸附层反离子 B.扩散层反离子 c.电位离子 D.反离子35.脂肪在消化过程中,需胆酸帮助才能变成微小液滴分散在水中,被肠胃黏膜吸收,胆酸所起的作用为( )。
A.保护作用 B.催化作用 C乳化作用 D.固化作用
溶液混合得到的溶胶,其( )。
36.由过量KBr溶液与AgN0
3
A.反离子是N0
B.电位离子是Ag+ C扩散层带负电 D.溶胶是负
3
溶胶
37.相同质量摩尔浓度的蔗糖溶液与NaCl溶液,其沸点( )。
A.前者大于后者 B.后者大于前者 C.两者相同 D.不能判断
38.将0℃水投0℃盐水溶液中,其结果是( )。
A.水会结冰 B.冰将融化 C.冰与溶液共存 D.不能判断39.将牛奶放人离心机进行离心分离,可使牛奶脱脂,该方法可以破坏( )。
A.真溶液&溶胶 c.乳浊液 D.脂肪
40.水和脂肪互不溶解,但在牛奶中能均匀地混合在一起,其原因是
( )
A .牛奶中的蛋白质起了乳化剂的作用 R 牛奶中又加入了乳化剂
C .牛奶中的蛋白质溶于水
D .牛奶中的乳糖是乳化剂
41.表面活性物质的分子结构中含有( )。
A .极性基团
B .非极性基团
C .两种都有
D .两种都没有
42.溶于水能显着降低水的表面张力的物质(如肥皂)称为( )。
A .活化剂
B .催化剂
C 表面活性物质
D .钝化剂
43.高分子化合物溶液对半透膜的行为( )。
A.不能透过 B .能透过 C.部分能透过 D .随半透膜不同而异 44医学上成5%的葡萄糖溶液为等渗溶液,这事因为( )
A.它与水的渗透压相等
B.它与5%NaCl 的渗透压相等
C.它与血浆的渗透压相等
D.它与尿的渗透压相等
45. 溶液的凝固点总是( )纯溶剂的凝固点。
A. 等于
B.高于
C.低于
D. 无法确定
(四)计算题
46.质量分数10%的盐酸,密度为1.047g .mL-1。
求:
(1)盐酸的物质的量浓度c(HCl);
(2)物质的量分数x(HCl)各为多少?
47. 有10.3g K 2CO 3·15 H 2O 的样品溶于150g 水中,以K 2CO 3计,溶液
中K 2CO 3的质量分数为多少溶质的质量摩尔浓度又为多少已知K 2CO 3·15 H 2O 量为408,K 2CO 3的式量为138。
48. 30.3g乙醇溶于50.0g四氯化碳中,配成溶液密度为1.28g/cm-3。
计算:(1)子纯的质量分数;(2)乙醇的物质的量分数;(3)乙醇的物质的量浓度。