串联质谱
- 格式:ppt
- 大小:673.00 KB
- 文档页数:3


三重四极杆串联质谱一、三重四极杆串联质谱的原理三重四极杆串联质谱是一种基于离子激发和离子分析的技术。
它由三个四极杆组成,每个四极杆都具有一个电场和一个磁场,可以对离子进行加速、分离和聚焦。
首先,样品通过离子源产生离子,然后进入第一个四极杆,通过调节电场和磁场来筛选离子。
接着,离子经过激发,激发成不稳定的离子态,然后再进入第二个四极杆进行进一步的分离和筛选。
最后,离子进入质谱仪进行质谱分析,得到样品的质谱图谱。
二、三重四极杆串联质谱的应用三重四极杆串联质谱在化学、生物和医药领域有着广泛的应用。
在化学领域,它可以用于分析复杂的有机化合物、无机化合物和高分子化合物,如蛋白质、DNA和RNA。
在生物领域,它可以用于分析生物样品的代谢产物、蛋白质组学、脂质组学和糖类组学。
在医药领域,它可以用于药物分析、代谢物分析和药物代谢动力学研究。
此外,三重四极杆串联质谱还可以结合其他分析技术,如色谱和电泳,进行多维分析,提高分析的灵敏度和分辨率。
三、三重四极杆串联质谱的发展趋势随着科学技术的不断发展,三重四极杆串联质谱也在不断改进和创新。
一方面,质谱仪器的灵敏度和分辨率不断提高,可以检测到更多的化合物和离子。
另一方面,质谱数据处理和分析的软件也不断升级,可以更方便地进行质谱数据的解释和应用。
此外,随着生物技术和医学技术的快速发展,三重四极杆串联质谱将会更多地应用于生物医学研究和临床诊断。
总之,三重四极杆串联质谱是一种重要的分析技术,它具有高灵敏度、高分辨率和广泛的应用领域。
随着科学技术的不断进步,三重四极杆串联质谱将会在化学、生物和医药领域发挥越来越重要的作用。
希望本文对读者对三重四极杆串联质谱有更深入的了解,并对相关研究和应用提供帮助。

串联质谱标记技术的应用
串联质谱标记(Tandem Mass Spectrometry,简称MS/MS)是一种常
用于分析生物大分子的技术,例如蛋白质和核酸。
它通过两个连续的质
谱过程来实现目标分子的识别和结构解析。
首先,样品经过质谱仪进行单一电荷态离子化,形成带电离子。
然后,
在第一级质谱(MS1)中,这些带电离子会根据它们的质量/电荷比(m/z)进行分离,并生成一个质谱图,其中显示了不同离子的丰度。
接下来,在第二级质谱(MS2)中,选择MS1中感兴趣的一个或多个特
定离子(称为前体离子),将其从MS1中分离出来。
然后,这些前体离
子在碰撞池中与高能量的气体发生碰撞,导致它们进一步解离成更小的
离子碎片。
在碰撞解离过程中产生的离子碎片会根据它们的m/z值在第二级质谱中
进行分离,并形成一个新的质谱图。
这个图谱显示了前体离子所产生的
碎片离子的相对丰度和m/z值,提供了关于目标分子的结构信息。
通过对比实验样品和标准物质的MS/MS谱图,可以确定样品中的目标分
子是什么物质,从而实现化合物的鉴定和结构解析。
串联质谱标记技术在生物学研究、药物开发、代谢组学等领域具有广泛
的应用,可以帮助科学家深入了解生物分子的组成和结构,从而推动科
学研究和医药领域的进展。
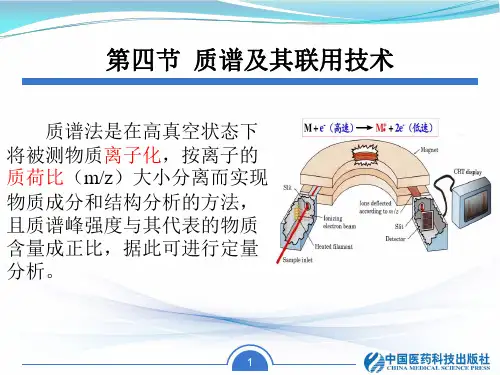

串联质谱测定肽段序列的原理与方法串联质谱法(Tandem Mass Spectrometry,简称MS/MS)是一种广泛用于确定肽段或蛋白质的氨基酸序列的分析技术。
这种技术主要基于两个质谱技术:质谱分析(Mass Spectrometry,MS)和串联质谱(Tandem Mass Spectrometry,MS/MS)。
本文将详细讨论串联质谱测定肽段序列的原理和方法。
1.原理:质谱分析(Mass Spectrometry,MS)是一种测量和分析化学物质离子质量和相对丰度的技术。
在质谱仪中,样品被气化并离子化,然后通过离子能量分析器分离出不同质量/电荷比(m/z)的离子。
MS/MS将两个MS仪放在一起使用。
首先,一台MS仪将样品分解为碎片离子,然后这些碎片离子经过质量分析器分离出不同m/z值。
然后,这些碎片离子进入第二台MS仪,通过二次质谱分析进一步鉴定和确定它们的结构。
2.方法:串联质谱测定肽段序列的方法通常包括以下几个步骤:(1)蛋白质或肽段的酶解:首先,蛋白质样品通过特定的酶进行酶解,将蛋白质降解为短肽段。
常用的酶包括胰蛋白酶、胰蛋白二酶、氨基肽酶等。
(2)质谱分析:酶解后的肽段样品被注入质谱仪进行质谱分析。
常用的质谱仪包括电喷雾质谱(Electrospray Ionization Mass Spectrometry,ESI-MS)和基质辅助激光解吸/电离质谱(Matrix-Assisted Laser Desorption/Ionization Mass Spectrometry,MALDI-MS)。
其中,ESI-MS是将样品通过电喷雾离子源转化为带电离子,然后通过毛细管进入质谱仪分析;MALDI-MS是通过激光解吸蒸发样品中的分析物,将其带向质谱仪质量分析器分析。
(3)鉴定肽段:鉴定肽段是将质谱图的离子片段与已知蛋白质数据库进行比对,找到最佳匹配。
鉴定肽段主要是利用质量对电荷比(m/z)值和碎片离子的相对丰度分析。

串联质谱如何定量串联质谱(tandem mass spectrometry, MS/MS)是质谱技术的一种高级形式,能提供比传统单段质谱更准确和详细的结构信息和定量分析。
串联质谱通过将两个或多个质谱过程连接在一起,可以同时获取目标化合物的质荷比和结构信息,从而实现定量分析。
本文将详细讨论串联质谱的定量方法和技术。
串联质谱的定性分析方法包括以下几种:预先设定法、无损失扫描法、选离子扫描法、多级质谱扫描法以及峰面积比法。
其中,预先设定法是基于连接两个或多个质谱过程,目标化合物将在每个过程中选择性地分离并产生特定的质谱峰。
实验者需要预先了解化合物的反应特性,然后设置适当的质谱条件来获取需要的信息。
例如,一种常用的方法是利用电子轰击(electron impact, EI)产生的质谱碎片特征来进行预先设定。
无损失扫描法是一种通过串联质谱实现碰撞诱导解离(collision-induced dissociation, CID)和多级质谱(multiple stage mass spectrometry, MSn)来分析和确认目标物的结构和组成的方法。
在这种方法中,化合物经过主谱的质谱过程后,在碰撞池中与分子间或分子内发生碰撞,产生与化学反应相关的碎片,然后在子谱中通过CID进一步产生新的碎片,并获得更多的结构信息。
选离子扫描法是通过选择目标离子的特定质荷比进行扫描,在质谱中只记录特定离子质荷比(m/z)范围内的质谱峰。
这种方法可以在样品中进行高选择性和高灵敏度的分析。
多级质谱扫描法是将多个串联质谱过程连接在一起,以获取更详细的结构信息。
例如,通过对前体离子进行CID产生新的碎片离子,然后对新的碎片离子再进行CID。
这种方法可以提供更丰富的结构信息,用于更准确地确定目标化合物。
除了以上定性分析方法外,串联质谱还可以用于定量分析。
串联质谱的定量分析方法包括靶向定量和无靶定量。
靶向定量是通过调整仪器的质谱参数以选择性地监测目标化合物的特定离子峰,从而实现无损失或有损失的定量分析。

百泰派克生物科技
串联质谱鉴定蛋白质
串联质谱鉴定蛋白质原理
串联质谱通过检测在质谱中获得的肽段碎片的分子质量来鉴定蛋白质,鉴定内容包括蛋白质的分子质量、蛋白质或多肽一级结构以及修饰位点等。
经过酶解的肽段在质谱仪中按照一定的规律解离成不同系列的离子,通过分析不同系列相邻离子的质量差等质谱数据推算氨基酸的质量及序列,进一步分析得到蛋白或多肽的分子质量和结构等信息。
串联质谱鉴定蛋白质技术
蛋白质串联质谱鉴定技术基于肽段中氨基酸序列的特异性对蛋白质进行鉴定,一次性分析蛋白酶解的所有肽段,解析其序列,比传统的蛋白质鉴定方法更简便、更准确、灵敏度更高。
适当调整后还可以鉴定蛋白翻译后修饰。
串联质谱技术在蛋白组学研究中发挥着越来重要的作用,已成为蛋白组学研究最先进的工具。
百泰派克生物科技使用Thermo公司最新推出的Obitrap Fusion Lumos质谱仪结合Nano-LC,可实现来自蛋白质提取物、SDS-PAGE蛋白条带、2D蛋白胶点、pull-down及co-IP等样品中的蛋白质进行高效精准的蛋白质谱鉴定服务,欢迎免费咨询152-****7680。

气相色谱串联质谱原理气相色谱串联质谱(GC-MS)是一种广泛应用的分析技术,通过将气相色谱(GC)与质谱(MS)相结合,可以提供高分辨、高灵敏度和高特异性的化学分析结果。
GC-MS在环境科学、食品安全、药物分析等领域被广泛使用。
GC-MS的原理基于两个关键技术:气相色谱和质谱。
气相色谱是一种用于分离和分析化合物的技术,它利用物质在气相中的分配系数差异来分离混合物。
质谱则是一种分析化合物结构和组成的技术,它通过测量碎片离子的质量/电荷比(m/z)来鉴定和定量分析样品中的化合物。
在GC-MS中,样品首先通过气相色谱柱进行分离。
气相色谱柱通常是一种长而细的管道,表面涂有化学物质,用于增加化合物与柱材之间的相互作用和分离效果。
当样品进入气相色谱柱时,插入柱口的进样针将样品注入,然后通过加热来蒸发,使其转化为气态物质。
样品分子在柱材上的分配系数差异导致它们以不同的速率通过柱子,从而实现分离。
待分离的化合物将以一定的时间间隔进入质谱仪。
质谱仪由离子源、质谱仪和数据系统组成。
离子源将进入的化合物转化为气态离子,然后将其传输到质谱仪,质谱仪在不同的m/z比下进行检测和记录。
质谱仪的第一部分是质子化室,它使用高能电子束或化学离子化技术将进入的化合物转化为正离子或负离子。
然后,在质谱仪的分析器中,离子按照它们的质荷比被分离为不同的离子流,每个离子流都表示一种特定的化合物。
分离后,离子在检测器中被收集,产生一个离子当量和m/z比的电流。
GC-MS的输出是质谱图,其中x轴表示m/z比,y轴表示所生成离子的相对信号强度。
通过与数据库中的标准化合物的质谱进行比对,可以确定样品中存在的化合物。
GC-MS有许多应用,如食品安全领域中的残留农药和有毒物质的分析,医药领域中药物代谢产物的鉴定,环境科学中有机污染物的监测等。
其优点包括高灵敏度、高分辨率、高特异性和广泛的分析能力。
总之,GC-MS利用气相色谱和质谱技术的结合,提供了一种高效、高分辨的化学分析方法。

串联质谱法和质谱法的区别
串联质谱法(Tandem Mass Spectrometry,简称MS/MS)和质谱法(Mass Spectrometry,简称MS)是两种常见的质谱技术,它们在分析样品分子结构和组成方面有一些区别。
1. 分析原理:MS/MS是基于两个阶段质谱分析的方法。
首先,通过质谱仪对样品中的分子进行离子化,得到一系列的离子片段。
然后,选择其中一个特定的离子片段作为前驱离子,再次通过离子化,生成更多的离子片段。
而MS则是通过质谱仪对样品中的分子进行离子化,然后对离子进行分析和检测。
2. 分析信息:MS/MS相比于MS可以提供更加详细的结构和组成信息。
通过两次离子化和产生的离子片段,可以提供更多的结构信息,包括分子中的官能团、它们之间的连接方式等。
而MS主要用于确定样品中分子的质量和相对丰度等信息。
3. 应用场景:MS/MS广泛应用于蛋白质组学、代谢组学等领域。
它可以提供更加精确的分析结果,帮助鉴定复杂混合物中的化合物以及定量分析。
而MS主要用于样品的质量和相对丰度分析,常用于化学、药物、环境等领域。
4. 仪器要求:MS/MS相对于MS需要更复杂的仪器配置。
MS/MS 需要具备两个质谱仪(选择性质谱仪),能够实现两次离子化和片段分析。

串联质谱一般扫描模式之精读质谱仪是一种用于分析化学物质的仪器,在化学、生物、环境等领域有着广泛的应用。
质谱仪的工作原理是将待测样品分解成带电离子,然后根据带电离子的质荷比分别进行分离和检测。
在质谱仪中,串联质谱(MS/MS)是一种常见的工作模式,它可以进一步提高分析的灵敏度和选择性。
串联质谱的基本原理是在两个质谱仪之间设置其中一种物质选择器件,例如碰撞单元或离子阱。
首先,样品经过母离子质谱(MS1)的第一次离子化,产生离子碎片。
然后,离子碎片进入碰撞单元或离子阱,再次离子化,生成更多的离子碎片。
最后,这些离子碎片进入子离子质谱(MS2)进行分离和检测。
串联质谱具有以下优点:1.提高灵敏度:通过多次离子化和离子碎片的产生,串联质谱可以提高质谱分析的灵敏度。
这是因为离子碎片的产生会增加检测信号的强度,并且在离子阱中积累更多的离子,从而增加了信号的信噪比。
2.提高选择性:串联质谱可以通过选择性地采集和分析特定的离子碎片来提高选择性。
通过调整碰撞能量或离子阱的电场,可以选择性地产生特定的离子碎片,从而提高对目标化合物的分析和识别能力。
3.降低干扰:由于串联质谱可以选择性地分离和检测特定的离子碎片,可以减少来自样品矩阵和其他杂质的干扰。
这有助于提高样品的准确性和可靠性。
4.结构确定:串联质谱可以通过分析离子碎片的质荷比和相对丰度,来确定分子化合物的结构。
通过比对离子碎片的质荷比和相对丰度与已知的数据库进行比对,可以快速确定目标化合物的结构。
需要注意的是,在进行串联质谱分析时1.碰撞能量:碰撞能量的选择会影响离子碎片的产生和相对丰度。
较低的碰撞能量可产生更多的母离子和断裂离子,而较高的碰撞能量可产生更多的碎片离子。
在实际操作中,需要根据目标化合物的离解特性来选择合适的碰撞能量。
2.离子阱参数:离子阱的参数,如电场强度、真空度等,会影响离子碎片的积累和检测。
较高的电场强度可以加速离子的进入和排出,提高离子碎片的产生和检测。

液相色谱串联质谱临床应用建议液相色谱串联质谱(LC-MS/MS)是一种高灵敏度的分析技术,广泛应用于生物、医学、药物研发等领域。
在临床应用中,LC-MS/MS主要用于生物样本(如血液、尿液等)中药物代谢产物的定量分析,以及蛋白质、肽类等生物分子的定性和定量分析。
以下是一些关于LC-MS/MS临床应用的建议:1. 样本处理:在进行LC-MS/MS分析前,需要对样本进行适当的处理,如蛋白质沉淀、液液萃取等,以去除干扰物质并提高分析的准确性。
同时,应确保样本的保存和运输条件符合规定,以避免样本变质或污染。
2. 方法验证:为确保分析结果的准确性和可靠性,应对LC-MS/MS方法进行严格的验证。
包括方法的线性范围、灵敏度、精密度、稳定性和重现性等方面的评估。
此外,还应定期进行方法的更新和优化,以适应临床需求和技术发展。
3. 质量控制:在临床应用中,质量控制是确保分析结果准确性的关键。
应建立严格的质量控制体系,包括仪器校准、试剂质量控制、样品处理过程的质量控制等,以确保分析结果的准确性和可靠性。
4. 数据分析:LC-MS/MS产生的数据量较大,因此需要进行适当的数据处理和分析。
应建立规范的数据处理流程,包括数据的导入、预处理、峰识别、定量分析等步骤,以确保数据的准确性和可靠性。
5. 临床解读:在临床解读LC-MS/MS结果时,应结合患者的病史、用药情况、临床表现等综合信息进行判断。
同时,应注意与其他临床实验室检查结果的相互印证,以提高诊断的准确性。
总之,液相色谱串联质谱在临床应用中具有广阔的前景和重要的价值。
为确保分析结果的准确性和可靠性,应重视样本处理、方法验证、质量控制、数据分析和临床解读等方面的工作。
液相色谱串联质谱原理液相色谱串联质谱(LC-MS)是一种常用的分析技术,它将液相色谱和质谱联用,能够对复杂混合物中的化合物进行高效、灵敏的分析和鉴定。
液相色谱是一种在液相中进行分离的技术,而质谱则是一种通过分析化合物的质荷比来鉴定其结构和组成的技术。
液相色谱串联质谱将这两种技术结合起来,可以充分发挥它们各自的优势,提高分析的准确性和灵敏度。
首先,液相色谱的原理是基于化合物在不同固定相上的分配系数不同而实现分离的。
在液相色谱中,样品首先被注入到流动相中,然后通过固定相的柱子,不同化合物在固定相上的分配系数不同,从而实现了它们的分离。
而质谱则是一种通过分析化合物的质荷比来鉴定其结构和组成的技术。
质谱通过将化合物转化为离子,并对这些离子进行加速、分离和检测,从而得到化合物的质荷比,进而鉴定其结构和组成。
液相色谱串联质谱的原理是将液相色谱和质谱联用,首先通过液相色谱将复杂混合物中的化合物分离出来,然后再通过质谱对这些化合物进行分析和鉴定。
这种联用技术能够充分发挥液相色谱和质谱各自的优势,提高分析的准确性和灵敏度。
在液相色谱串联质谱中,样品首先被注入到流动相中,然后通过固定相的柱子,不同化合物在固定相上的分配系数不同,从而实现了它们的分离。
分离后的化合物进入质谱进行分析和鉴定,质谱通过将化合物转化为离子,并对这些离子进行加速、分离和检测,从而得到化合物的质荷比,进而鉴定其结构和组成。
总的来说,液相色谱串联质谱原理是将液相色谱和质谱联用,充分发挥它们各自的优势,提高分析的准确性和灵敏度。
液相色谱通过分离样品中的化合物,而质谱通过分析和鉴定这些化合物。
两者结合起来,可以对复杂混合物中的化合物进行高效、灵敏的分析和鉴定。
这种技术在生物、药物、环境等领域有着广泛的应用,为科学研究和工业生产提供了有力的分析手段。
高效液相色谱-串联质谱法高效液相色谱-串联质谱法(HPLC-MS/MS)是一种现代化分析技术。
它结合了高效液相色谱(HPLC)和串联质谱(MS/MS)两种分析方法,能够快速、准确、灵敏地分析复杂的混合样品中的多种化合物。
HPLC-MS/MS技术的基本原理是将样品通过高效液相色谱进行分离,然后以极高的分辨率将分离后的化合物导入串联质谱分析仪中进行质谱检测和分析。
HPLC部分能够通过改变流速、温度、化合物间隔、载气、反应物、固相分离等方法来分离样品中的成分。
MS/MS 部分则能够通过改变离子源、离子传输、离子选择和离子检测等方式检测化合物。
具体来说,HPLC-MS/MS技术的实现过程如下:需要准备一定量的样品。
样品通常是一种混合物,需要进行分离和净化。
这可以通过一系列的化学方法和生物技术实现。
将样品注入到高效液相色谱仪中进行分离。
高效液相色谱仪通过改变环境条件可以分离出复杂混合物中的单个分量,比如改变洗脱剂的浓度、PH值、离子强度来调整样品中化合物的排列顺序。
高效液相色谱仪具有高速分离和高效洗脱的特点,具有处理大量和复杂样品的能力。
接着,通过HPLC输出的流缓和制备离子源,离子源生成的离子对化合物分子进行离子化。
这个过程利用化合物分子上的R基或者H+来形成游离气态的化合物离子。
然后,将产生的离子通过串接质谱进行分析。
在离子进入串联质谱仪的离子源之前,需要将它们选择性的分离为固定质量和电荷比的离子,这可以通过一系列的电子和电场进行控制来实现。
所得到的离子被送至陷入式离子阱,通过对离子的激发和断裂等过程,形成包含多种离子片段的离子质谱图谱。
这些离子片段遵循一定的质量电荷比的规律,可以通过特征峰和离子质量比等独特的质谱性质来鉴别。
将这些片段的数据输入到质谱数据库中,与已知化合物的质谱数据进行比对。
这样,就能够得到混合物中的每个化合物的特定质谱图谱,从而通过质量分析进行结构确认和鉴定。
HPLC-MS/MS技术的优点是明显的,该技术具有高效和灵敏的特点,能够分析非常低的浓度样品成分。
凯莱谱液相色谱串联质谱
凯莱谱液相色谱串联质谱是一种先进的检测技术,结合了液相色谱的高分离能力和串联质谱的高灵敏度和特异性。
这种技术可以用于检测和鉴定各种生物样品中的小分子化合物,如类固醇激素、脂溶性维生素等。
在凯莱谱液相色谱串联质谱中,样品首先通过液相色谱进行分离,将不同性质的化合物分离成不同的组分。
然后,这些组分通过质谱进行检测,通过离子化、裂解和能量损失等过程,得到每个组分的质谱图。
通过对质谱图的分析和处理,可以确定每个组分的化学性质和结构信息。
凯莱谱液相色谱串联质谱具有高灵敏度、高特异性和高分辨率等特点,可以用于痕量分析、复杂样品分析、多组分同时检测等方面。
这种技术已经广泛应用于药物研发、食品安全、环境监测等领域。
总之,凯莱谱液相色谱串联质谱是一种先进的检测技术,具有广泛的应用前景。
串联质谱项目的优势
串联质谱(tandem mass spectrometry,MS/MS)是一种用于分析化合物的质谱技术,它具有以下优势:
1. 高灵敏度:串联质谱可以检测极低浓度的化合物,因为它可以在第一级质谱中选择特定的母离子,然后在第二级质谱中对其进行碎裂和检测。
这使得串联质谱能够检测到传统质谱技术无法检测到的低浓度化合物。
2. 高选择性:串联质谱可以通过选择特定的母离子和碎裂模式来提高分析的选择性。
这使得串联质谱能够在复杂的混合物中准确地识别和定量目标化合物。
3. 高准确性:串联质谱可以提供化合物的确切质量,从而提高分析的准确性。
这对于确定化合物的结构和识别同分异构体非常重要。
4. 多功能性:串联质谱可以与其他分析技术(如色谱)结合使用,以提高分析的分辨率和选择性。
此外,串联质谱还可以用于定性和定量分析,以及结构鉴定和蛋白质组学等领域。
5. 快速性:串联质谱可以在短时间内提供大量的分析数据,这使得它成为高通量筛选和快速分析的理想选择。
总之,串联质谱具有高灵敏度、高选择性、高准确性、多功能性和快速性等优势,这些优势使得它成为现代分析化学中不可或缺的技术之一。