RAS及抑制剂
- 格式:ppt
- 大小:552.50 KB
- 文档页数:37

肝癌药物新成果—RAS抑制剂肝癌给患者带来的痛苦是难以想象的,全世界每年新发肝癌患者约六十万,居恶性肿瘤的第五位。
肝癌到了晚期再进行治疗的话,难度会变得相当大,往往存在不易控制转移,预后差的特点。
有些患者也是可以进行手术治疗的,不过主要是针对身体素质好,且转移部位单一,瘤体较小的肝癌患者,但手术切除容易导致复发,甚至引起严重并发症,多不主张手术治疗。
由于肝癌患者晚期身体状况较差,多数易发生扩散转移,治疗时要以控制症状、增强疗效、提高患者免疫力为原则。
部分患者可考虑化疗或者放射治疗,但须考虑患者的承受能力,根据具体的病情和患者综合素质选择。
靶向治疗也成为了癌症晚期较主要的治疗方法之一,因为很多患者都会发生不同类型的基因突变,所以靶向药物也就应运而生。
经过放疗后的肝癌患者有可能产生一系列的功能紊乱与失调,如精神不振,食欲下降,身体衰弱,疲乏,恶心呕吐,食后胀满等副作用。
而且大多数肝癌晚期患者都会有肝功能的减损,故饮食宜选用清淡、易消化,不宜进食过多高蛋白、高脂肪食品,因高蛋白、高脂肪饮食会加重肝脏、肾脏的负担,甚至可能诱发肝性脑病(肝解毒能力下降,过多的蛋白质分解产生大量的氨积聚在血液中,进入大脑使患者出现精神症状甚至昏迷、死亡)。
化疗其实主要就是使用药物来杀死肝癌细胞,所以对患者的身体会有较大的副作用。
对肝癌较为有效的药物以CDD[P为首选,常用的还有5Fu、阿霉素(ADM)及其衍生物、丝裂霉素、VP16和氨甲喋呤等。
一般认为单个药物静脉给药疗效较差。
采用肝动脉给药和(或)栓塞,以及配合内、外放射治疗应用较多,效果较明显。
对某些中晚期肝癌无手术指征,且门静脉主干癌栓阻塞不宜肝动脉介入治疗者和某些姑息性手术后患者可采用联合或序贯化疗。
靶向治疗是药物能够直接作用于发生突变的位点,更为准确地抑制癌细胞的增生与分化,成为治疗癌症的一个重要手段。
在服用靶向药物前,需做基因检测来判断发生突变的基因类型,才能对症下药。
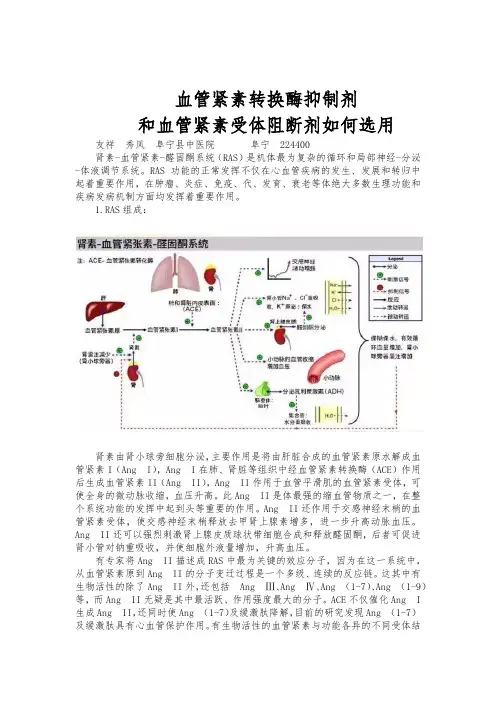
血管紧素转换酶抑制剂和血管紧素受体阻断剂如何选用友祥秀凤阜宁县中医院阜宁 224400肾素-血管紧素-醛固酮系统(RAS)是机体最为复杂的循环和局部神经-分泌-体液调节系统。
RAS功能的正常发挥不仅在心血管疾病的发生、发展和转归中起着重要作用,在肿瘤、炎症、免疫、代、发育、衰老等体绝大多数生理功能和疾病发病机制方面均发挥着重要作用。
1.RAS组成:肾素由肾小球旁细胞分泌,主要作用是将由肝脏合成的血管紧素原水解成血管紧素I(Ang I),Ang I在肺、肾脏等组织中经血管紧素转换酶(ACE)作用后生成血管紧素II(Ang II),Ang II作用于血管平滑肌的血管紧素受体,可使全身的微动脉收缩,血压升高。
此Ang II是体最强的缩血管物质之一,在整个系统功能的发挥中起到头等重要的作用。
Ang II还作用于交感神经末梢的血管紧素受体,使交感神经末梢释放去甲肾上腺素增多,进一步升高动脉血压。
Ang II还可以强烈刺激肾上腺皮质球状带细胞合成和释放醛固酮,后者可促进肾小管对钠重吸收,并使细胞外液量增加,升高血压。
有专家将Ang II描述成RAS中最为关键的效应分子,因为在这一系统中,从血管紧素原到Ang II的分子变迁过程是一个多级、连续的反应链。
这其中有生物活性的除了Ang II外,还包括Ang Ⅲ、Ang Ⅳ、Ang (1-7)、Ang (1-9)等,而Ang II无疑是其中最活跃、作用强度最大的分子。
ACE不仅催化Ang I 生成Ang II,还同时使Ang (1-7)及缓激肽降解,目前的研究发现Ang (1-7)及缓激肽具有心血管保护作用。
有生物活性的血管紧素与功能各异的不同受体结合,发挥不同的生物学效应。
这些受体包括AT1R、AT2R、AT3R、AT4R、Mas、胰岛素调节的氨肽酶(IRAP)等。
2.ACEI与ARB作用机制ACEI能竞争性地阻断Ang I转化为Ang II,从而降低循环和局部的Ang II水平,抑制其产生的氧化、炎性细胞黏附和纤维化等病理生理效应。


ras蛋白名词解释RAS蛋白是一种重要的信号转导分子,它在细胞内起着调控细胞增殖、分化和存活的关键作用。
RAS蛋白家族包括Harvey rat sarcoma viral oncogene homolog (HRAS)、Kirsten rat sarcoma viral oncogene homolog (KRAS) 和 Neuroblastoma RAS viral oncogene homolog (NRAS)三种成员。
RAS蛋白是一个GTP酶,在细胞内起着开关的作用。
当RAS蛋白结合到GTP时,它会被激活,并通过下游信号通路传递细胞生长和分化的信号。
而当RAS蛋白结合到GDP时,则处于不活跃状态。
RAS蛋白通过与其下游效应器相互作用,调控多个信号通路的激活。
其中一个重要的下游信号通路是MAPK(Mitogen-activated protein kinase)信号通路,它参与了细胞生长和分化的调控。
当RAS蛋白激活后,它可以通过激活MAPK通路,导致细胞核内的转录因子激活,从而调节基因表达,影响细胞的生物学功能。
RAS蛋白还可以通过调节PI3K(Phosphoinositide 3-kinase)信号通路,影响细胞的存活和增殖。
当RAS蛋白激活后,它可以激活PI3K,进而激活Akt信号通路,促进细胞的生长和存活。
此外,RAS蛋白还能调节细胞骨架的重排和细胞黏附,影响细胞迁移和浸润的能力。
RAS蛋白因其突变与一系列肿瘤的发生密切相关,成为人类研究的热点。
突变的RAS蛋白会导致其不受正常调控,在细胞内不断处于活跃状态,进而促进细胞的异常增殖和肿瘤形成。
据研究表明,RAS突变在多种癌症中广泛存在,如胰腺癌、结直肠癌和肺癌等,成为了药物靶点的重要候选。
因为RAS蛋白在细胞增殖和肿瘤发生中的关键作用,研究人员一直努力寻找RAS蛋白的调控机制和抑制剂。
尽管RAS蛋白目前被认为是难以靶向的,但在近年来的研究中,一些新的药物靶向RAS蛋白的策略已经取得了一定的进展,为RAS相关疾病的治疗提供了新的希望。

肾素-血管紧张素系统抑制剂在心力衰竭治疗中的进展心力衰竭(简称:心衰)是各种心血管疾病的严重和终末阶段,被称为“心脏病最后的战场”。
根据《中国心血管病报告》显示,中国35岁至75岁人群中,慢性心衰患病率为0.9%[1],且随着年龄增加显著上升。
肾素-血管紧张素系统(RAS)参与了心衰的发生与发展,研究证实通过抑制RAS可扩张血管、降低心脏负荷、抑制心室重构、抑制交感神经系统,改善心衰患者预后。
自上世纪八九十年代首次证实RAS抑制可使心衰患者获益至今,RAS抑制剂已被公认是治疗心衰最重要的药物之一。
1 RAS抑制剂药物类型传统的RAS抑制剂包括血管紧张素转换酶抑制剂(ACEI)、血管紧张素受体抑制剂(ARB)。
最近上市的沙库巴曲/缬沙坦是全球首个血管紧张素受体-脑啡肽酶抑制剂(ARNI),主要由缬沙坦和沙库巴曲按1:1 的比例结合而成。
不过二者并非简单地混合,而是以钠盐复合物的形式存在。
其中沙库巴曲是一种脑啡肽酶(NEP)抑制剂前体药物,其最小晶体结构是由阴离子部分(6 个分子的沙库巴曲和6 个分子的缬沙坦)、阳离子部分(18 个钠盐)和15 个分子的水组成[2]。
沙库巴曲缬沙坦通过阻滞血管紧张素Ⅱ受体和抑制脑啡肽酶,发挥舒张血管、预防和逆转心血管重构和促尿钠排泄等作用。
2 ARNI在射血分数减低型心衰(HFrEF)中的应用进展PARADIGM-HF 研究是一项大规模的Ⅲ期临床试验,该研究纳入了8442 例NYHA 分级为Ⅱ~Ⅳ级的HFrEF患者(纳入标准:LVEF≤35%、利钠肽水平升高以及之前至少接受4 周的依那普利(10 mg/d)或同等剂量的ACEI/ARB 类药物治疗),随机分配到沙库巴曲缬沙坦组(200 mg,每日2 次)和依那普利组(10 mg,每日2 次),持续随访27 个月,观察的终点指标是因心衰住院或因心血管疾病死亡时间。
研究结果显示,与依那普利相比,沙库巴曲缬沙坦使终点事件发生率下降20%,全因死亡率下降16%,心血管病死率下降20%,因心衰住院率下降21%。

RAS抑制剂减少蛋白尿,保护肾脏已有多项RCT研究证实,RAS抑制剂治疗在有效减少蛋白尿的同时能够保护肾脏,延缓慢性肾脏病的进展。
REIN和MICRO-HOPE研究结果表明,血管紧张素转换酶抑制剂(ACEI)治疗可减少非糖尿病及糖尿病患者的尿蛋白排泄率,降低心血管事件的风险。
AIPRI研究显示,对于合并慢性肾功能不全的患者,贝那普利与安慰剂相比,可使轻中度慢性肾功能不全患者发生肾脏终点事件(血清肌酐水平增加1倍、进入终末期肾脏病或死亡)的危险性减少38% 。
ESBARI研究证实,即便是血清肌酐值>3mg/dl的晚期(第4期)肾功能不全患者,用ACEI(贝那普利)治疗36个月时蛋白尿减少52%,内生肌酐清除率下降的危险降低24%,发展至终末期肾脏病的风险降低40%,主要终点减少43%(图2),并且ACEI对肾功能的保护独立于其降压作用。
同样,血管紧张素Ⅱ受体抑制剂(ARB)使2型糖尿病患者尿白蛋白/肌酐比值降低35%,达到肾脏硬终点的危险性降低16%。
由于蛋白尿(微量白蛋白尿)也是预示心血管事件的危险因素,因此减少蛋白尿也可能改善心血管病预后。
RENAAL研究结果表明,ARB减少2型糖尿病因心力衰竭而住院的次数,但不影响心血管的联合终点率(死亡和致残)。
目前尚无更多循证医学证据表明干预蛋白尿能改善慢性肾脏病人群的心血管病预后。
增加RAS抑制剂的抗蛋白尿效应尽管已有研究表明,增加RAS抑制剂的剂量可能会增强其抗蛋白尿作用,但针对蛋白尿的治疗能否改善慢性肾脏病的预后硬终点尚无循证医学证据。
为探索RAS抑制剂抗蛋白尿的最佳剂量及其对肾脏预后的影响,我们近年在中国慢性肾脏病人群中进行了一项前瞻、随机、开放标签、终点分析设盲的单中心临床研究——ROAD(Renoprotection of Optimal Antiproteinuric Doses,最佳抗蛋白尿剂量的肾脏保护)试验。
该研究共纳入360例有临床蛋白尿(尿蛋白定量>1.0g/d,超过3个月)和肾功能减退(血肌酐133~442 mmol/L)的非糖尿病慢性肾脏病患者,随机分入4组。


肾素—血管紧张素系统抑制剂治疗心力衰竭的循证依据作者:高秀芳施海明来源:《上海医药》2013年第17期摘要:肾素-血管紧张素系统(renin-angiotensin system, RAS)抑制剂在心力衰竭治疗中具有不可替代的地位。
本文简述RAS抑制剂的作用机制、分类和临床应用,着重回顾RAS抑制剂用于治疗心力衰竭的各项重要临床试验结果。
现有的临床证据表明,血管紧张素转化酶抑制剂仍是心力衰竭治疗的“基石”,其地位尚无其他RAS抑制剂能够替代。
对血管紧张素转化酶抑制剂不能耐受时可以血管紧张素Ⅱ受体拮抗剂替代,但目前没有足够的证据支持这两类药物联合用药治疗心力衰竭。
肾素抑制剂是一类新药,至今还无临床证据支持其用于心力衰竭治疗,且不良反应也值得关注。
关键词心力衰竭肾素-血管紧张素系统抑制剂血管紧张素转化酶抑制剂血管紧张素Ⅱ受体拮抗剂肾素抑制剂中图分类号:R972 文献标识码:A 文章编号:1006-1533(2013)17-0010-05肾素-血管紧张素系统(renin-angiotensin system, RAS)是一种激素系统,当大量失血或血压下降时被启动,能协助调节体内的血压与细胞外液量(体液平衡)。
任何原因引起血压下降时都会引起肾灌注下降和交感-肾上腺髓质系统兴奋,从而促使肾脏近小球细胞分泌肾素。
肾素会催化血管紧张素原水解产生血管紧张素(angiotensin, Ang)Ⅰ。
AngⅠ基本没有生物学活性,在肺循环中经血管紧张素转化酶(angiotensin-converting emzyme, ACE)剪切C-末端的2个氨基酸残基而转化为AngⅡ。
AngⅡ具有强力的血管收缩作用,可使血压升高。
此外,AngⅡ还会刺激肾上腺皮质分泌醛固酮。
醛固酮能促进肾脏对水和钠离子的重吸收,由此增加体液容量、升高血压。
心力衰竭患者的RAS持续过度激活,使血循环及组织中的AngⅡ等缩血管物质浓度升高,导致心室后负荷增加;同时会使醛固酮过度分泌,引起水-钠潴留,导致心室前负荷增加。


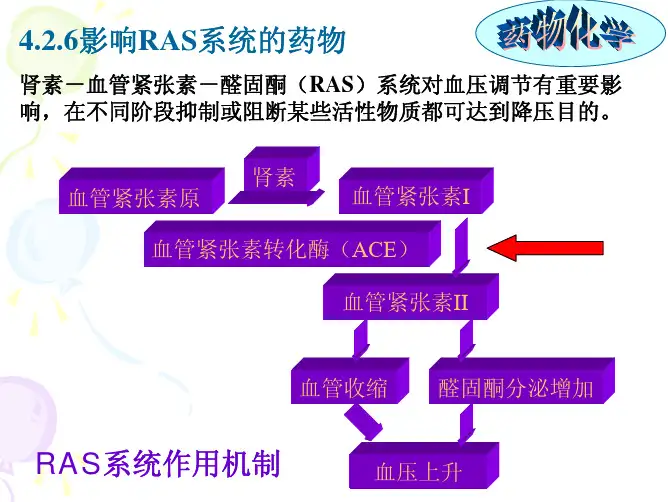
药物化学4:影响RAS系统的药物1. ACE抑制剂(ACE Inhibitors)ACE抑制剂是一类通过抑制血管紧张素转换酶(AngiotensinConverting Enzyme)活性,降低血管紧张素II (Angiotensin II)的,从而扩张血管、降低血压的药物。
代表药物有卡托普利(Captopril)、依那普利(Enalapril)等。
这类药物在治疗高血压、心力衰竭等疾病中具有显著疗效。
2. ARB类药物(Angiotensin II Receptor Blockers)ARB类药物通过阻断血管紧张素II与其受体的结合,从而抑制血管紧张素II的缩血管作用,降低血压。
代表药物有洛萨坦(Losartan)、厄贝沙坦(Irbesartan)等。
ARB类药物在治疗高血压、心肌梗死等疾病中具有重要作用。
3. 醛固酮受体拮抗剂(Aldosterone Antagonists)醛固酮受体拮抗剂通过阻断醛固酮与其受体的结合,减少钠、水的重吸收,降低血压。
代表药物有螺内酯(Spironolactone)、依普利酮(Eplerenone)等。
这类药物在治疗高血压、心力衰竭等疾病中具有辅助治疗作用。
4. RAS系统激活剂在某些特定情况下,如低血压休克,激活RAS系统可起到升压作用。
代表药物有血管紧张素I(Angiotensin I)及其类似物。
这类药物在临床治疗中主要用于急救场合。
影响RAS系统的药物在心血管疾病治疗中具有重要地位。
随着药物化学研究的深入,更多高效、低毒的RAS系统药物将被开发出来,为患者带来福音。
药物化学4:影响RAS系统的药物5. 肾素抑制剂(Renin Inhibitors)肾素抑制剂直接作用于RAS系统的起始环节,通过抑制肾素的活性,减少血管紧张素I的,从而降低血压。
这类药物的代表有阿利吉仑(Aliskiren)。
肾素抑制剂在治疗高血压方面具有独特优势,尤其适用于对其他抗高血压药物反应不佳的患者。
2014年4月11日,欧洲药品管理局(EMA)发布警告:避免联用两种在肾素-血管紧张素-醛固酮系统(RAS)有独立作用的药物。
作用于RAS系统的几类药物包括血管紧张素受体拮抗剂(ARB)、血管紧张素转换酶抑制剂(ACEI)和直接肾素抑制剂。
特别是糖尿病肾病的患者,不应联合使用ARB和ACEI。
EMA同时指出如果出现必须联用双抑制药物的情况时,必须严格检测肾功能、水钠平衡和血压。
ARBs类的坎替沙坦或缬沙坦可作为已经使用ACEI类药物的心衰病人的一项附加治疗,而严格禁止阿利克仑联用ACEI或ARBs治疗伴有肾功能不全或糖尿病的患者。
这项建议来自欧洲药物管理局药物警戒风险评估协会为期10个月的观察所得到的结果。
EMA药物警戒风险评估委员会(PRAC)从去年5月起经过10个月审查,最终由人用药物委员会(CHMP)作出决定,这代表了PRAC的官方建议。
2013年,Franz Messerli和Makani博士(美国St Luke-Roosevelt医院)等在《BMJ》发表了一项Meta分析,作为Messerli博士2009年《The sudden demise of dual renin-angiotensin system blockade or the soft science of the surrogate end point》的后续观点,在Meta分析中作者呼吁临床医生停止使用双联RAS抑制剂,因为发现其在ONTARGET研究上有明显的危害。
和单独使用相比,联合使用RAS抑制剂的重要风险包括高钾血症、低血压和肾功能恶化;,肾功能恶化是通过与单一使用一种药物治疗时的对比,但并未获得血压进一步降低的预期临床获益。
2014年JNC 8成人高血压治疗指南操作方法中已经明确指出ACEI和ARB不应联合使用。
而美国FDA尚未审查这些药物联合使用问题,也未发布任何警告。
加拿大心脏和卒中基金会则早在2009年就发布指南警告,建议患者如果正在同时服用ARB和ACEI,应尽快去看家庭医生,改变治疗方法。
RAS对靶器官的损害机制和ACEI和ARB的保护机制RAS(肾素-血管紧张素-醛固酮系统)是一个重要的调节系统,参与了血压、体液平衡、电解质代谢等生理过程。
然而,当RAS过度活跃时,它也可能对靶器官造成损害,如心血管系统和肾脏。
ACEI(血管紧张素转换酶抑制剂)和ARB(血管紧张素受体拮抗剂)是用来抑制RAS的药物,可以起到保护靶器官的作用。
下面将详细介绍RAS对靶器官的损害机制以及ACEI和ARB的保护机制。
1.RAS对心血管系统的损害机制:RAS通过产生血管紧张素II(Ang II)来调节血管张力和水盐平衡,但同时也导致以下损害:-引起血管收缩和增加外周阻力,导致高血压。
-促进心肌细胞增生和肥厚,导致心肌纤维化,使心肌功能受损。
-促进肾小球内皮细胞增生和肾小动脉收缩,导致肾小球滤过率增高和肾小球硬化,从而损害肾功能。
2.RAS对肾脏的损害机制:RAS在肾脏中起到调节血流和肾小球滤过率的作用,但过度活跃的RAS会导致肾脏损害:-血管紧张素II引起肾小动脉痉挛和GFR(肾小球滤过率)增加,长期高血压可引起肾小球硬化和慢性肾脏疾病。
-RAS过度激活还会增加肾小管和间质的纤维化,损伤肾单位结构。
3.ACEI和ARB的保护机制:ACEI和ARB是两种不同类型的RAS抑制药物-ACEI抑制了血管紧张素转换酶,阻断了血管紧张素I转化为血管紧张素II的过程,从而减少血管紧张素II的生成。
它们还可以抑制降解血管紧张素I的酶,增加缓解血管紧张素系统的效应。
通过这些作用,ACEI能够降低外周血管阻力,减轻心脏负荷,从而起到降低血压和防止心肌纤维化的作用。
此外,ACEI还能抑制肾小球内皮细胞的增生,减少肾小球滤过率的增加,从而保护肾脏功能。
-ARB是血管紧张素II受体的拮抗剂,能够竞争性地与AT1受体结合,阻断血管紧张素II的作用。
ARB通过这种方式能够降低外周血管阻力,减轻心脏负荷,与ACEI有类似的降压作用。
同时,ARB还能阻断血管紧张素II对心肌和肾小球的直接作用,减轻心肌纤维化和肾小球硬化的发展。
RAS基因抑制剂获准进入二期临床全台湾每年的癌症新增人数已冲破9万人,其中Ras基因,即一种人体中负责讯息传导与神经物质传导的重要蛋白质,是导致许多癌症发生的关键。
国内的生技公司今宣布,Ras基因靶向药可望在2017年上市。
国鼎生技公司首席研究员陈志铭博士表示,约3成癌症患者有Ras基因突变,其中胰腺癌更有9成患者Ras基因突变,其他包括大肠癌、肺癌等也都和Ras基因突变息息相关。
由于Ras 基因突变会使Ras蛋白质过度活化,进而使癌细胞快速生长,易使病况急速恶化,因此如何去抑制Ras基因蛋白质就相当重要。
陈志铭博士表示,由于Ras基因靶向药研发难度高,过去10-20年来国际医学界始终未能研发成功,而国鼎生技公司2006年研发出全球第一个抑制Ras的靶向药物安卓健(Antroquinonol),现在更针对非小细胞肺癌进入第二期临床试验,最快可望在3年内通过美国食品药物管理局与台湾卫生福利部的药证申请。
安卓健一期临床试验发现,晚期非小细胞肺癌患者在4周的治疗中靶病灶评估疾病稳定,连续服用三个月后,近六成肿瘤变小,有效延长了患者的生存期。
该项新药第一期临床试验在三军、台北荣总两家医学中心进行,结果已证实其安全性与有效性。
该项计划负责人、怡仁医院董事长吴首宝指出,Ras是导致许多癌症的关键基因,包括肺癌、大肠直肠癌、胰腺癌等患者中,约三成为Ras基因突变,而Ras基因突变的癌症病患目前无药可医。
以肺癌为例,因为无药可用,晚期Ras基因突变的肺癌患者,平均一年的死亡率高达六至七成。
国内所研发出的牛樟芝萃取物,被医界视为肺癌治疗一大突破,可望成为全球第一个抗肺癌Ras基因靶向药物。
最近美国FDA核准进入第二期临床试验,由美国Johns Hopkins医学中心肿瘤科与医学教授David S.Ettinger担任计划主持人。
吴首宝表示,由於末期Ras基因突变的肺癌患者急需药物治疗,在第二期临床研究结束後,美国FDA就会给予特殊的临时药证,让患者自费使用。
急性心肌梗死患者RAS抑制剂的应用选择 《中华现代内科学杂志》肾素-血管紧张素系统(renin angiotensin system,RAS)激活是急性心肌梗死(acute myocardial infarction,AMI)患者最重要的病理生理学反应之一。
早期、足量的抑制RAS,对于减轻心室重构、保护心脏功能以致最终降低AMI患者的死亡率和病死率,具有重要的临床意义。
其中ACE抑制剂的此种心脏保护作用已为较多的前瞻性随机临床研究所证实。
近年来投入临床使用的血管紧张素Ⅱ受体1型拮抗剂(angiotensin Ⅱtype 1 receptor blockers,ARB),因能同时阻断ACE和非ACE途径产生的血管紧张素Ⅱ,且无ACE抑制剂的咳嗽、血管神经性水肿等不良反应,从理论上讲与ACE抑制剂的心脏保护作用相当,甚或优于ACE抑制剂。
事实是否真的如此呢?在AMI患者,ARB是否应该优先选用或者完全替代ACE抑制剂,抑或ARB应该与ACE抑制剂联合使用?本文就这些问题复习近年来发表的文献资料,做一简要综述。
1 AMI患者ARB和ACE抑制剂的直接比较早期的死亡率试验中,有两项研究将ARB和有效剂量的卡托普利(50mg,tid)进行了直接比较(head to head comparison)[1,2]。
其中OPTIMAAL试验(The Optimal Therapy in Myocardial Infarction With the Angiotensin ⅡAntagonist Losartan)入选了5477例AMI患者,洛沙坦用量为ELITE试验中慢性心力衰竭(chronic heart failure,CHF)患者验证的有效剂量,50mg qd[1]。
另一项试验V ALIANT(The V alsartan in Acute Myocardial Infarction)入选了14703例AMI患者,缬沙坦用量为Val HeFT试验中CHF患者验证的有效剂量,160mg bid[3]。