电离平衡和缓冲溶液
- 格式:doc
- 大小:49.50 KB
- 文档页数:4







第1讲电离平衡一、电解质与非电解质1、电解质:水或熔化导电化合物2、非电解质:水和熔化都不导电化合物注意:1)、电解质和非电解质研究的对象必须是化合物2)、必须是它自身电离而导电。
3)、化合物隐含的条件必须是纯净物二、强、弱电解质1、强电解质:水中完全电离电解质常见种类:强酸、强碱、大多数盐、金属氧化物注意:象BaSO4、AgCl的溶解度虽然很小,但是溶于水的部分完全电离,所以它们属于是难溶的强电解质。
2、弱电解质:水中不完全电离电解质常见种类:弱酸、弱碱、水、某些盐(CH3COO)2Pb区分的关键是:看它们在水溶液中能否完全电离;三、电离方程式的书写强:HCl=H++Cl- KOH=K++OH- NaNO3=Na++NO3-弱:CH3COOH⇌CH3COO-+H+ NH3·H2O⇌NH4++OH- H2O⇌H++OH-多元弱酸:H2CO3⇌H++HCO3-第一级电离→难HCO3-⇌H++CO32-第二级电离→更难(因为一级电离产生的H+对二级电离起到抑制作用)四、溶液导电能力强弱:关键:取决于溶液中自由移动离子浓度的大小。
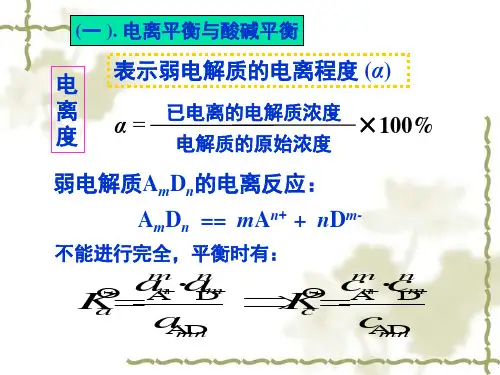
五、电离程度的判断(对弱电解质而言):电离程度=(已电离的量/起始的总量)×100%注意:“量”是指:物质的量或物质的量浓度等。
六、电离平衡(弱电解质)1、定义:在一定条件下、弱电解质、分子→离子的速率与离子→分子的速率相等、且各微粒浓度保持不变;2、特征:逆、等、定、动、变、3、外界条件对电离平衡的影响(一)浓度(1)C分子↑:向电离方向移动;电离程度减小、各粒子的浓度增大;C离子↓:(加入能与离子反应的物质来实现)向电离方向移动;电离程度增大;各微粒的浓度具体确定;(2)C离子↑:(加入含同种离子的物质来实现)向合成分子方向移动;电离程度↓;各微粒浓度具体确定;(3)加水稀释:向电离方向移动;电离程度↑;各微粒浓度均↓;(二)温度(电离都是吸热的)T↑:向电离方向移动;电离程度↑、C分子↓、C离子↑T↓:向合成分子方向移动;电离程度↓、C分子↑、C离子↓4、电离平衡常数(1)定义:一定温度下,弱电解质电离到达平衡时,离子浓度的系数次方的积与分子浓度的比值。



缓冲液的配制缓冲液是一种能在加入少量酸或碱时抵抗pH改变的溶液。
PH缓冲系统对维持生物的正常pH值,正常生理环境起重要作用。
多数细胞仅能在很窄的pH范围内进行活动,而且需要有缓冲体系来抵抗在代谢过程中出现的pH变化。
在生物体中有三种主要的pH缓冲体系,它们时蛋白质、重碳酸盐缓冲体系。
每种缓冲体系所占的分量在各类细胞和器官中是不同的。
在生化研究工作中,常常要用到缓冲溶液来维持实验体系的酸碱度。
研究工作的溶液体系pH值的变化往往直接影响到我们工作的成效。
如果提取酶实验体系的pH值变化或变化过大,会使酶活性下降甚至完全失活。
所以我们要学会配制缓冲溶液。
由弱酸及其盐组合一起使具有缓冲作用。
生化实验室常常用的缓冲系主要有磷酸、柠檬酸、碳酸、醋酸、巴比妥酸、Tiris(三羟甲基氨基甲烷)等系统,在生化实验或研究工作中要慎重地选择缓冲体系,因为有时影响实验结果的因素并不是缓冲液的pH值,而是缓冲液中的某种离子。
如硼酸盐、柠檬酸盐、磷酸盐和三羟甲基甲烷等缓冲剂都可能产生不需要的反应。
硼酸盐:硼酸盐与许多化合物形成复盐、如蔗糖。
柠檬酸盐:柠檬酸盐离子容易与钙结合,所以存在有钙离子的情况下不能使用。
磷酸盐:在有些实验,它是酶的抑止剂或甚至是一个代谢物,重金属易以磷酸盐的形式从溶液中沉淀出来。
而且它在pH7.5以上时缓冲能力很小。
三羟甲基氨基甲烷:它可以和重金属一起作用,但在有些系统中也起抑止的作用。
其主要缺点时温度效应。
这点往往被忽视,在室温pH是7.8的Tris一缓冲液,在4℃时是8.4,在37℃时是7.4,因此,4℃配制的缓冲液拿到37℃测量时,其氢离子浓度就增加了10倍。
而且它在pH7.5以下,缓冲能力很差。
缓冲液的pH值由哪些因素决定?设缓冲系统的弱酸的电离常数为K(平衡常数),平衡时弱酸的浓度为[酸],弱酸盐的浓度为[盐],则由弱酸的电离平衡式可得下式:根据此式可得出下列几点结论:(1)缓冲液的pH值与该酸的电离平衡常数K及盐和酸的浓度有关。
电离平衡和缓冲溶液
一、实验目的
1、进一步巩固电解质电离的特点和影响平衡移动的因素
2、 巩固pH 值的概念,掌握酸碱指示剂和pH 试纸的使用
3、学习缓冲溶液的配制试验及其性质
二、实验原理
① 基本概念:在弱酸或弱碱等弱电解质溶液中,加入与弱酸或弱碱解离后具有相同离子的易溶强电解质,使弱电解质解离度降低的现象称同离子效应。
在一定程度上能抵抗外加少量酸、碱或稀释,而保持溶液pH 值基本不变的作用称为缓冲作用。
具有缓冲作用的溶液称为缓冲溶液。
② 缓冲溶液组成及计算公式:
缓冲溶液一般是由共轭酸碱对组成的,例如弱酸和弱酸盐,或弱碱和弱碱盐(NH3·H 2O - NH4Cl)。
如果缓冲溶液由弱酸和弱酸盐 (例如HAc-NaAc)组成,则 其PH 计算的公式为:
可见缓冲溶液的PH 首先取决于PKa,即取决于弱酸的解离常数Ka 的大小,同时又与C a 和Cb 的比值有关. ③缓冲溶液性质: a.抗酸/碱,抗稀释作用
因为缓冲溶液中具有抗酸成分和抗碱成分,所以加入少量强酸或强碱,其pH 值基本上是不变的。
稀释缓冲溶液时,酸和碱的浓度比值不改变,适当稀释不影响其pH 值。
b.缓冲容量
缓冲容量是衡量缓冲溶液缓冲能力大小的尺度。
缓冲容量的大小与缓冲组分浓度和缓冲组分的比值有关。
缓冲组分浓度越大,缓冲容量越大;缓冲组分比值为 1:1 时,缓冲容量最大。
b
a
a c c pK pH lg
-=θ
三、仪器和药品
试管,量筒(100mL,10mL),烧杯(100mL,50mL),吸量管(10mL)等。
HAc(0.1mol/L),NaAc(0.1mol·L-1,1mol·L-1), NaH2PO4 (0.1 mol·L-1),Na2HPO4 (0.1 mol·L-1) NH3·H2O (0.1 mol·L-1),NH4Cl (0.1 mol·L-1),HCl (0.1 mol·L-1),NaOH (0.1 mol·L-1,1 mol·L-1),pH=4的HCl,pH=10的NaOH,pH=4.00标准缓冲溶液,pH=9.18标准缓冲溶液,甲基红溶液,广泛pH 试纸,精密pH试纸,吸水纸等。
四、实验步骤
思考题
(1) 为什么缓冲溶液具有缓冲作用?
(2) NaHCO3溶液是否具有缓冲作用,为什么?
(3) 用pH计测定溶液pH值时,已经标定的仪器,“定位”调节是否可以改变位置,为什么?。