化学人教版九年级下册附录1 部分酸碱盐溶解性表(常温)
- 格式:ppt
- 大小:386.00 KB
- 文档页数:20



人教版九年级化学下册附录I 部分酸、碱和盐的溶解性一、教材分析:本课题是人教版九年级化学下册第114页附录I的图表素材,内容为部分酸、碱和盐的溶解性表,这其中蕴藏着丰富的化学知识和教育价值。
若充分挖掘、合理利用“酸碱盐溶解性表”能很好地攻克“酸碱盐”涉及的四大基本化学用语:离子符号、化学式、化学方程式、物质组成及分类等问题,也能有效突破“酸碱盐”之间发生复分解反应条件的判定,从而进一步深化课堂教学知识范畴,提升教学质量。
所以本课题对于学生的学习十分重要。
(二)教学目标1.知识与技能目标:⑴通过实验探究,知道一些常用酸、碱、盐的溶解性规律;⑵通过研究溶解性规律,明确常见的沉淀及常见盐溶液中离子的颜色;⑶通过物质的溶解性,学会判断复分解反应能否发生。
2.过程与方法目标:⑴通过实验探究,明确溶解性规律,常见的沉淀及常见盐溶液中离子的颜色;⑵通过小组讨论,学会交流有用信息,自主归纳整理溶解性表中的知识。
3.情感态度价值观目标:通过小组实验探究,交流讨论完成学习任务,独自完成课堂练习,独立与合作之间相互转换,可逐步提升学生综合素质。
(三)教学重、难点教学重点:部分酸、碱、盐的溶解性规律;教学难点:部分酸、碱、盐的溶解性规律的灵活使用。
二、学情分析首先,学生学习上册知识对于常见元素符号、化合价、离子符号、化学式名称的记忆有一定的局限性,交叉法准确书写化学式的方法掌握的不熟练,加之下册教学中酸碱盐的学习不够系统与完善,不明确哪些物质是沉淀,哪些物质有颜色,所以本节课的学习能够将两册的化学知识系统的串联起来,完善学生的知识结构。
三、学法指导:在教师引导和协助下,学生通过实验探究、交流讨论难点、展示小组成果、独立测验等活动,逐步形成自主学习和合作学习的科学学习方法。
四、教学流程:根据酸、碱、盐类知识的特点和学生理解过程中易出现的问题,具体教学分以下几个阶段:环节一:视频欣赏、明确目标明确:探究酸碱盐的溶解性规律环节二:实验探究、交流展示根据实验探究、讨论交流了解酸碱盐的溶解性规律,以及在练习中的使用。

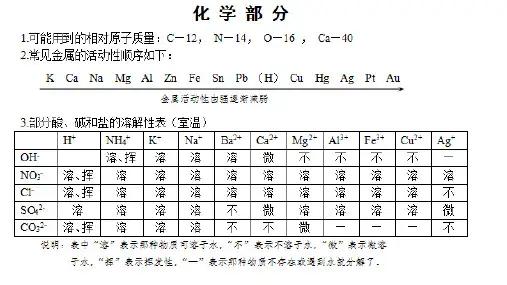
附录一部分酸、碱和盐的溶解性表(室温)教学设计一、教学目标1、通过对表格各离子不同组合,进一步加深对酸、碱、盐的组成理解,强化了酸碱盐化学式的书写。
2、从表中找出酸碱盐的溶解性特点,找出有效的记忆方法或口诀,快速判断出有沉淀生成的复分解反应能否实行。
3、利用表中常见的酸碱盐的溶解性,巩固酸碱盐的鉴别、转化、制取等实验技能,熟悉中考常考的特征离子的检验。
二、教学重难点1、教学重点:酸碱盐的溶解性规律及记忆方法。
2、教学难点:微溶物的处理。
三、课前准备:事先印一张表格,要求学生课前先完成化学式的书写。
附:酸碱盐化学式四、教学流程2、提问:酸碱盐之间发生复分解反应的条件是什么?注意学生往往没说到反应物应是溶液(可溶,酸例外)特别是“盐+碱”、“盐+盐”反应物一定要全溶。
3、引入问题:复分解反应要具备生成物有水、气体、沉淀三个条件之一才能实行,生成水或气体通过方程式很容易判断出来,最难是如何判断是否生成沉淀,所以今天我们来学习酸碱盐的溶解性表。
附练习:3、下列实验能观察到明显现象的()A、硫酸钠溶液滴入氯化铜溶液B、氯化钡溶液滴入氧化铜中C、氢氧化钾溶液滴入硝酸钠溶液中D、硝酸银溶液滴入氯化钠溶液4、只有一种试剂来鉴别NaOH、Ca(OH)2、稀H2SO4三种溶液,这种试剂是()A、氯化钡溶液B、石蕊溶液C、碳酸钠溶液D、酚酞溶液5、下列各种物质,相互不能发生反应的是()A、Ca(OH)2溶液和硫酸B、氧化铁和盐酸C、三氧化硫和氢氧化化钠溶液D、盐酸和二氧化碳6、下面是某同学实行碱的化学性质实验时记录的现象,其中与事实不符的是( )A、Ca(OH)2溶液中加入稀盐酸,无明显变化B、NaOH溶液中通入CO2气体,有白色沉淀生成C、Ca(OH)2溶液中加入石蕊溶液,溶液呈蓝色D、NaOH溶液中加入CuSO4溶液,有蓝色沉淀生成7、将下列各组物质放入水中,有化学反应发生,但无沉淀生成,也无气体生成,且溶液为无色的一组是( )A、K2CO3、BaCl2、NaClB、CaSO4、HNO3、NaClC、CaCl2、KOH、Na2CO3D、K2SO4、H2SO4、NaOH8.(2019广安市)酸、碱、盐的溶解性表为我们确定常见物质的溶解性提供了方便,下表是溶解性表中的一部分,结合表格和溶解度知识判断,下列说法不准确的是()常见酸、碱、盐的溶解性表(20℃)A.绘制表格的依据是物质的溶解度B.常见物质一般可分为:溶、微溶和不溶C.Ca(OH)2、CaSO4和CaCO3的溶解度都大于1gD.Ca2+、NO3-、Cl-三种离子在溶液中能大量共存9、完成发生的下列反应的化学方程式。


附录1部分酸、碱和盐的溶解性表大城县北魏乡北魏中学刁凤英教学目标:知识与技能:认识复分解反应发生的条件。
理解酸碱盐的溶解性;判断两物质能否发生反应。
过程与方法:通过分类归纳复分解反应的条件,促进分类学习和归纳学习能力的提升。
通过观察分析,学会独立思考,促进学生思维能力的提升。
情感态度与价值观:通过教师与学生的交互,体验化学学习的乐趣以及化学的奥秘,增强化学学习的内在动力,培养自身的科学素养;通过应用复分解反应发生的条件判断物质间是否发生反应,让学生领会学以致用的思想。
教学重点与难点:重点:复分解反应发生的条件和复分解反应发生的判断难点:1、复分解反应的发生的判断2、理解酸碱盐的溶解性教学用品:ppt课件、投影等教学过程:一、复习引入新课(学生自然的进入学习状态,形象的动态课件、电子白板教学吸引学生,激发学习兴趣)展台展示:通过前面的学习,请同学们判断下面反应属于何种反应类型?1.2KmnO4==K2MnO4+MnO2+O2↑2.Fe+CuSO4=FeSO4+Cu3.Na2CO3+2HCl=2NaCl+ H2O +CO2↑4.Na2CO3+Ca(OH)2=CaCO3↓+2NaOH学生回答:1是分解反应,2是置换反应,3、4是复分解反应教师根据学生回答在白板上批注教师提问:那么什么是复分解反应?其特点是什么?表达式是什么?学生回答教师根据学生回答进行归纳总结,并用ppt展示定义:在溶液中,由两种化合物互相交换成分,生成另外两种化合物的反应。
特点:化合物双交换,里应外合价不变。
提问:下面请大家看看这两个反应是否属于复分解反应?课件展示NaOH+HCl=NaCl+H2OCa(OH)2+H2SO4=CaSO4+2H2O学生讨论:根据复分解反应的特征分析中和反应是否属于复分解反应呢?分析总结:根据中和反应特点,反应物酸和碱是化合物,交换成分后生成另外两种化合物盐和水,因此,中和反应是复分解反应。
过渡:通过以上讨论可知,酸、碱和盐之间可以发生复分解反应,那是不是所有的酸、碱、盐之间均能发生复分解反应呢?ppt展示二、学习新课(通过教师与学生的交互,体验化学学习的乐趣以及化学的奥秘,增强化学学习的内在动力,培养自身的科学素养)(一)复分解反应发生的条件板书:复分解反应发生的条件请大家完成白板上的化学方程式1. Na2CO3 + Ca(OH)2=CuSO4 + 2NaOH=2. NaHCO3 + HCl=CaCO3 + 2HCl=3. H2SO4 + 2NaOH=2HCl + Ca(OH)2=4.CuSO4+NaOH=学生练习书写化学方程式,将结果展台展示,集体订正,并指名交流每组反应的共同点。

常见酸碱盐溶解性及其应用教学设计一、教学目标1、认识常见酸碱盐溶解性表2、通过观察常见酸碱盐溶解性表掌握常见酸碱盐溶解规律3、利用常见酸碱盐溶解性表解决相关问题二、教学重点和难点重点:通过观察常见酸碱盐溶解性表掌握常见酸碱盐溶解规律难点:利用常见酸碱盐溶解性表解决相关问题三、教学过程(一)、复习引入结合导学案自主复习酸碱盐的概念,为常见酸碱盐的溶解性做准备。
复习引入:酸碱盐的概念、酸:溶于水时解离(电离)出的阳离子只有1........的化合物,如:、、碱:溶于水时解离(电离)出的阴离子只有2........的化合物,如:、、盐:溶于水时解离(电离)出3......离子(或铵根离子)和离子(或氯离子)的化合物,如:、(二)、新授1、初步认识常见酸碱盐的溶解性表2、根据表格掌握常见阴阳离子结合后形成的化合物的化学式。
完成导学案相关内容。
写出对应阴阳离子结合形成的化合物的化学式OH -NO 3-Cl -SO42-CO 32-H +NH 4+K +Na+Ba2+Ca2+Mg 2+Al 3+Mn 2+Zn 2+Fe2+Fe3+Cu 2+Ag +3、根据常见盐的化学式将盐分类,为下面总结常见酸碱盐溶解规律做准备。
完成导学案相关内容。
常见盐的分类(1)、观察溶解性表,第二纵行除HNO 3外,其余化合物的阴离子都是,这样的盐可归类为硝酸盐,如:、。
(2)、观察溶解性表,第三纵行除HCl 外,其余化合物的阴离子都是(又叫做盐酸根),这样的盐可归类为盐酸盐,...如:、。
(3)、观察溶解性表,第二横行除 KOH 外,其余盐的金属离子都是,这样的盐可以归类为钾盐,如:、。
4、具体认识酸碱盐溶解性表,找出常见的具有挥发性的物质和不溶于水的物质。
完成导学案相关内容。
(1)、“溶” :表示方框对应的阳离子和阴离子形成的化合物可溶于...水,如:.、(2)、“不溶”:表示方框对应的阳离子和阴离子形成的化合物不溶于...水,如:.、(3)、“微溶”:表示方框对应的阳离子和阴离子形成的化合物微溶于...水,如:.、(4)、“挥发”:表示方框对应的阳离子和阴离子形成的化合物具有挥...发性,如:、..(5)、“——”:表示方框对应的阳离子和阴离子形成的化合物不存在...或遇水分解。
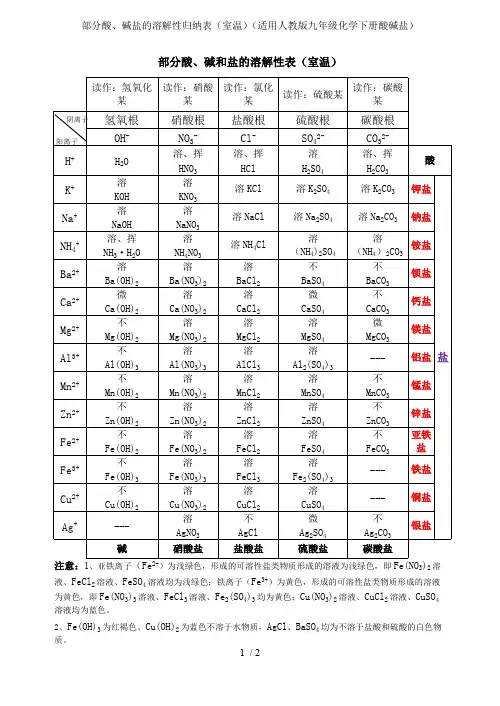
1 / 2部分酸、碱和盐的溶解性表(室温)注意:1、亚铁离子(Fe 2+)为浅绿色,形成的可溶性盐类物质形成的溶液为浅绿色,即Fe(NO 3)2溶液、FeCl 2溶液、FeSO 4溶液均为浅绿色;铁离子(Fe 3+)为黄色,形成的可溶性盐类物质形成的溶液为黄色,即Fe(NO 3)3溶液、FeCl 3溶液、Fe 2(SO 4)3均为黄色;Cu(NO 3)2溶液、CuCl 2溶液、CuSO 4溶液均为蓝色。
2、Fe(OH)3为红褐色、Cu(OH)2为蓝色不溶于水物质,AgCl 、BaSO 4均为不溶于盐酸和硫酸的白色物质。
读作:氢氧化某读作:硝酸某读作:氯化某读作:硫酸某读作:碳酸某氢氧根硝酸根盐酸根硫酸根碳酸根OH -NO 3-Cl -SO 42-CO 32-H +H 2O 溶、挥HNO 3溶、挥HCl 溶H 2SO 4溶、挥H 2CO 3酸K +溶KOH 溶KNO 3溶KCl 溶K 2SO 4溶K 2CO 3钾盐Na +溶NaOH 溶NaNO 3溶NaCl 溶Na 2SO 4溶Na 2CO 3钠盐NH 4+溶、挥NH 3·H 2O 溶NH 4NO 3溶NH 4Cl 溶(NH 4)2SO 4溶(NH 4)2CO 3铵盐Ba 2+溶Ba(OH)2溶Ba(NO 3)2溶BaCl 2不BaSO 4不BaCO 3钡盐Ca 2+微Ca(OH)2溶Ca(NO 3)2溶CaCl 2微CaSO 4不CaCO 3钙盐Mg 2+不Mg(OH)2溶Mg(NO 3)2溶MgCl 2溶MgSO 4微MgCO 3镁盐Al 3+不Al(OH)3溶Al(NO 3)3溶AlCl 3溶Al 2(SO 4)3---铝盐Mn 2+不Mn(OH)2溶Mn(NO 3)2溶MnCl 2溶MnSO 4不MnCO 3锰盐Zn 2+不Zn(OH)2溶Zn(NO 3)2溶ZnCl 2溶ZnSO 4不ZnCO 3锌盐Fe 2+不Fe(OH)2溶Fe(NO 3)2溶FeCl 2溶FeSO 4不FeCO 3亚铁盐Fe 3+不Fe(OH)3溶Fe(NO 3)3溶FeCl 3溶Fe 2(SO 4)3---铁盐Cu 2+不Cu(OH)2溶Cu(NO 3)2溶CuCl 2溶CuSO 4---铜盐Ag +---溶AgNO 3不AgCl微Ag 2SO 4不Ag 2CO 3银盐盐碱硝酸盐盐酸盐硫酸盐碳酸盐阳离子阴离子3、注意含Fe2+和Fe3+离子的碱和盐的读法。
