流式细胞术基本原理
- 格式:ppt
- 大小:3.98 MB
- 文档页数:50


流式细胞技术原理
流式细胞技术是一种高效的细胞分析方法,它可以对单个细胞进行快速、准确的分析。
该技术主要基于细胞在流动状态下通过激光束时所
产生的散射和荧光信号,通过对这些信号的测量和分析,可以获得有
关细胞形态、大小、表面标记物、内部结构和功能等方面的信息。
流式细胞技术基本原理如下:
1. 细胞样品制备:将待检测的细胞样品进行处理,如离心、洗涤等操作,使其达到单个细胞状态,并加入荧光染料或抗体等标记物,以便
在流式仪中进行检测。
2. 细胞在流式仪中流动:将制备好的样品注入到流式仪中,在高速液
体流动中被逐个单独地通过激光束。
3. 激光束照射:当细胞通过激光束时,会发生散射和荧光现象。
散射
现象包括前向散射(FSC)和侧向散射(SSC),前者与细胞大小相关,后者与细胞复杂程度和内部结构相关。
荧光现象则是标记物受激发后
发出的荧光信号,可以用于检测细胞表面标记物或内部结构。
4. 信号检测:流式仪会收集细胞产生的散射和荧光信号,并将其转化
为电信号,通过光电倍增管等装置进行放大和转换。
同时,流式仪还
会记录细胞通过激光束的时间和位置信息。
5. 数据分析:通过对上述收集到的信息进行分析,可以得到有关样品
中细胞数量、大小、形态、表面标记物、内部结构和功能等方面的信息。
这些数据可以用于研究细胞生理学、病理学、药理学等领域。
总之,流式细胞技术利用了细胞在流动状态下产生的散射和荧光信号,通过对这些信号的测量和分析,实现了对单个细胞的快速、准确分析。
该技术在生命科学研究中有着广泛应用,在临床诊断、药物筛选等方
面也有着重要作用。


流式细胞术的原理和应用1. 引言流式细胞术(Flow Cytometry)是一种广泛应用于生命科学研究和临床诊断的技术。
通过使用流式细胞仪,可以对生物细胞进行快速、精准的多参数分析,为科学家和医生提供了大量的有关细胞的信息。
流式细胞术已成为生物学领域的重要工具,被广泛应用于细胞分析、免疫表型分析、药物筛选等领域。
2. 原理流式细胞术基于细胞在封闭流动系统中单个通过的原理。
其基本流程包括样本制备、细胞标记、细胞检测和数据分析。
2.1 样本制备样本制备是流式细胞术的第一步,它需要将待检测的细胞样本制备成单细胞悬浮液。
这可以通过细胞培养、组织切片或体液等方式获得细胞样本。
重点是要避免细胞凝聚和聚集,以确保细胞在流式细胞仪中单个通过。
2.2 细胞标记细胞标记是流式细胞术的关键步骤之一。
它使用荧光染料或抗体等标记物与目标细胞发生特异性反应。
荧光染料可以通过不同的通道发出不同波长的荧光信号,从而实现多参数分析。
细胞表面标记的抗体通常与荧光素共价结合,以产生可检测的荧光信号。
同时,可以利用染料进行细胞内部器官或分子的标记,以更详细地研究细胞的功能和结构。
2.3 细胞检测细胞检测是流式细胞术中最关键的步骤之一。
它通过流式细胞仪将标记后的细胞悬浮液以单个细胞的形式通过单个检测区域。
这些细胞在流式细胞仪中被激活并产生荧光信号。
光电传感器将捕获和记录这些荧光信号,并将其转化为数字信号,供数据分析使用。
2.4 数据分析数据分析是流式细胞术的最后一步。
通过对获得的荧光信号的数字化处理,可以获得有关细胞的详细信息,包括细胞表面标记物的表达水平、细胞数量统计、细胞大小等信息。
数据分析可以使用专业的流式细胞仪软件完成,也可以使用其他数据分析软件进行更复杂的数据处理。
3. 应用流式细胞术作为一种全面、高通量的细胞分析技术,广泛应用于各个领域。
3.1 免疫学研究流式细胞术在免疫学研究中得到了广泛应用。
通过对免疫细胞的表面标记物进行检测,可以评估免疫细胞亚群的数量、功能和表达水平。

流式细胞术原理流式细胞术原理概述:1.什么是流式细胞术:流式细胞术是将多种特定条件下的离体细胞(即细胞不在原生质上)置入一个流式细胞仪,并利用各种仪器和仪器注入液体,通过细胞之间物质交换,使其在有限时间内受到良好的刺激、富集和选择,从而在定量和质量上均匀地输出体外驯化后的细胞。
2.流式细胞术应用:(1)表型分析:基因表达分析、蛋白质表型分析、抗原检测以及多种分子诊断测试;(2)免疫学应用:免疫细胞排序(FACS)、免疫细胞鉴定、免疫细胞功能分析;(3)其他研究:血液细胞分离以及人类疾病细胞的示蹤。
3.Flow Cytometry的原理:首先,将活细胞置于流式细胞术仪中,然后,在仪器里运动,在仪器里的运动速度是一个恒定的流动;接着,激光会从另一边投射进去,在有特定滤波器的情况下,激光射线就会倒射,与细胞中存在的染料结合,以此来分析表达位点上的基因和蛋白的表达情况,并且在此过程中会记录下所有的数据;最后,细胞会流经检测仪的椭圆形游标,当单束仪检测到某个细胞时,就会发出一个电信号,这样就可以将其标记出来,最后可以将所有细胞记录下来,便于分析表达位点或者染料反应情况,从而分析细胞的类型及其分布情况。
4.Flow Cytometry技术优势:(1)快速:流式细胞术可以在几秒钟内完成大量细胞的分析;(2)灵敏:细胞可以通过可调的激光强度以及多样的滤波器在流式细胞术下被准确检测;(3)准确:使用低酵母可以对细胞表面抗原以及内在细胞特性有更加准确的测定;(4)方便:整个实验过程只需要较少的样本量即可完成,且可以重复性进行,从而可以进行大量的分析和比较。
综上所述,流式细胞术是目前用于研究表型分析、免疫细胞排序以及细胞表面抗原及细胞内特性检测等多个研究领域,功能强大,分析快速准确,整个实验过程便捷、经济等特点,极大地拓展了体外实验、单细胞研究和诊断测试领域,成为细胞及分子生物学研究的有力工具。

流式细胞术工作原理流式细胞术又称为流式细胞分析(FACS),是一种用于快速测定和分析细胞及其组分的工具和技术。
它通过对单个细胞的多重参数进行单细胞测量和分析,可对不同种类和状态的细胞进行区分和识别,从而为细胞学、免疫学、实验室诊断和药物研发等领域提供了重要的实验手段和数据支持。
流式细胞术工作原理基于一定的光学原理和电子信号转换技术,其主要步骤包括样本准备、流式细胞仪检测和数据分析等三个部分。
下面将详细介绍各个部分的工作原理:1. 样本准备样本准备是流式细胞术的第一步,它主要是为了将待测细胞或细胞组分转化成能够被流式细胞仪检测和分析的样品,其中包括以下几个步骤:(1)细胞收集:这是流式细胞术的前提条件,它要求待测细胞必须单个存在,不能形成团块或粘连。
通常采用利用酶或化学试剂将细胞从组织、器官、培养基或体液中分离出来进行收集。
其中细胞来源各不相同,可以是血液、骨髓、组织癌变、分离免疫细胞等等。
细胞处理在流式细胞学中是个棘手的问题。
该过程既需要最大程度地维持细胞的原始形态和性质,又不影响流式细胞仪对细胞的检测和分析。
样本处理的方式包括细胞染色、标记、吸释样本预处理等方法,处理条件严格,样品要求高纯度,无污染。
细胞染色是为了能够让细胞在仪器中产生不同的光谱信号。
染色剂的种类有非常多,它们包括活细胞染色剂、细胞膜染色剂、DNA染色剂、标记抗体等。
一般情况下,染色前细胞都要进行适当的处理,如调节pH值、添加细胞破解液等,扩大染色剂与待测细胞的作用。
2. 流式细胞仪检测流式细胞仪是用于测量和分析单个细胞的主要工具和设备,它是由激光器、光学器件、检测单元和计算机组成的。
在具体工作中,样品通过采用压力推动等技术被强制通过一个光学器件中的微细通道,流式细胞仪则通过这个微细通道对其进行检测和分析。
具体步骤如下:(1)激光器发出激光:激光是流式细胞仪最核心的光源,它可以发射可见光、激光、紫外线等光谱范围内的单色光束。
光线经过反射器作用,形成光束。

流式细胞术原理流式细胞术工作原理是在细胞分子水平上通过单克隆抗体对单个细胞或其他生物粒子进行多参数、快速的定量分析。
操作步骤包括细胞表面标记的检测和细胞内细胞因子的检测。
流式细胞技术是利用流式细胞仪进行的一种单细胞定量分析和分选技术。
流式细胞术是单克隆抗体及免疫细胞化学技术、激光和电子计算机科学等高度发展及综合利用的高技术产物。
流式细胞仪由液流系统、光学系统和电子系统三部分形成。
流式细胞技术基本原则:1.并使各种液体和漂浮细胞样本新鲜,尽快顺利完成样本制取和检测;2.针对不同的细胞样本进行适当洗涤、酶消化或edta处理,以清除杂质,使粘附的细胞彼此分离而形成单细胞状态;3.对新鲜实体瘤非政府可以采用或单胺酶消化法,机械收编法和化学集中法去赢得足够多数量的单细胞悬液;4.对石蜡上皮组织非政府应先切开若干40-50um薄的蜡片,经二甲苯重熔至水后,再用前述方法制取单细胞悬液;5.单细胞悬液的细胞数不该多于个。
流式细胞的具体实验步骤基本是细胞表面标记的检测和细胞内细胞因子的检测两部分。
一、细胞表面标记的检测1.试剂平衡至室温。
准备:消毒台面;穿戴工作服,帽子,口罩和手套,放置棉签,草纸和有盖垃圾桶(内装有消毒剂);2.写编号纸并编号;3.每管加相应的抗体10l/每种和50l全血,震荡,室温避光20分钟。
加血前摇匀血样;4.加入溶血素1ml,震荡后室温避光10分钟;5.离心,转, 5分钟。
弃上清,震荡;6.加入pbs洗液2ml,震荡,离心,转, 5分钟。
弃上清,震荡;7.加入pbs l。
上机前4度保存;8.上机。
二、细胞内细胞因子的检测1.准备:消毒台面;穿戴工作服,帽子,口罩和手套,放置棉签,草纸和有盖垃圾桶(内装有消毒剂);2.写下编号纸并编号;3.取出pma(1∶),bfa(1∶10)和离子霉素(1∶10),使用无菌无叠氮钠pbs稀释储存液;4.提振:挑全血或pbmcs(细胞数在0.5-1 )50l/管,再重新加入50l rpmi展开吸收一倍,重新加入刺激剂pma,离子霉素和bfa,搅匀。

流式细胞术的原理流式细胞术是一种用于分析和分选细胞的技术,广泛应用于生物医学研究领域。
它能够快速、准确地分析细胞的表面标记物、内部结构和功能状态,为细胞生物学和免疫学研究提供了重要的手段。
流式细胞术的原理主要包括细胞样本的制备、激发光源的照射、细胞信号的检测和数据分析等步骤。
首先,对于流式细胞术的样本制备非常关键。
细胞样本需要经过胰酶消化、过筛等步骤,获得单细胞悬浮液。
然后,通过离心等手段将细胞沉淀,去除细胞培养基和其他杂质。
接着,将细胞悬浮液进行染色,使细胞表面或内部的标记物与荧光染料结合,以便后续的检测和分析。
其次,流式细胞术需要激发光源的照射。
常用的激发光源包括氩离子激光、氦氖激光等。
这些激发光源能够激发荧光染料发出荧光信号,不同的荧光染料对应不同的波长,因此可以通过选择不同波长的激发光源来激发不同的荧光信号,实现多参数的细胞分析。
然后,流式细胞术通过检测细胞信号来获取细胞的信息。
当细胞悬浮液经过流式细胞仪时,激发光源照射到细胞上,激发荧光染料产生荧光信号,流式细胞仪通过光学系统收集这些信号,并将其转化为电子信号。
这些电子信号经过放大、数字化等处理后,最终被传输到计算机中进行数据分析。
最后,数据分析是流式细胞术的重要步骤。
通过对细胞信号的数据分析,可以得到细胞的表面标记物表达情况、内部结构的特征、细胞的功能状态等信息。
同时,流式细胞术还可以进行细胞的分选,即根据细胞信号的特征,将特定类型的细胞进行分离和收集,为后续的实验研究提供纯净的细胞样本。
综上所述,流式细胞术通过样本制备、激发光源的照射、细胞信号的检测和数据分析等步骤,能够快速、准确地分析和分选细胞,为生物医学研究提供了重要的技术支持。
它在细胞生物学、免疫学、临床诊断等领域具有广泛的应用前景,对于揭示细胞的生理和病理过程,以及开发新的药物和治疗手段具有重要意义。
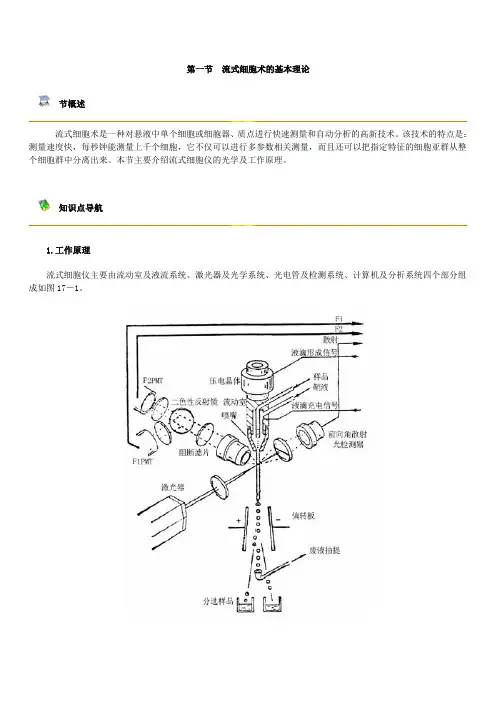
第一节流式细胞术的基本理论节概述流式细胞术是一种对悬液中单个细胞或细胞器、质点进行快速测量和自动分析的高新技术。
该技术的特点是:测量速度快,每秒钟能测量上千个细胞,它不仅可以进行多参数相关测量,而且还可以把指定特征的细胞亚群从整个细胞群中分离出来。
本节主要介绍流式细胞仪的光学及工作原理。
知识点导航1.工作原理流式细胞仪主要由流动室及液流系统、激光器及光学系统、光电管及检测系统、计算机及分析系统四个部分组成如图17-1。
图17-1 流式细胞仪的工作原理图待测细胞被制备成单细胞悬液,经特异性荧光染料染色后置于专用样品管中,在气体压力作用下被压入流动室,流动室内充满鞘液,在鞘液作用下,细胞排成单列,沿液流的轴心一个接一个地从流动室下端的喷嘴喷出,形成细胞液柱。
液柱与高度聚焦的激光束垂直相交,细胞受到激光激发产生荧光信号和散射光信号,这些光信号通过相应的光电管和检测器被接收并转换成电信号,经放大器放大后送入计算机并进行分析显示和结果输出。
2.光学原理流式细胞仪的光学系统由激光器和若干组透镜、滤光片及小孔组成,它们分别将不同波长的荧光信号送入到不同的电子探测器。
其主要光学元件是分色反射镜(DL)和滤光片(filter),它们一般分为三类:长通滤片(long pass filter,LP)、短通滤片(short pass filter,SP)和带通滤片(band pass filter,BP)。
(1)分色反射镜(488DL、 550DL、 600DL、640DL)用于选择被测荧光波长,只允许大于特定波长的光通过,而将小于特定波长的光反射到光电检测器。
(2)长通滤片只允许特定波长以上的光通过,特定波长以下的光不能通过。
如LP620 nm滤片,只允许620 nm以上的光通过,而620 nm以下的光吸收或返回。
(3)短通滤片与长通滤片相反,允许特定波长以下的光通过,而特定波长以上的光吸收或返回。
(4)带通滤片(488BP、525BP、575BP、675BP)允许某一特定波长的光线通过,而其他波长的光全部被阻断。


流式细胞术——原理,操作及应用(二)流式细胞术原理流式细胞术(Flow Cytometry)是一种通过流式细胞仪对细胞进行高速连续检测和分析的技术。
它利用细胞与荧光标记的抗体等特异性反应,通过流式细胞仪的高速流体流动和多通道探测系统来实现对数千个细胞的快速检测和分析。
操作1.细胞准备:首先需要从样品中获得待检测的细胞,并进行细胞的染色。
常用的染色方法包括直接染色和间接染色,可以利用荧光标记的抗体或荧光染料对细胞进行染色。
2.样品处理:将染色后的细胞悬浮液注入流式细胞仪的进样室中,通过机械或压力的方式使细胞以单细胞的形式通过流式细胞仪。
3.流式细胞仪操作:设置流式细胞仪的相关参数,包括激光光源的波长、光学滤波系统、探测器的选择等。
4.数据获取和分析:流式细胞仪会记录每个细胞的各项参数,包括细胞形态、大小、荧光强度等。
可以利用专门的数据分析软件对获取的数据进行分析和图表的制作。
应用流式细胞术在生命科学研究中有广泛的应用,以下是一些常见的应用:1.免疫学研究:利用流式细胞术可以对免疫细胞进行表面标记,例如CD4+ T细胞、CD8+ T细胞、B细胞等的检测和分析,以研究免疫应答、免疫细胞的亚群分布等。
2.血液学研究:流式细胞术可以用于血液中不同细胞类型的检测和分类,例如红细胞、白细胞以及不同亚群的白细胞等,有助于了解血液疾病的发生机制。
3.肿瘤学研究:利用流式细胞术可以检测肿瘤细胞的特定标记,例如细胞表面抗原、细胞周期相关蛋白等,帮助进一步了解肿瘤细胞的类型、分化程度、增殖活性等。
4.微生物学研究:流式细胞术可以用于微生物的检测和计数,例如细菌、酵母菌等,有助于研究微生物的生长特性、代谢活性等。
5.细胞生物学研究:流式细胞术可以用于对细胞周期的分析、细胞凋亡的检测、细胞增殖速度的测定等,有助于了解细胞生物学的基本过程和调控机制。
总结:流式细胞术是一种非常强大和多功能的技术,在生命科学研究中得到广泛应用。
流式细胞术的基本原理流式细胞术(Flow cytometry)是一种被广泛用于生物学和医学领域的细胞分析和排序技术。
该技术采用激光离子流和散射光学的原理,快速测定单个细胞的生物学和物理特性。
该技术不仅可以进行细胞计数、大小、形态特征、表面结构、细胞周期、代谢活性、细胞分化和生长状态等分析,还可以进行单细胞分选和纯化以及细胞染色体分析等研究。
基本原理流式细胞术的原理是通过射流将单个细胞迅速送入激光束中,该激光束激发细胞中的荧光染料和标记物或散射光学特性,进而检测细胞的光学信号,并进行信号转换和数字化处理,最终得到单个细胞的特异性指标。
流式细胞术的主要组成部分包括样品处理系统、流式细胞分析系统和数据分析系统。
样品处理系统:将细胞样品经过预处理、染色或标记,使其适用于流式细胞分析。
常用的样品预处理方法包括:细胞分离、染色、去除细胞碎片和去除红细胞等。
对于需要分选的细胞,还需要使用细胞排序技术分离目标细胞。
流式细胞分析系统:该系统包括激光、光电倍增管、光学透镜、光学滤波器、样品输送系统和电子系统等。
通过激光激发样品中的荧光染料或标记物,分析细胞的光学特性。
常用的荧光染料包括:FITC、PE、APC、PerCP、Cy5等。
常用的标记物包括:抗体、细胞因子、小分子荧光探针、DNA荧光探针等。
通过修改流式细胞分析仪的配置,可实现不同荧光染料和标记物的测定。
数据分析系统:流式细胞仪测定数据的处理和分析是采用计算机系统完成的。
数据分析的常用指标包括:细胞计数、细胞孔径(大小)、荧光强度(比例和强度)、散射特性等。
一般情况下,在细胞的某个特定荧光标记物上测定的强度与其他群体相比,该指标被用来区分并描述细胞。
流式细胞术的应用流式细胞术被广泛应用于生物医学研究和诊断中。
以下是一些常见的应用领域:1. 分析细胞表面和胞内蛋白表达:通过荧光共轭的抗体和标记物来测定单个细胞膜和胞内蛋白的表达量和分布,从而确定细胞分化状态和生理状态。
流式细胞术的工作原理及其临床应用一、本文概述流式细胞术(Flow Cytometry,FCM)是一种在液流中快速检测和分析单个细胞的技术,广泛应用于生物学、医学和生物技术等众多领域。
本文将对流式细胞术的工作原理进行详细介绍,并探讨其在临床诊断和治疗中的广泛应用。
我们将概述流式细胞术的基本原理和技术特点,包括细胞染色、荧光信号检测和数据分析等方面。
然后,我们将深入探讨流式细胞术在免疫学、血液学、肿瘤学等领域中的临床应用,以及其在疾病诊断、预后评估、疗效监测等方面的重要作用。
我们将对流式细胞术的未来发展趋势进行展望,以期为读者提供全面而深入的了解。
二、流式细胞术的工作原理流式细胞术(Flow Cytometry,FCM)是一种在液流中快速定量分析和分选细胞的技术。
其工作原理主要基于流式细胞仪的精确设计和操作。
待检测的细胞经过预处理,如荧光标记、固定和破膜等,使其带有可检测的荧光染料或抗体。
这些细胞随后被导入到流式细胞仪中,通过喷嘴形成单细胞悬液,并以一定的流速通过检测区域。
在检测区域,细胞经过激光束的照射,激发出荧光信号。
这些信号被光电倍增管等光电转换器接收,并转化为电信号。
电信号经过放大、数字化处理后,由计算机系统进行记录和分析。
流式细胞仪可以同时检测多个参数,如细胞大小、内部结构、DNA 含量、蛋白质表达等。
这些参数的分析主要基于荧光信号的强度和波长,以及细胞的电学特性,如电阻抗。
流式细胞术还可以结合分选技术,将特定类型的细胞从混合细胞群体中分离出来。
这主要通过在流式细胞仪的出口处设置电磁场或静电场,对带有特定荧光信号的细胞进行偏转,从而实现细胞的分选。
流式细胞术的工作原理是将单个细胞在液流中快速通过激光束,通过检测和分析荧光信号,实现细胞的定量和定性分析,以及细胞的分选。
这种技术具有高灵敏度、高分辨率和高通量的特点,广泛应用于生物医学研究的各个领域。
三、流式细胞术的临床应用流式细胞术(Flow Cytometry,FCM)作为一种高度灵敏且多功能的细胞分析技术,在临床医学领域的应用日益广泛。
第二讲:流式细胞术原理FSC与SSC我们在第一讲:流式细胞术概述中介绍了流式细胞术是什么,能够检测哪些样本的哪些参数,三大系统以及数据的呈现形式;另外,我们前段时间为大家分享了常用流式细胞仪荧光参数。
这一讲,实验小白为大家简单介绍一下流式细胞术的基本原理以及FSC和SSC这两个参数的用处。
流式细胞术原理在一定的压力下,鞘液带着细胞通过喷嘴中心进入到流式照射室,在流式照射室的分析点,激光照射到细胞发生散射和折射,发射出散射光(包括前向散射光和侧向散射光);同时细胞所携带的荧光素被激光激发并发射出荧光。
前向散射光(Forward scatter, FSC)和侧向散射光(side scatter, SSC)检测器把散射光转变成电信号。
而荧光则被聚光器收集,不同颜色的荧光被双色反光镜转向不同的光电倍增检测器,把荧光信号也转变成电信号。
这些电信号再经过数据化处理后输入电脑并储存,即可对细胞进行分析或分选。
流式细胞术中的三大系统根据工作原理,流式可以划分为液流系统、光学检测系统和电子控制系统三大系统:液流系统:流动室及液流驱动系统。
光学检测系统:激光光源及光束形成系统;聚焦光源透镜、各种滤光片;光电倍增管(PMT)收集不同波长荧光信号。
电子控制系统:荧光信号转换为电信号,并将信号放大;电信号转化为数字信号;流式软件:收集,分析,数据和图片的输出。
液流系统单细胞液流的形成我们在第一讲中就介绍了流式细胞术就是利用流式细胞仪对处在快速直线流动状态的单细胞进行逐个分析的技术。
那么单细胞液流是如何形成的呢?重点:FSC和SSC参数实验小白将实验样本制备成单细胞悬液,染色后就可以上机检测了。
单细胞悬液在上述的液流系统带动下逐个通过流式细胞仪的检测点,经过机器内部复杂的处理后,我们就可以得到一系列的数据。
然而,不管您是做什么流式实验,最先得到的都是FSC和SSC数据。
即使样本没有经过任何染色,您也可以得到FSC和SSC数据。
流式细胞术的技术原理将待测细胞染色后制成单细胞悬液。
用一定压力将待测样品压入流动室,从鞘液管喷出,鞘液管入口方向与待测样品流成一定角度,这样,组成一个圆形的流束,待测细胞在鞘液的包被下单行排列,依次通过检测区域。
流式细胞仪通常以激光作为发光源。
经过聚焦整形后的光束,垂直照射在样品流上,被荧光染色的细胞在激光束的照射下,产生散射光和激发荧光。
这两种信号同时被前向光电二极管和90°方向的光电倍增管接收。
光散射信号反映了细胞体积的大小;荧光信号的接受方向与激光束垂直,经过一系列双色性反射镜和带通滤光片的分离,形成多个不同波长的荧光信号。
荧光信号的强度代表了所测细胞膜表面抗原的强度或其核内物质的浓度,经光电倍增管接收后可转换为电信号,再通过模/数转换器,将连续的电信号转换为可被计算机识别的数字信号,计算机把所测量到的各种信号进行计算机处理。
检测数据的显示视测量参数的不同由多种形式可供选择。
单参数数据以直方图的形式表达,其X轴为测量强度,Y轴为细胞数目。
细胞的分选是通过分离含有单细胞的液滴而实现的。
在流动室的喷口上配有一个超高频电晶体,充电后振动,使喷出的液流断裂为均匀的液滴,待测定细胞就分散在这些液滴之中。
将这些液滴充以正负不同的电荷,当液滴流经带有几千伏特的偏转板时,在高压电场的作用下偏转,落入各自的收集容器中,不予充电的液滴落入中间的废液容器,从而实现细胞的分离。
流式细胞术应用例子1.白血病的诊断和治疗:FCM采用各种抗血细胞表面分化抗原(CD)的单克隆抗体,借助于各种荧光染料(异硫氰基荧光素FITC,藻红蛋白PE等)测定一个细胞的多种参数,以正确地判断出该细胞的属。
2.首先需要把实体瘤组织解聚、分散制备成单细胞悬液,用荧光染料(碘化吡啶PI)染色后对细胞的DNA含量进行分析,将不易区分的群体细胞分成三个亚群(G1期,S期和G2期),DNA含量直接代表细胞的倍体状态,非倍体细胞与肿瘤恶性程度有关。