实验6 铁制品锈蚀的条件 初中化学实验报告
- 格式:doc
- 大小:44.00 KB
- 文档页数:2
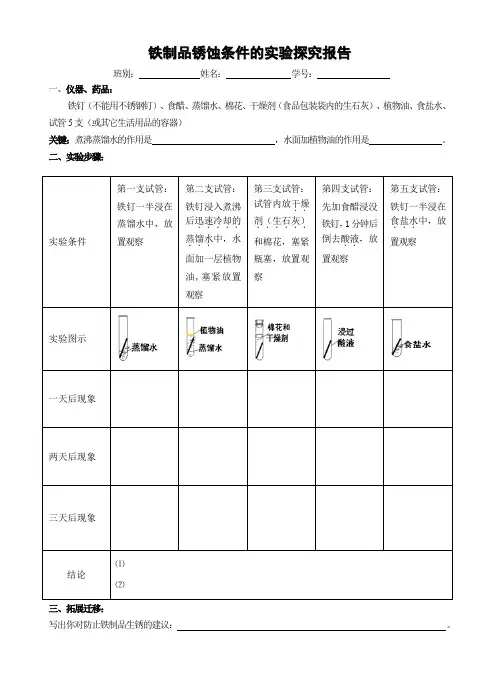
铁制品锈蚀条件的实验探究报告
班别: 姓名: 学号:
一、仪器、药品:
铁钉(不能用不锈钢钉)、食醋、蒸馏水、棉花、干燥剂(食品包装袋内的生石灰)、植物油、食盐水、试管5支(或其它生活用品的容器)
关键:煮沸蒸馏水的作用是 ,水面加植物油的作用是 。
二、实验步骤:
三、拓展迁移:
写出你对防止铁制品生锈的建议: 。
实验条件
第一支试管:铁钉一半浸在蒸馏水中,放
置观察
第二支试管:铁钉浸入煮沸后迅速冷却的.....
蒸馏水...中,水面加一层植物油,塞紧放置观察
第三支试管:试管内放干燥..
剂(生石灰)......和棉花,塞紧瓶塞,放置观察
第四支试管:先加食醋浸没铁钉,1分钟后倒去酸液..,放置观察
第五支试管:铁钉一半浸在食盐水...中,放置观察
实验图示
一天后现象
两天后现象
三天后现象
结论
⑴
⑵。

铁生锈实验报告Document serial number【LGGKGB-LGG98YT-LGGT8CB-LGUT-LGG08】铁生锈的实验报告一·设计方案如图中ⅰ ⅱ ⅲ所示ⅰ ⅱ ⅲ在第ⅰ支试管中放有洁净的铁钉和经煮沸迅速冷却的蒸馏水(铁钉未完全浸入水中);第ⅱ支试管中洁净的铁钉下半部分浸入蒸馏水中,上半部分浸入到植物油内(铁钉完全浸入液体内);第ⅲ支试管先经加热使试管干燥,然后放入洁净的铁钉,再在试管口塞上一团棉花,棉花上放一些干燥剂氯化钙,最后用橡皮塞塞紧。
二·实验现象过一周后,第ⅰ支试管内铁钉在水面以上部分生锈;第ⅱ支试管和第ⅲ支试管中铁钉未生锈。
三·分析现象第ⅰ支试管中铁钉在水面以上部分与氧气和水蒸气充分接触;第ⅱ支试管中铁钉与水接触,与氧气不接触;第ⅲ支试管中铁钉只与氧气接触。
四·结论铁制品锈蚀的条件是铁与氧气和水蒸气接触。
篇二:钢铁锈蚀条件的探究实验报告钢铁锈蚀条件的探究实验报告六年级六班石仪琳实验目的生活中铁在潮湿的空气中比在干燥的空气中要容易生锈,那么铁生锈是跟水发生反应呢还是跟水及空气一起发生反应?还是其它的反应呢?原因是什么呢?铁生锈必须具备那些条件呢? [实验目的]:研究铁生锈的条件 [实验目标]:通过自主探究等多样化的研究性学习活动方式,提升自身学习生活的经验、能力、情感体验和价值目标追求,密切学习生活与自然界、社会生活的联系,加强知识学习与实践活动的联系,发展综合运用已学的知识技能、解决实际问题的科学态度、方法和能力。
我们通过仔细的观察及调查后,对铁生锈的原因作出如下猜想:猜想1:铁生锈是因为铁与空气接触,和空气中的氧气化合所致。
依据:我们通过观察、调查发现,放在潮湿的地方的铁制品很容易生锈,但放在干燥的地方的铁制品却不是很容易生锈;猜想2:铁生锈是因为空气中有水蒸气,水和铁起化学反应所致。
依据:我们通过观察、调查发现,裸露在空气中的铁制品很容易生锈,但涂了油漆的或镀上了一些不易生锈的金属后的铁制品却不太容易生锈。

设计铁生锈条件的实验报告引言铁是一种常见的金属,但当铁接触到湿气或水时,容易发生氧化反应产生铁锈。
铁锈会对铁材料的性能和外观造成不良影响。
因此,研究铁生锈的条件对于了解铁材料的稳定性和使用寿命具有重要意义。
本实验致力于设计一种铁生锈的条件,并通过观察和分析来揭示铁生锈的机理。
实验目的1. 设计一种适合铁生锈的条件。
2. 观察和记录铁生锈的过程。
3. 分析铁生锈的机理。
4. 探讨防止铁生锈的方法。
实验材料- 铁片- 盐水溶液(浓度可调)- 不锈钢板(对照组)- 小型试管或容器- 塑料薄膜- 显微镜实验步骤1. 准备多个小型试管或容器,分别加入不同浓度的盐水溶液。
2. 将每个试管中的盐水溶液与一个铁片接触,确保铁片完全浸泡在盐水中,制作多组样品。
3. 设立对照实验组,将一个不锈钢板置于盐水中。
不锈钢在常温下不易生锈,用作对比观察。
4. 用塑料薄膜将每个试管或容器密封,以防止氧气流通。
5. 将实验组置于适宜的温度和湿度条件下,观察并记录铁片和不锈钢板的变化情况。
6. 定期检查和拍摄不同试验组的照片,特别注意铁片表面的颜色和纹理。
7. 使用显微镜观察铁片表面的细微结构和铁锈形成情况。
实验结果与讨论通过观察和记录,我们得到了以下实验结果:盐水浓度对铁生锈的影响我们分别使用了不同浓度的盐水溶液进行实验,观察到随着盐水浓度的增加,铁片表面的铁锈呈现出更加明显的红褐色。
这说明盐水中的离子对铁生锈起到了催化作用,加速了铁的氧化反应。
在高浓度盐水中,铁片表面的铁锈蔓延更广,形成了较为密集的凹凸纹理。
这可能是由于高浓度盐水中离子的浓度更高,提供了更多的反应物质。
温度和湿度对铁生锈的影响我们在不同温度和湿度条件下进行了实验,发现较高的温度和湿度有助于加速铁的氧化反应。
在相同的盐水浓度下,温度较高和湿度较高的实验组铁片表面的铁锈形成更快,而温度较低和湿度较低的实验组铁片表面的铁锈形成相对较慢。
铁锈的机理铁生锈的机理是由铁与氧气和水反应产生的。

铁锈蚀条件实验报告1.观察铁在不同条件下的腐蚀情况;2.研究不同条件下铁的腐蚀速度。
实验器材:1.铁钉;2.盐水溶液;3.干燥的空气;4.湿润的空气。
实验步骤:1.将铁钉分为四组,每组包含相同数量的铁钉;2.将第一组的铁钉完全浸泡在盐水溶液中;3.将第二组的铁钉暴露在干燥的空气中;4.将第三组的铁钉暴露在湿润的空气中;5.将第四组的铁钉作为对照组,放置在不受任何条件限制的环境中;6.观察每组铁钉的腐蚀情况,并记录观察结果;7.根据每组铁钉的腐蚀程度,计算出铁的腐蚀速度;8.对比不同条件下铁的腐蚀速度,得出结论。
实验结果:在盐水溶液中,铁钉表面明显出现了铁锈。
盐水中的氯离子能够催化铁的腐蚀反应,使铁离子迅速溶解,产生铁锈。
在干燥的空气中,铁钉表面只有少量的铁锈。
氧气在铁表面形成的氧化物膜能够保护铁钉的进一步腐蚀。
在湿润的空气中,铁钉表面出现了较多的铁锈。
湿润的环境会加速铁离子的溶解,从而加速铁的腐蚀反应。
计算腐蚀速度的公式为:腐蚀速度= (初始重量- 终止重量) / (实验时间x 铁的密度)利用上述公式,我们可以计算出不同条件下的腐蚀速度,并比较它们的差异。
结论:1.在盐水溶液中,铁的腐蚀速度最快,因为盐水中的氯离子能够催化铁的腐蚀反应。
2.在干燥的空气中,铁的腐蚀速度较慢,因为铁表面的氧化物膜能够保护铁钉的进一步腐蚀。
3.在湿润的空气中,铁的腐蚀速度比在干燥的空气中略快,因为湿润的环境会加速铁离子的溶解。
4.对照组的铁钉在一般环境条件下没有明显的腐蚀迹象。
根据实验结果,我们可以得出结论:盐水溶液是铁腐蚀速度最快的环境,而干燥的空气对铁的腐蚀有一定的保护作用,湿润的空气加速了铁的腐蚀反应。
这些结论对于了解铁腐蚀特性以及预防铁腐蚀有一定的指导意义。
在实际应用中,可以通过控制环境条件来减缓铁的腐蚀速度,延长铁制品的使用寿命。

一、实验目的1. 了解铁生锈的条件。
2. 探究氧气、水分、温度等因素对铁生锈的影响。
3. 掌握铁生锈的防护方法。
二、实验原理铁生锈是铁与氧气、水分发生氧化反应的结果。
在潮湿的空气中,铁表面与氧气和水蒸气接触,形成铁的氧化物,即铁锈。
铁锈的形成过程如下:4Fe + 3O2 + 6H2O → 4Fe(OH)3Fe(OH)3 → Fe2O3·nH2O(铁锈)三、实验材料1. 铁钉2. 水槽3. 氧气瓶4. 温度计5. 烧杯6. 滤纸7. 酒精灯8. 秒表9. 纱布四、实验步骤1. 将铁钉放入水槽中,观察铁钉在常温下的生锈情况。
2. 将氧气瓶中的氧气通入水中,观察铁钉在氧气环境下的生锈情况。
3. 将铁钉放入烧杯中,加入适量水分,观察铁钉在水分环境下的生锈情况。
4. 将铁钉放入烧杯中,加入适量水分,加热至一定温度,观察铁钉在温度环境下的生锈情况。
5. 对比不同条件下的生锈情况,分析氧气、水分、温度等因素对铁生锈的影响。
五、实验结果与分析1. 常温下,铁钉在水中生锈速度较慢,但仍有明显锈迹。
2. 在氧气环境下,铁钉生锈速度明显加快,锈迹较深。
3. 在水分环境下,铁钉生锈速度较快,锈迹较明显。
4. 在温度环境下,铁钉生锈速度明显加快,锈迹较深。
六、实验结论1. 铁生锈的条件是氧气、水分同时存在。
2. 氧气、水分、温度等因素都会影响铁生锈的速度。
3. 防止铁生锈的方法有:a. 保持干燥,减少水分对铁的侵蚀;b. 避免铁与氧气直接接触,如涂上油漆、涂抹油脂等;c. 控制温度,避免高温加速铁的氧化。
七、实验讨论1. 铁生锈对我们的生活有哪些影响?a. 铁制品使用寿命缩短;b. 铁制品腐蚀后,会影响其性能;c. 铁锈会污染环境。
2. 如何防止铁生锈?a. 使用不锈钢、铝合金等不易生锈的金属材料;b. 对铁制品进行表面处理,如涂漆、涂抹油脂等;c. 保持铁制品干燥,避免与潮湿环境接触。
八、实验总结本次实验通过对铁生锈条件的探究,使我们对铁生锈的原因和影响有了更深入的了解。

探究铁生锈的条件实验报告-概述说明以及解释1.引言1.1 概述概述部分的内容可以包括对铁生锈现象的简要介绍以及对本篇实验报告的总体介绍。
铁生锈是一种普遍的自然现象,当铁暴露在空气中或与水接触时,会逐渐发生氧化反应,形成铁锈。
这种现象不仅会影响铁的外观,还可能对铁制品的性能产生不良影响。
因此,研究铁生锈的条件对于了解铁的化学性质以及预防铁制品的腐蚀具有重要意义。
本篇实验报告旨在探究铁生锈的条件,并观察不同条件下铁生锈的程度和速度。
通过实验,我们将分析铁生锈的影响因素,并探讨可能的预防措施。
文章的结构如下:首先是引言部分,概述了本篇报告的目的和意义;接着是正文部分,介绍了铁的性质、铁的氧化反应以及铁生锈的条件和影响;然后是实验方法部分,详细说明了实验所使用的材料、步骤以及观察和记录的内容;最后是结论部分,总结了实验结果,探讨了铁生锈条件的影响,阐述了实验的局限性和改进方向,以及对实际应用的意义和建议。
通过本实验报告的撰写和实验的开展,我们希望能够更深入地了解铁生锈的条件和影响,为防止铁制品腐蚀提供可行的方案和建议。
文章结构部分的内容如下:1.2 文章结构本文将按照以下结构进行阐述铁生锈的条件的实验报告:第一部分为引言部分,将概述本文的主题和研究对象,并介绍文章的结构和目的。
本部分将为读者提供一个全面的背景,使其了解本文的目标和重点。
第二部分为正文部分,将详细探究铁的性质、铁的氧化反应、铁生锈的条件以及铁生锈对物体的影响。
本部分将通过对相关理论的阐述和实验的分析,揭示铁生锈的原因和过程。
第三部分为实验方法的介绍,将包括实验所使用的材料和实验的步骤。
实验观察与记录部分将记录实验的结果和观察到的现象。
实验结果分析部分将对实验数据进行统计和分析,以得出结论和解释实验结果。
第四部分为结论部分,将总结实验结果,探究铁生锈条件的影响因素,并讨论实验的局限性和改进方向。
最后,将探讨实际应用的意义和提出相关的建议,以促进对铁生锈条件的认识和应用。

探究铁制品锈蚀的条件实验报告铁制品在日常生活中随处可见,从家具到建筑,再到机械设备,铁的应用广泛而丰富。
然而,铁制品容易发生锈蚀现象,不仅影响美观,还会降低铁制品的使用寿命。
因此,探究铁制品锈蚀的条件成为了一项重要的研究课题。
在这个实验中,我们着重考察了铁制品锈蚀的条件,以便更好地了解铁锈形成的原因及条件。
通过实验,我们发现了几种能够影响铁制品锈蚀的主要条件,包括湿度、氧气和盐分等因素。
首先,我们研究了湿度对铁制品锈蚀的影响。
实验结果表明,高湿度环境会加速铁制品的锈蚀速度。
这是因为在高湿度的环境下,铁制品表面容易形成水膜,从而提供了锈蚀所需的水分。
此外,湿度高的情况下,空气中的氧气也更容易与铁发生反应,形成氧化铁,导致铁制品锈蚀加剧。
其次,氧气也是影响铁制品锈蚀的重要条件之一。
实验结果显示,氧气是铁锈的主要成分之一,而且氧气越充足,铁制品的锈蚀速度越快。
在实验中,我们将铁制品置于含氧气丰富的环境中,发现铁制品表面很快形成了红色的氧化铁皮,这是由铁与氧气反应所形成的。
因此,氧气的存在是铁制品锈蚀的必要条件。
另外,盐分也是一个影响铁制品锈蚀的重要因素。
实验结果表明,在含有盐分的环境中,铁制品的锈蚀速度更快。
这是因为盐能够增加水的溶解度,使得铁制品表面的水膜更容易形成。
同时,盐还能够提高水的电导率,促进锈蚀反应的进行。
在实验中,我们将铁制品浸泡在盐水中,发现铁制品的锈蚀速度比不含盐的水中要快很多。
通过这些实验,我们深入探讨了铁制品锈蚀的条件,为我们更好地保护铁制品提供了参考。
我们可以在日常生活中注意控制环境湿度,避免铁制品长时间暴露在高湿度环境中。
同时,定期清洁铁制品表面,去除积聚的盐分和水,也是保护铁制品的有效方法之一。
除此之外,我们还可以在铁制品表面涂上防锈涂层,阻止氧气和水分的接触,从而延长铁制品的使用寿命。
总的来说,我们通过这个实验深入探究了铁制品锈蚀的条件,揭示了湿度、氧气和盐分等因素对铁制品锈蚀的影响机制。

铁生锈的条件实验报告铁生锈的条件实验报告引言:铁生锈是指铁与空气中的氧气和水分发生化学反应,产生铁氧化物的现象。
铁生锈不仅影响了铁制品的外观美观,还会降低其使用寿命和功能。
为了深入了解铁生锈的条件,本实验通过模拟不同环境条件下的铁生锈过程,探究了影响铁生锈的因素。
实验一:湿度对铁生锈的影响实验目的:探究湿度对铁生锈的影响程度。
实验步骤:1. 准备两块相同大小的铁片,分别标记为A和B。
2. 将铁片A放置在干燥的环境中,将铁片B放置在潮湿的环境中。
3. 观察并记录每天铁片的变化情况,包括颜色变化和铁片表面的细节。
实验结果:经过一周的观察,铁片A几乎没有发生变化,而铁片B表面开始出现红棕色的斑点,逐渐蔓延并覆盖整个表面。
铁片B的生锈速度明显比铁片A快。
实验分析:湿度是铁生锈的重要因素之一。
湿度高时,空气中的水分更容易与铁发生反应,加速了铁生锈的过程。
实验结果表明,湿度越高,铁生锈的速度越快。
实验二:氧气对铁生锈的影响实验目的:探究氧气对铁生锈的影响程度。
实验步骤:1. 准备两块相同大小的铁片,分别标记为C和D。
2. 将铁片C放置在密封的容器中,使其与空气隔绝。
3. 将铁片D放置在通风的环境中,使其暴露在空气中。
4. 观察并记录每天铁片的变化情况,包括颜色变化和铁片表面的细节。
实验结果:经过一周的观察,铁片C几乎没有发生变化,而铁片D表面开始出现红棕色的斑点,逐渐蔓延并覆盖整个表面。
铁片D的生锈速度明显比铁片C快。
实验分析:氧气是铁生锈的必要条件之一。
铁与氧气发生反应,形成铁氧化物。
实验结果表明,当铁暴露在空气中时,铁生锈的速度明显加快。
实验三:盐对铁生锈的影响实验目的:探究盐对铁生锈的影响程度。
实验步骤:1. 准备两块相同大小的铁片,分别标记为E和F。
2. 将铁片E放置在不含盐的水中,将铁片F放置在含盐的水中。
3. 观察并记录每天铁片的变化情况,包括颜色变化和铁片表面的细节。
实验结果:经过一周的观察,铁片E几乎没有发生变化,而铁片F表面开始出现红棕色的斑点,逐渐蔓延并覆盖整个表面。

一、实验目的通过本实验,探究铁钉锈蚀的条件,分析不同环境下铁钉锈蚀的速度差异,从而加深对金属腐蚀原理的理解。
二、实验背景铁钉作为一种常见的金属材料,广泛应用于日常生活和工业生产中。
然而,铁钉在潮湿环境中容易发生锈蚀,影响其使用寿命和性能。
了解铁钉锈蚀的条件,有助于采取相应的防护措施,延长铁钉的使用寿命。
三、实验材料1. 铁钉:6根,规格一致2. 试管:6支,干净、透明3. 蒸馏水:适量4. 植物油:适量5. 干燥剂:适量6. 食盐水:适量7. 锌片:适量8. 铜丝:适量9. 记录本:1本10. 笔:1支四、实验步骤1. 将6根铁钉编号为1-6。
2. 将试管(1)放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触。
3. 将试管(2)的试管底放入干燥剂,再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触。
4. 将试管(3)先放入一根铁钉,趁热倒入煮沸的蒸馏水(赶出原先溶液在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触。
5. 将试管(4)中放入铁钉注入食盐水,使铁钉和空气及食盐水接触。
6. 将试管(5)放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片。
7. 将试管(6)放入相连的铁钉和铜丝,注入自来水浸没铁钉和铜丝。
8. 将6支试管放在试管架上,每天观察并记录铁钉锈蚀情况。
五、实验结果与分析1. 试管(1):铁钉与空气和水接触,锈蚀速度较快。
2. 试管(2):铁钉与干燥空气接触,锈蚀速度较慢。
3. 试管(3):铁钉与煮沸的蒸馏水和植物油接触,锈蚀速度最慢。
4. 试管(4):铁钉与食盐水和空气接触,锈蚀速度较快。
5. 试管(5):铁钉与锌片和自来水接触,由于锌比铁活泼,铁钉得到保护,锈蚀速度较慢。
6. 试管(6):铁钉与铜丝和自来水接触,由于铜比铁不活泼,铁钉被腐蚀,锈蚀速度较快。
六、实验结论1. 铁钉锈蚀需要氧气和水,且锈蚀速度受环境因素影响。
2. 在干燥空气中,铁钉锈蚀速度较慢。

铁制品锈蚀的条件
铁生锈的条件:同时和氧气、水接触.两者缺一不可。
铁生锈实际上就是:铁、氧气、水三者之间发生的氧化反应。
铁在什么情况下容易生锈
1、若铁上的杂质过多,在潮湿空气中会产生锈蚀,尤其是在碱或盐的溶液中生锈更快。
2、一般在常温中,铁在干燥空气里不易起反应,但在高温时会生成Fe3O4,赤热铁和水蒸气起反应会导致Fe3O4。
加热时均能同卤素、硫、硅、碳、磷等化合。
除了生成氧化物外,还有复合氧化物生成。
铁生锈的三个必要条件
1、铁本身的活泼的化学性质。
2、外界条件空气中所含的氧气。
3、水分是使铁容易生锈的物质之一。
总结而言,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成氧化铁的东西,这就是铁锈。
铁锈是一种棕红色的物质,它不像铁那样坚硬,很容易脱落,一块铁完全生锈后体积会胀大8倍。

通过本实验,探究铁钉在不同环境条件下生锈的情况,分析影响铁钉生锈的主要因素,并总结防止铁钉生锈的方法。
二、实验原理铁钉生锈是铁与氧气和水蒸气发生化学反应的过程。
铁在潮湿环境中,会与空气中的氧气和水蒸气发生氧化反应,生成氧化铁,即铁锈。
本实验通过对比不同环境下铁钉生锈的情况,来分析影响铁钉生锈的因素。
三、实验材料1. 铁钉:大小相同,形状相同2. 试管:3个3. 纯净水4. 植物油5. 干燥剂(如食品中的干燥剂)6. 计时器7. 量筒四、实验步骤1. 将三个试管洗净,放在水平桌面上。
2. 在第一个试管内放入一些干燥剂,放入一个铁钉,并用瓶塞将瓶口塞住,使其与外部的空气无法接触。
3. 在第二个试管内装入一个铁钉,用纯净水将铁钉完全浸没。
再向水上滴加一层植物油,使其与空气隔绝,盖上盖子。
4. 在第三个试管内装入一个铁钉,用水没过铁钉一半,使铁钉一部分在水里,另一部分裸露在空气,不盖盖,使其与外部空气接触。
5. 将三个试管放置在相同的环境条件下,开始计时。
6. 每隔一段时间(如一天、两天、三天等),观察并记录三个试管中铁钉的生锈情况。
1. 在第一个试管中,铁钉未生锈。
2. 在第二个试管中,铁钉未生锈。
3. 在第三个试管中,铁钉在水与空气的交界处生锈最为严重,远离水面的部分生锈较轻。
六、实验结果与分析1. 通过实验现象可知,铁钉生锈的主要条件是水和氧气。
在干燥环境中,铁钉不会生锈;在完全浸没在水中或与空气隔绝的环境中,铁钉也不会生锈。
2. 在水与空气的交界处,铁钉的生锈情况最为严重,这是因为在这个位置,铁钉同时接触到了水和氧气,从而加快了生锈的速度。
3. 在盐水中,铁钉的生锈速度会加快。
这是因为盐水中的氯离子会加速铁的腐蚀过程。
七、结论1. 铁钉生锈的主要条件是水和氧气。
2. 在干燥环境中,铁钉不会生锈。
3. 在水与空气的交界处,铁钉的生锈速度最快。
4. 盐水会加速铁钉的生锈速度。
八、防止铁钉生锈的方法1. 保持铁钉干燥,避免与水分接触。
探究铁生锈实验报告实验目的本实验的目的是探究铁生锈的原因,并通过实验验证所得结论。
实验材料- 铁钉- 水- 碘酒- 干燥管实验步骤1. 将干燥管中的碘酒倒入一个容器中,使其蒸发得到干燥后的碘酒晶体。
2. 在实验开始前,先将一根铁钉清洗干净,并且确保其表面无水分。
3. 在实验前,准备一个干燥无水分的容器,放入几块蒸发后的碘酒晶体。
4. 将铁钉放入容器中,尽量确保钉子与碘酒晶体接触。
5. 观察一段时间后,观察铁钉的表面变化。
实验结果观察实验过程中铁钉的表面,我们发现铁钉表面出现了明显的锈蚀。
锈蚀的程度和时间呈正相关,观察时间越长,铁钉的锈蚀现象越明显。
实验分析我们知道,铁钉出现锈蚀是由于铁与氧气反应生成了铁(III)氧化物,即常见的铁锈。
而在本实验中,碘酒充当了氧气的角色,从而促使了铁钉的锈蚀。
铁钉与碘酒反应的化学方程式为:2Fe + 3I2 →2FeI3在实验过程中,铁钉表面的铁离子与碘酒中的碘离子发生了置换反应,生成了铁(III)离子和碘化铁(III)。
而随着时间的推移,铁(III)离子进一步氧化形成了黑色的Fe2O3,即铁锈。
实验改进为了更好地观察铁的锈蚀现象,我们可以做一些实验改进。
首先,我们可以对比不同条件下铁钉的锈蚀情况,比如在有水的情况下和无水的情况下进行对比实验。
另外,我们还可以分别用不同气体替代碘酒,观察其对铁钉的影响。
这些改进可以更全面地了解铁锈形成的原因。
实验应用铁锈是一种常见的金属腐蚀现象,研究铁生锈可以帮助我们更好地理解金属在不同环境下的化学反应。
此外,对铁锈的研究也有助于开发相关的防锈措施和新型材料,以延长金属的使用寿命。
总结通过本次实验,我们验证了铁钉在氧气的作用下会发生锈蚀的现象。
铁与氧气反应生成的铁锈是由铁(III)离子和Fe2O3组成。
这项实验加深了我们对金属腐蚀的理解,并为进一步研究和应用提供了基础。
铁生锈了实验报告铁生锈了实验报告一、引言铁生锈是我们日常生活中常见的现象之一。
铁生锈不仅会影响铁制品的美观,还会降低其使用寿命。
为了深入了解铁生锈的原因和过程,我们进行了一系列实验来研究铁生锈的机制。
二、实验目的本实验的目的是观察铁在不同条件下的生锈情况,并探究铁生锈的原因和过程。
三、实验材料和方法1. 实验材料:- 铁块- 水- 盐- 醋酸- 砂纸2. 实验方法:- 实验一:将铁块放置在水中观察- 实验二:将铁块放置在含盐水中观察- 实验三:将铁块放置在醋酸中观察- 实验四:使用砂纸磨擦铁块表面后观察四、实验结果与分析1. 实验一:将铁块放置在水中观察我们将铁块放置在水中观察了一段时间后发现,铁块表面开始出现红褐色的斑点,逐渐扩散并形成一层薄薄的锈层。
这表明,铁与水中的氧气发生了反应,产生了铁的氧化物。
2. 实验二:将铁块放置在含盐水中观察在含盐水中进行的实验中,铁块表面的锈层形成速度更快。
这是因为盐水中的盐离子能够加速铁的氧化反应,形成更多的铁的氧化物。
3. 实验三:将铁块放置在醋酸中观察与水中的实验相比,铁块放置在醋酸中的时间更长,但铁的氧化速度较慢。
这是因为醋酸中的酸性能够与铁的氧化物发生反应,形成一层保护性的醋酸盐层,减缓了铁的进一步氧化。
4. 实验四:使用砂纸磨擦铁块表面后观察我们使用砂纸对铁块表面进行磨擦后发现,铁块表面的锈层被磨去,露出了铁的光亮表面。
这表明,铁的氧化是发生在铁的表面上的,只有将锈层去除,才能恢复铁的原貌。
五、实验结论通过以上实验,我们得出了以下结论:- 铁会在空气中与氧气发生反应,形成铁的氧化物,即生锈。
- 盐水中的盐离子能够加速铁的氧化反应,使铁生锈更快。
- 醋酸中的酸性能够与铁的氧化物反应,形成一层保护性的醋酸盐层,减缓铁的进一步氧化。
- 铁的氧化是发生在铁的表面上的,只有将锈层去除,才能恢复铁的原貌。
六、实验意义和应用铁生锈的研究不仅有助于我们了解铁的性质和化学反应,还有一定的应用价值。
一、实验目的1. 了解金属锈蚀的原因和过程;2. 探究金属锈蚀的防治方法;3. 分析金属锈蚀对人类生产生活的影响。
二、实验原理金属锈蚀是指金属表面与周围环境中的氧气、水分、酸、碱等物质发生化学反应,导致金属表面出现疏松多孔的氧化物或盐类物质,从而降低金属的强度和耐久性。
本实验通过观察铁、铜、铝等金属在不同环境条件下的锈蚀情况,分析金属锈蚀的原因和影响因素。
三、实验用品1. 金属样品:铁片、铜片、铝片;2. 实验容器:玻璃瓶、塑料瓶;3. 溶液:食盐水、硫酸铜溶液、稀盐酸;4. 其他用品:镊子、剪刀、胶头滴管、计时器、记录本等。
四、实验步骤1. 铁片锈蚀实验(1)将铁片分别放入玻璃瓶和塑料瓶中,分别加入食盐水、硫酸铜溶液、稀盐酸;(2)观察铁片在不同溶液中的锈蚀情况,记录锈蚀时间;(3)对比分析铁片在不同溶液中的锈蚀速度。
2. 铜片锈蚀实验(1)将铜片分别放入玻璃瓶和塑料瓶中,分别加入食盐水、硫酸铜溶液、稀盐酸;(2)观察铜片在不同溶液中的锈蚀情况,记录锈蚀时间;(3)对比分析铜片在不同溶液中的锈蚀速度。
3. 铝片锈蚀实验(1)将铝片分别放入玻璃瓶和塑料瓶中,分别加入食盐水、硫酸铜溶液、稀盐酸;(2)观察铝片在不同溶液中的锈蚀情况,记录锈蚀时间;(3)对比分析铝片在不同溶液中的锈蚀速度。
4. 防锈处理实验(1)将铁片、铜片、铝片分别放入玻璃瓶中,加入适量食盐水;(2)向玻璃瓶中加入适量的防腐剂,如石油磺酸钡、环氧树脂等;(3)观察金属样品在防腐剂处理后的锈蚀情况,记录锈蚀时间;(4)对比分析防腐剂对金属锈蚀的抑制作用。
五、实验结果与分析1. 铁片、铜片、铝片在不同溶液中的锈蚀速度:实验结果显示,铁片在食盐水、硫酸铜溶液、稀盐酸中的锈蚀速度依次增加,铜片和铝片的锈蚀速度相对较慢。
这表明金属的锈蚀速度与其化学性质和周围环境有关。
2. 防锈处理实验:实验结果显示,加入防腐剂后,金属样品的锈蚀速度明显减慢。
铁的锈蚀实验现象和结论一、实验现象:在日常生活中,我们常常见到铁制品出现锈蚀现象。
铁经过一段时间的接触空气和水分后,表面会出现红褐色的物质,这就是铁的锈蚀现象。
锈蚀通常是在湿润的环境中发生得更为明显,而在干燥的环境中很少发生。
锈蚀的速度也会随着环境的不同而有所变化。
二、实验过程:为了观察铁的锈蚀现象,我们可以进行以下简单的实验:1. 准备一些铁制品,如铁钉、铁片等。
2. 将铁制品放置在湿润的环境中,如容器中加入适量的水分。
3. 观察铁制品的表面变化,并记录下来。
三、实验结果:经过一段时间的观察,我们可以发现铁制品的表面出现了红褐色的物质,这就是铁的锈蚀产物。
锈蚀物质会逐渐覆盖整个铁制品的表面,并且越来越厚。
同时,铁制品的表面也会变得粗糙不平。
四、实验结论:1. 铁的锈蚀是由于铁与氧气和水分反应产生的。
2. 铁与氧气反应生成氧化铁,也就是我们常见的锈。
锈蚀物质的主要成分是铁的氧化物,包括Fe2O3和Fe3O4等。
3. 湿润的环境会加速铁的锈蚀过程,而干燥的环境则相对较慢。
4. 锈蚀物质的形成是一个缓慢的过程,需要一定的时间。
锈蚀的速度取决于环境条件、铁的纯度和表面处理等因素。
5. 锈蚀不仅会影响铁制品的外观,还会导致铁制品的质量下降,甚至损坏。
6. 为了减缓铁的锈蚀速度,我们可以采取措施进行防护,如涂层、镀层、防锈油等。
这些措施可以阻隔铁与氧气和水分的接触,从而延缓锈蚀的发生。
7. 铁的锈蚀现象不仅发生在日常生活中的铁制品上,也是一些工业设备和基础设施的常见问题。
因此,对于防止铁的锈蚀,具有重要的经济和实际意义。
铁的锈蚀是由于铁与氧气和水分反应产生的,湿润的环境会加速锈蚀的发生。
为了减缓铁的锈蚀速度,我们可以采取一些防护措施。
铁的锈蚀现象不仅影响铁制品的外观,还会导致质量下降和损坏。
因此,对于铁的锈蚀问题,我们应该重视并采取有效的措施进行防护。
一、实验目的1. 了解金属锈蚀的原理和条件;2. 探究不同因素对金属锈蚀速率的影响;3. 采取有效措施减缓金属锈蚀。
二、实验原理金属锈蚀是指金属与氧气、水等物质发生化学反应,导致金属表面产生氧化膜的现象。
金属锈蚀速率受多种因素影响,如氧气浓度、水分含量、温度、金属种类等。
三、实验材料1. 实验仪器:试管、烧杯、酒精灯、玻璃棒、量筒、铁钉、铜钉、锌钉、锡钉、盐酸、硫酸、氢氧化钠、蒸馏水、氯化钠等;2. 实验试剂:金属氧化物、金属盐类、酸、碱等。
四、实验步骤1. 实验一:探究氧气对金属锈蚀的影响(1)将铁钉、铜钉、锌钉、锡钉分别放入四个试管中;(2)向试管中加入等量的蒸馏水;(3)分别向试管中加入适量的氧气;(4)观察并记录金属锈蚀情况。
2. 实验二:探究水分含量对金属锈蚀的影响(1)将铁钉、铜钉、锌钉、锡钉分别放入四个试管中;(2)向试管中加入不同量的蒸馏水;(3)观察并记录金属锈蚀情况。
3. 实验三:探究温度对金属锈蚀的影响(1)将铁钉、铜钉、锌钉、锡钉分别放入四个试管中;(2)将试管放入不同温度的水中;(3)观察并记录金属锈蚀情况。
4. 实验四:探究金属种类对锈蚀的影响(1)将铁钉、铜钉、锌钉、锡钉分别放入四个试管中;(2)向试管中加入适量的氧气和蒸馏水;(3)观察并记录金属锈蚀情况。
5. 实验五:探究酸碱对金属锈蚀的影响(1)将铁钉、铜钉、锌钉、锡钉分别放入四个试管中;(2)向试管中加入适量的酸(盐酸、硫酸)和碱(氢氧化钠);(3)观察并记录金属锈蚀情况。
五、实验结果与分析1. 实验一:氧气对金属锈蚀的影响结果表明,氧气浓度越高,金属锈蚀速率越快。
铁钉、铜钉、锌钉、锡钉均与氧气发生反应,但锈蚀速率不同。
2. 实验二:水分含量对金属锈蚀的影响结果表明,水分含量越高,金属锈蚀速率越快。
当水分含量达到一定值时,金属锈蚀速率趋于稳定。
3. 实验三:温度对金属锈蚀的影响结果表明,温度越高,金属锈蚀速率越快。
实验6 铁制品锈蚀的条件
实验类型:
探究性实验
实验目的:
1.通过观察铁钉生锈的过程,认识铁生锈的条件;
2.了解金属锈蚀的原因。
实验用品:
试管、铁架台、橡皮塞;
铁钉、蒸馏水、植物油、棉花、氯化钙。
实验过程:
1.提出问题
铁生锈的条件是什么?
2.猜想与假设
(1)铁与氧气接触容易生锈;
(2);
(3)。
3.制定计划(设计实验方案)
(1)设计思路:观察铁钉在不同环境中的变化,探究铁制品锈蚀的条件。
(2)实验流程:将三支洁净无锈的铁钉分别与空气、水、氧气接触,持续观察一周→分析得出铁生锈的条件。
你设计的实验方案是。
水中,随后再注
入适量的植物
油;
在第三支试管
中塞入一团棉
花,然后在棉花
上放入干燥剂
氯化钙,并用橡
皮塞塞紧试管
口。
如图所示。
7
通过实验探究得出铁生锈的条件是。
5.反思与评价
(1)为什么铝制品在空气中不容易被腐蚀而铁制品在空气中容易被腐蚀?
(2)上面的实验中采用了哪些实验方法?
(3)铜在空气中也能生锈,请你根据铜锈的主要成分[Cu
2(OH)
2
CO
3
]猜测铜生锈的条件可
能是什么?。