实验六 生物氧化与电子传递
- 格式:doc
- 大小:86.50 KB
- 文档页数:6


生物体内的氧化还原反应与电子传递氧化还原反应是指物质中电子的转移,其中氧化剂接受电子,而还原剂则提供电子。
生物体内的氧化还原反应和电子传递是生命活动的重要组成部分,驱动着细胞代谢和细胞呼吸。
在这篇文章中,我们将探讨生物体内氧化还原反应与电子传递的相关机制。
1. 生物体内氧化还原反应的基础在生物体内,氧化还原反应的基础是分子中的原子之间电子的转移。
从能级角度来看,当一个原子失去电子时,它的能量将升高,并变为一种带正电的离子,也称为氧化剂。
而获得电子的原子将获得能量并变为带负电的离子,也称为还原剂。
生物体内的氧化还原反应通常涉及糖类、脂肪和蛋白质等有机化合物以及氧和水等无机化合物。
2. 酶的作用及其中的去氧化剂和还原剂生物体内的许多酶通过促进氧化还原反应来催化许多生命过程。
生物酶可以作为催化剂来提高氧化还原反应的速率。
常见的生物酶包括脱氢酶、过氧化物酶、还原酶和氧化酶等。
在这些酶中,一些酶起到去氧化剂的作用,即接受电子,而另一些酶则起到还原剂的作用,即提供电子。
通过这种方式,酶可以调节细胞中的氧化还原反应,维持细胞的健康状态。
例如,细胞色素c氧化酶是人体中最重要的酶之一,负责维持细胞的内能平衡。
该酶能够将细胞色素c还原为Fe3+,同时将O2还原为H2O,并同时释放能量和电子。
在这个过程中,氧化还原反应可以用化学方程式来表示为:2Fe2+ + 1/2O2 + 2H+ --> 2Fe3++ H2O。
3. 生物体内的电传递生物体内的电子传递是氧化还原反应的重要组成部分。
电子传递定义为生物体内电荷转移的过程,通常由酶系统和电子传递因子来介导。
电子传递过程也是生命的基础,从而为细胞提供能量、调节代谢、产生ATP以及减轻氧化损伤等等。
生物体内电子传递通常通过线粒体、细胞质以及质膜来实现,产生浓度梯度。
线粒体和质膜通过氢离子的转移来产生浓度梯度。
这些梯度可以使用包括ATP合成酶在内的酶系统来驱动以外的代谢过程。



生物化学学习题氧化还原反应和电子传递链生物化学学习题: 氧化还原反应和电子传递链在生物化学中,氧化还原反应和电子传递链是两个重要的概念。
氧化还原反应(Redox)涉及氧化和还原两个过程,是生命体内许多关键代谢途径中的核心步骤。
电子传递链是细胞内能量代谢的主要途径之一,通过电子的顺序传递来产生能量。
本文将详细介绍氧化还原反应和电子传递链的基本原理和重要作用。
一、氧化还原反应1. 氧化还原反应概述氧化还原反应是指一种或多种物质的氧化态和还原态之间的相互转化过程。
其中,氧化是指物质失去电子,还原是指物质获得电子。
在生物体中,氧化还原反应常以电子的转移为基础进行。
2. 氧化还原反应中的重要概念(1)氧化剂(oxidizing agent):能够接受电子的物质,它自身被还原。
(2)还原剂(reducing agent):能够给予电子的物质,它自身被氧化。
(3)氧化态(oxidation state):物质在化学反应中失去电子所具有的电荷状态。
(4)还原态(reduction state):物质在化学反应中获得电子所具有的电荷状态。
3. 氧化还原反应在生物体内的作用(1)能量产生:氧化还原反应是产生细胞内能量的重要途径,如细胞呼吸中的氧化过程。
(2)代谢调节:氧化还原反应参与多种代谢途径的调控,如葡萄糖分解、脂肪酸氧化等。
(3)维持氧化还原平衡:细胞内氧化还原反应可以维持细胞的内环境稳定,抵抗外界环境的氧化胁迫。
二、电子传递链1. 电子传递链概述电子传递链是生物体内能量代谢的核心过程之一,位于细胞线粒体内的线粒体内膜上。
通过一系列蛋白质复合物和细胞色素的电子传递,将电子从高能量形式的底物转移到低能量形式的受体,产生质子梯度并最终生成ATP。
2. 电子传递链中的重要组分(1)辅酶:如辅酶NAD+和辅酶FAD。
它们能够接受和给予电子,参与电子传递链的电子传递。
(2)蛋白质复合物:包括复合物Ⅰ、Ⅱ、Ⅲ和Ⅳ。
它们通过相互作用和电子传递来促进电子的输送。


11.1生物氧化、氧化电子传递链和氧化磷酸化作用生物氧化、氧化电子传递链和氧化磷酸化作用一、生物氧化的概念和特点。
糖,脂,蛋白质等有机物质在细胞中进行氧化分解,生成CO2,H2O并释放出能量,这个过程称生物氧化。
生物氧化是需氧细胞呼吸代谢过程中的一系列氧化还原作用,又称细胞氧化或细胞呼吸。
特点:反应条件温和,多步反应,逐步放能。
生物氧化在活细胞中进行,pH中性,反应条件温和,一系列酶和电子传递体参与氧化过程,逐步氧化,逐步释放能量,转化成ATP。
真核细胞,生物氧化多在线粒体内进行,在不含线粒体的原核细胞中,生物氧化在细胞膜上进行。
二、氧化电子传递过程生物氧化过程中形成的还原型辅酶(NADH和FADH2),通过电子传递途径,使其重新氧化,此过程称为电子传递过程。
在电子传递过程中,还原型辅酶中的氢以负质子(H —)形式脱下,其电子经一系列的电子传递体(电子传递链)转移,最后转移到分子氧上,质子和离子型氧结合生成H2O。
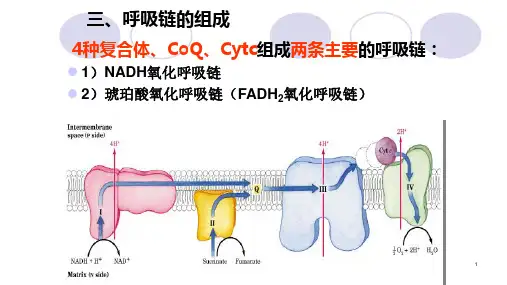
三、氧化电子传递链由NADH到O2的氧化电子传递链主要包括FMN、辅酶Q(CoQ)、细胞色素b、c1、c、a,a3及一些铁硫蛋白。
氧化电子传递链位于原核生物的质膜上,真核生物中位于线粒体的内膜上。
电子载体的标准势能△G o /是逐步下降的,电子沿着电势升高的方向流动。
其中有三个部位的势能落差△G较大,足以形成ATP(ADP磷酸化需要的自由能=7.3Kal/mol.)。
这三个部位正好是氧化磷酸化部位。
细胞内供能物质的彻底氧化产物是CO2、H2O其中CO2主要是在三羟酸循环中产生,水是在电子传递过程的最后阶段产生。
四、电子传递链的酶和电子载体呼吸链中的电子载体都是和蛋白质结合存在(包括NAD+、FMN、铁硫中心、细胞色素)。
这些蛋白质大都是水不溶性的,嵌在线粒体的内膜上。
NAD+是许多脱氢酶的辅酶,FMN是NADH脱氢酶的辅酶。
1、NAD+和NADP+脱氢酶分别与NAD+或NADP+结合,催化底物脱氢,这类酶称为与NAD(P)相关的脱氢酶,多数脱氢酶以NAD+为辅酶,少数以NADP+为辅酶(如G-6-P脱氢酶)少数酶能以NAD+或NADP+两种辅酶(Glu脱氢酶)。

题目及解答精要:
名词解释:(60分,10分一题)
甘油-3-磷酸穿梭:P139 需概括
苹果酸-天冬氨酸穿梭:P139 需概括
电子传递链:P119
解偶联剂:P137
化学渗透假说:P131
生物氧化:P114 两个出处,总结概括
问答题:(10分)
1.比较底物水平磷酸化和氧化磷酸化两者的异同?
参考答案:
也可自己概括
2.以前有人曾经考虑过使用解偶联剂如2,4-二硝基苯酚(DNP)作为减肥药,但不久即放弃使用,为什么?(10分)
参考答案:
3.已知有两种新的代谢抑制剂A和B:将离体的肝线粒体制剂与丙酮酸、氧气、ADP和无机磷酸一起保温,发现加入抑制剂A,电子传递和氧化磷酸化就被抑制;当既加入A又加入抑制剂B的时候,电子传递恢复了,但氧化磷酸化仍不能进行,请问:①.抑制剂A和B属于电子传递抑制剂,氧化磷酸化抑制剂,还是解偶联剂?②.给出作用方式和A、B类似的抑制剂?(20分)
参考答案:
和DNP。


氧化还原反应与电子传递电子传递的规律氧化还原反应与电子传递的规律氧化还原反应是化学反应中常见的一种类型,它涉及到原子或离子的电子的转移。
在氧化还原反应中,原子或离子发生电子的转移,从而改变其氧化态。
这种电子转移的过程被称为电子传递。
本文将介绍氧化还原反应以及电子传递的规律。
一、氧化还原反应的基本概念氧化还原反应是指物质中的某些原子或离子失去或获得电子而改变其氧化态的过程。
其中,原子或离子失去电子的过程被称为氧化反应,而获得电子的过程被称为还原反应。
在氧化还原反应中,氧化剂是指能够接受电子的物质,而还原剂是指能够提供电子的物质。
二、电子传递的规律氧化还原反应中的电子传递遵循一定的规律。
以下是一些常见的规律:1. 质子需要参与电子传递过程在氧化还原反应中,通常需要质子的参与。
质子可以通过溶液中的酸或者碱提供。
质子的参与可以促进电子转移的进行。
2. 能量变化与电子传递的方向在氧化还原反应中,电子的传递通常伴随着能量的变化。
当电子从高能级传递到低能级时,能量会释放出来,反应为放热反应;反之,当电子从低能级传递到高能级时,需要吸收能量,反应为吸热反应。
3. 氧化还原反应速率与电子传递速率在氧化还原反应中,电子的传递速率与反应的速率密切相关。
电子的传递速率取决于电子供应和接受者之间的距离以及电子在介质中的迁移速率。
因此,氧化还原反应的速率可以通过控制电子传递速率的方式来调节。
4. 电子传递过程的标准电动势氧化还原反应中的电子传递可以用标准电动势来描述。
标准电动势为衡量氧化剂和还原剂之间电子转移能力的物理量。
通过比较不同物质之间的标准电动势,可以预测氧化还原反应的方向和剧烈程度。
5. 电子传递与化学反应的结合电子传递过程是氧化还原反应中的关键步骤,但并非是整个反应的全部。
电子传递常常与其他化学反应相结合,如配位溶解和酸碱中和等。
这种结合使得电子传递反应更加复杂且多样化。
三、氧化还原反应的应用氧化还原反应在生活和工业中有着广泛的应用。
氧化还原反应电子的传递与交换氧化还原反应是化学中最常见的反应类型之一,也是电子传递与交换的重要过程。
本文将介绍氧化还原反应中电子的传递与交换机制,以及其在化学、生物和环境领域中的重要性。
一、电子传递的机制在氧化还原反应中,电子的传递是实现氧化和还原之间电荷平衡的关键步骤。
电子传递的机制主要有以下几种:1. 直接电子转移:电子直接从氧化剂转移到还原剂。
这种机制常见于一些简单的氧化还原反应,例如金属电极与溶液中的离子之间的反应。
2. 间接电子转移:电子通过中间体的转移实现氧化还原。
常见的一种间接电子转移机制是通过溶液中的电子带电离子的形式进行。
3. 过渡态电子转移:电子通过过渡态的形成和断裂转移到目标物质。
这种机制在一些催化反应中较为常见,例如氧合酶催化的氧气还原反应。
二、电子交换的机制电子交换在氧化还原反应中起到平衡电荷分布的作用。
电子交换的机制主要有以下几种:1. 直接电子交换:氧化剂和还原剂之间的电子直接交换。
这种机制通常发生在气体相或离子间的氧化还原反应。
2. 间接电子交换:通过介质媒介实现电子的交换。
常见的介质包括电解质溶液,其中的离子可以在氧化还原反应中接受或释放电子。
3. 激发态电子交换:电子在激发态下由氧化剂和还原剂交换。
这种机制在光化学反应中较为常见,例如光合作用中的电子传递过程。
三、氧化还原反应的重要性氧化还原反应在化学、生物和环境领域中都具有重要的作用。
1. 化学应用:氧化还原反应广泛应用于化学合成、电化学分析和能源转换等领域。
例如,电池充电和放电过程中的反应就是氧化还原反应。
2. 生物过程:细胞中的许多生物过程依赖于氧化还原反应,包括呼吸作用和光合作用。
这些反应通过电子传递链中的酶催化来完成。
3. 环境科学:氧化还原反应在环境污染治理中起到重要作用。
例如,废水处理中的氧化还原反应可以去除有害物质,净化水体。
综上所述,氧化还原反应中电子的传递与交换是实现化学反应的重要机制。
准确理解和掌握这些机制对于深入理解化学、生物和环境领域的相关过程具有重要意义,有助于推动科学研究和技术发展的进展。
氧化还原反应的电子传递过程氧化还原反应是化学反应中常见的一种类型,也是能量转化和化学反应中重要的一部分。
氧化还原反应通过电子从一个物质转移到另一个物质中实现。
本文将讨论氧化还原反应的电子传递过程,并探讨其在生物和非生物系统中的应用。
1. 氧化还原反应的基本原理在氧化还原反应中,一个物质会失去电子(被氧化),而另一个物质会获得相同数量的电子(被还原)。
电子的转移是通过氧化还原电位的差异来实现的。
氧化还原电位是测量物质氧化还原能力的指标,其数值越大,物质越容易还原;数值越小,物质越容易氧化。
2. 氧化还原反应的电子传递在氧化还原反应中,电子可以以两种方式进行传递:直接传递和间接传递。
2.1 直接传递直接传递是指电子直接从氧化剂传递到还原剂。
例如,在电池中,氧化剂和还原剂之间会通过电极发生直接的电子传递。
直接传递的一种常见机制是通过电子传导体的存在来实现,如金属导线。
2.2 间接传递间接传递是指电子通过中间体传递给还原剂。
在生物体内,间接传递是常见的电子传递方式。
一个常见的例子是细胞色素系统,其中电子通过色素分子(如叶绿素)在光合作用中传递。
3. 氧化还原反应在生物体内的应用氧化还原反应在生物体内起着重要的作用。
例如,在呼吸过程中,有机物在细胞色素系统中通过电子传递链逐步氧化,最终与氧反应形成水。
这个过程释放出的能量被细胞利用。
类似地,光合作用中,光能通过氧化还原反应转化为化学能,并且在植物细胞中用于合成有机物。
4. 氧化还原反应在非生物系统的应用除了生物系统,氧化还原反应在非生物系统中也有广泛的应用。
例如,电池利用半反应的氧化还原反应来产生电能。
金属的腐蚀也是由氧化还原反应引起的。
此外,氧化还原反应在工业上的合成反应和环境修复中也起着重要的作用。
总结:通过上述讨论,我们可以看到氧化还原反应在化学、生物和工业等领域中的重要性。
氧化还原反应中的电子传递过程是实现能量转化和化学反应的基础。
深入理解氧化还原反应的电子传递机制对我们对化学反应的理解以及在不同领域的应用具有重要意义。
氧化还原反应中的电子转移实验教案实验目的:探究氧化还原反应中电子的转移过程,理解氧化还原反应的基本概念和实验现象。
实验材料:- 锌片(Zn)和铜片(Cu)- 盐酸(HCl)- 锡氯酸(SnCl2)溶液- 明矾(FeSO4)溶液- 纸巾- 试管- 试管夹- 滴管实验原理:氧化还原反应是一种化学反应,其中一种物质被氧化而失去电子,另一种物质则被还原而获得电子。
电子的流动通过氧化还原反应导致了化学物质之间的变化。
在本实验中,我们将使用锌和铜作为氧化还原反应的参与物,通过媒介盐酸或试剂溶液促使电子的流动。
实验步骤:1. 准备工作:- 将锌片和铜片清洗并擦干,确保表面无杂质。
- 准备好盐酸、锡氯酸和明矾的溶液,并标明浓度。
2. 实验一: 锌片和盐酸的反应- 用试管夹将一块锌片固定在试管口,并加入足够的盐酸。
- 观察并记录反应现象。
3. 实验二: 锌片和铜离子的反应- 取一个干净的试管,加入适量的盐酸。
- 用滴管将一滴锡氯酸溶液滴入试管中,同时观察和记录反应现象,例如颜色变化和气体的释放。
4. 实验三: 铜片和明矾的反应- 将铜片放入另一个试管中,加入适量的明矾溶液。
- 观察并记录反应现象,特别是是否有固体沉淀生成。
实验结果与讨论:1. 实验一中,当锌片与盐酸反应时,可以观察到气泡的产生和试管外表面的结露。
这是因为锌被盐酸氧化,同时产生了氢气。
2. 实验二中,加入锡氯酸溶液后,可以观察到溶液颜色的变化。
锌被氧化为锌离子,而锡氯酸中的锡离子则被还原为金属锡。
这是因为锌的还原能力强于锡。
3. 实验三中,当铜片与明矾反应时,可以观察到明矾溶液逐渐变为蓝色,并有固体沉淀生成。
铜被氧化为铜离子,而明矾中的铁离子则被还原为金属铁。
实验结果表明,铜的还原能力较弱。
实验结论:在氧化还原反应中,电子从容易被氧化的物质转移到容易被还原的物质上。
在实验中,我们观察到了锌离子和铜离子的还原现象,并了解了锌和铜具有不同的还原能力。
这表明在氧化还原反应中,电子的传递导致化学物质之间的转化。
实验六生物氧化与电子传递(3学时)一实验目的与要求 1. 掌握电子在电子传递链中的传递过程;2. 了解体外实验中研究电子传递链的方法。
二实验原理生物氧化过程中代谢物脱下的氢由NAD+ 或FAD接受生成还原型NADH或FADH2,再经一系列电子传递体传递,最后与氧结合生成水。
这些存在于线粒体内膜上的氧化还原酶及其辅酶依次排列,顺序地起传递电子或电子和质子的作用,称为电子传递链或呼吸链。
在体内,代谢中间产物琥珀酸在线粒体琥珀酸脱氢酶(辅酶FAD)的作用下脱氢氧化生成延胡索酸,脱下的氢使FAD还原成FADH2,再经电子传递链传递,即FADH2→Q→细胞色素(b→c1→c→aa3),最后与氧结合生成水。
在体外实验中,组织细胞生物氧化生成琥珀酸的量可采用在琥珀酸脱氢时伴有颜色变化的化合物作氢受体来研究。
本实验以2,6-二氯酚锭酚(DPI)为氢受体,蓝色的DPI从还原型黄素蛋白(FADH2)接受电子,生成无色的还原型DPI·2H,蓝色消失,其反应过程如下:琥珀酸+FAD→延胡索酸+ FADH2DPI(蓝色)+ FADH2→DPI·2H(无色)+FAD根据褪色时间可测定生物氧化过程中各代谢物与琥珀酸之间在代谢途径中的距离。
三、试剂及材料磷酸钾缓冲溶液(PBS,50mmol/L,pH7.4):0.2mol/L磷酸二氢钾溶液500ml和0.2mol/L 氢氧化钠溶液395ml混合加水至2000ml。
猪心,2,6-二氯酚锭酚(1.5mmol/LPBS),葡萄糖溶液(90mmol/LPBS),琥珀酸溶液(90mmol/LPBS),乳酸溶液(90mmol/LPBS),NAD+(5mmol/L磷酸盐缓冲溶液)。
四、仪器设备绞肉机,纱布,细砂,研钵,冰浴,恒温水浴。
五、操作方法1. 心肌提取液的制备称取绞碎的心肌糜3g,置250ml烧杯中,加冰冷的去离子水200ml,搅拌1min,静置1min,小心倾去水层,同法洗涤3次后,以细纱布过滤并轻轻挤压除去过多液体。
实验六生物氧化与电子传递(3学时)一实验目的与要求 1. 掌握电子在电子传递链中的传递过程;2. 了解体外实验中研究电子传递链的方法。
二实验原理生物氧化过程中代谢物脱下的氢由NAD+ 或FAD接受生成还原型NADH或FADH2,再经一系列电子传递体传递,最后与氧结合生成水。
这些存在于线粒体内膜上的氧化还原酶及其辅酶依次排列,顺序地起传递电子或电子和质子的作用,称为电子传递链或呼吸链。
在体内,代谢中间产物琥珀酸在线粒体琥珀酸脱氢酶(辅酶FAD)的作用下脱氢氧化生成延胡索酸,脱下的氢使FAD还原成FADH2,再经电子传递链传递,即FADH2→Q→细胞色素(b→c1→c→aa3),最后与氧结合生成水。
在体外实验中,组织细胞生物氧化生成琥珀酸的量可采用在琥珀酸脱氢时伴有颜色变化的化合物作氢受体来研究。
本实验以2,6-二氯酚锭酚(DPI)为氢受体,蓝色的DPI从还原型黄素蛋白(FADH2)接受电子,生成无色的还原型DPI·2H,蓝色消失,其反应过程如下:琥珀酸+FAD→延胡索酸+ FADH2DPI(蓝色)+ FADH2→DPI·2H(无色)+FAD根据褪色时间可测定生物氧化过程中各代谢物与琥珀酸之间在代谢途径中的距离。
三、试剂及材料磷酸钾缓冲溶液(PBS,50mmol/L,pH7.4):0.2mol/L磷酸二氢钾溶液500ml和0.2mol/L 氢氧化钠溶液395ml混合加水至2000ml。
猪心,2,6-二氯酚锭酚(1.5mmol/LPBS),葡萄糖溶液(90mmol/LPBS),琥珀酸溶液(90mmol/LPBS),乳酸溶液(90mmol/LPBS),NAD+(5mmol/L磷酸盐缓冲溶液)。
四、仪器设备绞肉机,纱布,细砂,研钵,冰浴,恒温水浴。
五、操作方法1. 心肌提取液的制备称取绞碎的心肌糜3g,置250ml烧杯中,加冰冷的去离子水200ml,搅拌1min,静置1min,小心倾去水层,同法洗涤3次后,以细纱布过滤并轻轻挤压除去过多液体。
将肉糜转移至冰冷的研钵中,加等量细砂和PBS5ml,在冰浴中研磨至糊状,再加PBS15ml,抽提(至少5min),双层纱布过滤,滤液收集于试管,置冰浴中备用。
2. 底物的氧化取6支试管编号,按下表依次加入各试剂(单位ml)管号 1 2 3 4 5 6DPI 0.5 0.5 0.5 0.5 0.5 0.5 葡萄糖溶液0.5 0.5 ————琥珀酸溶液——0.5 0.5 ——乳酸溶液————0.5 0.5NAD+0.5 —0.5 —0.5 —将试管摇匀后于37℃中保温5min,加已经37℃水浴预保温5分钟的心肌提取液各1ml,混匀并继续保温。
3. 观察观察各管颜色变化,记录各管褪色时间,30min不褪色者记为不褪色。
分析实验结果所说明的问题。
六、注意事项1. 无色(还原型)DPI·2H与氧接触可重新氧化成蓝色的(氧化型)DPI,所以观察本实验结果时切勿振摇试管。
2. 体外实验亦可用甲烯蓝作为受氢体,再类似实验条件下蓝色的甲烯蓝(氧化型)受氢还原成无色甲烯蓝(还原型)。
七、思考题1. 名词解释:电子传递链;氧化磷酸化作用;解偶联作用;高能化合物2. 实验结果记录及分析3. 讨论下列问题:常见的呼吸链电子传递抑制剂有哪些?它们的作用机制是什么?实验七SDS-聚丙烯酰胺凝胶电泳测定蛋白质分子量(4学时)一、实验目的学习SDS-聚丙烯酰胺凝胶电泳测定蛋白质分子量的实验原理,掌握相应的实验技术。
二、实验原理聚丙烯酰胺凝胶是由单体丙烯酰胺(Acrylamide,简称Acr)和交联剂N,N –甲叉双丙烯酰胺(Methylence-bisacry-lamide,简称Bis)在催化剂和加速剂的作用下聚合交联形成的具有分子筛效应的三维网状结构凝胶。
凡以此凝胶为支持物的电泳均称为聚丙烯酰胺凝胶电泳(Polyacrylamide gel electrophoresis,简称PAGE)。
凝胶筛孔大小、机械强度和透明度等物理参数,主要取决于凝胶浓度(T%)及交联度(C%),随着这两个参数的改变,可获得对待测分子进行分离、分辨的最适孔径。
T%=[(丙烯酰胺g + 甲叉双丙烯酰胺g)/总体积]×100C%=[甲叉双丙烯酰胺g/(丙烯酰胺g + 甲叉双丙烯酰胺g)]×100 丙烯酰胺凝胶电泳根据其有无浓缩效应,分为连续系统与不连续系统两大类。
在连续系统中缓冲溶液pH值及凝胶浓度相同,带电颗粒在电场的作用下主要靠电荷及分子筛效应得以分离;而在不连续系统中,不仅具有前两种效应,还具有浓缩效应,使电泳具有良好的清晰度和分辨率。
电泳时样品的浓缩效应主要由以下原因产生:(1)凝胶孔径的不连续。
在不连续的PAGE 中,电泳凝胶由上下两层不同pH、不同孔径的浓缩胶和分离胶组成,在电场的作用下,蛋白质颗粒在大孔的浓缩胶中泳动的速度快,当进入小孔分离胶时,其泳动过程受阻,因而在两层凝胶交界处,由于凝胶孔径的这种不连续性造成样品位移受阻而压缩成很窄的区带。
(2)缓冲体系离子成分及pH值的不连续性。
在Tris-甘氨酸缓冲体系中,各胶层中均含有HCl,HCl在任何pH溶液体系中均容易离解出Cl-,它在电场中迁移率最大;甘氨酸等电点为6.0,在pH6.8的浓缩胶中,离解度很低,仅有0.1%~1%的NH2CH2COO-,因而在电场中的迁移速度很慢;大部分蛋白质pI在5.0左右,在此电泳环境中都以负离子形式存在。
通电后,这三种负离子在浓缩胶中都向正极移动而且它们的泳动率按m d a ch > m p a p > m q a q排序(有效迁移率等于迁移率m与离解度a的乘积)。
于是蛋白质就在快、慢离子形成的界面处,被压缩成极窄的区带。
(3)是由电位梯度的不连续性所至。
电泳开始后,由于Cl_-的迁移率最大,很快超过蛋白质,因此在快离子后面,形成一个离子浓度低的电导区,由此产生一个高的电位梯度,使蛋白质和慢甘氨酸离子在快离子后面加速移动,当快离子和慢离子的移动速度相等的稳定状态建立后,由于蛋白质的有效迁移率正好介于快、慢离子之间而被浓缩形成一狭小的区带。
当样品进入分离胶后,凝胶pH变为8.8,此时甘氨酸解离度大大增加,其有效迁移率也因此加大,并超过所有蛋白质分子。
这样,快慢离子的界面(由溴酚蓝指示剂标记)总是跑在被分离的蛋白质样品之前,不再存在不连续的高电势梯度区域。
于是,蛋白质样品在一个均一的电势梯度和均一的pH条件下,通过凝胶的分子筛作用,根据各种蛋白质所带的净电荷不同,具有不同迁移率而达到分离目的。
垂直平板电泳凝胶是在两块垂直放置、间隔几个毫米的平行玻璃中进行的,所得的是垂直平板状的凝胶。
垂直平板电泳有以下优点:一系列样品能在同一块凝胶板上进行,显色条件也相同;平板表面大,有利于凝胶冷却;易于进行光密度扫描测定。
SDS-聚丙烯酰胺凝胶电泳是聚丙烯酰胺凝胶电泳的一种特殊形式。
实验证明,在蛋白质溶液中加入十二烷基硫酸钠(SDS)这阴离子表面活性剂和巯基乙醇后,巯基乙醇能使蛋白质分子中的二硫键还原;SDS能使蛋白质的氢键、疏水键打开,并结合到蛋白质分子上,形成蛋白质–SDS复合物。
大约每克蛋白质可结合1.4克SDS,蛋白质分子一经结合了一定量的SDS阴离子,所带负电荷量远远超过了它原有的电荷量,从而消除了不同种类蛋白质间原有电荷的差别。
同时,SDS与蛋白质结合后,还引起了蛋白质构象的变化,使它们在水溶液中的形状近似于长椭圆棒,不同蛋白质的SDS复合物的短轴长度均为1.8mm,而长轴则随蛋白质的相对分子量成正比的变化。
这样的蛋白质–SDS复合物,在凝胶电泳中的迁移率不再受蛋白质原有电荷和形状的影响,仅取决蛋白质分子量的大小。
故可根据标准蛋白质分子量的对数和迁移率所做的标准曲线,求出未知物的分子量。
三、试剂与仪器(一)试剂(所用水为重蒸水)1.30%单位胶储备液(Acr:Bis=29:1)称58g丙烯酰胺(Acr)溶于180mL双蒸水,再加入2g甲叉双丙烯酰胺(Bis),溶解后定容至200mL,过滤备用。
2.分离胶缓冲液(pH8.8,3mol/L Tris-HCl)称取36.33g Tris溶于80mL双蒸水中,在pH计上用HCl调pH至8.8,然后定容至100mL。
3.浓缩胶缓冲液(pH6.8,1mol/L Tris-HCl)称12.11g Tris溶于80mL双蒸水中,在pH计上用HCl调pH至6.8,加水定容至100mL。
4.10% SDS:称取10g SDS,在65℃下用水溶解并定溶至100mL。
5.10%过硫酸铵(AP,聚合用催化剂)称5g AP溶解于50mL双蒸水中,最好临用之前新鲜配制。
也可置于4℃冰箱中避光保存,7天后重配。
6.10% N,N,N',N'–四甲基乙二胺(TEMED)(聚合用加速剂)移取0.1mL TEMED稀释至1.0mL。
置于4℃保存。
7.Tris-Gly电极缓冲溶液:称取7.5g Tris盐和36g甘氨酸用水溶解,再加入10%SDS 25mL,用水定容至500mL,备用。
临用时稀释5倍。
8.50mmol / L Tris-HCl (pH6.8)缓冲溶液称取0.606g Tris溶于80mL双蒸水,在pH计上用HCl调pH至6.8,然后加水至100mL。
9.加样缓冲溶液:吸取50mmol / L Tris-HCl (pH6.8)缓冲溶液3.2mL、10%SDS 溶液11.5mL、β-巯基乙醇2.5mL、溴酚蓝2mg以及甘油5 mL,用水溶解并定容至50mL。
10.染色液称取0.5g考马斯亮蓝R–250溶于甲醇和冰醋酸混合液(80mL/20mL)中,过滤备用。
11.脱色液取150mL甲醇与50mL冰醋酸混溶,加双蒸水至500mL。
12.3%琼脂溶液。
13.标准分子量蛋白(电泳专用试剂)。
(二)仪器1、直流稳压稳流电泳仪,电流100mA,电压400V—500V。
2、夹芯式垂直电泳槽,DYYⅢ 2A型,1.0mm梳槽。
四、操作方法(一)电泳槽安装夹芯式垂直电泳槽两侧为有机玻璃制成的电极槽,两电极槽中间夹有一个由凹形硅胶框,长短玻璃板及样品槽模板组成(如图所示)。
电泳槽分上贮槽(白金电极面对短玻璃板)、下贮槽(白金电极面对长玻璃板),回纹状玻璃管用于冷凝。
两电泳槽与凝胶模间靠贮液槽螺钉固定。
夹心垂直电泳槽示意图凝胶模示意图1、导线接头;2、下电极缓冲液槽;1、样品槽定位模扳;2、长玻璃板;3、凹型橡胶板;4、样品槽模板;3、短玻璃板;4、凹型橡胶框。
5、固定螺丝;6、上电极缓冲液槽;7、冷凝系统。
图1 垂直板电泳槽结构示意图1.组装前各部件应做彻底清洗,尤其是长短玻璃及凹形带槽橡胶框,须用少许洗衣粉彻底清洗,晾干后才能使用。