中国化学会1999年全国高中学生化学竞赛(省级赛区)
- 格式:doc
- 大小:123.50 KB
- 文档页数:6


⾼中五⼤联赛介绍⾼中五⼤联赛介绍问题⼀:⾼中五⼤联赛包括哪⼏项?1. 数学:全国⾼中数学联赛(省级赛区)中国数学奥林匹克2. 物理:全国中学⽣物理竞赛(省级赛区)全国中学⽣物理竞赛决赛3. 化学:全国⾼中学⽣化学竞赛(省级赛区)全国⾼中学⽣化学竞赛4. ⽣物:全国中学⽣⽣物学联赛(省级赛区)全国中学⽣⽣物学竞赛5. 信息学:全国青少年信息学奥林匹克联赛(省级赛区)全国青少年信息学奥林匹克竞赛主管单位:中国科学技术协会主办单位分别为:中国数学会、中国物理学会、中国化学会、中国植物学会和中国动物学会、中国计算机学会问题⼆:联赛考察内容是什么?1. 数学:⼀试:⾼考考纲内,中⾼档题⽬,7填空每个8分,3⼤题,14、15、15共占100分,考80分钟。
休息10分钟。
⼆试:两个半⼩时。
09年前平⾯⼏何、代数或数论、组合,09年开始考四项,共200分。
获奖标准:需要⾄少完成哪些题⽬,60分以下不计分,170分左右能拿⼀等奖。
2. 物理:预赛:考笔试3⼩时,满分200分。
复赛:笔试实验=160分 40分,各考3⼩时。
决赛:笔试实验=140分 60分,各考3⼩时。
3. 化学:介于⾼中和⼤学,知识要偏很多,⼤部分都是课外知识。
初赛:笔试3⼩时。
决赛:理论竞赛4⼩时,实验竞赛4-5⼩时。
4. ⽣物学:理论考分与实验考分⽐按75%:25%分配。
每年8⽉在承办地举办全国⽣物竞赛。
全国竞赛包括理论和实验两部分,理论与实验分数⽐例各占50%,分数相同的情况下以实验分⾼者为先。
5. 信息学:NOIP初赛以通⽤和实⽤的计算机知识为考试内容,重在考察基础与实⽤的知识,以笔试为主。
复赛为程序设计。
参加初赛者须达到⼀定分数线后才有资格参加复赛。
各省市、⾃治区都应参加联赛,参加联赛是参加NOI的必要条件。
问题三:⾼中联赛的评奖设置简述(现在每年获奖⼈数稍有提升)1.数学:联赛:省级⼀等奖40,⼆等奖78⼈,三等奖120⼈。
⼀般年份⼀等奖是170多分;有的年份题⽬特别难,⽐如07年是120多分;我们参加的那⼀年,即06年好像有200多分⼀般题⽬⼀年简单⼀年难所以分数不⼀定不过只要拿下平⾯⼏何⼀等奖就差不多了。

中国科协全国五项学科竞赛条例一、总则第一条为规范全国五项学科竞赛,制定本条例。
第二条本条例的适用范围是全国五项学科竞赛(以下简称学科竞赛)。
其名称分别是:1、数学:全国高中数学联赛中国数学奥林匹克2、物理学:全国中学生物理竞赛(省级赛区)全国中学生物理竞赛决赛3、化学:全国高中学生化学竞赛(省级赛区)全国高中学生化学竞赛4、信息学:全国青少年信息学奥林匹克联赛全国青少年信息学奥林匹克竞赛5、生物学:全国中学生生物学联赛全国中学生生物学竞赛第三条学科竞赛是一项面向全国中学生的竞赛活动,其宗旨是:向中学生普及科学知识,激发他们学习科学的兴趣和积极性,为他们提供相互交流和学习的机会;促进大、中学校教学改革;通过竞赛和相关的活动培养和选拔优秀学生,为参加国际学科竞赛选拔参赛选手。
第四条学科竞赛属于课外活动,坚持学有余力、有兴趣的学生自愿参加的原则。
是在教师指导下学生研究性学习的重要方式。
二、竞赛的组织机构第五条主管单位:中国科学技术协会。
第六条主办单位:各有关全国性学会,分别是:1.中国数学会:数学竞赛;2.中国物理学会:物理学竞赛;3.中国化学会:化学竞赛;4.中国计算机学会:信息学竞赛;5.中国植物学会和中国动物学会:生物学竞赛。
第七条主办单位的职责:制定本学科竞赛的(章程)(或条例)、负责本学科竞赛的组织、命题、成绩认定、奖励和惩处、选定承办单位、工作人员聘任、上报竞赛成绩等工作。
第八条联席会议:由主管单位召集学科竞赛主办单位参加的会议,其主要任务是协调五学科竞赛、交流信息、研究在竞赛过程中遇到的问题和解决的办法。
第九条省级赛区主管机构:由各省、自治区、直辖市科协牵头,联系当地教育行政管理部门和各有关省级学会,成立省级五项学科竞赛管理委员会(以下简称省竞赛管委),负责省级赛区学科竞赛的领导和管理工作。
其主要职责为:1、监督、协调本省五项学科竞赛的各项组织工作。
2、监督赛区实施单位的工作,接受、处理与学科竞赛有关的申诉与投诉。

中国化学会2023年国初化竞试题(2023年10月13日9︰00-12︰00 共计3小时)●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
第1题(4分)今年5月底6月初,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。
据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。
根据你的化学知识作出如下判断(这一判断的对的性有待证明):当事人使用的液态洁污剂之一必然含氯,最也许的存在形式是和。
当另一种具有(性质)的液态洁污剂与之混合,也许发生如下反映而产生氯气:第2题(2分)目然界中,碳除了有2种稳定同位素12C和13C外,尚有一种半衰期很长的放射性同位素14C,丰度也十分稳定,如下表所示(注:数据后括号里的数字是最后一位或两位的精确度,14C只提供了大气丰度,地壳中的含量小于表中数据):试问:为什么通常碳的相对原子质量只是其稳定同位素的加权平均值而不将14C也加入取平均值?答:第3题(4分)最近报道在-100℃的低温下合成了化合物X,元素分析得出其分子式为C5H4,红外光谱和核磁共振表白其分子中的氢原子的化学环境没有区别,而碳的化学环境却有2种,并且,分子中既有C-C单键,又有C=C双键。
温度升高将迅速分解。
X的结构式是:第4题(10分)去年报道,在-55℃令XeF4(A)和C6F5BF2(B)化合,得一离子化合物(C),测得Xe的质量分数为31%,阴离子为四氟硼酸根离子,阳离子结构中有B的苯环。
C是首例有机氙(IV)化合物,-20℃以下稳定。
C为强氟化剂和强氧化剂,如与碘反映得到五氟化碘,放出氙,同时得到B。

全国高中学生化学竞赛(省级赛区)模拟试题一题 号 1 2 3 4 5 6 7 总分满 分 4 13 14 13 15 23 18100得 分● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
第一题(4分)1、有一种物质的化学式内包含五个原子,它的式量为520,请写出一种可能的物质__________。
2、有一种物质的化学式内包含六个原子,它的式量为22,请写出一种可能的物质__________。
第二题(13分)人们知道有有机金属化合物是比较早的事情,早在1827年丹麦化学家Zeise 制得了一种鈀的有机化合物322[()]K PdCl CH CH +-=,比Frankland 发现二乙基锌早了22年,著名的Grignard 试剂也是一种有机金属化合物。
1、 请说出Zeise 的322[()]K PdCl CH CH +-=中Pd 的化合价。
2、 科学家用苯基氯化镁与氯化锌反应生成了二苯锌,请写出方程式。
Victor Grignard1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr H Li Be B C N O FNaMg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr SrBa Ra Y La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]HeNe Ar Kr Xe Rn相对原子质量Rf Db Sg Bh Hs Mt3、下面可能引起1中试验失败的因素是( )。


1999年全国高中学生化学竞赛(决赛)理论试题1999年1月29日厦门注意:∙竞赛时间:4小时∙所有答案必须写在答卷纸的指定地方,否则无效。
∙所有答案必须使用黑色圆珠笔或黑墨水钢笔书写,否则无效。
第一题:纳米粒子是指粒径为1—100nm的超细微粒,由于表面效应和体积效应,纳米粒子常有奇特的光、电、磁、热性质,可开发为新型功能材料。
人工制造纳米材料的历史至少可以追溯到一千多年前。
中国古代铜镜表面的防锈层,经实验证实为氧化锡纳米粒子构成的薄膜。
分散质微粒的直径大小在1-100nm之间的分散系叫做胶体。
胶体化学法是制备纳米粒子的重要方法之一,其关键是“促进成核、控制生长”。
用该法制备纳米Cr2O3的过程如下:氨水适量稀盐酸CrCl3溶液(去杂质)Cr2O3·x H2O沉淀 Cr2O3·x H2O水溶胶DBS* 有机溶剂萃取分离热处理Cr2O3有机溶胶纳米Cr2O3* DBS———十二烷基苯磺酸钠回答下列问题:1. 加稀盐酸起什么作用?盐酸加多了或加少了将会怎样影响Cr2O3的产率?2. 为什么形成Cr2O3水溶胶可以阻止粒子长大?3. 用示意图描绘Cr2O3胶粒加DBS所得产物的结构特征。
4. 为什么有机溶剂可以把“氧化铬”萃取出来?萃取的目的是什么?5. DBS直接排入水体会给环境造成何种影响(举1—2点)?已知DBS能够进行生物降解,其降解的最终产物是什么?东晋葛洪所著《抱朴子》中记载有“以曾青涂铁,铁赤色如铜”。
“曾青”即硫酸铜。
这是人类有关金属置换反应的最早的明确记载。
铁置换铜的反应节能、无污染,但因所得的镀层疏松、不坚固,通常只用于铜的回收,不用作铁器镀铜。
能否把铁置换铜的反应开发成镀铜工艺呢?从化学手册上查到如下数据:电极电势:Fe2++2e == Fe φ == – 0.440V;Fe3++e == Fe2+ φ == – 0.771V;Cu2++2e == Cu φ == 0.342V; Cu2++e == Cu+φ == 0.160V平衡常数:K w = 1.0⨯10-14;K sp (CuOH)=1.0⨯10-14;K sp [Cu(OH)2]=2.6⨯10-19;K sp [Fe(OH)2]=8.0⨯10-16;K sp [Fe(OH)3]=4.0⨯10-38;回答如下问题:1. 造成镀层疏松的原因之一可能是夹杂固体杂质。

全国高中学生化学竞赛实施细则一、初赛(省级赛区化学竞赛)的实施1. 组织初赛(省级赛区化学竞赛)的组织工作由各省、市、自治区化学会或化学化工学会负责,在省级学科竞赛管理委员会的指导、支持、监督与合作下,成立化学竞赛机构组织实施。
各省、市、自治区学会须在每年竞赛前选定竞赛总负责人并上报中国化学会备案。
2. 报名报名于赛前三个月开始。
报名费应符合当地教育行政部门的规定。
报名前须向学生公布与竞赛有关的文件。
坚持学生自愿报名的原则,任何学校和部门不得摊派,不得限制。
报名时须向学生说明竞赛的具体要求,并发放准赛证。
准赛证由各省、市、自治区竞赛机构负责人负责统一印制,不得翻印。
准赛证上必须有编号、参赛学生的姓名、所在学校名称及近期照片、赛场地点(学校及教室)和竞赛时间(开始时间及总时间)等要素,并加盖相应印章。
省级以下单位报名结束后应制作报名花名册(含参赛学生姓名、学校、编号、赛场、参赛总人数等要素,并预留竞赛成绩栏),复印上缴各省、市、自治区竞赛总负责人备案。
各省、市、自治区竞赛总负责人汇总全省参赛学生名册(要素同上)后,于赛前1个月将参赛总人数报中国化学会办公室。
3. 试卷制作与分发试卷由全国高中学生化学竞赛委员会组织命题小组命题,于每年8月20日前定稿交予中国化学会办公室负责人,由办公室负责人监制并装成小袋通过保密渠道分发至各省、市、自治区竞赛管委会指定的收卷人处。
试题未经批准不得复制,一经发现使用未经批准而自行复制的试卷竞赛,竞赛成绩无效。
竞赛试卷由中国化学会根据各省、市、自治区参赛总人数分发到各省、市、自治区竞赛管委会指定的收卷人处后,由总负责人于竞赛前按赛场人数在监督下分封后由各赛场监考负责人专程携往竞赛试场于开赛时当众拆封。
分发与拆封均需签名存档。
试题标准答案于竞赛后二天在因特网公布。
4. 竞赛赛场竞赛赛场必须有各省、市、自治区选派的监考负责人在场, 各省、市、自治区竞赛总负责人须将分赛场和各赛场负责人报告中国化学会办公室。
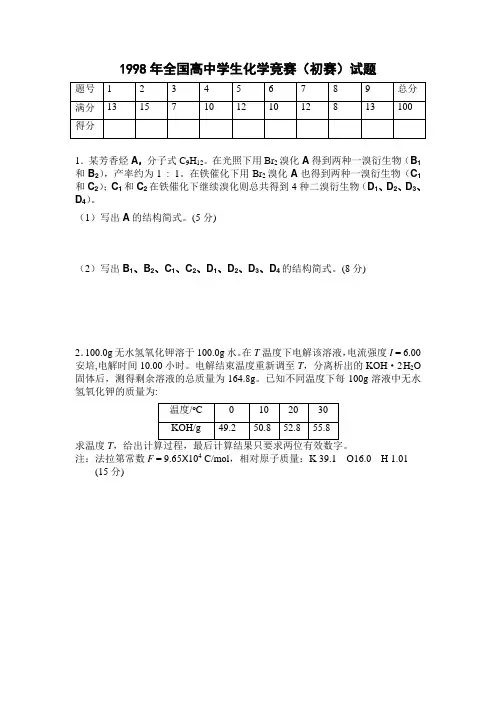
1998年全国高中学生化学竞赛(初赛)试题1.某芳香烃A,分子式C9H12。
在光照下用Br2溴化A得到两种一溴衍生物(B1和B2),产率约为1 : 1。
在铁催化下用Br2溴化A也得到两种一溴衍生物(C1和C2);C1和C2在铁催化下继续溴化则总共得到4种二溴衍生物(D1、D2、D3、D4)。
(1)写出A的结构简式。
(5分)(2)写出B1、B2、C1、C2、D1、D2、D3、D4的结构简式。
(8分)2.100.0g无水氢氧化钾溶于100.0g水。
在T温度下电解该溶液,电流强度I = 6.00安培,电解时间10.00小时。
电解结束温度重新调至T,分离析出的KOH·2H2O 固体后,测得剩余溶液的总质量为164.8g。
已知不同温度下每100g溶液中无水氢氧化钾的质量为:求温度T注:法拉第常数F = 9.65X104 C/mol,相对原子质量:K 39.1 O16.0 H 1.01 (15分)3.迄今已合成的最重元素是112号,它是用Zn 7030高能原子轰击Pb 20882的靶子,使锌核与铅核熔合而得。
科学家通过该放射性元素的一系列衰变的产物确定了它的存在,总共只检出一个原子。
该原子每次衰变都放出一个高能 粒子,最后得到比较稳定的第100号元素镄的含153个中子的同位素。
(7分) (1)112号是第几周期第几族元素?(2)它是金属还是非金属?(3)你认为它的最高氧化态至少可以达到多少?(4)写出合成112元素的反应式(注反应式中的核素要用诸如31H 、Pb 20882等带上下标的符号来表示,112号元素符号未定,可用M 表示)。
4.100.00mL SO 32–和S 2O 32–的溶液与80.00mL 浓度为0.0500mol/L 的K 2CrO 4的碱性溶液恰好反应, 反应只有一种含硫产物和一种含铬产物; 反应产物混合物经盐酸酸化后与过量的BaCl 2溶液反应, 得到白色沉淀, 沉淀经过滤、洗涤、干燥后称量,质量为0.9336g 。

第27届中国化学奥林匹克(初赛)试题、解答、评分标准及评分细则第1题(12分) 写出下列化学反应的方程式1-1 加热时,三氧化二锰与一氧化碳反应产生四氧化三锰。
1-2 将KCN 加入到过量的CuSO 4水溶液中。
1-3 在碱性溶液中,Cr 2O 3和K 3Fe(CN)6反应。
1-4 在碱性条件下,Zn(CN)42?和甲醛反应。
1-5 Fe(OH)2在常温无氧条件下转化为Fe 3O 4。
1-6 将NaNO 3粉末小心加到熔融的NaNH 2中,生成NaN 3(没有水生成)。
1-1 3Mn 2O 3+CO =2Mn 3O 4+CO 2 2分 1-2 4CN ?+2Cu 2+=2CuCN +(CN)2 2分 1-3 Cr 2O 3+6Fe(CN)63?+10OH ? =2CrO 42?+6Fe(CN)64?+5H 2O 2分 1-4 Zn(CN)42?+4H 2CO +4H 2O =4 HOCH 2CN +Zn(OH) 42?? 2分 1-5 3Fe(OH)2=Fe 3O 4+H 2+2H 2O 2分 1-6 NaNO 3+3NaNH 2=NaN 3+NH 3+3NaOH 2分 1方程式正确才能得满分。
2若全部物质皆写对而未配平,可得1分。
第2题(23分) 简要回答或计算2-1 Bi 2Cl 82-离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi 原子的杂化轨道类型。
Bi 2Cl 82-的结构:ClClBiClClCl2-或ClClClClCl2- 2分.......未画成楔形键不扣分;不画电子对不扣分;若画了电子对且画成如上图(蓝)所示的连线,则与电子对相连的线不画成虚线(左)、虽画成虚线但远离Bi 原子,扣0.5分杂化轨道类型:sp 3d 2 1分2-2在液氨中,E θ(Na +/Na)=-1.89V ,E θ(Mg 2+/Mg)=-1.74V ,但可以发生Mg 置换Na 的反应:Mg +2NaI =MgI 2+2Na ,指出原因。

1999年普通高等学校招生全国统一考试化学试卷本试卷分第I 卷(选择题〕和第II 卷(非选择题)两部分,第I 卷1至4页,第II 卷5至10页。
共150分。
考试时间[120]分钟。
第I 卷(选择题共:83分)注意事项:1.答第I 卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2. 每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑如需改动佣橡皮擦干净后。
再选涂其它答案,不能答在试题卷上。
3. 考试结束,监考人将本试卷和答题卡一并收回。
可能用到的原子量:Hl C12 N14 O l6 Na 23 Mg 24一.选择题(本题包括5小题,每小题3分,并15分,每小题只有一个选项符合题意。
)1.近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是A.提高汽油燃烧效率B.降低汽油成本C.避免铅污染大气D.铅资源短缺2.Murad 等三位教授最早提出NO 分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖,关于NO 的下列叙述不正确的是A.NO 可以是某些含低价N 物质氧化的产物B.NO 不是亚硝酸酐C.NO 可以是某些含高价N 物质还原的产物D.NO 是红棕色气体3.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir)元素的原子核外电子数恰好相等,因此称为“铱星计划”。
已知铱的一种同位素是Ir 19177,则其核内的中子数是A.77B.114C.191D.2684.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为192.22,这两种同位素的原子个数比应为A.39︰61B.61︰39C.1︰1D.39︰115.右图装置可用于A.加热NaHCO 3制CO 2B.用Cu 与稀HNO 3反应制NOC.用NH 4Cl 与浓NaOH 溶液反应制NH 3D.用NaCl 与浓H 2SO 4反应制HCl二.选择题(本题包括12小题,每小题3分,共36分。
●竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
第1题(12分)通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成Si(OH)4。
1-1已知反应分两步进行,试用化学方程式表示上述溶解过程。
早在上世纪50年代就发现了CH5+的存在,人们曾提出该离子结构的多种假设,然而,直至1999年,才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢原子围绕着碳原子快速转动;所有C-H 键的键长相等。
1-2该离子的结构能否用经典的共价键理论说明?简述理由。
1-3该离子是()。
A.质子酸B.路易斯酸C.自由基D.亲核试剂2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。
该分子的结构简图如下:1-4该分子的分子式为;1-5该分子有无对称中心?1-6该分子有几种不同级的碳原子?1-7该分子有无手性碳原子?1-8该分子有无手性?第2题(5分)羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下:NH2OH+HN﹡O2→A+H2ONH2OH+HN﹡O2→B+H2OA、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。
请分别写出A和B的路易斯结构式。
第3题(8分)X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。
该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。
中国化学会全国高中学生化学竞赛(省级赛区)试题第1题(5分)元素M,其地壳丰度居第12位,是第3种蕴藏最丰富的过渡元素,是海底多金属结核的主要成分,是黑色金属,主要用途:炼钢,也大量用来制作干电池,还是动植物必需的微量元素。
1. M的元素符号是2. M的最重要矿物的化学式是3. M的三种常见化合物是、和。
第2题(6分)用地壳中某主要元素生产的多种产品在现代高科技中占重要位置,足见化学对现代物质文明的重要作用。
例如:1. 计算机的芯片的主要成分是;2. 光导纤维的主要成分是:3. 目前应用最多的太阳能电池的光电转化材料是;4. 用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类称为的化合物;5. 有一大类化合物,结构独特,兼备无机材料和有机材料双重性能,有耐温、电绝缘性好、难燃、憎水、耐腐蚀……等特性,广泛用于航空航天、电子电气、建筑、运输等行业,用于密封、粘合、润滑、涂层、表面活性、防水、防潮……,已为现代社会不可替代的新材料。
这类材料在分子结构上的特点是和。
第3题(3分)Cm核,发生核合成反应,得到新元素X。
研究者将X与氧最近有人用高能26Mg核轰击24896气一起加热,检出了气态分子XO4,使X成为研究了化学性质的最重元素。
已知的X同位素如下表所示,上述核反应得到的核素是其中之一,该核素的衰变性质保证了其化学性质实验获得成功。
1. X的元素符号是。
2. 用元素符号并在左上角和左下角分别标注其质量数和质子数,写出合成X的核反应方程式(方程式涉及的其他符号请按常规书写):第4题(6分)1. 汞与次氯酸(摩尔比1︰1)发生反应,得到2种反应产物,其一是水。
该反应的方程式为;反应得到的含汞产物的中文名称为。
2. N2H4在一定条件下热分解,产生NH3、N2和H2,后两者摩尔比为3︰2,写出反应方程式。
3. 第二周期元素A与氢形成的如下化合物中的A-A键的键能(kJ/mol)CH3-CH3 346,H2N—NH2 247,HO-OH 207试问:它们的键能为什么依次下降?第5题(13分)六配位(八面体)单核配合物MA2(NO2)2呈电中性;组成分析结果:M 31.68%,N 31.04%,C 17.74%;配体A不含氧:配体(NO2)x的氮氧键不等长。
(竞赛介绍系列1)大学招生改革了,高中还有必要学竞赛么?是否学竞赛是很多中学家长和同学纠结的问题。
尤其是高考改革之后,自主招生形势变的不再明朗,竞赛在高中还有必要学么?对于这些科目学习有兴趣,并且学有余力的同学来说,高一时候很值得学。
高一的主要困难是科目多、数学和物理和初中风格迥异,如果能很快的适应和解决这两个问题,并且学有余力的同学,完全可以在高一阶段,学1门竞赛,锁定在自己最感兴趣的科目。
这样才能事半功倍,为将来的自主招生、各种大学招生的夏令营、乃至出国求学,做多一手的准备。
如果到了高二,还能保持这种全科成绩还不错,一个科目有优势的情形,就可以继续拼一个比较大的奖。
如果到了高二,竞赛学习牵扯精力过多,耽误了其他科目的学习,就得早点收手。
毕竟现在影响最大的还是全科的成绩、和最终高考的成绩。
对于初中那些很优秀,进入顶级高中问题不大的同学,完全可以更早的介入高中竞赛的学习。
因为这些孩子的目标应该是锁定名校的实验班、竞赛班。
很多学校比如RDF、四中等分班考试的内容都往往围绕着高中竞赛的一些内容和方法进行设计。
提前学习优势会更大。
而且眼光放的更长远一些。
如果孩子将来打算在理科、工科有所建树。
高中的竞赛学习,也是一种很好的提前准备。
比如物理竞赛的孩子、往往普通物理、高等数学方面优势很大。
化学生物竞赛基本就是要提前修习大学的课程。
这样孩子进入大学之后,在头两年,就会有很多的时间空余出来,可以进行更深入的学习和研究。
对于希望通过竞赛直接加分保送的同学来说,基本没戏了。
竞赛现在加分保送的影响范围缩小到了国家级一等奖,换句话讲,也就是孩子得考到全国前50名左右才能获得保送的资格。
算到北京也一般一科只有个位数。
所以绝大多数孩子希望渺茫。
总而言之。
竞赛学习,如果目标锁定在保送、获大奖,的确风险很大,学习要谨慎。
如果目标是为了学习知识,为了将来的学业有所帮助,那么竞赛的学习完全可以是全科学习的一种有益补充。
同学们和家长们,一定要针对自己的情况,酌情处理,切不可跟风而行。
1-1向硫酸锌中加氨水至过量现象、方程式1-2热重分析曲线根据失重峰考查失重后组分化学式2-1根据元素周期律及相关反应方程式进行元素推断(B、Cl)2-2三重旋转轴推导结构示意图2-3格氏试剂相关反应考查2-4醇解反应(醇断氧氢单键发生取代)3-1草酸与高锰酸钾酸性条件下的反应3-2高锰酸根酸性环境受热生成无色二价锰离子3-3碘离子与铜离子的反应碘三离子与硫代硫酸根的反应3-4未知晶体化学式计算(依据滴定反应、电荷守恒、摩尔质量进行计算)4-1、2晶体中多种离子的结构图(注意镜象异构和题目中的原子共面)5-1已知单斜晶系的晶胞参数和晶体密度,求晶体中分子比例5-2依据分子间形成氢键的情况书写化学单位结构6-1喹啉酸能量最低构型(考查分子内氢原子及电子转移)6-2已知喹啉酸的一级电离平衡常数,书写电离方程式6-3根据喹啉酸释放二氧化碳形成烟酸,书写烟酸结构7-1依据离子所带电荷及多硼酸跟离子中硼原子成键方式书写五硼酸根离子结构7-2参考7-1推导出其他离子化学式,并依据B(OH)3和B(OH)4-的比例为离子排序8-1依据E-pH图、电极电势、电离平衡常数计算体系中主要物种浓度8-2依据E-pH图书写物种转化方程式(可根据电荷守恒判断反应物)8-3依据E-pH图书写物种转化方程式,并分析电极电势随pH变化的原因8-4依据E-pH图书写向体系中加入U3+之后的反应8-5依据E-pH图,判断离子共存9-1考查亲核试剂判断9-2考查六氢吡啶对亲核试剂、亲电试剂的影响9-3依据题目中反应机理,仿写反应物9-4反应机理(NaCN/H2O的作用)10 有机反应机理11-1烯烃溴化反应的应用11-2休克尔规则(4n+2规则)11-3、4、5有机反应机理1-1化学史知识(居里夫人发现了Ra,镭Po,钋)1-2无机化学物质性质、1-3依据描述写出分子构性1-4考查配位键知识,书写结构简式1-5根据电极电势书写离子方程式和电极方程式2-1配合物的结构式书写2-2配离子中心阳离子未成对电子数判断(依据电子排布式和所带电荷数)2-3判断配合物是否有手性异构2-4 2,4-戊二酮负离子的结构简式及离域π键的表示2-5推导物质间的反应,并书写部分离子的结构式3 元素推断及物质推断4-1根据化合价变化书写离子方程式4-2碘单质与硫代硫酸根的反应4-3根据电中性原则计算元素化合价(即氧化数)和根据电子得失守恒计算氧缺陷的量5-1、2根据价电子数目和中间产物结构书写物质的结构式5-3依据配合物的价电子数目判断中心原子的氧化态5-4依据配合物的价电子数目和价层电子对互斥理论判断中心离子杂化轨道类型5-5依据配合物的价键理论推测物质的顺磁性或抗磁性6-1物化知识,对PV=nRT的考查及应用6-2依据6-1中结果,判断平衡移动方向,从而回答颜色变化。
1999年全国高中学生化学竞赛(初赛)试题
(1999年10月9日 9:00 - 12:00共计3小时)
● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿
纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 允许使用非编程计算器以及直尺等文具。
1.008
Zr Nb
Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re Os
Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr
H
Li Be B C N O F
Na Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni
Cu Zn G a G e As Se Br
Rb Cs Fr Sr Ba
Ra
Y La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.94
52.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6
107.9197.0106.4195.1102.9192.2101.1
190.298.91186.2
95.94183.992.91
180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210]
126.979.9035.45
4.00320.1839.9583.80131.3[222]
He Ne Ar Kr Xe Rn Ïà ¶Ô Ô- ×Ó ÖÊ Á¿
第一题(12分)12.0g 含2种化合物(由常见元素组成)的近白色固体溶于过量盐酸, 释放出2.94L 气体(标准状态), 气体密度为同温度下空气密度的1.52倍; 剩余的不溶性残渣含氧53.2%,既不溶于酸又不溶于稀碱溶液。
通过计算分别写出2种化学物质的化学式。
第二题(10分)A和B两种物质互相溶解的关系如图1所示,横坐标表示体系的总组成,纵坐标为温度,由下至上,温度逐渐升高。
T1时a是B在A中的饱和溶液的组成,b是A在B中的饱和溶液的组成,(T2时相应为c、d)。
T3为临界温度,此时A和B完全互溶。
图中曲线内为两相,曲线外为一相(不饱和液)。
某些物质如H2O和(C2H5)3N,C3H5(OH)3和间-CH3C6H4NH2有低的临界温度(见示意图2)。
请根据上述事实,回答下列问题:
T3
T2 c d
T1 a b
18.5 C
A 100% 80% 60% 40% 20% 0% H2O (C2H5)3N
0% 20% 40% 60% 80% 100%B
图1 图2
2-1解释图1中T存在的原因。
2-2说明图2所示的两对物质存在低的临界温度的原因。
第三题(12分)铬的化学丰富多采,实验结果常出人意料。
将过量30% H2O2加入(NH4)2CrO4的氨水溶液, 热至50o C后冷至0o C,析出暗棕红色晶体A。
元素分析报告:A含Cr 31.1%,N 25.1%,H 5.4%。
在极性溶剂中A不导电。
红外图谱证实A有N-H键,且与游离氨分子键能相差不太大,还证实A中的铬原子周围有7个配位原子提供孤对电子与铬原子形成配位键,呈五角双锥构型。
3-1以上信息表明A
A的可能结构式为:(请画在右边
的大方框中)
3-2A
3-3预期A最特征的化学性质为:
3-4生成晶体A的反应是氧化还原反应,请写出反应方程式:
第四题(12分)市场上出现过一种一氧化碳检测器,其外观像一张塑料信用卡,正中有一个直径不到2cm的小窗口,露出橙红色固态物质。
若发现橙红色转为黑色而在短时间内不复原,表明室内一氧化碳浓度超标,有中毒危险。
一氧化碳不超标时,橙红色虽也会变黑却能很快复原。
已知检测器的化学成分:亲水性的硅胶、氯化钙、固体酸H8[Si(Mo2O7)6]·28H2O、CuCl2·2H2O和PdCl2·2H2O(注:橙红色为复合色,不必细究)。
4-1CO与PdCl2·2H2O的反应方程式为:
4-24-1的产物之一与CuCl2·2H2O反应而复原,化学方程式为:
4-3
第五题(16分)水中氧的含量测定步骤如下:
步骤1:水中的氧在碱性溶液中将Mn2+氧化为MnO(OH)2。
步骤2:加入碘离子将生成的MnO(OH)2再还原成Mn2+离子。
步骤3:用硫代硫酸钠标准溶液滴定步骤2中生成的碘。
5-1
步骤
步骤
步骤
有关的测定数据如下:
1:Na2S2O3溶液的标定。
取25.00 mL KIO3标准溶液(KIO3浓度:174.8 mg·L-1)与过量KI在酸性介质中反应,用Na2S2O3溶液滴定,消耗12.45 mL。
2:取20.0°C下新鲜水样103.5mL,按上述测定步骤滴定,消耗Na2S2O3标准溶液11.80 mL。
已知该温度下水的饱和O2含量为9.08 mg·L-1。
3.在20.0°C下密闭放置5天的水样102.2 mL,按上述测定步骤滴定,消耗硫代硫酸钠标准溶液6.75 mL。
5-2计算标准溶液的浓度(单位mol·L-1)。
5-3计算新鲜水样中氧的含量(单位mg·L-1)。
-1)。
5-5 以上测定结果说明水样具有什么性质?
第六题(10分)曾有人用金属钠处理化合物A(分子式C5H6Br2,含五元环),欲得产物B,而事实上却得到芳香化合物C(分子式C15H18)。
6-1请画出A、B、C的结构简式。
6-2为什么该反应得不到B却得到C?
6-3预期用过量酸性高锰酸钾溶液处理C,得到的
产物是D,请将D的结构式写在右边的大框中。
第七题(12分)在星际云中发现一种高度对称的有机分子(Z),在紫外辐射或加热下可转化为其他许多生命前物质,这些事实支持了生命来自星际的假说。
有人认为,Z的形成过程如下:(1)星际分子CH2=NH聚合生成X;(2)X与甲醛加成得到Y(分子式C6H15O3N3);(3)Y与氨(摩尔比1:1)脱水缩
合得到Z 。
试写出X 、Y 和Z 的结构简式。
X 的结构式 Y 的结构式 Z 的结构式 第八题(16分)盐酸普鲁卡因是外科常用药,化学名:对-氨基苯甲酸- -二乙胺基乙酯盐酸盐,结构式如右上。
作为
局部麻醉剂,普鲁卡因在传导麻醉、浸
润麻醉及封闭疗法中均有良好药效。
它的合成路线如下,请在方框内填入试剂、中间产物或反应条件。
[H 2N C OCH 2CH 2NH(C 2H 5)2]Cl
-+||O
H 3。