碳族元素在周期表中的位置
- 格式:ppt
- 大小:867.50 KB
- 文档页数:15


化学元素周期表及口诀口诀:1氢(qīng)H 2氦(hài) He 3锂(lǐ)Li 4铍(pí)Be 5硼(péng)B 6碳(tàn)C 7氮(dàn) N 8氧(yǎng)O 9氟(fú)F 10氖(nǎi) Ne 11钠(nà)Na 12镁(měi)Mg 13铝(lǚ)Al 14硅(guī)Si 15磷(lín)P 16硫(liú)S 17氯(lǜ)Cl 18氩(yà)Ar 19钾(jiǎ)K 20钙(gài)Ca化学元素周期表口诀:按周期分:第一周期:氢、氦——侵害第二周期:锂、铍、硼、碳、氮、氧、氟、氖——鲤皮捧碳蛋养福奶第三周期:钠、镁、铝、硅、磷、硫、氯、氩——那美女桂林留绿牙第四周期:钾、钙、钪、钛、钒、铬、锰、铁、钴、镍、铜、锌、镓、锗——嫁改XXX反革命,铁姑捏痛新嫁者砷、硒、溴、氪——生气休克第五周期:铷、锶、钇、锆、铌、钼、锝、钌——如此一告你,不得了铑、钯、银、镉、铟、锡、锑、碲、碘、氙——老把银哥印西堤,地点仙第六周期:铯、钡、镧、铪、钽、钨、铼、锇、铱、铂、金、汞、砣、铅、铋、钋、砹、氡——(彩)色贝(壳)蓝(色)河,但(见)乌(鸦)(引)来鹅,一白巾供它牵,必不爱冬(天)第七周期:钫、镭、锕——防雷啊!按族分:氢、锂、钠、钾、铷、铯、钫——请XXX加入私访铍、镁、钙、锶、钡、镭——媲美XXX被雷硼、铝、镓、铟、铊——碰女嫁音他碳、硅、锗、锡、铅——探归者西迁氮、磷、砷、锑、铋——蛋临身体闭氧、硫、硒、碲、钋——养牛西蹄扑氟、氯、溴、碘、砹——父女绣点爱氦、氖、氩、氪、氙、氡——害耐XXX先动全部:青害XXX,探丹阳付奶。
(氢氦锂铍硼,碳氮氧氟氖)那美女桂林,流露押嫁该。
(钠镁铝硅磷,硫氯氩钾钙)抗台反革命,提供难题新。
(钪钛钒铬锰,铁钴镍铜锌)假者生喜羞,可入肆意搞。

元素周期表中的主族元素元素周期表是化学中的重要工具,它将元素按照一定规律排列。
其中,主族元素是指周期表中第1A到第8A族元素,也就是代表性元素。
这些元素具有共性,其化学性质也有规律可循。
本文将介绍元素周期表中的主族元素,以及它们在日常生活中的应用。
一、第1A族元素 - 碱金属碱金属是元素周期表中的第1A族元素。
它们包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素具有低密度、低熔点和非常活泼的化学性质。
碱金属在自然界中以化合物的形式存在,比如氯化钠(NaCl),它是我们常见的食盐。
此外,钾和铷还用于冶金工业中的合金制备。
二、第2A族元素 - 碱土金属碱土金属是元素周期表中的第2A族元素。
它们包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
与碱金属相比,碱土金属的化学性质更为稳定。
它们在自然界中以氧化物和硫化物的形式广泛存在。
钙是人体骨骼、牙齿的重要组成元素,被广泛应用于医药和建筑材料制造。
镁用于制备轻便合金,广泛应用于航空航天领域。
三、第3A族元素 - 硼族元素硼族元素是元素周期表中的第3A族元素。
它们包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl)和镓(Uut)。
这些元素的数量较少,化学性质各异。
铝是最常见的硼族元素,具有良好的导电性和导热性,广泛应用于建筑、汽车和航空领域。
四、第4A族元素 - 碳族元素碳族元素是元素周期表中的第4A族元素。
它们包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)和镤(Fl)。
碳是生命的基础,几乎所有有机物都含有碳元素。
硅在电子工业中应用广泛,是半导体材料的重要组成部分。
锡和铅常用于合金制备,具有良好的焊接性能。
五、第5A族元素 - 氮族元素氮族元素是元素周期表中的第5A族元素。
它们包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)和镤(Mc)。
氮是地球大气中的主要成分,也是生物体内常见的元素。

元素周期表中的主族元素与过渡金属元素周期表是化学中重要的工具之一,它按照元素的原子序数与化学性质的周期性变化进行排列。
其中,主族元素与过渡金属是周期表中两个重要的分类。
一、主族元素主族元素是指元素周期表中1、2、13、14、15、16、17和18族的元素。
它们的特点如下:1. 1、2族元素:位于周期表最左侧的两个族别,即“碱金属”和“碱土金属”。
- 碱金属:包括锂(Li)、钠(Na)、钾(K)等。
它们的电子排布规则为ns^1,具有较低的电离能和较强的还原性。
- 碱土金属:包括铍(Be)、镁(Mg)、钙(Ca)等。
它们的电子排布规则为ns^2,具有较高的电离能和较强的硬度。
2. 13-18族元素:分别是“硼族”、“碳族”、“氮族”、“氧族”、“氟族”和“稀有气体”。
- 硼族元素:包括硼(B)、铝(Al)等。
它们的电子排布规则为ns^2np^1,具有较高的电离能和一些金属特性。
- 碳族元素:包括碳(C)、硅(Si)等。
它们的电子排布规则为ns^2np^2,是非金属元素的重要代表。
- 氮族元素:包括氮(N)、磷(P)等。
它们的电子排布规则为ns^2np^3,具有较高的电负性。
- 氧族元素:包括氧(O)、硫(S)等。
它们的电子排布规则为ns^2np^4,通常表现出较高的电负性。
- 氟族元素:包括氟(F)、氯(Cl)等。
它们的电子排布规则为ns^2np^5,是最活跃的非金属元素。
- 稀有气体:包括氦(He)、氖(Ne)等。
它们的电子排布规则为ns^2np^6,具有极低的化学活性。
二、过渡金属过渡金属是指元素周期表中3到12族的元素,它们具有以下特征:1. 金属性质:过渡金属大多数为金属,具有良好的导电性、导热性和延展性等。
2. 电子结构:它们的原子内外电子分布比较复杂,电子结构填满顺序为(n-1)d^1-10ns^0-2。
3. 反应性:过渡金属具有多种氧化态,可以参与多种反应和配位化学。
4. 彩色与催化性:许多过渡金属化合物呈现出丰富的颜色,并且在催化反应中起到重要作用。
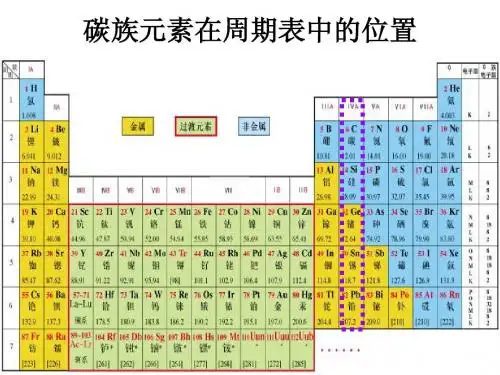


碳元素在元素周期表的位置
碳元素具有许多重要的化学和生物特性,这使得它在现代社会中起到至关重要的作用。
碳元素所在的位置也很重要。
碳元素是元素周期表的第六列的第14个元素。
它是第二个小组元素,也就是碳族元素。
碳元素的原子序数为6,原子量为12.011。
它属于非金属元素,具有非常强烈的化学活性。
它是所有元素中最稳定的元素之一,因此它在大多数有机化合物中都有重要的作用。
碳元素也是生命体的基本组成部分。
它是构成细胞的基本元素,也是构成有机物的基本元素。
碳元素可以与其他元素形成许多化合物,例如碳酸、糖类等,这些物质在生物体的代谢过程中起着重要的作用。
此外,碳元素还可以与氢、氧、氮等元素结合,形成碳水化合物,这在生物体的代谢过程中也发挥着重要作用。
碳元素也可以形成各种复杂的有机物,例如蛋白质和油脂等,这些物质对于生命体的基本功能和发育至关重要。
因此,碳元素在元素周期表中的位置非常重要,它是现代社会中最重要的化学元素之一。
它是构成有机物的基本元素,也是生命体的基本组成部分,它的存在对健康的人类有着不可磨灭的重要性。


碳族元素碳及其化合物碳族元素是指位于元素周期表第14族的元素,包括碳(C),硅(Si),锗(Ge),锡(Sn)和铅(Pb)。
碳族元素在自然界中广泛存在,具有重要的地球化学和生物化学意义。
碳是最为重要的碳族元素,因为它是生命的基础,能形成无数种具有复杂结构的有机化合物。
1.碳的性质碳是一种非金属元素,具有原子序数6和相对原子质量12.01、它的外层电子构型为2s22p2,因此能形成四个共价键。
碳具有非常高的熔点和沸点,以及很高的硬度。
它可以形成纯净的晶体结构,比如钻石和石墨。
2.碳的化合物碳可以与其他元素形成大量的化合物,包括有机化合物和无机化合物。
有机化合物是以碳为主要成分的化合物,它们在自然界和生命体系中广泛存在。
有机化合物包括烷烃、烯烃、炔烃、醇、酮、酸、酯等等。
无机化合物则是碳与非金属元素和金属元素形成的化合物,比如一氧化碳(CO)、二氧化碳(CO2)和碳酸盐。
3.碳的地球化学意义碳是地球上最常见的元素之一,它在地壳中的储量很大。
地球上大部分的有机物质也含有碳,包括化石燃料、生物质和土壤有机质。
碳的循环在地球上起着重要的作用,包括碳的释放和吸收过程。
人类活动导致大量的碳排放,加速了全球变暖和气候变化。
4.碳在生物化学中的作用碳是生命体系中最为重要的元素,它构成了所有有机化合物,包括蛋白质、核酸、脂质和碳水化合物。
这些化合物在生物机体的结构和功能中起着重要的作用。
碳还参与能量代谢过程中的碳循环,包括光合作用和细胞呼吸。
5.碳的应用由于碳形成的有机化合物种类繁多,碳化合物在工业和生活中有广泛的应用。
有机化合物被用于制造塑料、橡胶、纤维和药物等。
碳纳米管和石墨烯等碳材料也具有重要的应用潜力,可用于电子器件、储能材料和生物传感器等。
此外,碳的同位素碳-14也被广泛应用于射击物体的定年和环境探测。
总结:碳族元素是地球上最重要的元素之一,在地球化学和生物化学中起着关键的作用。
碳的化合物形式多样,有机化合物是生命体系中的基本组成部分。

高中化学碳和硅的知识点介绍在高中的化学学习中,学生过会学习到很多的知识点,下面店铺的小编将为大家带来化学中关于碳和硅的知识点的介绍,希望能够帮助到大家。
高中化学碳和硅的知识点(一)碳族元素1、组成和结构特点(1)碳族元素包括碳、硅、锗、锡、铅五种元素,位于元素周期表的IVA族。
(2)碳族元素原子最外层有4个电子,在化学反应中不易得到或失去电子,易形成共价键。
主要化合价有+2和+4价,其中碳和硅有负价。
碳族元素在化合物中多以+4价稳定,而铅在化合物中则以+2价稳定。
碳族元素中碳元素形成的单质(金刚石)硬度最大;碳元素形成的化合物种类最多;在所有非金属形成的气态氢化物中,CH4中氢元素的质量分数最大;12C是元素相对原子质量的标准原子;硅在地壳中的含量仅次于氧,其单质晶体是一种良好的半导体材料。
2、性质的递变规律随着原子序数的增大,碳族元素的原子半径依次增大,由非金属元素逐渐转变为金属元素,即金属性逐渐增强,非金属性逐渐减弱;最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;气态氢化物的稳定性逐渐减弱,还原性逐渐增强。
(二)碳及其化合物1、碳单质(1)碳的同素异形体(2)碳的化学性质常温下碳的性质稳定,在加热、高温或点燃时常表现出还原性,做还原剂,温度越高,还原性越强,高温时的氧化产物一般为一氧化碳。
溶解性不同:一般情况下,所有的钾盐、钠盐和铵盐是可溶的,所有的酸式盐是可溶的,正盐的溶解度小于酸式盐的溶解度,但碳酸钠的溶解度大于碳酸氢钠的溶解度。
热稳定性不同:一般情况下,难溶的正盐和酸式盐受热易分解,可溶性碳酸盐稳定不易分解。
与酸反应的剧烈程度不同:两者都能与强酸(H+)反应产生CO2,但反应的剧烈程度不同,根据反应的剧烈程度可鉴别两者。
可溶性盐的水解程度不同:相同浓度的正盐溶液的pH值大于酸式盐溶液的pH值。
与碱反应不同:弱酸的酸式盐可与碱反应生成正盐。
与盐反应不同:碳酸钠可与氯化钙或氯化钡反应生成难溶性碳酸盐,但碳酸氢钠不反应。

碳在元素周期表中的位置
碳(C)是元素周期表中的第六个元素,属于第二周期和第14族元素。
它的原子序数为6,原子量为12.011。
在周期表中,碳位于同族元素如硅(Si)、锗(Ge)和锡(Sn)等之间。
它的电子结构是1s²2s²2p²,具有4个价电子,使得碳具有强大的化学反应性和广泛的化学性质。
碳在自然界中存在于多种形态。
最常见的是石墨、大理石和煤炭。
碳还存在于有机物中,包括脂肪、糖类和蛋白质等,在生命体系中扮演着重要角色。
碳的性质和应用非常广泛。
由于其高强度和低比重,碳纤维具有良好的力学性能和电导性,是航空航天和高科技场所中常见的高性能材料。
碳还常被用于制造锂离子电池负极、反渗透膜和水过滤器等。
此外,碳还被广泛用于工业、医学和环境治理等领域。
它是制造钢铁的关键原料,也是生产活性炭以吸附污染物的重要材料。
在医学领域,碳被用作医用材料、医疗设备和药物载体等。
在环境治理方面,碳被用作土壤改良剂和油污处理剂,提高了土地的肥力和水污染物的处理效率。
因此可以看出,碳作为元素周期表中的重要元素,其广泛的应用和作用甚至影响到了现代社会的方方面面。
非金属离子
非金属离子是指由非金属元素组成的离子。
在化学中,非金属元素通常指的是那些位于元素周期表中右上方的元素,它们大多位于第14族(碳族)、第15族(氮族)、第16族(氧族)和第17族(卤素)。
这些元素在自然界中通常以气态或固态的形式存在,并且它们的原子在化学反应中容易获得电子,从而形成负离子。
以下是一些常见的非金属离子及其特性:
1.卤素离子(如F⁻、Cl⁻、Br⁻、I⁻):卤素是周期表中的第17族元素。
它们形成的
负离子通常具有稳定的八隅体结构,因此在化学反应中相对稳定。
卤素离子可以与金属离子结合,形成盐类,如氯化钠(NaCl)中的氯离子(Cl⁻)。
2.氧离子(O²⁻):氧是周期表中的第16族元素,具有很强的电负性。
氧离子通常
是由氧原子获得两个电子而形成的。
在化合物中,氧离子通常与金属离子结合,如氧化钠(Na₂O)中的氧离子(O²⁻)。
3.氮离子(如N³⁻):氮是周期表中的第15族元素。
尽管氮原子通常很难形成负
离子,但在某些特殊情况下,如与碱金属反应时,可以形成氮离子。
4.碳离子(如C⁴⁻):碳是周期表中的第14族元素。
由于碳原子具有四个价电子,
因此在一般情况下很难形成负离子。
但在某些特殊环境中,如高温高压条件下,碳可以与某些金属元素结合,形成碳离子。
非金属离子在化学反应中通常表现出较强的氧化性,因为它们容易获得电子成为更稳定的负离子。
此外,非金属离子还参与了许多重要的化学反应,如酸碱反应、氧化还原反应等。
高中化学碳族元素的知识点总结碳族元素是周期表中的第14族,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)和麦家(Ja)。
碳族元素具有一些共同的性质和特征,下面将对碳族元素的知识点进行总结。
1.原子结构:碳族元素的原子结构特点是外层电子壳的电子数量为4个。
每个碳族元素的原子内核都有与其电子数相等的质子数,电荷中和,具有相应的原子序数。
电子层的排布为[2,8,4],其中两个内层电子属于填充内层,而最外层电子属于价电子。
2.定位和周期性:碳族元素位于第2周期,是元素周期表中的第14组。
它们具有相似的化学性质,因为它们有相同数量的价电子,并且在化学反应中容易失去或获得4个电子。
3.物理性质:碳族元素的物理性质有一定的规律性。
随着原子序数的增加,原子半径逐渐增加,原子核对外层电子的束缚减弱,电子云容易发生形变。
此外,碳族元素的密度、熔点和沸点也随着原子序数的增加而递增。
4.化学性质:碳族元素的化学性质主要由它们的外层电子配置所决定,其中最外层电子的数量为4个。
碳族元素常发生+4价和-4价两种价态。
在化合物中,它们通常与其他元素形成共价键或离子键。
5.碳的性质:以碳为代表的碳族元素是生命中的基础元素,生物分子的骨架和结构都以碳为主要构成部分。
碳的共有4个价电子,因此形成氧化态及共价化合物较为常见。
碳的同素异形体分子和同系物在化学反应中具有独特的性质和活性。
6.半金属元素:碳族元素中的硅,被认为是一种半金属元素。
硅的特点是中等电负性、半导体特性和热稳定性较好。
硅在电子学和材料科学领域有广泛的应用,如制备半导体器件和太阳能电池。
7.其他碳族元素:除碳和硅外,锡、铅和麥家也是碳族元素。
锡和铅是广泛使用的金属,它们常用于制备合金。
麦家是放射性元素,具有高毒性和放射性衰变的特点。
8.化合物和应用:碳族元素形成的化合物具有多样性和广泛的应用。
例如,碳形成的化合物包括有机化合物(有机化学的基础)、无机化合物(如碳酸盐)和碳化物(如硅碳化物)。
硅和硅酸盐工业单元复习
一、碳族元素
1.碳族元素在周期表中的位置、原子结构和性质
⑴位于周期表中的第( )族,包括( )五种元素。
⑵原子的最外层有( )个电子。
⑶主要化合价是( )。
其中( )的+4价是( ),而( )的+2是稳定的。
( )只有+4价。
4.二氧化硅是熔点( ),硬度( ),( )溶于水的固体。
5.SiO 2的的化学性质
①具有弱氧化性 SiO 2+ C==
②具有酸性氧化物的通性(硅酐)
化学 SiO 2 + CaO== (此反应用于 )
性质 SiO 2 + NaOH==
故盛放碱性溶液的试剂瓶不能用( )塞,常用( )塞。
③特性 SiO 2+ HF== 故盛放氢氟酸不能用( )瓶。
6.硅酸是( )溶于水的( )酸,其酸性比碳酸( )。
7.硅酸钠的水溶液溶液俗名( )。
写出各其中加入盐酸和通入二氧化碳时发生的化学反应方程式
( )。
8. CO 2是动、植物呼吸作用的废气成分;又是植物进行光合作用的原料气,光合作用的方程式
为 。
(9)硅是一种良好的 材料,常用于电子工业。
(10)SiO 2是高性能通信材料 的主要原料。
(11)化石原料燃烧产生大量的CO 2,使大气中CO 2含量增大,会导致 的环境问题。
(12)利用CaCO 3和Ca(HCO 3)2互相转化解释“水滴石穿”和“滴水成石”的化学解释,请写化学方程式。
“水滴石穿”:______________________;“滴水成石”:__________________________。
初中化学元素周期表中的主族元素与副族元素解析元素周期表是化学中非常重要的工具,它将所有已知的元素按照一定的规律排列起来。
其中,元素周期表中的元素可分为主族元素和副族元素两大类别。
一、主族元素主族元素也称为A族元素,包括1A、2A、3A、4A、5A、6A和7A族元素。
它们的特点是原子外层电子数与主量子数(即元素周期数)相等,电子排布规则符合“2n²”规律,其中n表示主量子数。
1. 1A族元素(碱金属)1A族元素包括氢(H)、锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素在化合物中通常带正一价电荷,因为它们的最外层只有一个电子。
2. 2A族元素(碱土金属)2A族元素包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
这些元素在化合物中通常带正二价电荷,因为它们的最外层有两个电子。
3. 3A族元素(硼族元素)3A族元素包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl)和鉍(Bi)。
这些元素在化合物中通常带正三价电荷,因为它们的最外层有三个电子。
4. 4A族元素(碳族元素)4A族元素包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb)。
这些元素在化合物中通常呈多种价态存在。
5. 5A族元素(氮族元素)5A族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)。
这些元素在化合物中通常带正三价电荷。
6. 6A族元素(氧族元素)6A族元素包括氧(O)、硫(S)、硒(Se)、碲(Te)和钋(Po)。
这些元素在化合物中通常带正二价电荷。
7. 7A族元素(卤素)7A族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
这些元素在化合物中通常带负一价电荷,因为它们的最外层只缺少一个电子。
二、副族元素副族元素也称为B族元素,包括1B、2B、3B(除了铝)、4B、5B、6B、7B、8B(除了镁和锌)、1B和2B(除了镁和锌)族元素。
碳在元素周期表中的位置
碳在元素周期表中的位置:碳在元素周期表中的第二周期IVA族。
碳可以说是人类接触到的最早的元素之一,也是人类利用得最早的元素之一。
常见的碳的自然形式有金刚石、炭和石墨。
化学元素周期表是根据核电荷数从小至大排序的化学元素列表。
在周期表中,元素是以元素的原子序数排列,最小的排行最先。
原子半径由左到右依次减小,上到下依次增大。
由于周期表能够准确地预测各种元素的特性及其之间的关系,因此它在化学及其他科学范畴中被广泛使用,作为分析化学行为时十分有用的框架。
元素周期表有7个周期,16个族。
横行称周期,用阿拉伯数字表示,有第1、2、3、4、5、6、7周期,其中1、2、3称为短周期,4、5、6
称为长周期,第7周期称不完全周期。
而纵行称为族,16个族分为7
个主族(IA~V II A),7个副族(IB~V II B),1个V III B族,1个零族。
因此可以从元素周期表找到碳元素的位置,碳在第二周期第IV A族。
1。
第8讲碳族元素和氮族元素碳族元素一、碳族元素(一)、碳族元素在周期表中的位置、原子结构和性质1、位于周期表ⅣA族,包括C、Si、Ge、Sn、Pb2、原子最外层电子均为4说明:从8电子稳定结构看:碳族元素既难得到4个电子,又难失去4个电子,因此容易以共用电子对结合形成共价化合物。
3、主要价态:+4、+2价,C、Si、Ge、Sn的+4价化合物是稳定的,而Pb的+2化合物是稳定的例如:Sn+2Cl2=SnCl4Pb+Cl2=PbCl2例如:Fe3O4可以写成FeO·Fe2O3,则Pb3O4可以写成2PbO·PbO2Sn2+具有还原性、Pb4+具有氧化性例如:Sn2++2Fe3+=Sn4++2Fe2+PbO2+4HCl(浓) =PbCl2+Cl2↑+2H2O(二)二、碳金刚石:原子晶体1、同素异形体石墨:混合晶体C60:分子晶体C(金刚石,s) 高温C(石墨,s) ;△H = -1.89 KJ/mol(石墨比金刚石稳定)2、化学性质(1)可燃性:C + O2点燃CO2 (O2足量) 2C + O2点燃2CO (O2不足) (2)还原性:C + 2CuO △2Cu + CO2 C + H2O 高温CO + H2(水煤气)CaO + 3C 通电CaC2 + CO↑(电石的制法)(3)与氧化性酸反应C + 2H2SO4(浓) △CO2↑+ 2SO2↑+ 2H2OC +4HNO3(浓)△CO2↑+4NO2↑+2H2O三、碳的化合物(一)CO的性质1、物理性质:无色无味气体,剧毒难溶于水。
中性氧化物(不成盐氧化物)2、化学性质(1)可燃性:2CO + O2点燃2CO2(用点燃的方法除去CO)(2)还原性:Fe2O3+3CO △+3CO2(炼铁)CuO+CO △Cu+CO2(除CO)CO+H2O 高温CO2+H2(工业上用于制H2)(3)毒性:CO能于人体中血红蛋白结合,使血红蛋白失去携氧的能力,使人缺氧死亡。