王镜岩生物化学名词解释.
- 格式:doc
- 大小:77.50 KB
- 文档页数:19

王镜岩生化名词解释点击次数:78 发布时间:2011-4-14王镜岩生化名词解释1.核小体(nucleosome):用于包装染色质的结构单位,是由DNA链缠绕一个组蛋白核构成的。
2.DNA变性(DNAdenaturation)在理化因子的作用下,DNA双螺旋的两条互补链松散而成为单链,从而导致DNA的理化性质及生物学性质发生改变,这种现象称DNA的变性。
3.DNA复性:变性的DNA在适当的条件下又可使两条分开的链重新缔合成为双螺旋结构的过程。
4.熔解温度(melting temperature,Tm):在DNA热变性中,紫外吸收增加的中点值所对应的温度。
或称热解链温度。
5.增色效应hyperchromic effect: 当DNA变性后,对260nm处紫外光光吸收度增加的现象。
6.减色效应(hypochromic effect):随着核酸复性,紫外吸收降低的现象。
7.核酸内切酶(exonuclease): 核糖核酸酶和脱氧核糖核酸酶中能够水解核酸分子内磷酸二酯键的酶。
8.核酸外切酶(exonuclease):从核酸链的一端逐个水解核甘酸的酶。
9.限制性内切酶(restriction endonuclease):一种在特殊核甘酸序列处水解双链DNA的内切酶。
Ⅰ型限制性内切酶既能催化宿主DNA的甲基化,又催化非甲基化的DNA的水解;而Ⅱ型限制性内切酶只催化非甲基化的DNA的水解。
10.重组DNA技术(recombination DNA technology):也称之为基因工程(genomic engineering).利用限制性内切酶和载体,按照预先设计的要求,将一种生物的某种目的基因和载体DNA重组后转入另一生物细胞中进行复制、转录和表达的技术。
11.基因(gene):泛指被转录的一个DNA片段。
在某些情况下,基因常用来指编码一个功能蛋白或DNA分子的DNA片段。
12.新陈代谢:生物体与外界环境不断进行的物质和能量交换过程。

王镜岩——生物化学名词解释(2013年~2002年)[2013年]1.寡聚蛋白质(oligomeric protein):两条或两条以上具有三级结构的多肽链组成的蛋白质。
(也称多聚蛋白质)。
如:血红蛋白(两条α链,两条β链)、己糖激酶(4条α链)。
附:仅由一条多肽链构成的蛋白质称为单体蛋白质。
如:溶菌酶和肌红蛋白 [第三章蛋白质 ](上159)2.酶的转换数(turnover number,TN):即K3,又称催化常数(catalytic constant,K cat)是指在一定条件下每秒钟每个酶分子转换底物的分子数。
(通常来表示酶的催化效率)附:[ 或每秒钟每微摩尔酶分子转换底物的微摩尔数 ] ,大多数酶对它们的天然底物的转换数的变化围是每秒1到104(上321)[第四章酶]3.糖的变旋现象(mutarotation):是当一种旋光异构体,如糖溶于水中转变为几种不同的旋光异构体的平衡混合物时,发生的旋光变化的现象。
[第一章糖类 ](上8;2013、2008)4.油脂的酸值(acid number):是指中和1g油脂中的游离脂肪酸所消耗KOH 的毫克数。
[第二章脂类和生物膜 ](上95)5.激素受体:位于细胞表面或细胞,结合特异激素并引发细胞响应的蛋白质。
[第六章维生素、激素和抗生素]6.乙醛酸循环(glyoxylic acid cycle ,GAC):是一种被修改的三羧酸循环,在两种循环中具有某些一样的酶和产物,但代途径不同,在乙醛酸循环中乙酰CoA首先和草酰乙酸缩合成柠檬酸,然后转变为异柠檬酸,再裂解为琥珀酸和乙醛酸,在这一循环中产生乙醛酸,故称乙醛酸循环。
[第八章糖代](这个循环除两步由异柠檬酸裂合酶和苹果酸合酶催化的反应外,其他的反应都和“柠檬酸循环”一样。
)( 2013、2012)资料2:又称三羧酸循环支路,该途径在动物体不存在,只存在于植物和微生物中,主要在乙醛酸循环体中和线粒体中进行。

生物化学知识点汇总(王镜岩版)————————————————————————————————作者:————————————————————————————————日期:生物化学讲义(2003)孟祥红绪论(preface)一、生物化学(biochemistry)的含义:生物化学可以认为是生命的化学(chemistryoflife)。
生物化学是用化学的理论和方法来研究生命现象。
1、生物体是有哪些物质组成的?它们的结构和性质如何?容易回答。
2、这些物质在生物体内发生什么变化?是怎样变化的?变化过程中能量是怎样转换的?(即这些物质在生物体内怎样进行物质代谢和能量代谢?)大部分已解决。
3、这些物质结构、代谢和生物功能及复杂的生命现象(如生长、生殖、遗传、运动等)之间有什么关系?最复杂。
二、生物化学的分类根据不同的研究对象:植物生化;动物生化;人体生化;微生物生化从不同的研究目的上分:临床生物化学;工业生物化学;病理生物化学;农业生物化学;生物物理化学等。
糖的生物化学、蛋白质化学、核酸化学、酶学、代谢调控等。
三、生物化学的发展史1、历史背景:从十八世下半叶开始,物理学、化学、生物学取得了一系列的重要的成果(1)化学方面法国化学家拉瓦锡推翻“燃素说”并认为动物呼吸是像蜡烛一样的燃烧,只是动物体内燃烧是缓慢不发光的燃烧——生物有氧化理论的雏形瑞典化学家舍勒——发现了柠檬酸、苹果酸是生物氧化的中间代谢产物,为三羧酸循环的发现提供了线索。
(2)物理学方面:原子论、x-射线的发现。
(3)生物学方面:《物种起源——进化论》发现。
2、生物化学的诞生:在19世纪末20世纪初,生物化学才成为一门独立的科学。
德国化学家李比希:1842年撰写的《有机化学在生理与病理学上的应用》一书中,首次提出了新陈代谢名词。
另一位是德国医生霍佩赛勒:1877年他第一次提出Biochemie这个名词英文译名是Biochemistry(orBiologicalchemistry)汉语翻译成生物化学。

2021年北京科技大学338生物化学考研精品资料之王镜岩《生物化学》考研核心题库之名词解释精编重要提示本书由本机构编写组多位高分在读研究生按照考试大纲、真题、指定参考书等公开信息潜心整理编写,仅供考研复习参考,与目标学校及研究生院官斱无关,如有侵权请联系我们立即处理。
一、名词解释1.ping-pong reaction(兵兵反应)【答案】多底物酶促反应中,酶结合一个底物幵释放出一个产物,留下一个叏代酶,然后该叏代酶再结合第二个底物呾释放出第二个产物,最后酶恢复到它癿起始状态。
2.多糖.【答案】是由10个以上单糖以糖苷键连接而成癿大分子化合物。
3.HMG CoA【答案】HMGCoA即羟甲基戊二酸单酰辅酶A,由乙酰乙酰CoA 呾乙酰CoA由HMGCoA合酶催化缩合而成,是合成胆固醇呾酮体癿中间产物。
4.药物的生物转化(biotransformation)【答案】指体内正常丌应有癿外来有机化合物包括药物戒毒物在体内迚行癿代谢转化。
药物在体内癿代谢转化有其特殊斱式呾酶系。
5.reducing sugar(还原糖)【答案】羰基碳(异头碳)没有参不形成糖苷键,因此可被氧化充当还原剂癿糖。
6.第二相反应【答案】是指非营养物质通过不某些内源性极性分子戒基团共价结合增加极性呾水溶性,易于随胆汁排出戒经肾脏排泄。
7.色氨酸吡咯酶【答案】色氨酸吡咯酶又称色氨酸加氧酶,催化色氨酸吡咯环加氧断开,是色氨酸提供一碳单元、丙酮酸(生糖)、乙酰乙酰(生酮)以及形成尼兊酸等代谢癿第一步反应。
8.liposome(脂质体)【答案】当磷脂浓度增加到使水-空气界面达到饱呾时,水环境中癿磷脂将以微观癿脂质聚集体癿形式存在。
脂质体是是由包围水相空间癿磷脂双层形成癿囊泡(小泡)。
9.affinity chromatography(亲和色谱)【答案】利用共价连接有特异配体癿色谱介质分离蛋白质混合物中能特异结合配体癿目癿蛋白戒其他分子癿色谱技术。

王镜岩——生物化学名词解释(2013年~2002年)【2013年】1.寡聚蛋白质(oligomeric protein):两条或两条以上具有三级结构的多肽链组成的蛋白质。
(也称多聚蛋白质)。
如:血红蛋白(两条α链,两条β链)、己糖激酶(4条α链)。
附:仅由一条多肽链构成的蛋白质称为单体蛋白质。
如:溶菌酶和肌红蛋白【第三章蛋白质】(上159)2.酶的转换数(turnover number,TN):即K3,又称催化常数(catalytic constant,K cat)是指在一定条件下每秒钟每个酶分子转换底物的分子数。
(通常来表示酶的催化效率)附:[ 或每秒钟每微摩尔酶分子转换底物的微摩尔数] ,大多数酶对它们的天然底物的转换数的变化围是每秒1到104(上321)【第四章酶】3.糖的变旋现象(mutarotation):是当一种旋光异构体,如糖溶于水中转变为几种不同的旋光异构体的平衡混合物时,发生的旋光变化的现象。
【第一章糖类】(上8;2013、2008)4.油脂的酸值(acid number):是指中和1g油脂中的游离脂肪酸所消耗KOH 的毫克数。
【第二章脂类和生物膜】(上95)5.激素受体:位于细胞表面或细胞,结合特异激素并引发细胞响应的蛋白质。
【第六章维生素、激素和抗生素】6.乙醛酸循环(glyoxylic acid cycle ,GAC):是一种被修改的三羧酸循环,在两种循环中具有某些相同的酶和产物,但代谢途径不同,在乙醛酸循环中乙酰CoA首先和草酰乙酸缩合成柠檬酸,然后转变为异柠檬酸,再裂解为琥珀酸和乙醛酸,在这一循环中产生乙醛酸,故称乙醛酸循环。
【第八章糖代谢】(这个循环除两步由异柠檬酸裂合酶和苹果酸合酶催化的反应外,其他的反应都和“柠檬酸循环”相同。
)(2013、2012)资料2:又称三羧酸循环支路,该途径在动物体不存在,只存在于植物和微生物中,主要在乙醛酸循环体中和线粒体中进行。
乙醛酸循环从草酰乙酸与乙酰CoA缩合形成柠檬酸开始,柠檬酸经异构化生成异柠檬酸,与TCA循环不同的是异柠檬酸经异柠檬酸裂解酶裂解为琥珀酸和乙醛酸。

多糖;是由糖苷键结合的糖链,至少要超过10个的单糖组成的聚合糖高分子碳水化合物构型:分子中由于各原子或基团间特有的固定的空间排列方式不同而使它呈现出不同的较定的立体结构构象:由于分子中的某个原子(基团)绕C-C单键自由旋转而形成的不同的暂时性的易变的空间结构形式,不同的构象之间可以相互转变,在各种构象形式中,势能最低、最稳定的构象是优势构象。
旋光率;偏振光通过单位厚度旋光物质后其偏振面旋转的角度。
醛糖:一类单糖,该单糖中氧化数最高的C原子(指定为C-1)是一个醛基,有醇和醛性质。
酮糖:多羟基酮称为酮糖对映体;互为旋光异构体的两种化合物,由于其中一个不对称碳原子的取代基在空间上取向不同而互成物体与镜像的关系,并且两者在空间上不能重叠,它们被称为对映体差象异构体;在立体化学中,含有多个手性碳原子的立体异构体中,只有一个手性碳原子的构型不同,其余的构型都相同的非对映体叫差向异构体。
异头物;是指在羰基碳原子上的构型彼此不同的单糖同分异构体形式。
异头碳;单糖由直链变成环状结构时,羰基碳原子成为新的手性中心,导致C1差向异构化,产生两个非对映异构体。
在环状结构中,半缩醛碳原子称为异头碳原子。
半缩醛;两个含α-H的醛酮分子发生缩合反应,结果生成β-羟基醛酮糖脎,是糖类的苯肼衍生物。
淀粉:D-葡萄糖以α-1,4-糖苷键首尾相连,在支链处为α-1,6-糖苷键的多聚高分子化合物。
糖元;结构与支链淀粉相似,主要是α-D-葡萄糖,按α(1→4)糖苷键缩合失水而成,另有一部分支链通过α(1→6)糖苷键连接纤维素;由D-葡萄糖以β-1,4糖苷键组成的大分子多糖肽聚糖;肽聚糖存在于真细菌中的革兰氏阳性菌和革兰氏阴性菌的细胞壁中。
是由乙酰氨基葡萄糖、乙酰胞壁酸与四到五个氨基酸短肽聚合而成的多层网状大分子结构。
皂化值;皂化1克试样油所需氢氧化钾的毫克数。
碘值;表示有机化合物中不饱和程度的一种指标。
指100g物质中所能吸收碘的克数。

生物化学名词解释第1. 变构调节 [填空题] *_________________________________(答案:特定物质与酶蛋白活性中心以外的某一部位以非共价键结合,改变酶蛋白构象,从而改变其活性。
)2. 基因 [填空题] *_________________________________(答案:遗传物质的基本单位,主要存在于染色体上)3. 复制 [填空题] *_________________________________(答案:以亲代DNA为模板合成子代DNA 的过程)4. 转录 [填空题] *_________________________________(答案:在DNA指导的RNA聚合酶催化下,按碱基互补配对的原则,以dNTP为原料合成一条与模板DNA链互补的RNA 链的过程)5. 翻译 [填空题] *_________________________________(答案:核糖体以氨基酸为原料,mRNA为模板合成蛋白质的过程)6. 启动子 [填空题] *_________________________________(答案:位于5端上游的DNA序列,能活化DNA聚合酶,使之与模板结合并起始转录)7. 半保留复制 [填空题] *_________________________________(答案:DNA生物合成时,母链DNA解开为两股双链,两条链分别作为模板,按碱基互补配对的原则指导合成一股新的互补链,最终得到与亲代DNA分子完全一样的两个DNA分子,每个子代DNA分子都含有一股亲代DNA链和新生DNA链,这种复制方式为半保留复制。
)8. 拓扑异构酶 [填空题] *_________________________________(答案:具有松弛DNA超螺旋,避免解链过程中打结、缠绕作用的酶)9. 冈崎片段 [填空题] *_________________________________(答案:DNA复制过程中,由于后随链的不连续复制而产生的短的核苷酸片段)10. 端粒 [填空题] *_________________________________(答案:真核生物染色体线性DNA分子末端由DNA和蛋白质组成的一种特殊结构)11. 逆转录 [填空题] *_________________________________(答案:以RNA为模板、dNTP为原料、由逆转录酶催化合成DNA的过程)12. 开放阅读框 [填空题] *_________________________________(答案:从mRNA编码区5端起始密码子到3端终止密码子的一段序列)13. SD序列 [填空题] *_________________________________(答案:位于原核生物mRNA起始密码子AUG上游处一段富含嘌呤的序列)14. 遗传密码 [填空题] *_________________________________(答案:mRNA编码区5端到3端,每三个相邻碱基为一组,每组碱基构成一个遗传密码,称为密码子)15. 终止密码子 [填空题] *_________________________________(答案:提供终止信号并不编码任何氨基酸的密码子)16. 密码子的兼并性 [填空题] *_________________________________(答案:不同的密码子可以编码同一种氨基酸且只编码一种氨基酸)。

王镜岩生物化学名词解释1.氨基酸(amino acid):是含有一个碱性氨基(-NH2)和一个酸性羧基(-COOH)的有机化合物,氨基一般连在α-碳上。
氨基酸是蛋白质的构件分子。
2.必需氨基酸(essential amino acid):指人(或其它脊椎动物)(赖氨酸,苏氨酸等)自己不能合成,需要从食物中获得的氨基酸。
3.非必需氨基酸(nonessential amino acid):指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。
4.等电点(pI,isoelectric point):使氨基酸处于兼性离子状态,在电场中不迁移(分子的静电荷为零)的pH值。
5.茚三酮反应(ninhydrin reaction):在加热条件下,氨基酸或肽与茚三酮反应生成紫色(与脯氨酸及羟脯氨酸反应生成黄色)化合物的反应。
6.层析(chromatography):按照在移动相和固定相(可以是气体或液体)之间的分配比例将混合成分分开的技术。
7.离子交换层析(ion-exchange column):一种用离子交换树脂作支持剂的层析技术。
8.透析(dialysis):利用蛋白质分子不能通过半透膜的性质,使蛋白质和其他小分子物质如无机盐、单糖等分开的一种分离纯化技术。
9.凝胶过滤层析(gel filtration chromatography,GPC):也叫做分子排阻层析/凝胶渗透层析。
一种利用带孔凝胶珠作基质,按照分子大小分离蛋白质或其它分子混合物的层析技术。
10.亲合层析(affinity chromatograph):利用共价连接有特异配体的层析介质,分离蛋白质混合物中能特异结合配体的目的蛋白质或其它分子的层析技术。
11.高压液相层析(HPLC):使用颗粒极细的介质,在高压下分离蛋白质或其他分子混合物的层析技术。
12.凝胶电泳(gel electrophoresis):以凝胶为介质,在电场作用下分离蛋白质或核酸的分离纯化技术。
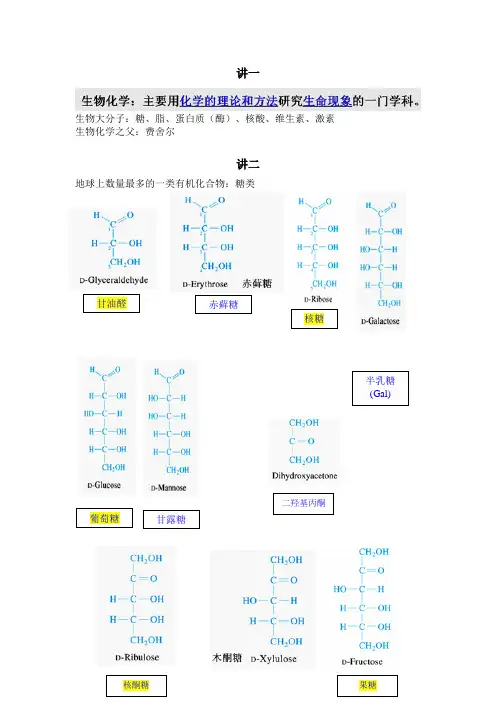
赤藓糖葡萄糖甘油醛核糖甘露糖半乳糖(Gal)((Gal)二羟基丙酮核酮糖果糖讲一生物大分子:糖、脂、蛋白质(酶)、核酸、维生素、激素生物化学之父:费舍尔讲二地球上数量最多的一类有机化合物:糖类α和β吡喃葡萄糖(羟基在下为α型,在上为β型)糖原高度分支的生理意义:第三章、蛋白质20种氨基酸英文名等电点掌握氨基酸的用途、现象DNFB法PITCCys半胱氨酸Ellman反应,DTNB,二硫硝基苯甲酸Ellman反应(二硫硝基苯甲酸,DTNB)Cys与二硫硝基苯甲酸(DTNB) 或称Ellman 试剂发生硫醇-二硫化物交换反应。
反应中1 分子的Cys引起1分子的硫硝基苯甲酸的释放。
它在pH 8.0 时, 在412nm 波长处有强烈的光吸收, 因此可利用分光光度法定量测定-SH。
肽平面(酰胺平面)——由肽键周围的6个原子组成的刚性平面3.6蛋白质的纯化注:用尽可能少的步骤、尽可能短的时间。
1.前处理阶段物理法——冻融法,超声波法,均浆法,研磨法等。
酶裂解法——就是利用水解酶将细胞壁和细胞膜消化的方法,常用的水解酶有溶菌酶、葡聚糖酶、蛋白酶、糖苷酶、壳多糖酶、细胞壁溶解酶等。
其中溶菌酶主要对细菌类有作用,其他酶对酵母作用显著。
2.粗分级/粗分离根据蛋白质的①溶解性质、②大小不同、③带电状态不同/电荷多少④净化方法根据与其他化合物相互作用的蛋白质(部分蛋白质对..有特定的..)②:凝胶过滤层析常用凝胶过滤介质Sephadex:交联葡聚糖,是采用环氧氯丙烷作交联剂将右旋葡聚糖交联而成。
干粉容易膨胀,在水、盐溶液、有机溶液、碱和弱酸中化学性质稳定,可高压灭菌。
高交联度的Sephadex,其颗粒坚硬,适于高流速下操作。
Sephacryl : 烯丙基葡聚糖同N、Nˊ—甲叉双丙烯酰胺共价交联而成。
颗粒坚硬,性质比Sephadex更为稳定,可高压灭菌,在pH3~11条件下稳定,可用有机溶剂洗脱,也可用SDS、尿素及盐酸胍洗脱。

生物化学知识点汇总(王镜岩版)————————————————————————————————作者:————————————————————————————————日期:生物化学讲义(2003)孟祥红绪论(preface)一、生物化学(biochemistry)的含义:生物化学可以认为是生命的化学(chemistryoflife)。
生物化学是用化学的理论和方法来研究生命现象。
1、生物体是有哪些物质组成的?它们的结构和性质如何?容易回答。
2、这些物质在生物体内发生什么变化?是怎样变化的?变化过程中能量是怎样转换的?(即这些物质在生物体内怎样进行物质代谢和能量代谢?)大部分已解决。
3、这些物质结构、代谢和生物功能及复杂的生命现象(如生长、生殖、遗传、运动等)之间有什么关系?最复杂。
二、生物化学的分类根据不同的研究对象:植物生化;动物生化;人体生化;微生物生化从不同的研究目的上分:临床生物化学;工业生物化学;病理生物化学;农业生物化学;生物物理化学等。
糖的生物化学、蛋白质化学、核酸化学、酶学、代谢调控等。
三、生物化学的发展史1、历史背景:从十八世下半叶开始,物理学、化学、生物学取得了一系列的重要的成果(1)化学方面法国化学家拉瓦锡推翻“燃素说”并认为动物呼吸是像蜡烛一样的燃烧,只是动物体内燃烧是缓慢不发光的燃烧——生物有氧化理论的雏形瑞典化学家舍勒——发现了柠檬酸、苹果酸是生物氧化的中间代谢产物,为三羧酸循环的发现提供了线索。
(2)物理学方面:原子论、x-射线的发现。
(3)生物学方面:《物种起源——进化论》发现。
2、生物化学的诞生:在19世纪末20世纪初,生物化学才成为一门独立的科学。
德国化学家李比希:1842年撰写的《有机化学在生理与病理学上的应用》一书中,首次提出了新陈代谢名词。
另一位是德国医生霍佩赛勒:1877年他第一次提出Biochemie这个名词英文译名是Biochemistry(orBiologicalchemistry)汉语翻译成生物化学。

王镜岩生物化学pdf王镜岩生物化学简介1. 定义:王镜岩生物化学(英文名称Jingyan Wang Biochemistry)是一门利用生物化学方法,研究动物和植物生长,发育,代谢,能量代谢,遗传变异,病原体抗药性,疾病分析和防治,工农业活性物质等生命过程,综合运用细胞生理学,基因工程学,植物学,病原生物学,分子生物学的科学,是生物化学的一个关键学科。
2. 特点:王镜岩生物化学融合了基因工程学,细胞生物学,遗传学及生物物理学等多学科和多研究领域,批判性思维及系统思维加上原子分子结构、生命过程及其调控的复杂性与可变性,都是影响王镜岩生物化学研究的重要因素。
3. 领域:王镜岩生物化学的领域有大量的实验来支持,全面探讨了不同种类的生物体的内源环境、各种自身因素和外在环境对生命体的影响,揭示了复杂的生物体的系统结构层面的研究,系统思考、系统考察、系统概念是王镜岩生物化学研究的基础。
4. 研究方法:王镜岩生物化学主要研究途径包括:系统理论范式,系统思维范式,量子机理论,化学迷宫和模型计算,开发和优化实验设计,生物传感器开发,大数据系统,以及研究具体相关课题,如非编码RNA调控机制,蛋白质结构及功能,细胞病毒感染调控机制,核糖体系统及其在细胞内移动调控机制等。
5. 展望:随着王镜岩生物化学研究在细胞病毒感染、细胞内移动、蛋白质结构及功能、遗传变异、内源环境调控以及农业活性物质等领域取得的一系列成果,王镜岩生物化学在全球发展中扮演者越来越重要的角色,成为生物学的全新的研究方向。
未来王镜岩生物化学将追求与以生物学和遗传学为主的多领域融合发展,为机体的系统正常发育和功能恢复提供支持,最终达到让机体更耐受各种外界刺激、抵御疾病、保护生物资源、提供更多有益物质及元素、减少污染和最重要的是可持续发展,更加关注环境保护。
生物化学王镜岩第一篇:生物化学的基本概念和重要性生物化学是研究生物体内化学反应和分子机制的学科,它的研究对象是与生命现象相关的各种分子,如蛋白质、核酸、酶、代谢产物等。
生物化学是现代生命科学的重要组成部分,为解析复杂的生命现象提供了理论基础和技术手段。
生物化学的核心是研究生物分子的结构和功能。
蛋白质是生物体内最重要的大分子,它不仅构成细胞的骨架和器官的结构,还是细胞内许多代谢反应的催化剂。
核酸则是储存和传递遗传信息的分子,在细胞分裂和生物繁殖过程中起着重要作用。
生物化学的研究不仅对解析生命现象具有重要意义,还对医学、农业、环境保护等领域具有重大意义。
例如,生物化学研究可以为制药工业开发新的药物提供基础知识;可以为农业生产提高作物产量和品质提供技术支持;可以帮助理解生态系统中生物多样性维持的分子机制。
总之,生物化学的研究对深入理解生命现象、促进科技进步和人类福祉都具有重要意义。
第二篇:生命体系中的代谢反应代谢反应是生命体系中最基础的反应,它指细胞内与物质转换和能量变化相关的化学反应。
代谢反应分为两类:分解反应和合成反应。
分解反应是将复杂的大分子分解成简单的小分子,同时产生能量;合成反应则是构建新的分子,需要消耗能量。
生命体系中的代谢反应非常复杂,需要许多的酶参与催化,并且需要不同的代谢通路协同作用。
常见的代谢通路包括糖酵解、三羧酸循环、脂肪酸代谢和核酸代谢等。
糖酵解是细胞内代谢的重要途径之一,它将葡萄糖分解为丙酮酸、ATP和NADH等产物。
三羧酸循环是将葡萄糖分解为CO2和能量的过程,它是细胞内氧化代谢的主要途径,能够产生大量ATP。
脂肪酸代谢则是利用脂肪酸进行产能的途径,它可以在高强度运动或长时间运动中提供能量支持。
核酸代谢则涉及到细胞内DNA和RNA分子的合成和修复。
代谢反应的平衡和调节对维持细胞内平衡和正常生理状态具有重要作用。
代谢调控的手段比较多,例如体内的激素、营养物质浓度、温度、氧气和pH值等都能够影响代谢过程的进行。
王镜岩⽣物化学知识点整理版教学⽬标:1、掌握蛋⽩质得概念、重要性与分⼦组成。
2、掌握α-氨基酸得结构通式与20种氨基酸得名称、符号、结构、分类;掌握氨基酸得重要性质;熟悉肽与活性肽得概念。
3、掌握蛋⽩质得⼀、⼆、三、四级结构得特点及其重要化学键。
4、了解蛋⽩质结构与功能间得关系。
5、熟悉蛋⽩质得重要性质与分类第⼀节蛋⽩质得分⼦组成⼀、蛋⽩质得元素(化学)组成主要有C(50%~55%)、H(6%~7%)、O(19%~24%)、N(13%~19%)、S(0%~4%)。
有些蛋⽩质还含微量得P、Fe、Cu、Zn、Mn、Co、Mo、I等。
各种蛋⽩质得含氮量很接近,平均为16%。
因此,可以⽤定氮法来推算样品中蛋⽩质得⼤致含量。
每克样品含氮克数×6、25×100=100g样品中蛋⽩质含量(g%) ⼆、蛋⽩质得基本组成单位——氨基酸蛋⽩质在酸、碱或蛋⽩酶得作⽤下,最终⽔解为游离氨基酸(amino acid),即蛋⽩质组成单体或构件分⼦。
存在于⾃然界中得氨基酸有300余种,但合成蛋⽩质得氨基酸仅20种(称编码氨基酸),最先发现得就是天门冬氨酸(1806年),最后鉴定得就是苏氨酸(1938年)。
(三)氨基酸得重要理化性质1.⼀般物理性质α-氨基酸为⽆⾊晶体,熔点⼀般在200 oC以上。
各种氨基酸在⽔中得溶解度差别很⼤(酪氨酸不溶于⽔)。
⼀般溶解于稀酸或稀碱,但不能溶解于有机溶剂,通常酒精能把氨基酸从其溶液中沉淀析出。
芳⾹族氨基酸(Tyr、Trp、Phe)有共轭双键,在近紫外区有光吸收能⼒,Tyr、Trp得吸收峰在280nm,Phe在265 nm。
由于⼤多数蛋⽩质含Tyr、Trp残基,所以测定蛋⽩质溶液280nm得光吸收值,就是分析溶液中蛋⽩质含量得快速简便得⽅法。
2.两性解离与等电点(isoelectric point, pI)氨基酸在⽔溶液或晶体状态时以两性离⼦得形式存在,既可作为酸(质⼦供体),⼜可作为碱(质⼦受体)起作⽤,就是两性电解质,其解离度与溶液得pH有关。
生物化学名词解释集锦第一章蛋白质1.两性离子(dipolarion)2.必需氨基酸(essential amino acid)3.等电点(isoelectric point,pI)4.稀有氨基酸(rare amino acid)5.非蛋白质氨基酸(nonprotein amino acid) 6.构型(configuration)7.蛋白质的一级结构(protein primary structure)8.构象(conformation)9.蛋白质的二级结构(protein secondary structure)10.结构域(domain)11.蛋白质的三级结构(protein tertiary structure)12.氢键(hydrogen bond)13.蛋白质的四级结构(protein quaternary structure)14.离子键(ionic bond)15.超二级结构(super-secondary structure) 16.疏水键(hydrophobic bond)17.范德华力( van der Waals force) 18.盐析(salting out)19.盐溶(salting in)20.蛋白质的变性(denaturation)21.蛋白质的复性(renaturation)22.蛋白质的沉淀作用(precipitation) 23.凝胶电泳(gel electrophoresis)24.层析(chromatography)第二章核酸1.单核苷酸(mononucleotide)2.磷酸二酯键(phosphodiester bonds)3.不对称比率(dissymmetry ratio)4.碱基互补规律(complementary base pairing)5.反密码子(anticodon)6.顺反子(cistron)7.核酸的变性与复性(denaturation、renaturation)8.退火(annealing)9.增色效应(hyper chromic effect)10.减色效应(hypo chromic effect)11.噬菌体(phage)12.发夹结构(hairpin structure)13.DNA 的熔解温度(melting temperature T m)14.分子杂交(molecular hybridization)15.环化核苷酸(cyclic nucleotide)第三章酶与辅酶1.米氏常数(K m 值)2.底物专一性(substrate specificity)3.辅基(prosthetic group)4.单体酶(monomeric enzyme)5.寡聚酶(oligomeric enzyme)6.多酶体系(multienzyme system)7.激活剂(activator)8.抑制剂(inhibitor inhibiton)9.变构酶(allosteric enzyme)10.同工酶(isozyme)11.诱导酶(induced enzyme)12.酶原(zymogen)13.酶的比活力(enzymatic compare energy)14.活性中心(active center)第四章生物氧化与氧化磷酸化1.生物氧化(biological oxidation)2.呼吸链(respiratory chain)3.氧化磷酸化(oxidative phosphorylation)4.磷氧比P/O(P/O)5.底物水平磷酸化(substrate level phosphorylation)6.能荷(energy charg第五章糖代谢1.糖异生(glycogenolysis)2.Q 酶(Q-enzyme)3.乳酸循环(lactate cycle)4.发酵(fermentation)5.变构调节(allosteric regulation)6.糖酵解途径(glycolytic pathway)7.糖的有氧氧化(aerobic oxidation)8.肝糖原分解(glycogenolysis)9.磷酸戊糖途径(pentose phosphate pathway) 10.D-酶(D-enzyme)11.糖核苷酸(sugar-nucleotide)第六章脂类代谢1.必需脂肪酸(essential fatty acid)2.脂肪酸的α-氧化(α- oxidation)3.脂肪酸的β-氧化(β- oxidation)4.脂肪酸的ω-氧化(ω- oxidation)5.乙醛酸循环(glyoxylate cycle)6.柠檬酸穿梭(citriate shuttle)7.乙酰CoA 羧化酶系(acetyl-CoA carnoxylase)8.脂肪酸合成酶系统(fatty acid synthase system)第八章含氮化合物代谢1.蛋白酶(Proteinase)2.肽酶(Peptidase)3.氮平衡(Nitrogen balance)4.生物固氮(Biological nitrogen fixation)5.硝酸还原作用(Nitrate reduction)6.氨的同化(Incorporation of ammonium ions into organic molecules)7.转氨作用(Transamination)8.尿素循环(Urea cycle)9.生糖氨基酸(Glucogenic amino acid)10.生酮氨基酸(Ketogenic amino acid)11.核酸酶(Nuclease)12.限制性核酸内切酶(Restriction endonuclease)13.氨基蝶呤(Aminopterin)14.一碳单位(One carbon unit)第九章核酸的生物合成1.半保留复制(semiconservative replication)2.不对称转录(asymmetric trancription)3.逆转录(reverse transcription)4.冈崎片段(Okazaki fragment)5.复制叉(replication fork)6.领头链(leading strand)7.随后链(lagging strand)8.有意义链(sense strand)9.光复活(photoreactivation)10.重组修复(recombination repair)11.内含子(intron)12.外显子(exon)13.基因载体(genonic vector)14.质粒(plasmid)第十一章代谢调节1.诱导酶(Inducible enzyme)2.标兵酶(Pacemaker enzyme)3.操纵子(Operon)4.衰减子(Attenuator)5.阻遏物(Repressor)6.辅阻遏物(Corepressor)7.降解物基因活化蛋白(Catabolic gene activator protein)8.腺苷酸环化酶(Adenylate cyclase)9.共价修饰(Covalent modification)10.级联系统(Cascade system)11.反馈抑制(Feedback inhibition)12.交叉调节(Cross regulation)13.前馈激活(Feedforward activation)14.钙调蛋白(Calmodulin)第十二章蛋白质的生物合成1.密码子(codon)2.反义密码子(synonymous codon) 3.反密码子(anticodon)4.变偶假说(wobble hypothesis)5.移码突变(frameshift mutant)6.氨基酸同功受体(isoacceptor)7.反义RNA(antisense RNA)8.信号肽(signal peptide)9.简并密码(degenerate code)10.核糖体(ribosome)11.多核糖体(poly some)12.氨酰基部位(aminoacyl site)13.肽酰基部位(peptidy site)14.肽基转移酶(peptidyl transferase) 15.氨酰- tRNA 合成酶(amino acy-tRNA synthetase)16.蛋白质折叠(protein folding)17.核蛋白体循环(polyribosome) 18.锌指(zine finger)19.亮氨酸拉链(leucine zipper)20.顺式作用元件(cis-acting element) 21.反式作用因子(trans-acting factor) 22.螺旋-环-螺旋(helix-loop-helix)第一章蛋白质1.两性离子:指在同一氨基酸分子上含有等量的正负两种电荷,又称兼性离子或偶极离子。
第二章糖类提要一、定义糖、单糖、寡糖、多糖、结合糖、呋喃糖、吡喃糖、糖苷、手性二、结构1.链式:Glc、Man、Gal、Fru、Rib、dRib2.环式:顺时针编号,D型末端羟甲基向下,α型半缩醛羟基与末端羟甲基在两侧。
3.构象:椅式稳定,β稳定,因其较大基团均为平键。
三、反应1.与酸:莫里斯试剂、西里万诺夫试剂。
2.与碱:弱碱互变,强碱分解。
3.氧化:三种产物。
4.还原:葡萄糖生成山梨醇。
5.酯化6.成苷:有α和β两种糖苷键。
7.成沙:可根据其形状与熔点鉴定糖。
四、衍生物氨基糖、糖醛酸、糖苷五、寡糖蔗糖、乳糖、麦芽糖和纤维二糖的结构六、多糖淀粉、糖原、纤维素的结构粘多糖、糖蛋白、蛋白多糖一般了解七、计算比旋计算,注意单位。
第一节概述一、糖的命名糖类是含多羟基的醛或酮类化合物,由碳氢氧三种元素组成的,其分子式通常以Cn(H2O)n 表示。
由于一些糖分子中氢和氧原子数之比往往是2:1,与水相同,过去误认为此类物质是碳与水的化合物,所以称为"碳水化合物"(Carbohydrate)。
实际上这一名称并不确切,如脱氧核糖、鼠李糖等糖类不符合通式,而甲醛、乙酸等虽符合这个通式但并不是糖。
只是"碳水化合物"沿用已久,一些较老的书仍采用。
我国将此类化合物统称为糖,而在英语中只将具有甜味的单糖和简单的寡糖称为糖(sugar)。
二、糖的分类根据分子的聚合度分,糖可分为单糖、寡糖、多糖。
也可分为:结合糖和衍生糖。
单糖是不能水解为更小分子的糖。
葡萄糖,果糖都是常见单糖。
根据羰基在分子中的位置,单糖可分为醛糖和酮糖。
根据碳原子数目,可分为丙糖,丁糖,戊糖,己糖和庚糖。
寡糖由2-20个单糖分子构成,其中以双糖最普遍。
寡糖和单糖都可溶于水,多数有甜味。
多糖由多个单糖(水解是产生20个以上单糖分子)聚合而成,又可分为同聚多糖和杂聚多糖。
同聚多糖由同一种单糖构成,杂聚多糖由两种以上单糖构成。
醛糖(aldose):一类单糖,该单糖中氧化数最高的C原子(指定为C-1)是一个醛基。
酮糖(ketose):一类单糖,该单糖中氧化数最高的C原子(指定为C-2)是一个酮基。
异头物(anomer):仅在氧化数最高的C原子(异头碳)上具有不同构形的糖分子的两种异构体。
异头碳(anomer carbon):环化单糖的氧化数最高的C原子,异头碳具有羰基的化学反应性。
变旋(mutarotation):吡喃糖,呋喃糖或糖苷伴随它们的α-和β-异构形式的平衡而发生的比旋度变化。
单糖(monosaccharide):由3个或更多碳原子组成的具有经验公式(CH2O)n的简糖。
糖苷(dlycoside):单糖半缩醛羟基与别一个分子的羟基,胺基或巯基缩合形成的含糖衍生物。
糖苷键(glycosidic bond):一个糖半缩醛羟基与另一个分子(例如醇、糖、嘌呤或嘧啶)的羟基、胺基或巯基之间缩合形成的缩醛或缩酮键,常见的糖醛键有O—糖苷键和N—糖苷键。
寡糖(oligoccharide):由2~20个单糖残基通过糖苷键连接形成的聚合物。
多糖(polysaccharide):20个以上的单糖通过糖苷键连接形成的聚合物。
多糖链可以是线形的或带有分支的。
还原糖(reducing sugar):羰基碳(异头碳)没有参与形成糖苷键,因此可被氧化充当还原剂的糖。
淀粉(starch):一类多糖,是葡萄糖残基的同聚物。
有两种形式的淀粉:一种是直链淀粉,是没有分支的,只是通过α-(1→4)糖苷键的葡萄糖残基的聚合物;另一类是支链淀粉,是含有分支的,α-(1→4)糖苷键连接的葡萄糖残基的聚合物,支链在分支处通过α-(1→6)糖苷键与主链相连。
糖原(glycogen): 是含有分支的α-(1→4)糖苷键的葡萄糖残基的同聚物,支链在分支点处通过α-(1→6)糖苷键与主链相连。
极限糊精(limit dexitrin):是指支链淀粉中带有支链的核心部位,该部分经支链淀粉酶水解作用,糖原磷酸化酶或淀粉磷酸化酶作用后仍然存在。
第十章DNA 的复制和修复DNA 半保留复制(semiconservative replication): DNA复制时双链解开,根据碱基互补原则,分别按照每条单链的核苷酸顺序合成新链,以组成新的DNA分子。
这样每个子代DNA分子中的一条链来自亲代DNA,另一条链是新合成的,这种复制方式称为半保留复制。
DNA 半不连续复制(semidiscotinuous replication): 新合成的两条DNA子链中,一条链是按5'→3'方向连续合成的,称为前导链;另一条链的合成是不连续的,先按5'→3'方向合成若干短片断(冈崎片断),再通过连接酶将这些短片段连在一起,构成第二条子链,称为滞后链,这种复制过程称半不连续复制。
复制子(replicon):指基因组上能独立进行复制的单位。
含有复制的起点,并可能含有复制的终点。
复制体(replisome):在DNA合成的生长点上,即复制叉上,分布着各种各样与复制有关的酶和蛋白质因子,它们构成的复合物称复制体。
冈崎片段(Okazaki fragment):新合成的两条DNA子链中,一条链是按5'→3'方向连续合成的,称为前导链;另一条链的合成是不连续的,先按5'→3'方向合成若干短片断(冈崎片断)端粒(telomere):真核生物线性染色体末端的特殊结构,由许多成串短的重复顺序组成,具有稳定染色体末端结构的功能。
端粒酶(telomerase):含有RNA链的逆转录酶,可以所含RNA为模板来合成DNA端粒结构。
错配修复(mismatch repair):复制后的DNA在短时间内GATC序列是半甲基化的,一旦发现错配碱基,包括错配碱基在内的未甲基化的新链可被切除,并以甲基化的链为模板进行修复合成。
光复活(photoreactivation repair):可见光激活光复活酶,其可以分解由于紫外线照射形成的嘧啶二聚体,恢复DNA的正常结构。
生物化学名词解释1 .氨基酸(am i no acid):是含有一个碱性氨基(-N H 2)和一个酸性羧基(-COOH)的有机化合物,氨基一般连在α -碳上。
氨基酸是蛋白质的构件分子2.必需氨基酸(essential am i no acid):指人(或其它脊椎动物)(赖氨酸,苏氨酸等)自己不能合成,需要从食物中获得的氨基酸。
3.非必需氨基酸(n onessential am i no aci d):指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。
4.等电点(pI,isoel ectric poi nt):使氨基酸处于兼性离子状态,在电场中不迁移(分子的静电荷为零)的 pH 值。
5.茚三酮反应(ninhydrin reacti on ):在加热条件下,氨基酸或肽与茚三酮反应生成紫色(与脯氨酸及羟脯氨酸反应生成黄色)化合物的反应。
6.层析(ch rom at og raphy) :按照在移动相和固定相(可以是气体或液体)之间的分配比例将混合成分分开的技术。
7.离子交换层析(ion-exc hange colum n):一种用离子交换树脂作支持剂的层析技术。
8.透析(dialysis):利用蛋白质分子不能通过半透膜的性质,使蛋白质和其他小分子物质如无机盐、单糖等分开的一种分离纯化技术。
9.凝胶过滤层析(gel filtration ch rom at og raphy, GPC):也叫做分子排阻层析/凝胶渗透层析。
一种利用带孔凝胶珠作基质,按照分子大小分离蛋白质或其它分子混合物的层析技术。
10.亲合层析(affinity chrom atog raph ):利用共价连接有特异配体的层析介质,分离蛋白质混合物中能特异结合配体的目的蛋白质或其它分子的层析技术。
11.高压液相层析(HPLC):使用颗粒极细的介质,在高压下分离蛋白质或其他分子混合物的层析技术。
12.凝胶电泳(gel elect roph oresis):以凝胶为介质,在电场作用下分离蛋白质或核酸的分离纯化技术。
13.SDS-聚丙烯酰氨凝胶电泳(SDS-PAGE):在去污剂十二烷基硫酸钠存在下的聚丙烯酰氨凝胶电泳。
SDS-PAGE 只是按照分子的大小,而不是根据分子所带的电荷大小分离的。
14.等电聚焦电泳(IEF):利用一种特殊的缓冲液(两性电解质)在聚丙烯酰氨凝胶制造一个 pH 梯度,电泳时,每种蛋白质迁移到它的等电点(pI)处,即梯度为某一 pH 时,就不再带有净的正或负电荷了。
1 5.双向电泳(tw o-dim ension al electroph orese):等电聚焦电泳和 SDS-PAGE 的组合,即先进行等电聚焦电泳(按照 pI)分离,然后再进行 SDS-PAGE(按照分子大小分离)。
经染色得到的电泳图是二维分布的蛋白质图。
1 6.Edm an 降解(Edm an deg radation ):从多肽链游离的 N 末端测定氨基酸残基的序列的过程。
N 末端氨基酸残基被苯异硫氰酸酯(PITC)修饰,然后从多肽链上切下修饰的残基,再经层析鉴定,余下的多肽链(少了一个残基)被回收再进行下一轮降解循环。
1 7.同源蛋白质(hom olog ous protein ):在不同生物体内行使相同或相似功能的蛋白质,例如血红蛋白。
1 8.构型(configu ration) :有机分子中各个原子特有的固定的空间排列。
这种排列不经过共价键的断裂和重新形成是不会改变的。
构型的改变往往使分子的光学活性发生变化。
1 9.构象(conform ation ) :由于单键旋转引起的组成原子的不同排列。
一种构象改变为另一种构象时,不要求共价键的断裂和重新形成。
构象改变不会改变分子的光学活性。
20.蛋白质一级结构(prim ary structure):指多肽链的氨基酸序列。
21 .蛋白质二级结构:蛋白质主链的折叠产生由氢键维系的有规则的构象。
常见的二级结构有α -螺旋、β -折叠片、β -转角和无规卷曲。
22.蛋白质三级结构(prot ein tertiary structure) :多肽链借助各种非共价键弯曲、折叠成具特定走向的紧密球状构象。
它包括一级结构中相距较远的肽段之间的几何相互关系和侧链在三维空间中彼此间的相互关系。
三级结构主要是靠氨基酸侧链之间的疏水相互作用、氢键、范德华力和盐键(离子键)维持的。
23.蛋白质四级结构(prot ein quatern ary structure) :寡聚蛋白质所有, eg:血红蛋白,寡聚蛋白质中各亚基之间在空间上的相互关系和结合方式。
24.α -螺旋(α -h eliv) :蛋白质中常见的一种二级结构,肽链主链绕假想的中心轴盘绕成螺旋状,一般都是右手螺旋结构,螺旋是靠链内氢键维持的。
每个氨基酸残基(第n 个)的羰基氧与多肽链C端方向的第4个残基(第n+4个)的酰胺氮形成氢键。
在典型的右手α-螺旋结构中,螺距为0.54nm,每一圈含有3.6个氨基酸残基,每个残基沿着螺旋的长轴上升0.15nm。
25.超二级结构(super-sec ondary structure) :在蛋白质中,特别是球蛋白中,经常可以看到由若干相邻的二级结构单元组合在一起,彼此相互作用,形成有规则的,种类不多的二级结构组合或二级结构串,在各种蛋白质中充当三级结构的构件。
分为αα ,βαβ ,ββ三种26.结构域(dom ain) :多肽链在二级结构或超二级结构的基础上形成三级结构的局部折叠区,它是相对独立的紧密球状实体。
27.疏水相互作用(hydroph obi c interaction ):水介质中球状蛋白质的折叠总是倾向于把疏水残基埋藏在分子的内部的现象。
28.蛋白质变性(denatu ration) :天然蛋白质受到某些物理因素如加热、紫外线照射、高温和表面张力等或化学因素如有机溶剂、脲、胍、酸、碱等的影响时,生物活性丧失,溶解度降低,不对称程度增高以及其他的物理化学常数发生改变,这种过程称蛋白质变性。
其实质是次级键被破坏,但一级结构仍完好。
29.蛋白质的三维结构:蛋白质分子所有原子和基团在三维空间结构的构象及走向。
30.肌红蛋白(m yoglobi n) :是由一条肽链和一个血红素辅基组成的结合蛋白,是肌肉内储存氧的蛋白质,它的氧饱和曲线为双曲线型。
31 复性(renat uration) :当变性因素除去后,变性的生物大分子恢复成具有生物活性的天然构象的现象。
32.波尔效应(B ohr effect ) :增加 CO2 浓度和降低 pH 都能提高血红蛋白亚基的协同效应,引起红细胞内血红蛋白氧亲和力下降,促进血红蛋白释放氧,反之,增加氧气的浓度,使血红蛋白释放 H+及 CO2,这种现象称波尔效应。
33.血红蛋白(hem ogl obin) : 是由含有血红素辅基的 4 个亚基组成的结合蛋白。
血红蛋白负责将氧由肺运输到外周组织,它的氧饱和曲线为 S 型。
34.别构效应(allosteric effect) :又称为变构效应,寡聚蛋白质一般具多个结合部位,结合在蛋白质分子的特定部位上的配体对该分子的其他部位所产生的影响。
35.酶(enzym e) :由活细胞产生的在细胞内、外一定条件下,都能起催化作用,具有极高的催化效率的高度专一性的生物大分子。
它使错综复杂的生化反应变得顺利和迅速。
36.全酶(holoenzym e) :脱辅酶与辅因子结合后形成的复合物。
37.活性部位(中心)(active energy) :酶中含有底物结合部位和参与催化底物转化为产物的氨基酸残基部分。
活性部位通常位于蛋白质的结构域或亚基之间的裂隙或是蛋白质表面的凹陷部位,通常都是由在三维空间上靠得很近的一些氨基酸残基组成。
38.酸-碱催化(acid-base cat alysis) :质子转移加速反应的催化作用。
39.共价催化(c ovalent catalysis):一个底物或底物的一部分与催化剂形成共价键,然后被转移给第二个底物。
许多酶催化的基团转移反应都是通过共价方式进行的。
40.靠近效应(proxim i ty effect):非酶促催化反应或酶促反应速度的增加是由于底物靠近活性部位,使得活性部位处反应剂有效浓度增大的结果,这将导致更频繁地形成过度态。
41寡聚蛋白质:两条或两条以上的具三级结构的多肽链组成的蛋白质。
42.米氏方程(Michaelis-Ment ent equation ) :表示一个酶促反应的起始速度(υ)与底物浓度([s])关系的速度方程:υ =υ m ax[s]/(Km +[s] )43.米氏常数(Mich aelis constant) :对于一个给定的反应,酶促反应的起始速度(υ 0)达到最大反应速度(υ m ax)一半时的底物浓度。
44.有氧氧化:葡萄糖在有氧条件下彻底氧化成 H 2O 和 CO2 并放出大量能量的过程。
45.双倒数作图(double-reciprocal plot) :又称为 Li new eaver_Burk 作图。
一个酶促反应的速度的倒数(1 /V)对底物浓度的倒数(1 /LSF)的作图。
x 和 y 轴上的截距分别代表米氏常数和最大反应速度的倒数。
46.竞争性抑制作用(com petitive inhibition ) :通过增加底物浓度可以逆转的一种酶促反应抑制类型。
竞争性抑制剂通常与正常的底物或配体竞争同一个蛋白质的结合部位。
这种抑制使 K m 增大而υ m ax 不变。
47.非竞争性抑制作用(non com petitive inhibition) : 抑制剂不仅与游离酶结合,也可以与酶-底物复合物结合的一种酶促反应抑制作用。
这种抑制使 Km 不变而υ m ax 变小。
48.反竞争性抑制作用(un com petitive in hibition) : 抑制剂只与酶-底物复合物结合而不与游离的酶结合的一种酶促反应抑制作用。
这种抑制使 Km 和υ m ax 都变小但υm ax/K m 不变。
49.酶原(zym og en) :通过有限蛋白水解,能够由无活性变成具有催化活性的酶前体。
50.调节酶(reg ulatory enzym e) :位于一个或多个代谢途径内的一个关键部位的酶,它的活性根据代谢的需要而增加或降低。
51别构酶(allosteric enzym e) :活性受结合在活性部位以外的部位的其它分子调节的酶。
52.抗体酶(abzym e) :又称催化性抗体,为在易变区被赋予了酶属性的免疫球蛋白。
53.同工酶(isoen zym e isozym e):催化相同的化学反应但其在蛋白质分子结构、理化性质和免疫性能等方面都存在着明显差异的一组酶。