高中化学系列课件_选修4-三大守恒_新人教版
- 格式:ppt
- 大小:1.01 MB
- 文档页数:27

人教版高中化学选修四化学平衡课件人教版高中化学选修四是一门专注于化学反应原理的课程,其中涉及到了化学平衡的相关知识。
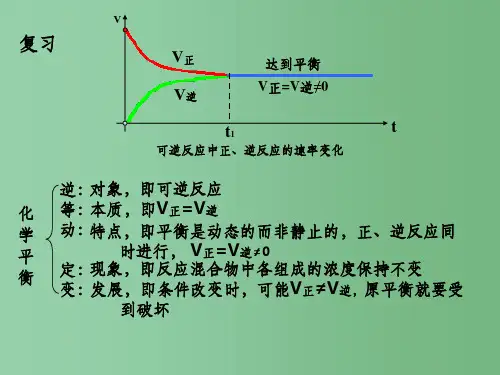
化学平衡是化学反应中一个重要的概念,它描述了在一定条件下,化学反应正反两个方向的速率相等,从而达到动态平衡的状态。
在人教版高中化学选修四中,化学平衡的知识点主要包括以下几个方面:1、化学平衡的原理化学平衡的原理是建立在化学反应速率理论基础上的。
在一定条件下,化学反应的速率取决于反应物质的浓度和温度。
当反应正向进行的速率和逆向进行的速率相等时,反应就达到了平衡状态。
这个状态下的反应物质浓度不再发生变化,反应也就停止了。
2、化学平衡常数化学平衡常数是描述化学平衡状态的一个重要参数,它反映了在一定温度下,反应物和生成物浓度比值的关系。
根据质量作用定律,化学平衡常数可以用来表示反应物和生成物之间浓度关系的变化对反应速率的影响。
3、影响化学平衡的因素温度、压力、浓度等因素都会影响化学平衡的状态。
其中,温度升高会使反应速率加快,平衡状态向正向进行;反之,温度降低会使反应速率减缓,平衡状态向逆向进行。
压力对平衡的影响则比较复杂,需要具体问题具体分析。
浓度变化也会影响平衡状态,增加反应物浓度会使平衡状态向正向进行,而增加生成物浓度则会使平衡状态向逆向进行。
4、化学平衡的应用化学平衡的理论应用广泛,不仅可以用于解释日常生活中的一些化学现象,还可以用于指导工业生产过程。
例如,在化工生产中,通过调节反应条件来控制化学平衡,可以提高产物的产率和纯度,降低副反应的发生,从而达到优化生产过程的目的。
总之,人教版高中化学选修四中的化学平衡知识点是化学学科中的一个重要理论,它不仅可以帮助我们更好地理解化学反应的本质,还可以指导我们解决一些实际问题。
在学习化学平衡时,我们需要深入理解其原理和相关概念,掌握计算方法和应用技巧,以便更好地应用于实践。


掌握三大守恒以及解决离子浓度大小比较一、溶液中电离、水解程度大小比较1.单一溶质的弱酸的酸式盐溶液:主电离的显酸性、主水解的显碱性,换一种说法来讲比较该酸根电离常数Ka与水解常数Kh的大小,谁大谁占主导地位。
例如Ka2(H2CO3)=5.61*10-11,Kh=2.22*10-8。
由于水解常数大于电离常数,故溶液呈碱性2.等浓度的一元弱酸及其正盐共存于溶液中时,溶液呈酸性还是碱性,取决于酸电离程度。
正常情况下来讲,若酸的酸性比碳酸强(即酸的K值大于碳酸的K1).则酸的电离程度大于对应的盐的水解程度。
反之则盐的水解程度大于对应酸的电离程度。
高中常见的电离程度比碳酸强的酸(即K比碳酸大的):CH3COOH、HSO3-、H2CO4,比碳酸弱的酸:HCIO、H2S、HCN.3.三大守恒:电荷守恒:(由于溶液呈电中性,所以n(正电荷)=n(负电荷))如NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO3-)+c(0H-);物料守恒:(两种原子间构成量的关系)如NaHC03溶液中n(Na):n(C)=1:1;推出:c(Na+)=c(HCO3-)+c(CO3-)+c(H2CO3);质子守恒:(溶液中H+得失守恒)1、H+转移的物质的量可用得到H+生成产物的物质的量和失去H+后生成物质的物质的量来表示,在NH4HCO3溶液中H3O+(可直接看做H+)、H2CO3为得到质子后的产物;NH3(即NH3·H2O)、OH-、CO32-为失去质子后的产物,故有以下关系:c(H+)+c(H2CO3)=c(NH3·H2O)+c(OH-)+c(CO3-)。
【当溶液中为单一溶质或两种溶液反应后为单一溶质可使用上述方法书写质子守恒,更加方便迅速】练习:写出Na2CO3溶液中的质子守恒:解析:分析可知溶液中能得氢离子的有CO32-,H2O;其中一个CO32-得到一个H+变成HCO3-(水解得到H+),一个CO32-得到两个H+变成H2CO3(分两步水解),H2O发生自偶电离生成H3O+;能失去氢离子的只有H2O失去氢离子生成OH-,,故质子守恒为:2c(H2CO3)+c(HCO3-)+c(H3O+)=c(OH-)。