金属与盐溶液反应专题
- 格式:doc
- 大小:471.50 KB
- 文档页数:11



中考复习微专题金属与盐溶液反应考点1 滤液、滤渣成分的判断例1.将铁粉和铜粉置于AgNO3和Zn(NO3)2混合溶液中,待反应完毕后,过滤得滤液和滤渣,下列说法错误的是()A.滤渣一定有Ag,可能有ZnB.滤液最少有两种金属阳离子C.滤渣中加酸,可能有气泡D.滤渣中加酸,可能无气泡例2.在CuSO4和FeSO4的混合溶液中加入一定量的镁粉,下列说法正确的是()A.若镁粉无剩余,且滤液为蓝色,则滤液中一定含有MgSO4、FeSO4B.若镁粉无剩余,且滤液为无色,则滤液中一定含有MgSO4、FeSO4C.若镁粉有剩余,则滤液中一定含有MgSO4,可能含有FeSO4,不含CuSO4D.若镁粉有剩余,则滤液中一定含有MgSO4、FeSO4,不含CuSO4考点2 滤液、滤渣质量的判断例3.向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒。
下图是反应过程中氯化亚铁的质量变化情况。
(1)B点时,反应的化学方程式是________。
(2)B点时,溶液中的溶质有________。
(3)C点与A点相比。
溶液质量增加的原因是________。
例4.某化学小组的同学将单质锌和单质银的混合物ag 加入到一定量的Cu(NO3)2溶液中,充分反应后过滤,得到一定温度下的滤液(不饱和)和滤渣,在滤渣中加入稀盐酸,有气泡冒出。
下列有关说法中,不合理的是()A.滤液一定是无色溶液B.滤液中一定含有Zn2+C.滤渣的质量一定大于agD.滤渣中一定含有单质银、单质铜和单质锌考点3 根据计算推断金属混合物的组成试卷第1页,共8页试卷第2页,共8页例5.向200gAgNO 3溶液中加入m 克Fe 和Cu 的混合粉末,搅拌,充分反应后过滤、洗涤、干燥得16.2固体。
向滤液中滴加NaCl 溶液,产生白色沉淀。
下列说法正确的是( )A .滤液的质量是183.8gB .混合粉末的质量范围是4.2g<m <4.8gC .固体中加入稀盐酸可能会有气体生成D .原AgNO 3溶液的溶质质量分数是12.75%巩固训练:1.向一定质量的AgNO 3、Cu (NO 3)2和Mg (NO 3)2的混合溶液中加入一定质量铁粉,充分反应后过滤,得滤液M 和滤渣N 。


专题04 金属与酸、金属与盐溶液的反应金属与酸反应的定量分析(2020湖南湘潭)1. 某固体由镁、锌、铁三种金属中的一种或几种组成,现取ag 固体于烧杯中,再加入足量稀盐酸,充分反应后,将所得溶液小心蒸干(不考虑操作过程中物质的损耗),得到(a+14.2)g 不含结晶水的固体,则a 的取值范围是A. 48≤a≤13.0B. 11.2<a≤13.0C. 3.6≤a≤11.2D. 4.8≤a<11.2 【答案】A【解析】【详解】镁与稀盐酸反应:22Mg+2HCl=MgCl +H ↑;锌与稀盐酸反应:22Zn+2HCl=ZnCl +H ↑;铁与稀盐酸反应:22Fe+2HCl=FeCl +H ↑,充分反应后,将所得溶液小心蒸干(不考虑操作过程中物质的损耗),得到(a+14.2)g 不含结晶水的固体,故最后得到的是盐酸盐混合物,根据质量守恒定律,化学反应前后,元素的质量不变,故该盐酸盐混合物中氯元素的质量为:(a+14.2)g-ag=14.2g ; 假设该金属固体全部是镁,设镁的质量为x22Mg +2HCl =MgCl +H 247114.2gx↑氯元素质量24=7114.2gx x =4.8g ; 假设该金属固体全部是锌,设锌的质量为y 22Zn +2HCl =ZnCl +H 657114.2gy ↑氯元素质量65=7114.2gy y =13g ; 假设该金属固体全部是铁,设铁的质量为z22Fe +2HCl =FeCl +H 567114.2gz氯元素质量56=7114.2gz z =11.2g ; 故a 的取值范围为:4.8≤a≤13.0。
故选A 。
(2020湖北武汉) 2. 有一包固体粉末X 可能含有锌、铁、氧化铜中的一种或几种。
为探究其成分,将mg 固体粉末加入到一定质量的稀盐酸中,充分反应后剩余ng 固体。
下列说法正确的是A. 若固体粉末X 含有铁,则m 可能小于nB. 若充分反应后溶液中含有四种阳离子,则剩余固体一定为纯净物C. 若充分反应后溶液中含有三种阳离子,则固体粉末X 一定由三种物质组成D. 剩余ng 固体可能由铁和氧化铜组成【答案】B【解析】【详解】A 、固体X 一旦被溶解,则固体质量一定会减小,即使氧化铜转化为单质铜,固体质量还是会减小,因此m 一定大于n ,选项错误;B 、若充分反应后溶液中含有四种阳离子,则溶液中的溶质是氯化锌、氯化亚铁、氯化铜和稀盐酸,则剩余的固体不能与稀盐酸反应,即该固体只能是铜,铜是一种纯净物,选项正确;C 、若溶液中含有三种阳离子,则溶液中一定含有氯化锌、氯化亚铁,可能含有盐酸、氯化铜中的一种,则滤渣中一定不含锌、铁,一定含有铜,可能含有氧化铜,固体粉末X 由三种或两种物质组成,选项错误;D 、将酸加入固体混合物中,盐酸先与氧化铜反应生成氯化铜和水,活动性比铜强的铁或锌能够与氯化铜反应生成铜,所以剩余固体中一定会有铜,选项错误,故选B 。

2023年中考化学专题训练——金属与盐溶液反应一、单选题1.波尔多液由硫酸铜、生石灰加水配制而成。
在烧杯中加入少量波尔多液,向其中加入过量稀盐酸,待溶液澄清后,再放入一个表面光亮的铁钉,下列实验现象或结论错误的是A.铁钉表面有红色固体析出B.铁钉表面有金属钙析出C.有无色气泡放出D.该实验说明铁的金属活动性比铜的强2.若将一定量的铁粉与硫酸铜溶液混合,充分反应后过滤,得到滤液和滤渣,下列判断正确的是A.硫酸铜中铜、硫、氧元素的质量比是1:2:1B.反应前后各元素的化合价都发生了改变C.若滤液呈蓝色,则加入的铁粉无剩余D.若向滤渣中加入稀盐酸无气泡,则滤液中一定有硫酸铜3.把一定量镁粉和锌粉的混合物放入硫酸铜溶液中,充分反应后过滤,往滤渣中加入稀盐酸有气泡产生。
下列情况不可能的是A.滤渣只含有Cu、Zn B.滤液中的溶质只含有ZnSO4 C.滤渣含有Cu、Zn、Mg D.滤液中的溶质只含有MgSO4 4.将m克Fe加入到含n克CuSO4的溶液中,下列图像能正确表示反应中固体质量变化的是A.B.C.D.5.烧杯中现有质量为11.2g 的铁,先逐滴向烧杯中加入一定量的Cu(NO 3)2溶液,充分反应后再逐滴加入AgNO 3溶液,剩余固体质量与所加溶液总质量的关系如图所示。
下列说法正确的是A .A 点剩余固体中Cu 的质量为m 1gB .AB 段发生的是Cu 和AgNO 3溶液的反应C .C 点溶液中的溶质为Fe(NO 3)2和AgNO 3D .m 2对应的数值为43.26.下列实验操作能达到实验目的的是 选项物质 目的 主要实验操作 A 蚕丝、羊毛线鉴别 取样,灼烧,闻气味 B Fe 粉和CuSO 4粉末分离 溶解、过滤、洗涤、烘干,蒸发结晶 C与NaOH 中和后,盐酸是否有剩余 检验 取样,滴加AgNO 3溶液,观察有无沉淀D Ca (NO 3)2溶液中混有CaCl 2 除杂 加入过量的Na 2CO 3溶液,搅拌、过滤、洗涤,将所得固体溶于适量稀硝酸A .AB .BC .CD .D7.现有X 、Y 、Z 三种金属,将X 和Y 分别放入盐酸中,X 溶解并产生H 2,Y 不反应,将Y 和Z 分别放入AgNO 3溶液中,一段时间后,在Y 表面有Ag析出,而Z 没有变化。

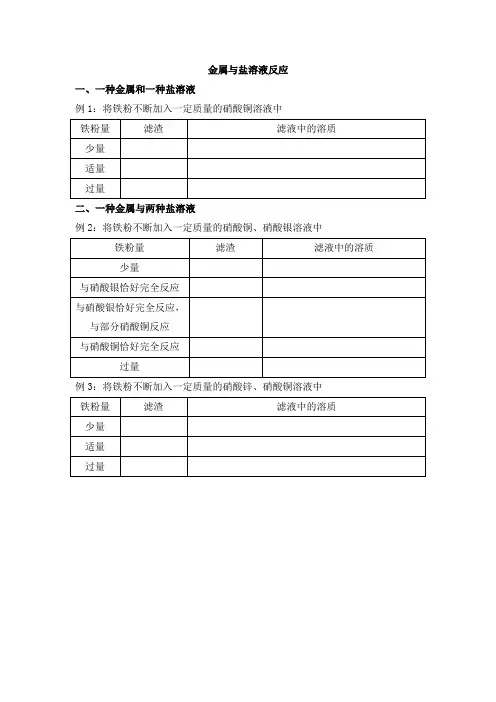
金属与盐溶液反应
一、一种金属和一种盐溶液
例1:将铁粉不断加入一定质量的硝酸铜溶液中
二、一种金属与两种盐溶液
例2:将铁粉不断加入一定质量的硝酸铜、硝酸银溶液中
例3:将铁粉不断加入一定质量的硝酸锌、硝酸铜溶液中
三、一种金属与三种盐溶液
例4:将铁粉不断加入一定质量的硝酸锌、硝酸铜和硝酸银溶液中
四、两种金属与一种盐溶液
例5:将一定量的铁粉和铜粉的混合物加入到硝酸银溶液中
例6:将一定量的锌粉和铜粉的混合物加入到硝酸亚铁溶液中。


解析金属与盐溶液间的置换反应专题复习?金属与盐溶液混合后能否发生置换反应的判断、分析是初中化学的难点,学生在解决此类问题时很容易出错,其实,解决这类题目是有规律的。
一、理解内涵金属活动性顺序的内容:我们已经知道:金属与盐溶液间的置换反应是较活泼的金属可置换较不活泼的金属;盐类必须溶于水,故只有可溶性盐的水溶液才会与金属反应。
根据金属活动性顺序,只有排在前面的金属才能把排在后面的金属从它的盐溶液中置换出来,也就是说:前面的金属单质与后面的金属离子不能共存于溶液中,常见反应有:Cu+2AgNO3=2Ag+Cu(NO3)2Fe+CuSO4=FeSO4+Cu值得注意的是极活泼的金属(钾、钠、钡、钙等)常温下与水剧烈反应,因此它们不能置换出盐溶液中的金属。
例如,金属钠与硫酸铜溶液反应时,钠首先与水反应生成氢气和氢氧化钠,然后氢氧化钠又与硫酸铜发生复分解反应:2Na+2H2O+CuSO4 = Na2SO4+Cu(OH)2↓+H2↑2NaOH + CuSO4 = Na2SO4+Cu(OH)2↓二、熟记条件金属与盐溶液发生置换反应的条件是:(1)金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2)特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3)盐必须溶于水;(4)铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时要用+2价的亚铁盐。
三、灵活运用在实际的应用中我们会发现在金属与盐溶液反应中,包括了这样2类反应.1.多种金属与一种盐溶液反应;2.一种金属与多种盐溶液反应。
但是无论其中哪一种反应,都遵循这样一条规律:金属活动性相差越大,它们间的置换反应越易发生。
1、一种金属与多种盐溶液反应例题1:在KNO3、Cu(NO3)2、AgNO3的混合溶液中,加入一定量的Zn粉,充分反应后过滤,得到滤液和滤渣,则滤液中一定有????????? ,一定没有????????? ,可能有????????? ;滤渣中一定有????????? ,一定没有????????? ,可能有????????? 。

(5)金属与盐溶液反应后滤液、滤渣成分的判断1.往4CuSO 溶液中加入一定量的铁粉,充分反应后,有金属析出:过滤,洗涤后往滤渣中加入一定量的稀硫酸,有气泡产生,则下列说法错误的是( ) A. 滤渣中一定有Cu 和Fe B. 滤液一定呈浅绿色 C. 滤液一定不含4CuSOD. 滤液一定含()243Fe SO2.向3AgNO 、32Cu(NO )的混合溶液中加入一定量铁粉,完全反应后过滤,不可能存在的现象是( )A.滤纸上有Ag ,滤液中有Ag +、2Cu +、2Fe +B.滤纸上有Ag 、Cu ,滤液中有2Fe +C.滤纸上有Ag 、Cu 、Fe ,滤液中有2Fe +D.滤纸上有Ag 、Cu 、Fe 滤液中有Ag +、2Cu +3.向3AgNO 和()32Cu NO 的混合溶液中缓慢连续加入g m 锌粉,析出固体的质量与加入锌粉的质量关系如图所示,下列分析不正确的是( )A.向N 点对应溶液中加入氯化钠溶液,有白色沉淀产生B.P 点对应的固体一定有Cu ,可能有AgC.Q 点对应的溶液为无色,此时溶液的溶质无()32Cu NO ,只有()32Zn NOD.加入g m 锌粉后,过滤,向滤渣中加入稀盐酸,有气泡产生4.某工厂废液中含有()32Fe NO 和()32Cu NO 两种溶质,取部分废液于烧杯中,加入一定量的锌粉,测定所得溶液中某溶质质量与时间的关系如图所示,下列说法不正确的是( )A.图中纵坐标表示溶液中()32Fe NO 的质量B.a 点时溶液中有3种溶质C.d 点时烧杯中有三种金属单质D.完全反应后过滤,向滤渣中加稀盐酸,一定有气泡产生5.向一定质量()332AgNO Cu NO 、的混合溶液中加入一定量的Zn ,溶液质量随反应时间变化的情况如图所示。
下列说法不正确的是( )A.ab 段反应的化学方程式为()332Zn 2AgNO Zn NO 2Ag ++B.bc 段反应的化学方程式为()()3322Zn Cu NO Zn NO Cu ++C.反应至b 点时将溶液过滤,所得滤液的成分是()()33322AgNO Cu NO Zn NO 、、D.反应至c 点时将溶液过滤,所得滤渣的成分是Ag 和Cu6.将一定质量的铁粉和铜粉的混合物加入硝酸银溶液中,充分反应后过滤得到滤渣和滤液。
金属与多种盐混合溶液的反应常考的三种情况1、一种活泼金属与两种不活泼金属的盐的混合溶液反应将一定量Fe粉加入到Cu(NO3)2、AgNO3的混合溶液中,从Fe粉的量逐渐增加考虑滤液中溶质滤渣 Fe+ 2AgNO3=Fe(NO3)2+2AgAgNO3、Fe(NO3)2、Cu(NO3)2 Ag 少×多√√√Fe(NO3)2、Cu(NO3)2 Ag 恰×恰×√√Fe+ Cu(NO3)2=Fe(NO3)2+CuFe(NO3)2、Cu(NO3)2 Ag、Cu 少×多√√√Fe(NO3)2、 Ag、Cu 恰×恰×√√Fe(NO3)2、 Ag、Cu、Fe 多√少×√√2、两种活泼金属的混合物与一种不活泼金属的盐溶液反应将一定量的铁粉和铜粉的混合物加入到硝酸银溶液中,充分反应后过滤,从AgNO3用量的逐渐增加考虑滤液中溶质滤渣 2AgNO3+ Fe=Fe(NO3)2+2AgFe(NO3)2 Fe、Ag、Cu 少×多√√√Fe(NO3)2 Ag、Cu 恰×恰×√√2AgNO3+ Cu = Ag+Cu(NO3)2Fe(NO3)2、Cu(NO3)2 Ag、Cu 少×多√√√Fe(NO3)2、Cu(NO3)2 Ag 恰×恰×√√Fe(NO3)2、Cu(NO3)2、AgNO3 Ag 多√少×√√3、一种活泼金属盐与一种不活泼金属的盐的混合溶液与活泼性居中的金属单质反应将一定量的铜粉加入到硝酸银和硝酸铝的混合溶液中滤液中溶质滤渣 2AgNO3+ Cu = Ag+Cu(NO3)2Al(NO3)3、Cu(NO3)2 Ag、Cu 少×多√√√Al(NO3)3、Cu(NO3)2 Ag 恰×恰×√√Al(NO3)3、Cu(NO3)2、AgNO3 Ag 多√少×√√练习:1(2014河西区)金属材料在生产、生活中有着广泛的应用.(1)如图1的下列生活用品,主要利用金属具有良好导热性的是______(填序号).(2)铁制品在空气中会发生锈蚀,其原因是铁与空气中的______共同作用的结果.为防止钢铁制品锈蚀,厨房中的铁锅和菜刀通常需做的防护是______(要求一种方法即可).(3)化学小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如图2所示实验方案.根据图2实验一判断出镁的金属活动性比铁强,依据的现象是______;根据图2实验二的现象应得出的结论是______.(4)茜茜同学向含有FeSO4和CuSO4两种溶质的溶液中,加入一定量镁粉,充分反应后过滤.滤液呈绿色,再向滤液中放入一枚洁净的铁钉,足够时间后取出,铁钉表面无变化.根据此现象作出了下列判断,你认为正确的是______(填序号).A.滤纸上一定有Fe,可能有Mg、CuB.滤纸上一定有Cu,可能有Fe,一定没有MgC.滤液中一定有FeSO4,可能有MgSO4、CuSO4D.滤液中一定有MgSO4、FeSO4,一定没有CuSO4.答案;(1)A、是利用了金属的导热性,B、是利用了金属的导电性,C、是利用了金属的延展性,D、是利用了金属的硬度大的性质,故填:A;(2)铁在与水和氧气并存时易生锈;防止铁锅和菜刀生锈可以保持铁制品表面的洁净干燥,故填:氧气和水,擦干;(3)铜不与稀硫酸反应,铁能与稀硫酸反应产生氢气但是速率慢,镁与稀硫酸反应产生氢气的速率大;将铜伸入硝酸汞溶液中,铜表面有银白色固体附着,说明铜的活动性比汞强,故填:镁与稀硫酸反应比铁快,铜的活动性比汞强;说明滤液中不含有硫酸铜;A、滤纸上不一定有铁,若是锌与硫酸铜恰好完全反应,则一定没有铁,由于锌不与硫酸镁反应,故一定没有镁,故A错误;反应,故一定没有镁,故B正确;C、放入铁钉没有变化,故滤液中一定不含有硫酸铜,故C错误;D、锌不与硫酸镁反应,故滤液中一定含有硫酸镁,滤液为浅绿色,故滤液中一定含有硫酸亚铁,放入铁钉没有变化,故滤液中一定不含有硫酸铜,故D正确;故选BD.2、(2013红桥区)Ag、Cu、Fe和Al是生产或生活中广泛使用的金属。
金属与盐溶液反应后滤液、滤渣成分的判断(5年5考)
一、优先反应原则(金属活动性顺序表中“远距离先发生”规律) (1)金属与混合盐溶液反应
例:将一定量的铁粉加入到硝酸铜和硝酸银的混合溶液中 先:
后:
(2)金属混合物和盐溶液的反应
例:将铁和铜的混合物加入到硝酸银溶液中 先:
后:
二、常考化学式:硝酸银: 硝酸铜: 硝酸亚铁: 硝酸镁:
硝酸锌: 硝酸铝:
三、常考化学方程式:
四、反应后滤液和滤渣的成分分析
(1)金属与混合盐溶液反应(以233)(NO Cu AgNO Fe 和与的混合溶液反应为例)
①Fe 能将3AgNO 反应一部分 :滤液:23233)(,)(,NO Cu NO Fe AgNO 滤渣:Ag ②Fe 能将3AgNO 恰好反应完 :滤液:2323)(,)(NO Cu NO Fe 滤渣:Ag
③Fe 能将3AgNO 反应完后,还能反应一部分23()NO Cu 滤液:2323)(,)(NO Cu NO Fe 滤渣:Cu Ag , ④Fe 能将3AgNO ,23()NO Cu 都恰好反应完 滤液:23)(NO Fe 滤渣:Cu Ag ,
⑤Fe 能将3AgNO ,23()NO Cu 都反应完后,还有剩余 滤液:23)(NO Fe 滤渣:Fe Cu Ag ,, (2)混合金属与盐溶液的反应(以Cu Fe AgNO 和与3的混合物反应为例)
①3AgNO 能将Fe 反应一部分 滤液:23)(NO Fe 滤渣:Cu Fe Ag ,, ②3AgNO 能将Fe 恰好反应完 滤液:23)(NO Fe 滤渣:Cu Ag ,
③3AgNO 能将Fe 反应完后,还能反应一部分Cu 滤液:2323)(,)(NO Cu NO Fe 滤渣:Cu Ag , ④3AgNO 能将Fe ,Cu 都恰好完全反应 滤液:2323)(,)(NO Cu NO Fe 滤渣:Ag
⑤3AgNO 能将Fe ,Cu 都完全反应后,还有剩余 滤液:23233)(,)(,NO Cu NO Fe AgNO 滤渣:Ag
五、总结:
1)滤渣中一定有最弱的金属
2)滤渣中有最强的金属,则所有金属都有(滤渣:有强必有弱) 3)滤液中一定含有最强金属的化合物溶液
4)滤液中有最弱金属的化合物溶液,则所有金属的化合物溶液都有(滤液:有弱必有强)
1.(2018·二模)向硝酸铜、硝酸银和硝酸铝的混合溶液中加入一定量的锌粉,充分反应后过滤,过滤后所得固体(已洗涤、干燥)的质量等于加入锌粉的质量。
(1)相关反应的化学方程式为______________________________(只写一个)。
(2)滤液中一定含有的溶质为________________(填化学式)。
(3)过滤所得固体物质中一定含有________。
2.(2019·改编题)向一定质量的FeCl2和CuCl2的混合溶液中,逐渐加入足量的锌粉。
下图是反应过程中氯化亚铁的质量变化情况。
(1)B点时,反应的化学方程式是________________________。
(2)C点时,溶液中的溶质有______________。
(3)C点与A点相比,溶液质量增加的原因是_____________________________
__________________________________________________________________
3.(2018·说明与检测)向含有AgNO3、Cu(NO3)2和Al(NO3)3的废液中加入一定量的锌粉,充分反应后过滤,得到滤液甲和固体乙。
(1)固体乙一定含有________。
(2)若反应后的滤液呈蓝色,则溶液中一定含有________________________。
(3)引起溶液质量减小的反应的化学方程式为____________________________。
4.(2018·说明与检测)向Zn(NO3)2、AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤。
请回答下列问题:
(1)写出加入一定量的铁粉后,一定发生的反应的化学方程式。
(2)向滤渣中加入盐酸,若无明显现象,则反应后的滤液中一定含有哪些金属离子?
5、(2017·)在一定质量Cu(NO3)2、AgNO3和Al(NO3)3的混合溶液中加入过量的Zn,充分反应后,过滤,可得到固体和溶液。
(1)请写出一个有关反应的化学方程式。
(2)向所得固体上滴加盐酸,能观察到什么现象?
(3)反应后所得溶液的质量与反应前溶液的质量相比,可能保持不变,为什么?
6、(2018·说明与检测)向一定量AgNO3和Fe(NO3)2的混合溶液中加入Zn,充分反应后,过滤,得到固体和滤液,所得滤液的质量与原混合物溶液的质量相等。
(1)请写出该过程中一定发生的反应的化学方程式。
(2)把所得固体放入一定量的硫酸铜溶液中,能观察到什么现象?
7、(2018·一模)某化学小组用一定量MgSO4和CuSO4的混合溶液进行了下图实验。
(1)若向固体乙上滴加稀盐酸时无气泡产生,则溶液甲中一定含有的溶质有
哪些(写化学式)?
(2)请写出一个有关反应的化学方程式。
(3)充分反应后,溶液甲的质量一定比原混合溶液的质量小,请解释原因。
8、(2017·二模)向一定量硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉的质量关系如下图。
请分析:
(1)a点时溶液中有哪有溶质?
(2)c点时过滤能得到哪些固体?
(3)写出bd段发生反应的化学方程式。
2016年:金属材料与人类的生产和生活密切相关.
(1)为了验证铝、铜、银三种金属的活动顺序,有下列四种方案,其中可行的是(填序号).
①将铝、银分别浸入到硫酸铜溶液中
②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中
④将铜分别浸入到硫酸铝、硝酸银溶液中
(2)在氧化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液,滤液中一定含有的溶质是(填化学式),向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是(填化学式).
【解答】解:(1)①铝与硫酸铜反应,可验证铝的活动性比铜强.银与硫酸铜不反应,可知银的活动性比铜弱,可验证铝、铜、银三种金属的活动性顺序.故①是可行的方案;
②银与硫酸铝、硫酸铜都不反应反应,可验证铝、铜的活动性比银强.与但不能验证铝、铜的活动性,不可验证铝、铜、银三种金属的活动性顺序,故②是不可行的方案;
③铜、银与硫酸铝都不反应反应,可验证铝的活动性比铜、银强.但不能验证铜、银的活动性,不可验证铝、铜、银三种金属的活动性顺序,故③是不可行的方案;
④铜与硫酸铝不反应,可知铜的活动性比铝弱;铜与硝酸银反应,可验证铜的活动性比银强,可验证铝、铜、银三种金属的活动性顺序,故④是可行的方案;
故选:①④;
(4)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,镁会首先与氯化铜反应生成氯化镁和铜,所以①滤液中一定含有的溶质是MgCl2;
②向滤液中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是Fe.
故答案为:(1)①④;(2)MgCl2;Fe.
2015年:
2014年:
2013年:
针对性训练:1
2
3.
4.
5.将一定量的铁粉投入到一定量的硝酸钾、硝酸镁、硝酸锌、硝酸铜和硝酸银的混合溶液中,充分反应后过滤:
(3)若向滤液中加入一定量的稀盐酸,有白色沉淀产生,则滤渣中一定有
参考答案
1.
2.
3.
4.
5.Ag、Fe、Cu
、、、
Ag
、、、
解:根据金属活动性顺序:钾K 钙Ca 钠Na 镁Mg 铝Al 锌Zn 铁Fe 锡Sn 铅铜Cu 汞Hg 银Ag 铂Pt 金Au,可以知道:钾镁锌铁铜银,则:铁与硝酸钾、硝酸镁、硝酸锌不反应,而反应后加稀盐酸生成气泡,该气泡为氢气,因为银铜不能与酸反应产生氢气,所以该金属只能是铁;而“加入一定量的稀盐酸,有白色沉淀产生”,考虑硝酸银是否反应,则:
(1)若向滤渣中加入一定量的稀盐酸,有气泡产生,说明铁过量,则硝酸铜和硝酸银与铁反应生成铜和银,故滤渣中一定有:Ag 、Fe、Cu.
(2)若向滤渣中加入一定量的稀盐酸,没有气泡产生,说明铁不过量
,硝酸铜和硝酸银是否全反应,无法判定,因
为铁与硝酸钾、硝酸镁、硝酸锌不反应,则滤液中一定有的金属阳离子是:、、、
(3)若向滤液中加入一定量的稀盐酸,有白色沉淀产生,说明硝酸银有剩余,则滤渣中一定有Ag;
(4)若向滤液中加入一定量的稀盐酸,没有白色沉淀产生,硝酸银全部反应了,而铁与硝酸钾、硝酸镁、硝酸锌不反应,而硝酸银是否全反应,无法判定,滤液中一定有的金属阳离子是、、、. 因此,本题正确答案是:(1)Ag、Fe、、、、;、、、.
12.(2019·改编题)碳酸亚铁(FeCO3)是生产补血剂的原料。
以下是某同学设计的利用铁矿烧渣(主要成分是Fe2O3、FeO和泥沙等)制取碳酸亚铁的实验流程图。
请回答下列问题:
(1)操作a中需要用到的玻璃仪器主要有烧杯、玻璃棒和________。
(2)滤液Ⅰ中含有的金属阳离子:Fe2+、________(填离子符号)。
(3)滤液Ⅰ中加入铁粉后可能发生的化学反应方程式:①__________________________________________
(4)“调节滤液Ⅱ的pH”的操作用________测定加入氨水后溶液的pH。
(5)加入碳酸铵得到碳酸亚铁的化学反应方程式为_____________________。