2020年高考化学图象专题聚焦攻略(三)电化学装置图
- 格式:pdf
- 大小:346.20 KB
- 文档页数:8




化学识图能力再提升一、电化学装置示意图1.金属的腐蚀与防护2.新型化学电源3.电解原理的应用陌生装置教材装置知识联系(2016·全国卷Ⅰ,11):三室式电渗析法处理含Na2SO4废水阳离子交换膜法电解饱和食盐水氯碱工业中,利用阳离子交换膜既能防止氯气与氢气混合爆炸,又能防止氯气与生成的NaOH反应,影响产品的纯度。
电渗析法是运用多种离子交换膜,使离子有选择性的定向移动,即可达到物质分离的目的二、坐标曲线图1.单曲线如:某溶液中存在:AsO3-3(aq)+I2(aq)+2OH-(aq)AsO3-4(aq)+2I-(aq)+H2O(l)。
溶液中c(AsO3-4)与反应时间(t)的关系如图所示。
2.对比曲线如:铁的浸出率结果如下图:(1)(2)(2017·全国卷Ⅰ,13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
3.多曲线(2017·全国卷Ⅱ,12)如:改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。
三、物质转化关系图1.熟悉教材中的工艺流程(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:分析过程废液加入过量铁粉过滤,滤液中的主要成分为FeCl2,滤渣为Cu和过量的铁,再加盐酸溶解过量的铁,得FeCl2溶液和单质铜,并将FeCl2合并后用Cl2氧化,实现了FeCl3再生回收利用。
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。
主要步骤如下:分析过程海水中首先加入生石灰沉淀Mg2+,过滤得到Mg(OH)2,将沉淀分离,加入盐酸溶解,变成氯化镁溶液,完成Mg2+的富集;再经过蒸发结晶、过滤得到氯化镁晶体,在HCl 气流中脱水干燥得到无水氯化镁;最后电解熔融的无水氯化镁制得金属镁和氯气。
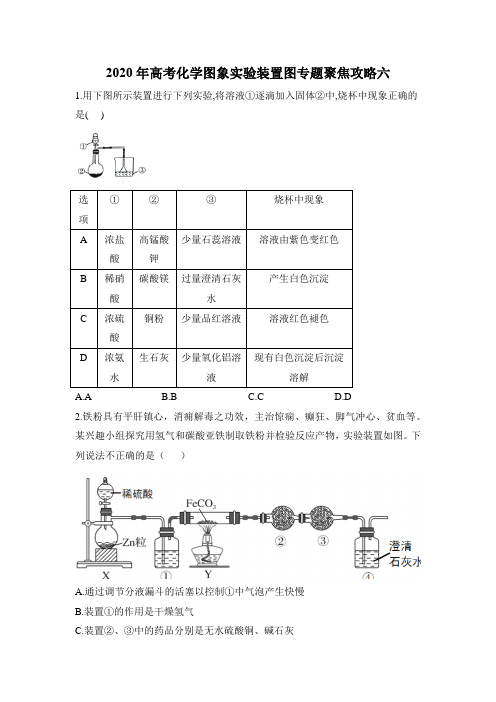
2020年高考化学图象实验装置图专题聚焦攻略六1.用下图所示装置进行下列实验,将溶液①逐滴加入固体②中,烧杯中现象正确的是( )A.AB.BC.CD.D2.铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。
某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。
下列说法不正确的是()A.通过调节分液漏斗的活塞以控制①中气泡产生快慢B.装置①的作用是干燥氢气C.装置②、③中的药品分别是无水硫酸铜、碱石灰D.加热装置Y 前,应先让X 反应一段时间,排除装置中的空气3.3BCl 常用作半导体硅的掺杂源或有机合成催化剂,若选择下图所示装置(装置可重复使用),以化合反应的方法制备3BCl (已知3BCl 的熔点为-107.3℃,沸点为12.5℃;遇水剧烈反应生成盐酸和硼酸)。
下列说法错误的是( )A.装置A 用于制备2Cl ,固体反应物换成4KMnO ,则不需要加热B.装置D 用于冷却产物3BCl ,装置E 用于防止空气中的水进入前面装置引起副反应C.仪器的连接顺序为A C F B D E →→→→→D.硼酸(33H BO )的钠盐化学式为[]4Na B(OH),硼酸是三元酸4.某实验小组将2SO 通入2Na S 和23Na SO 的混合溶液中制备硫代硫酸钠(223Na S O )。
其装置如图所示(省略夹持装置),下列说法错误的是( )A.装置②的作用之一是观察2SO 的生成速率,其中的液体可以是饱和 3NaHSO 溶液B.为提高产品纯度,使烧瓶中2Na S 和2Na SO 、恰好完全反应,则()()223Na S 1Na SO 2n n =C.装置④的作用是吸收尾气,同时防止倒D.装置①也可用于高锰酸钾与浓盐酸反应制备氯气5.某化学研究小组利用下图实验装置,制备氢化钙(2CaH ),氢化钙遇水剧烈反应。
下列说法不正确的是( )A .酸R 可以是稀盐酸或稀硫酸B .装置b 和装置d 中盛装的都是浓硫酸C .实验开始时,应该先打开活塞K ,一段时间后再点燃酒精灯D .e 装置中集气瓶中的气体可使带火星的木条复燃6.氮化钡(Ba 3N 2)是一种重要的化学试剂。

(1)结合新型化学电源,考查原电池和电解池原理。
(2)考查电池正负极的判断,以及电极方程式的书写。
(3)考查电子、电流的移动方向,能量转换类型。
(4)考查电解液离子浓度变化以及电子守恒计算。
考点一原电池工作原理及应用1.原电池的工作原理2.原电池正、负极的判断3.把握解答可充电电池问题的一般思路4.掌握解答新型化学电源问题的两个关键(1)电极反应式的书写(以甲醇、O2燃料电池为例)酸性介质,如稀H 2SO 4负极CH 3OH -6e -+H 2O===CO 2↑+6H+正极32O 2+6e -+6H +===3H 2O 碱性介质,如KOH 溶液负极CH 3OH -6e -+8OH -===CO 2-3+6H 2O正极32O 2+6e -+3H 2O===6OH -熔融盐介质,如熔融K 2CO 3负极CH 3OH -6e -+3CO 2-3===4CO 2↑+2H 2O正极32O 2+6e -+3CO 2===3CO 2-3高温下能传导O2-的固体作电解质负极CH 3OH -6e -+3O 2-===CO 2↑+2H 2O正极32O 2+6e -===3O 2-(2)解答新型化学电源问题四步骤1.中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如图:下列说法正确的是()A .电极Ⅰ为阴极,其反应为O 2+4H ++4e -===2H 2OB .聚丙烯半透膜允许阳离子从右往左通过C .如果电极Ⅱ为活性镁铝合金,则负极区会逸出大量气体D .当负极质量减少5.4g 时,正极消耗3.36L 气体解析:选CA 项,电极Ⅰ为正极,碱性条件下电极反应为O 2+2H 2O +4e -===4OH -,错误;B 项,由题意,为了便于回收铝才设置聚丙烯半透膜,故其作用是阻止阳离子通过,错误;C 项,如果电极Ⅱ为活性镁铝合金,镁铝形成很多细小的原电池,镁失去电子,铝上氢离子得到电子,因此在负极区会逸出大量气体,正确;D 项,不明确是否为标准状况,无法计算正极消耗气体的体积,错误。
2020年高考一轮复习题型突破有“断点”的图像分析速率图像中改变的条件的方法速率图像中有一个速率出现连续性,则改变的条件一定是浓度;对于一个反应前后气体体积发生变化的反应来说,如果正、逆反应速率变化程度相等,改变的条件一定是催化剂;对于一个反应前后气体体积不变的反应来说,如果正、逆反应速率变化程度相等,改变的条件可能是压强,也可能是催化剂。
若“断点”后的速率大,则可能是升高温度或增大压强,再利用平衡移动方向作出具体的判断。
1.速率—压强(或温度)图像曲线的意义是外界条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度。
如图7-27-5中交点A是平衡状态,压强增大,正反应速率增大得快,平衡移动。
规律小结方法技巧2.转化率(或百分含量)—时间—温度(或压强)图像已知不同温度或压强下,反应物的转化率α(或百分含量)与时间的关系曲线,推断温度的高低及反应的热效应或压强的大小及气体物质间的化学计量数的关系。
[以a A(g)+b B(g)c C(g)中反应物的转化率αA为例说明]正确掌握图像中反应规律的判断方法①图甲中,T2>T1,升高温度,αA降低,平衡逆向移动,正反应为反应。
②图乙中,p1>p2,增大压强,αA升高,平衡正向移动,则正反应为反应。
③图丙中,a表示使用了或(气体分子数反应前后相等的可逆反应)。
注意:若纵坐标表示A的百分含量,则甲中正反应为吸热反应,乙中正反应为气体体积增大的反应。
3.恒温线(或恒压线)图像已知不同温度下的转化率-压强图像或不同压强下的转化率-温度图像,推断反应的热效应或反应前后气体物质间化学计量数的关系。
[以反应A(g)+B(g)C(g)中反应物的转化率αA为例说明]解答这类图像题时应注意以下两点:(1)“定一议一”原则:可通过分析相同温度下不同压强时反应物A的转化率大小来判断平衡移动的方向,从而确定反应方程式中反应物与产物气体物质间的化学计量数的大小关系。