完整初中必记的知识点
- 格式:doc
- 大小:76.00 KB
- 文档页数:9

一、文言文知识点1.句读文言文句子结构通常是主谓宾的结构,读文言文句子时要注意短语和修饰词的读法。
2.字义文言文字义比现代汉语更加广泛,要注意体会上下文的意境,理解字义的多义性。
3.成语文言文中使用了大量的成语和常用词汇,要掌握其意义和用法。
4.修辞手法文言文中常用到的修辞手法有比喻、夸张、反衬、对偶等,要学会辨认和提炼。
二、古诗文知识点1.格律掌握古诗文的格律特点,如五言、七言等。
2.修辞手法古诗文中常用到的修辞手法有对仗、描写、夸张、比喻等,要学会通过修辞手法来体现作品的韵味和艺术效果。
3.意境古诗文常借景抒情,掌握作品的意境和情感表达。
4.人物塑造通过对人物形象的描写,体现人物的特点和情感。
三、现代汉语知识点1.词语辨析掌握汉字的词义和用法,了解词语辨析的规则。
2.语法掌握完整的句子结构,如主谓宾、主谓表等,以及常见的语法现象。
3.修辞手法掌握修辞手法的使用,如比喻、拟人、夸张等。
4.议论文写作掌握论点的提出、论证和结论的表达方式。
四、作文知识点1.段落写作掌握段落的结构和连贯的方法,尽量做到首尾呼应、衔接自然。
2.修辞手法作文中常用的修辞手法有排比、描绘、引用等,要学会运用修辞手法来增强文章的表现力。
3.结构安排作文的结构安排要合理、有层次,要注意开篇引起读者的兴趣,以及总结部分的归纳和总结。
4.语言运用作文中要注意语言的准确性和规范性。
五、阅读理解知识点1.文章类型掌握不同类型文章的阅读方法,如记叙文、说明文、议论文等,要善于抓住文章的中心思想。
2.提问方式掌握常见的提问方式,如主旨大意、推理判断、观点态度等。
3.信息阅读时要善于从文章中信息,理清信息之间的逻辑关系。
4.解题技巧掌握解题技巧,如排除法、归纳法等,提高解题效率。
六、写作知识点1.主题思考写作时要明确主题思考,围绕主题展开,并进行思维的逻辑顺序。
2.逻辑结构写作时要注重逻辑结构的构建,进行层层展开,合理安排段落和句子的顺序。

初三中考语文重要必背知识点归纳(最新)整理的一些初三中考语文重要必背知识点归纳,欢迎阅读参考。
初中语文中考必备知识点总结【知识点储备】一、表达方式:记叙、描写、抒情、说明、议论二、表现手法:象征、对比、烘托、设置悬念、前后呼应、扬抑、托物言志、借物抒情、联想、想象、衬托(正衬、反衬) 三、修辞手法:比喻、拟人、夸张、排比、对偶、设问、反问、反复、四、记叙文六要素:时间、地点、人物、事情的起因、经过、结果五、记叙顺序:顺叙、倒叙、插叙六、描写角度:正面描写、侧面描写七、描写人物的方法:语言、动作、神态、心理、外貌 (肖像)八、描写景物的角度:视觉、听觉、味觉、触觉九、描写景物的方法:动静结合(以动写静)、概括与具体相结合、由远到近(或由近到远) 十、描写(或抒情)方式:正面(又叫直接)、反面(又叫间接) 十一、说明顺序:时间顺序、空间顺序、逻辑顺序十二、说明方法:举例子、列数字、打比方、作比较、下定义、分类别、作诠释、摹状貌、引用十三、小说情节四部分:开端、发展、高潮、结局十四、小说三要素:人物、情节、环境十五、环境描写分为:自然环境、社会环境 ,十六、议论文三要素:论点、论据、论证十七、论据分类为:事实论据、道理论据十八、论证方法:举例论证(例证法)、道理论证(引证法)、对比论证、比喻论证(喻证法)【答题技巧】一、某句话在文中的作用:1、文首:开篇点题;渲染气氛(记叙文、小说),埋下伏笔(记叙文、小说),设置悬念(小说作铺垫;总领下文); 2、文中:承上启下;总领下文;总结上文; 3、文末:点明中心(记叙文、小说);深化主题(记叙文、小说);照应开头 (议论文、记叙文) 二、修辞手法的作用:1、比喻、拟人:生动形象; 答题格式:生动形象地写出了+对象+特性。
2、排比:有气势、加强语气、一气呵成等; 答题格式:强调了+对象+特性 3、设问:引起读者注意和思考; 答题格式:引起读者对+对象+特性的注意和思考反问:强调,加强语气等; 4、对比:强调了……突出了……5、反复:强调了……加强语气 6、夸张--为突出某一事物或强调某一感受。

初中数学知识点初中数学知识点总结归纳(完整版)初中数学知识点1一、数与式易错点1:有理数、无理数以及实数的有关概念理解错误;相反数、倒数、绝对值的意义概念混淆,以及绝对值与数的分类。
每年选择必考。
易错点2:实数的运算,要掌握好与实数有关的概念、性质,灵活地运用各种运算律,关键是把好符号关;在较复杂的运算中,不注意运算顺序或者不合理使用运算律,从而使运算出现错误。
易错点3:平方根、算术平方根、立方根的区别。
填空题必考。
易错点4:求分式值为零时,易忽略分母不能为零。
易错点5:分式运算时要注意运算法则和符号的变化。
当分式的分子、分母是多项式时要先因式分解,因式分解要分解到不能再分解为止。
注意计算方法,不能去分母,把分式化为最简分式。
填空题必考。
易错点6:非负数的性质:几个非负数的和为0,每个式子都为0;整体代入法;完全平方式。
易错点7:计算第一题必考。
五个基本数的计算:0指数,三角函数,绝对值,负指数,二次根式的化简。
易错点8:科学记数法。
精确度,有效数字。
易错点9:代入求值要使式子有意义。
各种数式的计算方法要掌握,一定要注意计算顺序。
二、方程(组)与不等式(组)易错点1:各种方程(组)的解法要熟练掌握,方程(组)无解的意义是找不到等式成立的条件。
易错点2:运用等式性质时,两边同除以一个数必须要注意不能为0的情况,还要关注解方程与方程组的基本思想。
(消元降次)主要陷阱是消除了一个带未知数的公因式要回头检验!易错点3:运用不等式的性质3时,容易忘记改不变号的方向而导致结果出错。
易错点4:关于一元二次方程的取值范围的题目,易忽视二次项系数不为0导致出错。
易错点5:关于一元一次不等式组有解无解的条件,易忽视相等的情况。
易错点6:解分式方程时首要步骤是去分母,易忘记根检验,导致运算结果出错。
易错点7:不等式(组)的解的问题要先确定解集,确定解集的方法运用数轴。
易错点8:利用函数图象求不等式的解集和方程的解。
三、函数易错点1:各个待定系数表示的意义。
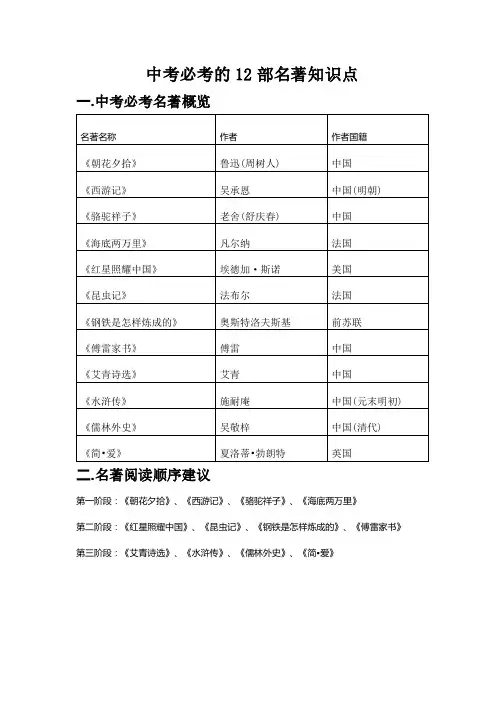
中考必考的12部名著知识点一.中考必考名著概览名著名称 作者 作者国籍《朝花夕拾》 鲁迅(周树人) 中国《西游记》 吴承恩 中国(明朝) 《骆驼祥子》 老舍(舒庆春) 中国《海底两万里》 凡尔纳 法国《红星照耀中国》 埃德加·斯诺 美国《昆虫记》 法布尔 法国《钢铁是怎样炼成的》 奥斯特洛夫斯基 前苏联《傅雷家书》 傅雷 中国《艾青诗选》 艾青 中国《水浒传》 施耐庵 中国(元末明初) 《儒林外史》 吴敬梓 中国(清代)《简•爱》 夏洛蒂•勃朗特 英国二.名著阅读顺序建议第一阶段:《朝花夕拾》、《西游记》、《骆驼祥子》、《海底两万里》第二阶段:《红星照耀中国》、《昆虫记》、《钢铁是怎样炼成的》、《傅雷家书》 第三阶段:《艾青诗选》、《水浒传》、《儒林外史》、《简•爱》三.名著知识点解析1.《朝花夕拾》【文学常识】作者是鲁迅,原名周树人,字豫才,浙江绍兴人,我国现代伟大的文学家、思想家、革命家小说集:《呐喊》、《彷徨》,散文集:《朝花夕拾》(原名《旧事重提》,散文诗集:《野草》,中国历史上第一部白话文小说:《狂人日记》,小说代表作:《孔乙己》,《朝花夕拾》是鲁迅回忆童年、少年和青年时期不同生活经历与体验的散文集。
【篇目介绍】1.《阿长与山海经》:表达了对阿长的真诚怀念。
2.《藤野先生》:表达了对藤野先生的深切怀念。
3.《范爱农》:表达了对旧民主革命的失望和对这位真正倔强的爱国者的同情和悼念。
4.《从百草园到三味书屋》:揭示儿童的生活趣味与束缚儿童天性的封建私塾教育的尖锐矛盾,表达了应让儿童健康活泼成长的合理要求。
5.《琐记》:主要描写了作者离开绍兴去南京求学的过程,批评了洋务派办学的乌烟瘴气,表现了作者探求真理的强烈愿望。
6.《五猖会》:批判了封建教育对儿童天性的压制和摧残。
(迎神赛会前在观看被父亲强迫背诵《鉴略》7.《狗猫鼠》:猫:尖锐又形象地讽刺生活中与猫相似的“正人君子”,嘲讽他们散布流言。

《初中数学知识点记忆口诀》1、有理数的加法运算:同号相加一边倒;异号相加“大”减“小”,符号跟着大的跑【“大”减“小”是指绝对值的大小】。
绝对值相等“零”正好。
2、合并同类项:合并同类项,法则不能忘,只求系数和,字母、指数不变样。
3、去括号、添括号法则:去括号和添括号,关键看符号,括号前面是正号,去、添括号不变号;括号前面是负号,去、添括号都变号。
4、一元一次方程:已知未知要分离,分离方法就是移,加减移项要变号,乘除移了要颠倒。
5、恒等变换:两个数字来相减,互换位置最常见,正负只看其指数,奇数变号偶不变。
= ;6、平方差公式:平方差公式有两项,符号相反莫要忘;首加尾乘首减尾,莫与完全平方相混淆。
7、完全平方公式:完全平方有三项,首尾符号是同乡;首平方、尾平方,首尾二倍放中央;首±尾括号带平方,尾项符号随中央。
8、因式分解:一提(公因式)、二套(公式)、三分组。
细看几项不离谱:两项只用平方差;三项十字相乘法、方法熟练不马虎;四项仔细看清楚,若有三个平方数(项),就用一三来分组,否则二二去分组;五项、六项更多项,二三、三三试分组;以上若都行不通,拆项、添项合理用。
9、“代入”口决:挖去字母换上数(式),数字、字母都保留;换上分数或负数,给它带上小括弧,原括弧内出(现)括弧,逐级向下变括弧(小中大)10、单项式运算:加、减、乘、除、乘(开)方,三级运算分得清,系数进行同级(运)算,指数运算降级(进)行。
11、一元一次不等式解题的一般步骤:去分母、去括号,移项时候要变号,同类项、合并好,再把系数来除掉,两边除(以)负数时,不等号改向莫忘掉。
12、一元一次不等式组的解集:大大取较大;小小取较小;小大、大小取中间;大小,小大无处找。
13、一元二次不等式、一元一次绝对值不等式的解集:大(鱼)于(吃)取两边,小(鱼)于(吃)取中间。
14、分式混合运算法则:分式四则混合算,莫忘顺序乘、除、加、减;乘除同级运算,除法符号须变(乘);乘法进行化简,因式分解需在先,分子分母相约分,然后再行运算;加减分母需相同,异母运算是关键;找出最简公分母,通分计算不算难;变号必须有两处,结果要求化最简。

初中生物必记知识点1.细胞理论:所有生物都是由细胞组成的,细胞是生物体的基本单位。
细胞分为原核细胞和真核细胞,真核细胞有明显的核膜和细胞器。
2.细胞器的功能:核负责储存遗传信息,线粒体负责产生细胞能量,内质网负责蛋白质的合成和包装等。
3.遗传:遗传信息以基因的形式存储在DNA中,遗传物质通过黏合在一起的染色体传递给后代。
4.遗传的方式:主要有性繁殖和无性繁殖两种方式。
有性繁殖通过配子的结合产生后代,无性繁殖则是通过一种个体的繁殖方式。
5.组织与器官:细胞通过特定的方式组织在一起,形成组织。
组织的结合和功能相似的细胞形成了器官。
6.呼吸系统:负责将氧气吸入体内,将二氧化碳排出体外。
主要有气管、支气管和肺等组成。
7.消化系统:将食物分解为小分子物质,以方便被细胞吸收利用。
主要包括口腔、食管、胃和肠等器官。
8.循环系统:通过心脏泵动,将血液送往全身各个部位,并将废物排出体外。
主要由心脏、血管和血液组成。
9.神经系统:负责接收和传递各种信息,以调节和协调体内的各种功能。
主要由神经元和神经纤维组成。
10.生物的分类:生物按照其形态、结构和功能的相似性进行分类。
分类有层级性,从大到小依次为界、门、纲、目、科、属和种。
11.生态系统:由生物群落和非生物环境组成的综合体。
包括气候、土壤、水域、植被和动物等成分。
12.环境保护:保护生物多样性和维护生态平衡,并促进可持续发展。
包括保护自然景观、限制环境污染和合理利用资源等。
13.遗传变异:生物种群中存在基因的突变和基因再组合,导致个体间的遗传差异,进而推动物种的进化。
14.生物多样性:指地球上各种生物的存在种类丰富性和基因的多样性。
物种多样性、生境多样性和基因多样性是生物多样性的重要组成部分。
15.自然选择:由于环境压力和资源竞争的存在,对适应环境的个体有利的基因逐渐在种群中积累,从而改变物种的表征和特征。
16.光合作用:植物利用光能将二氧化碳和水合成为有机物质,并释放出氧气。

第一章 有理数考点一、实数的概念及分类 (3分)1、实数的分类正有理数有理数 零 有限小数和无限循环小数实数 负有理数正无理数无理数 无限不循环小数负无理数2、无理数:32,7,3π+8,sin60o 。
第二章 整式的加减考点一、整式的有关概念 (3分)1、单项式只含有数字与字母的积的代数式叫做单项式。
注意:单项式是由系数、字母、字母的指数构成的,其中系数不能用带分数表示,如b a 2314-,这种表示就是错误的,应写成b a 2313-。
一个单项式中,所有字母的指数的和叫做这个单项式的次数。
如c b a 235-是6次单项式。
考点二、多项式 (11分)1、多项式几个单项式的和叫做多项式。
其中每个单项式叫做这个多项式的项。
多项式中不含字母的项叫做常数项。
多项式中次数最高的项的次数,叫做这个多项式的次数。
2、同类项所有字母相同,并且相同字母的指数也分别相同的项叫做同类项。
几个常数项也是同类项。
第三章 一元一次方程考点一、一元一次方程的概念 (6分)1、一元一次方程只含有一个未知数,并且未知数的最高次数是1的整式方程叫做一元一次方程,其中方程)为未知数,(0a x 0≠=+b ax 叫做一元一次方程的标准形式,a 是未知数x 的系数,b 是常数项。
第四章 图形的初步认识考点一、直线、射线和线段 (3分)1、点和直线的位置关系有线面两种:①点在直线上,或者说直线经过这个点。
②点在直线外,或者说直线不经过这个点。
2、线段的性质(1)线段公理:所有连接两点的线中,线段最短。
也可简单说成:两点之间线段最短。
(2)连接两点的线段的长度,叫做这两点的距离。
(3)线段的中点到两端点的距离相等。
(4)线段的大小关系和它们的长度的大小关系是一致的。
3、线段垂直平分线的性质定理及逆定理垂直于一条线段并且平分这条线段的直线是这条线段的垂直平分线。
线段垂直平分线的性质定理:线段垂直平分线上的点和这条线段两个端点的距离相等。

超详细的初中化学必背知识点初中化学必背知识点1.分子是保持化学性质的最小微粒。
原子是化学变化中的最小微粒。
2.元素是具有相同核电荷数(即质子数)的同一类原子的总称。
3.分子和原子的主要区别是在化学反应中,分子可分,原子不可分。
4.元素的化学性质主要决定于原子的最外层电子数。
5.在原子中,质子数 = 核电荷数 = 核外电子数。
6.相对原子质量 = 质子数 + 中子数7.镁离子和镁原子具有相同的质子数或核电荷数。
8.地壳中含量最多的元素是氧元素。
最多的金属元素是铝元素。
9.决定元素的种类是质子数或核电荷数。
10.空气是由几种单质和几种化合物组成的混合物。
11.石油、煤、天然气都是混合物。
12.溶液都是混合物。
例如:稀硫酸、食盐水、石灰水、盐酸等。
13.氧化物是由两种元素组成的,其中一种是氧元素的化合物。
14.化学变化的本质特征是有新物质生成。
15.燃烧、铁生锈、食物变质等都是化学变化。
初中化学教学计划一、学生状况本期我所任教的初三两个班级中,十班学生相对基础较好一些,学生的学习已经形成了良好的习惯,班级学风较为浓厚,大多数学生都有很强的上进心和学习积极性,有极强的求知欲,这就为本期的教学提供了较好的教学素材,也对老师的教学工作提出较高的要求;但相对来说,三班的学生基础相对薄弱,大多是没有养成良好的学习兴趣,自觉性比较差,或者家庭社会因素等,而导致这些学生对学习产生了厌倦情绪,这就给教学工作的开展带来了较大的难度,对于不同这样差距比较大的学生,我们只能因材施教,根据学生的差异做不同层次的要求,使学生能够各取所需,在不同层次上得到充分的发展,同时又能轻松适应校园生活,做到真正的以人为本。
二、教材分析九年级的化学教材为新教材,今年9月份开始使用新课标新教材,分为上下两册,其中上册为本期的教学内容,它由七个单元组成:第一单元走进化学世界从三个方面向学生介绍了化学是一门以实验为基础的自然科学,通过一些日常生活中的化学现象将学生带入化学的殿堂,从而很自然地接受这门新的课程,并激发了学生的学习兴趣。

数学初一到初三的所有知识点
数学初一到初三的知识点涵盖了许多基础但重要的概念和方法,以下是其中的一些关键内容:
1.初一数学知识点:
有理数:包括有理数的定义、数轴、相反数、绝对值等概念,以及有理数的加减法、乘法法则。
整式:学习整式的加减、整式的乘法、因式分解等。
一元一次方程:掌握一元一次方程的概念、解法,以及方程的应用。
图形的初步认识:了解线段、角、平行线、相交线等基本几何元素及其性质。
2.初二数学知识点:
函数:学习函数的概念、正比例函数、一次函数等,理解函数的图象和性质。
三角形:掌握三角形的分类、性质,以及全等三角形、相似三角形的判定和性质。
四边形:学习平行四边形、矩形、菱形、正方形的性质和判定。
轴对称与中心对称:理解轴对称和中心对称的概念,掌握其性质和应用。
3.初三数学知识点:
二次函数:学习二次函数的定义、图象、性质,以及最值问题。
圆:掌握圆的基本性质,包括垂径定理、圆周角定理等,以及点和圆、直线和圆的位置关系。
概率初步:学习概率的基本概念、计算,以及利用概率解决实际问题。
反比例函数:理解反比例函数的概念、图象和性质,掌握其应用。
此外,还有数据的收集与整理、图形的变换(如平移、旋转、翻折等)、勾股定理、锐角三角函数、投影与视图等知识点也是初中数学的重要内容。

初中必记知识点初中是一个重要的学习阶段,这里是我们开始接受高中和大学学习的基础。
在这个阶段,我们需要掌握大量的知识和技能,为未来的学习打下坚实的基础。
以下是初中必备的一些知识点。
语文1. 理解和记忆课文初中语文的重点是对课文的理解和记忆。
学生需要学会仔细阅读,理解其中的含义和情节,并能准确地记忆;同时也需要不断提高自己的写作技能。
2. 作文作文是初中语文的重要组成部分。
学生需要学会写不同类型的文章,例如叙事性、议论性和说明性文章,并需要掌握文章的结构和写作技巧。
3. 词汇词汇量的积累是初中语言学习的重点之一。
学生需要通过不断的背诵、记忆和使用词汇来提高自己的语言功底。
数学1. 数的四则运算数的四则运算包括加减乘除。
初中数学的基础就是数的四则运算,学生需要掌握优先级和运算规则。
2. 代数初中数学还有一个重要领域就是代数。
学生需要学会如何用字母表示数,并掌握如何对代数式进行运算、化简和因式分解。
3. 几何初中数学的第三个重要领域是几何学。
学生需要学会如何测量和绘制图形,理解各种几何形状的性质,如角度、线段、面积、体积等。
科学1. 生物学生物学是初中科学教育的一个重要领域。
学生需要学习细胞结构、遗传、生殖和身体系统等内容,并掌握实验和观察技能。
2. 物理学物理学是初中科学的另一个重要领域。
学生需要掌握各种物理概念和定律,例如重力、动量、电磁力等,并学会应用这些概念解决问题。
3. 化学化学也是初中科学的一个关键领域。
学生需要学习原子、分子、化学反应、化学元素周期表等内容,并学会实验和观察技能。
英语1. 词汇学生需要学习大量的英语词汇,掌握单词词根、前缀和后缀的组合规则,以及把词汇应用到写作、听力和口语中。
2. 语法学生需要掌握英语语法的不同部分,例如名词、动词、形容词、代词等。
学生需要学会使用正确的语法,以确保英语句子的准确性和流畅性。
3. 听力和口语学生需要不断提高自己的英语听力和口语技能。
他们应该练习听不同类型的英语材料,并学会不同的口语表达方式,以便更好地应用英语。

九年级化学上册必记知识点与初中化学的终极记忆方法
九年级化学上册必记必会知识点
一、化学用语:
1、1~~20号元素符号,其他常见元素符号(课本62页相对原子质量表中其他元素);
2、常见离子(包括化合价表中的原子团);
3、常见物质化学式;
4、常见化学反应方程式(共约30个---见“化学方程式复习方法二”);
5、常见元素化合价
6、原子的表示方法---元素符号、原子结构示意图、周期表单元格
二、概念理论类
1、物质分类概念---要理解:纯净物与混合物、化合物与单质、含氧化合物与氧化物
2、化学反应分类:化合反应、分解反应;氧化反应、还原反应;
3、催化剂及催化作用,
4、原子、离子、分子及元素的关系
5、相对原子质量,相对原子质量与质子、中子数关系
6、物理、化学变化,物理、化学性质;
7、质量守恒定律及本质原因
8、温室效应、燃烧、着火点
9、石油分馏、煤的综合利用
10、几位科学家及贡献
三、物质组成
1、空气的组成
2、稀有气体
3、地壳中元素含量
4、软水与硬水及区别
6、空气及水污染
7、生物体、海水的元素含量前六位
四、应用理解
1、元素符号、离子符号、化学式、化学方程式的意义。
初中文言文知识点总结一、常用实词实词有实在意义,能够单独充当句子成分,一般能单独回答问题。
实词包括名词、动词、形容词、数词、量词、代词六类。
掌握常见文言实词的用法及意义,是提咼文言文阅读能力的关键。
1•安(1)安逸。
例:死于安乐(《生于忧患,死于安乐》)⑵养,奉养。
例:衣食所安,弗敢专也(《曹刿论战》)(3)怎么。
例:燕雀安知鸿鹄之志哉(《陈涉世家》)(4)安稳,安定。
例:风雨不动安如山(《茅屋为秋风所破歌》)2•曾(1)同增”增加。
例:曾益其所不能(《生于忧患,死于安乐》)⑵副词,常与不”连用,译为连……都不……”例:曾不若孀妻弱子(《愚公移山》”曾不盈寸(《核舟记》)(3)曾经。
例:相逢何必曾相识(《琵琶行》)(4)同层”重叠。
例:荡胸生曾云(《望岳》)3•从(1)跟,随。
例:战则请从(《曹刿论战》”隶而从者(《小石潭记》)(2)学习。
例:择其善者而从之(《论语。
述而》)(3)追寻。
例:溯洄从之(《蒹葭》)(4)依从。
例:民弗从也(《曹刿论战》)(5)自,由。
例:从口入,初极狭(《桃花源记》)(6)在。
例:吾从北方闻子为梯(《公输》)(7)堂房亲属。
例:赠从弟(《赠从弟》)(8)向。
例:从乡之先达执经叩问(《送东阳马生序》)4. 得(1)能够。
例:余因得遍观群书(《送东阳马生序》)(2)领会。
例:得之心而寓之酒也(《醉翁亭记》)(3)同德”恩惠,感激。
例:所识穷乏者得我与(《鱼我所欲也》)(4)实施。
例:得道者多助(《得道多助,失道寡助》)(5)得意。
例:怡然自得(《童趣》)(6)得到,获得。
例:优劣得所(《出师表》)5. 道(1)(正确的)方法。
例:策之不以其道(《马说》)(2)主张,思想,学说。
例:益慕圣贤之道(《送东阳马生序》)(3)路。
例:道不通,度已失期(《陈涉世家》)(4)政治的理想境界。
例:大道之行也(《礼记。
大道之行也》)(5)仁政。
例:得道者多助(《得道多助,失道寡助》)(6)说。
初中必记学科知识点整理中国的初中教育体系包括了多个学科,每个学科都有其独特的知识点。
在初中的学习过程中,掌握并记忆这些知识点是非常重要的。
本文将为您整理出初中必记的学科知识点,帮助您更好地应对学习和考试。
语文是初中学生必修的一门学科,其知识点主要包括文字的认读、咏诵、阅读理解、作文等方面。
在学习语文的过程中,必须牢记不同字的正确发音、字义的理解以及句子的结构和修辞手法等。
此外,还需多读文学作品,培养自己的阅读和写作能力。
数学作为一门抽象的学科,也是初中学生必修的一门科目。
数学的知识点主要包括数的认识、运算、代数、几何、函数等方面。
在学习数学时,必须掌握数的基本性质和运算法则,了解代数方程式的解法,熟悉几何图形的性质和计算等。
数学需要不断的练习和思考,通过解题提高自己的数学思维能力。
英语是一门国际性的语言课程,在中国的初中课程中也是必修的一门科目。
英语的知识点主要包括词汇的记忆、语法的掌握、听力和口语的训练等方面。
为了学好英语,初中学生需要积累大量的词汇量,掌握常见的语法规则,并通过听力和口语练习来提高自己的听说能力。
自然科学包括物理、化学、生物等多个分支学科,初中学生需要学习这些学科的基础知识。
物理的知识点主要包括力学、光学、声学等方面;化学的知识点主要包括元素周期表、化学反应等方面;生物的知识点主要包括细胞结构、生物遗传等方面。
通过学习这些知识点,可以让初中学生对自然科学有更深入的认识,并为进一步学习和研究打下坚实的基础。
历史和地理是人文社会科学的学科,它们的知识点主要包括历史事件、人物、地理概念等。
通过学习历史和地理,可以了解人类社会的发展过程,掌握地理环境对人类生活的影响。
初中学生需要记忆重要的历史事件和人物,了解各个地理概念的含义和作用,从而培养自己的人文素养和地理思维能力。
除了以上几门主要学科外,初中学生还需要学习体育、艺术和信息技术等学科。
体育的知识点主要包括体育运动的规则和技巧;艺术的知识点主要包括音乐、美术等方面;信息技术的知识点主要包括计算机的基本操作和应用。
基本概念和基本理论(一)物质的变化和性质1.物质的变化:物理变化:没有生成其他物质的变化。
化学变化:生成了其他物质的变化。
化学变化和物理变化常常同时发生。
物质发生化学变化时一定伴随物理变化;而发生物理变化,不一定同时发生化学变化。
物质的三态变化(固、液、气)是物理变化。
物质发生物理变化时,只是分子间的间隔发生变化,而本身没有发生变化;发生化学变化时,分子被破坏,本身发生变化。
化学变化的特征:生成了其他物质。
2.物质的性质物理性质:颜色、状态、气味、熔点、沸点、硬度、密度、溶解性。
化学性质:通过化学变化表现出的性质。
还原性、氧化性、酸性、碱性、可燃性、热稳定性。
元素的化学性质跟原子的最外层电子数关系最密切。
原子的最外层电子数决定元素的化学性质。
(二)物质的分类3.混合物:是由两种或两种以上的物质混合而成(或由不同种物质组成) 例如,空气,溶液(盐酸、澄清的石灰水、碘酒、矿泉水)矿物(煤、石油、天然气、铁矿石、石灰石),合金(生铁、钢)注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。
纯净物、混合物与组成元素的种类无关。
即一种元素组成的物质可能是纯净物也可能是混合物,多种元素组成的物质可能是纯净或混合物。
4.纯净物:由一种物质组成的。
例如:水、水银、蓝矾(CuSO4 ?5H2 O)都是纯净物,冰与水混合是纯净物。
名称中有“某化某”“某酸某”的都是纯净物,是化合物。
5.单质:由同种(或一种)元素组成的纯净物。
例如:铁氧气(液氧)、氢气、水银。
6.化合物:由不同种(两种或两种以上)元素组成的纯净物。
名称中有“某化某”“某酸某”的是化合物。
7.有机物(有机化合物):含碳元素外的化合物(除CO、CO2和含碳酸根化合物外),无机物(无机化合物):不含碳元素的化合物以及CO、CO2 和含碳酸根的化合物8. 氧化物:由两种元素组成,其中一种是氧元素的化合物。
a.酸性氧化物:跟碱反应生成盐和水的氧化物CO2,SO2,SO3大部分非金属氧化物都是酸性氧化物,跟水反应生成同价的含氧酸。
七年级上册必记知识点作为一个初中生,七年级上册是自己学习道路上的一个重要节点。
在这个阶段,我们需要掌握很多知识点,这些知识点是我们以后学习的基础。
今天我给大家整理了一些七年级上册必记知识点,希望大家认真阅读,掌握好这些知识点,从而打好学习基础。
语文:1、常用古诗词知识点:最好背会60首以上,目前一些比较常见的古诗词有《静夜思》、《春晓》、《将进酒》、《登高》等。
2、现代文阅读基础:要认真阅读故事、小说、报告、科普文章等,提高自己的阅读理解能力。
3、修辞手法:摆脱单一表达方式,要能够使用各种修辞手法进行表达。
比如像夸张、设问、反问、排比等。
数学:1、正数、负数的概念:正数是指大于0的数,负数是指小于0的数。
2、整数的概念:正整数、负整数以及0构成的数集称为整数。
3、有理数的概念及化简:能表示成两个整数比值的数叫有理数,能化简成分数的应该尽量化简4、数轴上数的表示:负数在数轴上是朝左的,正数在数轴上是朝右的,数0在数轴上为原点。
5、基础代数知识:因式分解、加减、乘除、化简等计算方法要掌握娴熟。
英语:1、基础词汇:要掌握一定数量的英语单词,并掌握基本的语法规则。
2、常用句型:掌握一些常用的英语句型,如“be动词”、“情态动词”、“一般现在时”、“一般过去时”、“一般将来时”等。
3、听力训练:要多听英语听力,提高自己的听力理解能力。
4、口语训练:合理利用空余时间,多与人练习口语表达。
物理:1、运动学基础知识:掌握位移、速度、加速度等概念,熟悉直线运动和曲线运动的公式。
2、力学基础知识:认识力、质量、惯性及牛顿三定律。
3、声光电知识:学习声、光、电的概念,听写基本单词,理解相关规律与实践场景交融的概念。
4、测量学基础知识:掌握常见物理量单位、直尺、量角器、卡尺等测量工具的使用方法。
化学:1、元素、化合物的基础概念:元素是指由相同原子组成的物质,而化合物则是由两种或两种以上的不同原子以一定比例构成的物质。
2、化学式的写法:要掌握离子式、分子式、化合价等知识点,并能根据给定条件写出各种类型的化学式。
初中化学全册必背常识点一、化学用语1、常见元素及原子团的名称和符号非金属:0氧H氢N氮C1氯C碳P磷S硫金属:K钾Ca钙Na钠Mg镁A1铝Zn锌Fe铁Cu铜Hg汞Ag银Mn镒Ba颌原子团(根):氢氧根硝酸根碳酸根硫酸根铉根OH-- CO:— S0i 2~ NH.,+2、(1)常见元素化合价口诀:一价氯氢钾钠银,二价重钙钥镁锌,二三铁二四碳,二四六硫都齐全;铜汞二价最常见,三铝四硅五氮磷,单质零价要记清。
(2)常见原子团(根)化学价口诀:负一硝酸氢氧根,负二硫酸碳酸根,正一价的是铉根。
3、必须熟记的常见物质的俗称、化学名称、化学式、用途4、必须熟记的制取物质的化学方程式(1)尝试室制取氧气一:2KMn04===K2Mn0.i+Mn02+02 t(2)尝试室制取氧气二:2H2O2 ==2H20+02 t(3)尝试室制取氧气三:2KC1O.3==2KC1+3O2 t(4)尝试室制法C02:CaCO3+2HC 1 ==CaC 12+H20+C021(5)尝试室制取氢气:Zn+HzSO户二ZnSOi+Hz t Zn + 2HC1 = ZnCl2+也t(6)电解水制取氢气:2氏0==2也t +O21(7)湿法炼铜术(铁置换出铜):Fe+CuSOF=FeSO4+Cu(Fe与盐、酸反映都生成的是+2价亚铁离子)(8) 炼铁原理:3C0+Fe 203===2Fe+3C02 (Fe2()3与酸反映生成的是+3价铁离子)(9) 熟灰水[Ca(OH) 2]的 制取方式:CaO+H 2O==Ca(OH)(10)生石灰(氧化钙)制取方式:CaC03 ===Ca0+C02 t二.金属运动性次序:棕黄色(如FeCL 溶液),其余溶液一样为无色。
(高猛酸钾溶液为紫红色)4、 (1)具有刺激性气体的气体:NH 3 (氨气)、SO?、HC1 (皆为无色)金属运动性由强至弱:K Ca Na Mg Al , Zn Fe Sn Pb (H) Cu Hg Ag Pt Au o(按5个一句次序背诵) 钠镁铝,锌 (氢),铜汞 银钳金。
第一章有理数一. 知识框架二.知识概念 1. 有理数: (1) 凡能写成 q (p,q 为整数且 p 0)形式的,数,都是有理数 . 正整数、0、负整数统称整数; p正分数、负分数统称分数;整数和分数统称有理数 . 注意: 0即不是正数,也不是负数; -a 不一定是负数, +a 也不一定是正数; 不是有理数;正有理数 正整数正分数整数 正整数 零(2) 有理数的,分:① 有理数 零② 有理数负整数负有理数 负整数负分数分数正分数 负分数2.数轴:数轴是规定了原点、正方向、单位长度的,一条直线 .数轴上的,点和实数的,对应关系:数轴上的,每一个点都表示一个实数,而每一个实数 都可以用数轴上的,唯一的,点来表示。
实数和数轴上的,点是一一对应的,关系。
3.相反数:(1) 只有符号不同的,两个数,我们说其中一个是另一个的,相反数; 0 的,相反数还是 0; (2) 相反数的,和为 0 a+b=0 a 、 b 互为相反数 .4. 绝对值:一个实数 a 的,绝对值,就是数轴上表示这个数的, 点到原点的, 距离。
|a| ≥0。
(1) 正数的,绝对值是其本身, 0 的,绝对值是 0,负数的,绝对值是它的,相反数; 注意:绝对值的,意义是数轴上表示某数的,点离开原点的,距离;a (a 0)(2) 绝对值可表示为: a 0 (a 0) 或 a a (a 0)去掉绝对值符号(化简)必须要对绝对值符号里面的,实数进行数性(正、负)确认, 再去掉绝对值符号。
5. 有理数比大小:(1)正数的,绝对值越大,这个数越大; (2)正数永远比 0 大,负数永 远比 0 小;(3)正数大于一切负数; (4)两个负数比大小,绝对值大的,反而小; (5)数 轴上的,两个数,右边的,数总比左边的,数大; (6)大数-小数 > 0,小数-大数 < 0.6. 互为倒数:乘积为 1 的,两个数互为倒数;注意: 0 没有倒数;若 a ≠0,那么 a 的,倒 数是 1;若 ab=1 a 、b 互为倒数;若 ab= - 1a 、b 互为负倒数 .a7. 有理数加法法则:(1)同号两数相加,取相同的,符号,并把绝对值相加;(2)异号两数相加,取绝对值较大的,符号,并用较大的,绝对值减去较小的,绝对值;a (a 0) a (a 0)绝对值的,问题经常分类讨论;(3)一个数与0 相加,仍得这个数.8.有理数加法的,运算律:(1)加法的,交换律:a+b=b+a ;(2)加法的,结合律:(a+b)+c=a+(b+c). 9.有理数减法法则:减去一个数,等于加上这个数的,相反数;即a-b=a+(-b ).10 有理数乘法法则:(1)两数相乘,同号为正,异号为负,并把绝对值相乘;(2)任何数同零相乘都得零;(3)几个数相乘,有一个因式为零,积为零;各个因式都不为零,积的,符号由负因式的,个数决定.11 有理数乘法的,运算律:(1)乘法的,交换律:ab=ba;(2)乘法的,结合律:(ab)c=a(bc);(3)乘法的,分配律:a(b+c)=ab+ac .12.有理数除法法则:除以一个数等于乘以这个数的,倒数;注意:零不能做除数,即a无意义.0 (1)两数相除,同号得正,异号得负,并把绝对值相除。
初中化学必记初中常见物质的化学式氢气碳氮气氧气磷硫氯气(非金属单质)H2 C N2 O2 P S Cl2钠镁铝钾钙铁锌铜钡钨汞(金属单质)Na Mg Al K Ga Fe Zn Cu Ba W Hg水一氧化碳二氧化碳五氧化二磷氧化钠二氧化氮二氧化硅H2O CO CO2 P2O5 Na2O NO2 SiO2二氧化硫三氧化硫一氧化氮氧化镁氧化铜氧化钡氧化亚铜SO2 SO3 NO MgO CuO BaO Cu2O氧化亚铁三氧化二铁(铁红)四氧化三铁三氧化二铝三氧化钨FeO Fe2O3 Fe3O4 Al2O3 WO3氧化银氧化铅二氧化锰 (常见氧化物)Ag2O PbO MnO2氯化钾氯化钠(食盐) 氯化镁氯化钙氯化铜氯化锌氯化钡氯化铝KCl NaCl MgCl2 CaCl2 CuCl2 ZnCl2 BaCl2 AlCl3氯化亚铁氯化铁氯化银(氯化物/盐酸盐)FeCl2 FeCl3 AgCl硫酸盐酸硝酸磷酸硫化氢溴化氢碳酸(常见的酸)H2SO4 HCl HNO3 H3PO4 H2S HBr H2CO3硫酸铜硫酸钡硫酸钙硫酸钾硫酸镁硫酸亚铁硫酸铁CuSO4 BaSO4 CaSO4 KSO4 MgSO4 FeSO4 Fe2 (SO4)3硫酸铝硫酸氢钠硫酸氢钾亚硫酸钠硝酸钠硝酸钾硝酸银Al2(SO4)3 NaHSO4 KHSO4 NaSO3 NaNO3 KNO3 AgNO3硝酸镁硝酸铜硝酸钙亚硝酸钠碳酸钠碳酸钙碳酸镁MgNO3 Cu(NO3)2 Ca(NO3)2 NaNO3 Na2CO3 CaCO3 MgCO3碳酸钾(常见的盐)K2CO3氢氧化钠氢氧化钙氢氧化钡氢氧化镁氢氧化铜氢氧化钾氢氧化铝NaOH Ca(OH)2 Ba(OH)2 Mg(OH)2 Cu(OH)2 KOH Al(OH)3氢氧化铁氢氧化亚铁(常见的碱)Fe(OH)3 Fe(OH)2甲烷乙炔甲醇乙醇乙酸 (常见有机物)CH4 C2H2 CH3OH C2H5OH CH3COOH碱式碳酸铜石膏熟石膏明矾绿矾Cu2(OH)2CO3 CaSO4•2H2O 2 CaSO4•H2O KAl(SO4)2•12H2O FeSO4•7H2O 蓝矾碳酸钠晶体(常见结晶水合物)CuSO4•5H2O Na2CO3•10H2O尿素硝酸铵硫酸铵碳酸氢铵磷酸二氢钾(常见化肥)CO(NH2)2 NH4NO3 (NH4)2SO4 NH4HCO3 KH2PO4酸硫酸 H2SO4亚硫酸 H2SO3盐酸 HCl硝酸 HNO3硫化氢 H2S碳酸 H2CO3沉淀:红褐色絮状沉淀--------Fe(OH)3浅绿色沉淀------------Fe(OH)2蓝色絮状沉淀----------Cu(OH)2白色沉淀--------------CaCO3,BaCO3,AgCl,BaSO4,(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,CaCO3 BaCO3是溶于HNO3 的白色沉淀),Mg(OH)2.淡黄色沉淀(水溶液中)----S微溶于水------------Ca(OH)2,CaSO4初中化学方程式汇总一、氧气的性质:(1)单质与氧气的反应:(化合反应)1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O43. 铜在空气中受热:2Cu + O2 加热 2CuO4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O35. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃 2P2O57. 硫粉在空气中燃烧: S + O2 点燃 SO28. 碳在氧气中充分燃烧:C + O2 点燃 CO29. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO(2)化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO211. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O(3)氧气的来源:13.玻义耳研究空气的成分实验 2HgO 加热 Hg+ O2 ↑14.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑17.生石灰溶于水:CaO + H2O == Ca(OH)218.二氧化碳可溶于水: H2O + CO2==H2CO3三、质量守恒定律:19.镁在空气中燃烧:2Mg + O2 点燃 2MgO20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C + O2 点燃 CO224.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑25.焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑(2)煤炉中发生的三个反应:(几个化合反应)26.煤炉的底层:C + O2 点燃 CO227.煤炉的中层:CO2 + C 高温 2CO28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2(3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳):CaCO3 + 2HCl == CaCl2 + H2O + CO2↑30.碳酸不稳定而分解:H2CO3 == H2O + CO2↑31.二氧化碳可溶于水: H2O + CO2== H2CO332.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温 CaO + CO2↑33.石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2 + CO2 === CaCO3 ↓+ H2O(4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO235.一氧化碳的可燃性:2CO + O2 点燃 2CO2其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑五、燃料及其利用:37.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O38.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O39.氢气中空气中燃烧:2H2 + O2 点燃 2H2O六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg + O2 点燃 2MgO41.铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O442. 铜在空气中受热:2Cu + O2 加热 2CuO43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg(3)金属铁的治炼原理:55.3CO+ 2Fe2O3 高温 4Fe + 3CO2↑七、酸、碱、盐1、酸的化学性质(1)酸 + 金属 -------- 盐 + 氢气(见上)(2)酸 + 金属氧化物-------- 盐 + 水56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O(3)酸 + 碱 -------- 盐 + 水(中和反应)60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O(4)酸 + 盐 -------- 另一种酸 + 另一种盐64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl 2、碱的化学性质(1)碱 + 非金属氧化物 -------- 盐 + 水68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O 69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O 70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O 71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O 72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)(3)碱 + 盐 -------- 另一种碱 + 另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH3、盐的化学性质(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu(2)盐 + 酸-------- 另一种酸 + 另一种盐75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH(4)盐 + 盐 ----- 两种新盐77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO378.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl一、物质的学名、俗名及化学式⑴金刚石、石墨:C ⑵水银、汞:Hg (3)生石灰、氧化钙:CaO (4)干冰(固体二氧化碳):CO2 (5)盐酸、氢氯酸:HCl (6)亚硫酸:H2SO3 (7)氢硫酸:H2S (8)熟石灰、消石灰:Ca(OH)2 (9)苛性钠、火碱、烧碱:NaOH (10)纯碱:Na2CO3 碳酸钠晶体、纯碱晶体:Na2CO3•10H2O (11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打) (12)胆矾、蓝矾、硫酸铜晶体:CuSO4•5H2O (13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质) (14)甲醇:CH3OH 有毒、失明、死亡 (15)酒精、乙醇:C2H5OH (16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子)具有酸的通性 (17)氨气:NH3 (碱性气体) (18)氨水、一水合氨:NH3•H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱) (19)亚硝酸钠:NaNO2 (工业用盐、有毒)二、常见物质的颜色的状态1、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色3、红色固体:Cu、Fe2O3 、HgO、红磷▲硫:淡黄色▲ Cu2(OH)2CO3为绿色4、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。