乙烯
- 格式:ppt
- 大小:445.50 KB
- 文档页数:18

乙烯(不饱和烃)⑴ 分子结构特点分子式:C 2H 4 结构简式:CH 2=CH 2 结构式:⑵ 物理性质:无色、稍有气味的气体,标准状况下密度为1.25g·L -1,比空气略轻,难溶于水。
⑶ 化学性质:易氧化、易加成(加聚)、易分解 ① 氧化反应ⅰ与酸性高锰酸钾反应(特征反应)现象:酸性高锰酸钾溶液褪色。
(乙烯被酸性高锰酸钾氧化成CO 2)ⅱ 可燃性:现象:火焰明亮,伴有黑烟。
② 加成反应:CH 2=CH 2+Br 2CH 2Br ―CH 2Br (1,2—二溴乙烷)加成反应:有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应叫做加成反应。
被加成的试剂如:H 2、X 2(X 为Cl 、Br 或I)、H 2O 、HX 、HCN 等能离解成一价原子或原子团的物质。
通过有机物发生加成反应时反应物之间的量关系,还可定量判断该有机物分子结构中不饱和键的情况:是C =C 键,还是C≡C 键,或是苯环结构,以及它们的个数。
能与Cl 2、H 2 、HX 、H 2O 的加成:CH 2=CH 2+Cl 2CH 2Cl ―CH 2Cl③ 加聚反应CH 2=CH 2+CH 2=CH 2+CH 2=CH 2+···催化剂[―CH 2―CH 2―+―CH 2―CH 2―+―CH 2―CH 2―+···]→[―CH 2―CH 2―CH 2―CH 2―CH 2―CH 2―···]→ⅰ 加聚反应:在聚合反应中,由不饱和(即含碳碳双键或三键)的相对分子质量小的化合物分子通过加成聚合的形式结合成相对分子质量很大的高分子化合物的反应。
ⅱ 聚合反应:相对分子质量小的化合物分子互相结合成相对分子质量很大的高分子化合物的反应。
ⅲ 高分子化合物:相对分子质量很大(1万以上)的物质,简称高分子或高聚物。
聚乙烯,塑料,分子量达几万到几十万,性质坚韧,化学性质稳定,难降解。

乙烯性质知识点总结归纳1. 物理性质乙烯是一种无色、有刺激性气味的气体。
在常温和常压下,乙烯是一种无色无臭的气体。
它的沸点为-103.7摄氏度,密度为0.91克/升。
由于乙烯是一种不稳定的气体,通常以液态的形式存储和运输,以减少安全风险。
2. 化学性质乙烯是一种高度活泼的化合物,它具有许多特殊的化学性质。
首先,乙烯对氧气具有很高的亲和力,容易发生氧化反应,导致氧化性质比较强。
其次,乙烯还可以和卤素发生加成反应,例如和氯气发生加成反应得到1,2-二氯乙烷。
此外,乙烯可以和水发生加成反应,生成乙醇。
最后,乙烯还可以和许多有机物发生加成反应,生成不同种类的有机化合物。
3. 燃烧性质乙烯是一种易燃的气体,在空气中可以燃烧产生火焰。
乙烯的燃烧反应为:C2H4 + 3O2 → 2CO2 + 2H2O在氧气充足的条件下,乙烯燃烧会产生大量的热能和光能,释放出明亮的火焰。
这使得乙烯成为一种重要的燃料和燃烧剂,在工业生产和日常生活中都有广泛的应用。
4. 溶解性质乙烯在水中的溶解度相对较低,但可以在一定程度上溶解。
乙烯还可以溶解在一些有机溶剂中,例如乙醇、丙酮等。
此外,乙烯还可以在液态氨中溶解,形成乙烯-氨复合物。
这些溶解性质对于乙烯的分离和提纯具有一定的意义。
5. 催化性质乙烯具有很强的催化性质,它可以用作许多重要的工业催化剂。
例如,乙烯可以作为裂化反应的催化剂,将较重的烃类化合物裂解成较轻的烃类化合物。
此外,乙烯还可以用作合成乙烯醇、聚乙烯等重要化学产品的催化剂。
6. 光敏性质乙烯在紫外线的作用下会产生自聚合分解反应,生成聚乙烯。
这种光敏性质使得乙烯成为一种重要的聚合物原料,在塑料工业、合成橡胶工业中有着广泛的应用。
7. 生物活性乙烯在植物生长中起着重要的生理作用。
乙烯可以促进植物的果实成熟和脱落,调节植物的生长和发育过程。
此外,乙烯还可以作为一种植物激素,参与植物的生长和代谢过程。
因此,乙烯在农业生产中有着重要的应用价值。

乙烯知识点总结文库1. 物理性质乙烯是一种无色、无味、可燃的气体,在常温下呈现为无色、无味的气体,但可以在软泥煤、天然气、石油等矿物燃料中找到。
乙烯的比重为0.552g/cm3,沸点为-103.6℃,在常温下为无色无味的气体。
2. 化学性质乙烯是一种不稳定的化合物,可以和氧气、溴、氯等元素发生剧烈的化学反应。
乙烯可以和氯气作用生成氯乙烷,和溴作用生成1,2-二溴乙烷,和氢卤酸发生反应生成卤代乙烷等。
此外,乙烯还可以和羰基化合物发生羰基化反应,生成乙烯基醛、醇和酸。
3. 生产方法乙烯的生产方法主要包括烷烃裂解、醇脱水、乙烷氧化和原生材料合成等几种方法。
烷烃裂解是通过加热石油烃类化合物,使其分解为乙烯和其他烃类物质。
醇脱水是通过将醇类化合物和酸性或碱性催化剂一起加热,使其分解为乙烯和水。
乙烷氧化是将乙烷和氧气在铋钒酸盐催化剂的作用下,产生一氧化碳和二氧化碳并生成乙烯。
原生材料合成是通过木材、秸秆等生物质性原料提取乙醇,再通过脱水反应制得乙烯。
4. 应用领域乙烯是一种重要的工业原料,广泛用于合成塑料、橡胶、溶剂和化肥等化工产品。
乙烯可以被用来制造聚乙烯、聚氯乙烯、聚苯乙烯、聚丙烯、聚碳酸酯等各种合成树脂和塑料。
另外,乙烯还可以用于制造橡胶、制造合成纤维、制造皂化物质等。
在化工工业中,乙烯还可以被用作溶剂、去除,干燥、发泡等劬利剂。
此外,乙烯还可以用于制造氯化乙烯、醋酸乙烯、烯烃类石油树脂、乙烯醛、酒精类食品添加剂等。
另外,作为一种无毒、无害的气体,乙烯还可以被用于制造乙烯化植物生长调节剂、消毒剂等。

乙烯知识点归纳总结1. 乙烯的结构和性质乙烯是一种无色气体,具有特殊的气味和易燃性。
它是一种烯烃,由两个碳原子和四个氢原子组成。
乙烯具有高度不饱和的结构,因此容易与其他化合物进行反应。
它的分子结构是一个双键的碳链,双键部分容易发生加成反应,可以与其他分子形成加成产物。
2. 乙烯的生产乙烯是一种重要的工业原料,它的生产主要通过裂解石油或天然气中的烃类化合物来实现。
常用的生产方法有石油蒸馏、裂解炉、催化裂解等。
其中,裂解炉是一种重要的生产方法,通过高温将重质烃类分子裂解成轻质的乙烯和其他烯烃。
此外,乙烯也可以通过乙烷的脱氢或醋酸的脱羧而得到。
3. 乙烯的用途乙烯作为一种重要的有机化学原料,具有广泛的用途。
首先,它是合成塑料和橡胶的重要原料之一。
例如,聚乙烯是一种重要的塑料材料,广泛用于包装、建筑、家具等领域。
此外,乙烯还可以用于合成乙烯醇、醋酸乙烯酯、氯乙烯等重要的有机化合物。
另外,乙烯还可以用于制备合成纤维、合成洗涤剂、合成香料等。
4. 乙烯的反应乙烯作为一种烯烃,具有高度不饱和的结构,因此容易发生多种反应。
首先,乙烯可以与氢气发生加成反应,生成乙烷。
其次,乙烯可以和溴水发生加成反应,生成1,2-二溴乙烷。
此外,乙烯还可以和氯气、溴气、氢氧化钠等发生加成反应,生成不同的产物。
此外,乙烯还可以参与聚合反应,形成聚合物材料,如聚乙烯、聚氯乙烯等。
5. 乙烯的安全性乙烯是一种有毒气体,长时间接触或高浓度吸入可引起中毒。
另外,乙烯具有较高的易燃性,容易在空气中发生爆炸。
因此,在生产和使用过程中,需要严格控制乙烯的浓度和使用条件,确保安全生产和使用。
综上所述,乙烯是一种重要的有机化学原料,具有广泛的生产和应用价值。
它的结构和性质决定了它在合成塑料、橡胶、合成纤维等领域的重要地位。
同时,需要注意乙烯的安全问题,加强生产和使用过程中的安全管理和控制。
希望本文对乙烯的相关知识有所帮助,能够更好地理解和应用这一重要化学品。
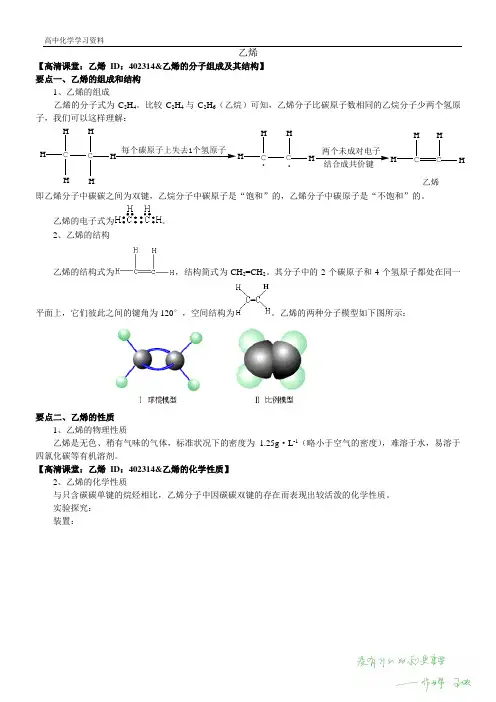
乙烯【高清课堂:乙烯ID:402314&乙烯的分子组成及其结构】要点一、乙烯的组成和结构1、乙烯的组成乙烯的分子式为C2H4。
比较C2H4与C2H6(乙烷)可知,乙烯分子比碳原子数相同的乙烷分子少两个氢原子,我们可以这样理解:CHHH C HHH每个碳原子上失去1个氢原子CHHC HH.两个未成对电子结合成共价键CHHC HH乙烯.即乙烯分子中碳碳之间为双键,乙烷分子中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
乙烯的电子式为。
2、乙烯的结构乙烯的结构式为,结构简式为CH2=CH2。
其分子中的2个碳原子和4个氢原子都处在同一平面上,它们彼此之间的键角为120°,空间结构为。
乙烯的两种分子模型如下图所示:要点二、乙烯的性质1、乙烯的物理性质乙烯是无色、稍有气味的气体,标准状况下的密度为1.25g·L-1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
【高清课堂:乙烯ID:402314&乙烯的化学性质】2、乙烯的化学性质与只含碳碳单键的烷烃相比,乙烯分子中因碳碳双键的存在而表现出较活泼的化学性质。
实验探究:装置:实验步骤与现象:实验步骤实验现象将气体通入酸性高锰酸钾溶液中溶液褪色将气体通入溴的四氯化碳溶液中溶液褪色用排水法收集气体验纯后,点燃火焰明亮,伴有黑烟结论一:石蜡油分解产生了能使高锰酸钾溶液、溴的四氯化碳溶液褪色的气态产物,由此可知产物中含有与烷烃性质(烷烃不能使酸性高锰酸钾溶液褪色)不同的烃。
结论二:研究表明,石蜡油分解的产物主要是乙烯和烷烃的混合物。
要点诠释:a.碎瓷片起催化作用。
b.高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c.酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d.酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化乙烯使酸性高锰酸钾溶液褪色的实质是乙烯被酸性高锰酸钾溶液氧化。


总结乙烯知识点的方法一、形成原理乙烯是一种简单的烃类物质,由两个碳原子和四个氢原子组成。
其分子式为C2H4,结构示意图如下所示:H|H-C=C-H|H乙烯分子的形成主要有两种途径,一种是通过裂解乙烷合成,另一种是通过蒸馏煤焦油合成。
在裂解乙烷合成乙烯的过程中,先将乙烷加热至800-900℃,随后通过热裂解反应将乙烷分解成乙烯和氢气。
而蒸馏煤焦油合成乙烯的过程则是将煤焦油蒸馏得到高纯度的乙烯。
二、物理性质1. 外观:乙烯是一种无色的气体,具有类似醇类的气味。
2. 密度:乙烯的密度较小,约为0.968 g/cm3,但在液态状态下密度较大,约为0.567g/cm3。
3. 沸点和熔点:乙烯的沸点为-103.7℃,熔点为-169.2℃。
4. 燃点:乙烯的燃点为260℃,是一种易燃物质。
5. 溶解性:乙烯在水中难以溶解,但在有机溶剂中溶解度较大。
三、化学性质1. 燃烧反应:乙烯是一种易燃气体,遇到明火或高温时会发生爆炸性燃烧,生成二氧化碳和水。
2. 加成反应:乙烯分子可以与氢气发生加成反应生成乙烷,也可与卤素发生加成反应生成卤代烃。
3. 卤素化反应:乙烯可以与卤素发生加成反应生成卤代乙烯,而且在这一类反应中,氯代乙烯的产率最高。
4. 氢化反应:乙烯可以通过催化加氢反应得到乙烷,这是一种重要的工业合成方法。
5. 聚合反应:乙烯可以通过聚合反应得到聚合物聚乙烯,是一种重要的高分子材料。
四、实际应用乙烯是一种广泛应用的化工原料,其主要应用领域有:1. 合成聚乙烯:聚乙烯是一种重要的塑料材料,其主要原料就是乙烯。
聚乙烯具有优良的绝缘性能和耐腐蚀性能,广泛应用于包装、建筑、电气等领域。
2. 合成乙烯醇:乙烯醇是一种重要的有机化工产品,广泛用于制备醋酸乙烯酯、乙烯醇胶等。
3. 合成乙烯胺:乙烯胺是一种重要的医药中间体,用于合成多种药物。
4. 合成乙烯氧化物:乙烯氧化物是一种广泛用于合成乙二醇、丙二醇等化工产品的重要原料。

乙烯的性质
乙烯(ethylene)是一种无色的、无味的、有毒的气态烃,其分子式为C2H4,它是一种二元烃,也是最简单的烃之一,是乙烯和乙
烯氧化物等衍生物的重要原料。
乙烯是一种极易挥发的液体,分子量非常小,无色无味,具有强烈的自毒性,对氧气有很强的氧化性,容易结合氧形成乙烯的氧化物。
因其分子结构的特殊性,它也是多种重要的化学反应的催化剂,可以用来合成乙烯氧化物,如乙烯醇,乙烯酸,乙酰乙酸等等。
由于乙烯的特性,它广泛应用于日常生活中,如用来制作塑料,橡胶,颜料,染料,农药等物质,也是普通水溶液,溶剂,膜,浆料等物质的重要原料。
乙烯也可以用在医学上,如作为药丸的表面功能材料,也可以用在精细化学工业上,使用乙烯氧化物可以制造用于制造医疗器械,仪器和仪器的部件,如管道,晶体,测量仪器,照相机,玻璃等类型的装置。
乙烯也是火焰反应的主要成分,由于它具有非常强烈的氧化性,它可以被用来加热材料,它是许多化学反应的主要原料,如催化剂,还可以用来制造半导体、液晶等新型材料。
乙烯是生物体中重要的一种激素,它不仅可以促进植物生长发育,还可以促进植物对环境的适应,对动物也有特殊的作用,如促进生长发育,合成抗体,调节内分泌功能等。
综上所述,乙烯是一种重要的物质,它具有极强的氧化性,可以用于许多工业,催化剂,材料,药物等,而且也是生物体重要的激素
之一,可以促进植物及动物的生长发育及其对环境的适应。
因此,乙烯是一种具有重要作用的物质。
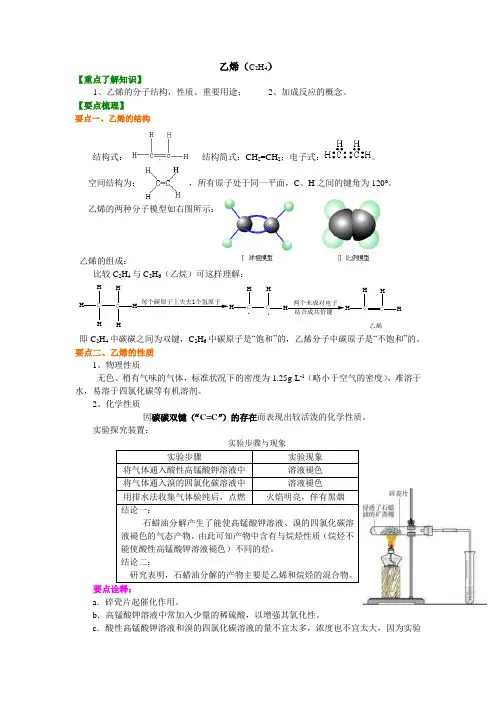
乙烯(C 2H 4)【重点了解知识】1、乙烯的分子结构,性质、重要用途;2、加成反应的概念。
【要点梳理】要点一、乙烯的结构结构式: , 结构简式:CH 2=CH 2;电子式:。
空间结构为: ,所有原子处于同一平面,C 、H 之间的键角为120°。
乙烯的两种分子模型如右图所示:乙烯的组成:比较C 2H 4与C 2H 6(乙烷)可这样理解:C HH HC HH H每个碳原子上失去1个氢原子HH CH .两个未成对电子CHHC HH 乙烯.即C 2H 4中碳碳之间为双键,C 2H 6中碳原子是“饱和”的,乙烯分子中碳原子是“不饱和”的。
要点二、乙烯的性质 1、物理性质无色、稍有气味的气体,标准状况下的密度为1.25g·L -1(略小于空气的密度),难溶于水,易溶于四氯化碳等有机溶剂。
2、化学性质因碳碳双键(“C=C ”)的存在而表现出较活泼的化学性质。
实验探究装置:实验步骤与现象要点诠释:a .碎瓷片起催化作用。
b .高锰酸钾溶液中常加入少量的稀硫酸,以增强其氧化性。
c .酸性高锰酸钾溶液和溴的四氯化碳溶液的量不宜太多,浓度也不宜太大,因为实验中乙烯量不大。
d .酸性高锰酸钾、溴的四氯化碳溶液能检验乙烯等不饱和烃。
(1)氧化反应①乙烯被酸性高锰酸钾溶液氧化——使酸性高锰酸钾溶液褪色启示:利用此性质可鉴别CH 4和C 2H 4,但不能除去CH 4中的C 2H 4,原因是:5CH 2=CH 2+12KMnO 4+18H 2SO 410CO 2↑+6K 2SO 4+12MnSO 4+28H 2O 产物中有CO 2↑,仍混在甲烷中,达不到除杂的目的。
②乙烯的燃烧在空气中燃烧,现象:火焰明亮并伴有黑烟,同时放出大量的热。
C 2H 4 + 3O22CO 2 +2H 2O重点提示:a . 产生黑烟:乙烯分子中含碳量较高,燃烧时部分碳并没有完全被氧化,而导致多余的碳析出。
以黑烟的形式冒出。
碳粒本身被烧成炽热的状态,所以乙烯的火焰很明亮,没有被氧化的碳呈游离态 b .乙烯属于易燃易爆的气体,点燃前一定要先验纯。

乙烯性质知识点总结在本文中,我将详细介绍乙烯的性质,包括物理性质、化学性质、制备方法以及其在工业和化工中的应用。
第一部分:乙烯的物理性质1.密度和相对分子质量乙烯的相对分子质量约为28.05 g/mol,密度约为0.88 g/cm3。
在标准大气压下,乙烯的沸点为-103.7°C,冰点为-169.4°C。
它是一种易挥发的气体,在室温下无色无味。
2.燃烧性质乙烯是一种易燃气体,与空气混合形成爆炸性混合物。
当乙烯与氧气混合燃烧时,会产生高温和大量的热量,它的燃烧方程式为:C2H4 + 3O2 → 2CO2 + 2H2O3.溶解性乙烯可溶于非极性溶剂,如乙醚、苯和石油醚等。
在水中的溶解度较低,但可以通过气相吸收法大量溶解于水中。
第二部分:乙烯的化学性质1.加成反应乙烯是一种具有高度反应性的烯烃,它可以与许多化合物发生加成反应,生成新的化合物。
例如,乙烯与卤素发生加成反应生成卤代乙烷,与酸发生加成反应生成乙醇。
2.聚合反应乙烯是一种重要的合成树脂和合成橡胶的原料,它可以通过聚合反应生成聚乙烯。
聚乙烯是一种常见的塑料,具有良好的机械性能和化学稳定性。
3.氧化反应乙烯可以通过氧化反应生成乙烯醇和乙醛。
例如,乙烯在氧气的存在下可以氧化生成乙烯醇,化学方程式为:C2H4 + O2 → C2H4O4.加氢反应乙烯可以通过加氢反应生成乙烷。
在催化剂的作用下,乙烯与氢气反应生成乙烷,化学方程式为:C2H4 + H2 → C2H6第三部分:乙烯的制备方法1.烃基卤化物的脱氢乙烯可以通过烃基卤化物的脱氢制备。
例如,当溴乙烷经过催化剂的作用加热时,可以发生脱氢反应生成乙烯。
2.乙醇的干燥脱水乙烯还可以通过乙醇的干燥脱水制备。
当乙醇在高温下经过干燥剂的作用,会发生脱水反应生成乙烯。
3.集气法乙烯可以通过使用集气法制备。
例如,可以通过乙烷的裂解或气相吸收法从天然气中提取乙烯。
第四部分:乙烯的应用1.化工原料乙烯是一种重要的化工原料,广泛用于合成各种有机化合物,如醇类、酮类、醛类等。

乙烯,也被称为乙烯烷,是一种无色、无臭的气体。
它是一种极为重要的化学物质,广泛应用于许多工业领域。
本文将介绍乙烯的基本概念、制备方法、应用领域以及与环境的关系。
1. 乙烯的基本概念乙烯的化学式为C2H4,由两个碳原子和四个氢原子组成。
它是一种不饱和烃,具有双键结构。
乙烯是一种相对简单的有机化合物,但其重要性却不可低估。
2. 乙烯的制备方法乙烯的主要制备方法包括石油和天然气的裂解以及乙醇脱水。
2.1 石油和天然气的裂解在炼油过程中,石油和天然气中的烃类会通过高温裂解的方式分解成小分子烃烷。
在这个过程中,乙烯会被生成。
2.2 乙醇脱水乙醇可以通过脱水反应生成乙烯。
这种方法常用于工业规模的乙烯生产。
3. 乙烯的应用领域乙烯是一种非常重要的化学原料,广泛应用于许多工业领域。
3.1 塑料工业乙烯是许多塑料的主要原料,如聚乙烯(PE)、聚氯乙烯(PVC)等。
这些塑料在日常生活中随处可见,广泛用于包装材料、建筑材料、电子产品等领域。
3.2 橡胶工业乙烯也是橡胶工业的重要原料之一。
通过聚合反应,乙烯可以制备乙烯基橡胶,被广泛应用于轮胎、密封件等产品中。
3.3 化工工业乙烯在化工工业中也有广泛应用。
它可以用于制备乙烯醇、醋酸乙烯、乙烯胺等化学品,这些化学品又可以用于制备其他有机化合物。
3.4 药品工业乙烯还被应用于药品工业。
例如,它可以用于制备乙烯吡啶,作为抗生素的合成原料。
4. 乙烯与环境乙烯的广泛应用给环境带来了一定的影响。
首先,乙烯的生产需要大量的能源消耗,会增加温室气体的排放。
其次,废弃的塑料制品会对环境造成污染。
因此,需要采取措施来减少乙烯的生产和塑料的使用,以保护环境。
结论乙烯作为一种重要的化学物质,具有广泛的应用领域。
它不仅是塑料和橡胶的主要原料,还被应用于化工和药品工业。
然而,乙烯的生产和使用对环境也带来了一定的影响,需要采取措施来减少其负面影响。
通过合理的生产和使用乙烯,我们可以更好地平衡其经济和环境效益。
乙烯的性质和用途乙烯是一种无色、无味的气体,化学式为C2H4,相对分子质量为28.05、以下是关于乙烯的性质和用途的详细介绍:乙烯的物理性质:1.熔点和沸点:乙烯的熔点为-169.4°C,沸点为-103.9°C。
2. 密度:乙烯的密度为0.879 g/cm33.溶解性:乙烯在水中几乎不溶,但可以溶于有机溶剂如醚、醇、酮等。
4.稳定性:乙烯具有较高的化学稳定性,不易燃烧,但在高温和高压条件下会发生自发性聚合反应。
乙烯的化学性质:1.氧化反应:乙烯可以与氧气发生燃烧反应,生成二氧化碳和水。
2.加成反应:乙烯是一种典型的亲电试剂,在反应中与其他化合物发生加成反应,如和卤代烷反应生成烷烃,和水反应生成乙醇等。
3.聚合反应:乙烯是一种重要的单体,可以发生聚合反应生成聚乙烯,这是一种常用的塑料材料。
乙烯的用途:1.聚乙烯的制备:乙烯是聚乙烯的主要原料。
通过高温、高压催化剂的作用,乙烯通过聚合反应可以制备聚乙烯。
聚乙烯是一种重要的塑料材料,具有良好的化学稳定性、电绝缘性能和低温耐性,广泛用于包装、建筑、电子、汽车等行业。
2.乙烯的制醇:乙烯可以通过加水反应生成乙醇。
乙醇是一种重要的有机溶剂,广泛用于化工、制药、冶金等领域。
3.乙烯的制醛:乙烯通过氧化反应可以生成乙醛。
乙醛是一种常用的有机合成原料,广泛用于制造树脂、染料、药品等。
4.乙烯的制酯:乙烯可以与酸酐反应生成相应的酯。
乙烯酯是一种重要的溶剂和涂料原料,在化工、油漆、印刷等领域中有广泛的应用。
5.乙烯的制橡胶:乙烯可以通过聚合反应制备乙烯橡胶。
乙烯橡胶具有高强度、耐磨性好等特点,广泛用于轮胎、密封件、管道等领域。
6.乙烯的催化裂化:乙烯可以通过催化裂化反应在高温下分解成其他有机化合物,如乙苯、丙烯等。
这些有机化合物是许多化工产品的重要原料。
7.乙烯的用于水果成熟:乙烯可以作为植物生长激素,促进水果的成熟和脱落。
总结:乙烯是一种重要的化工原料,具有广泛的用途。
乙烯的理化性质及危险特性
概述
乙烯(又称乙烯烃、乙烯基)是一种无色、无臭的气体,分子
式为C2H4。
它是有机化合物的一种,常见于石油、天然气等化石
燃料的裂解产物中。
乙烯具有一些重要的理化性质和危险特性,本
文将对其进行介绍。
理化性质
1. 熔点和沸点:
- 乙烯的熔点为-169.4℃,沸点为-103.7℃。
由于其较低的沸点,乙烯常以气体形式存在。
2. 密度:
- 乙烯的密度为0.909 g/cm³(20℃,液态),0. g/cm³(0℃,
气态)。
3. 溶解性:
- 在常温下,乙烯几乎不溶于水,但可溶于多数有机溶剂,如
醇类、醚类和脂类等。
4. 燃烧性:
- 乙烯是易燃物质,在空气中与氧气反应会产生火焰,燃烧产物主要为二氧化碳和水。
5. 化学反应:
- 乙烯可以通过加成反应与许多物质发生反应,如与卤素、硫酸、硝酸等。
危险特性
1. 火灾和爆炸:
- 乙烯是易燃气体,与火源接触可能引发爆炸。
在空气中的浓度达到3.4%到36%时,乙烯能够形成可燃气体混合物。
2. 毒性:
- 乙烯对人体有一定的毒性,长时间暴露于高浓度乙烯气体中会引起嗜睡、头痛、头晕等中毒症状。
3. 环境影响:
- 乙烯会对环境造成一定影响,其燃烧生成的二氧化碳是温室
气体之一,对全球气候变化产生影响。
结论
乙烯是一种重要的化学物质,具有独特的理化性质和危险特性。
在使用和处理乙烯时,应注意其易燃性和对人体健康的影响,同时
也要重视其对环境的潜在影响。
乙烯知识点归纳总结一、乙烯的分子结构乙烯是一种无色、易燃、具有强烈气味的有机化合物,分子式为C2H4。
其结构式为H2C=CH2,乙烯分子是由两个碳原子和四个氢原子组成的,其中碳原子以双键连接,这是乙烯最重要的结构特征。
二、乙烯的物理性质乙烯是一种透明、无味的气体,具有强烈的刺激性。
其密度为0.925g/L,比空气轻。
在标准压力下,乙烯的沸点为-103.7℃,熔点为-100.6℃。
乙烯的溶解性较好,可以溶解在有机溶剂中。
三、乙烯的化学性质1、氧化反应:乙烯与氧气反应,生成环氧乙烷和水。
2、加成反应:乙烯与氢气反应,生成乙烷;与卤素单质反应,生成卤代烷;与水反应,生成乙醇。
3、聚合反应:乙烯在一定条件下可以聚合成高分子化合物。
4、裂解反应:在热和催化剂的作用下,乙烯发生裂解反应,生成小分子烯烃。
四、乙烯的制备主要通过石油裂解和天然气转化两种方法制备乙烯。
石油裂解是将石油中的长链烃断裂成乙烯的过程;天然气转化是将天然气转化为合成气,再进一步转化为乙烯的过程。
五、乙烯的应用1、制造聚合物:乙烯在聚合反应中生成高分子化合物,广泛用于制造塑料、纤维、橡胶等产品。
2、制造有机溶剂:乙烯与水反应生成乙醇,乙醇是一种良好的有机溶剂,可用于制造涂料、油漆等产品。
3、农业用途:乙烯是一种植物生长调节剂,可以促进植物生长和开花。
4、其他用途:乙烯还可用于制造乙醛、乙基胺等化学物质,以及用作制冷剂等。
六、乙烯的安全措施由于乙烯易燃、易爆,因此在处理和储存时应采取以下安全措施:1、储存于阴凉、通风的库房中,远离火源和热源。
2、避免与氧化剂、酸类物质混存。
3、使用防爆电气设备,并定期检查电线绝缘层是否完好。
4、使用前必须对设备进行彻底清洗和干燥,避免产生静电火花。
因式分解知识点归纳总结因式分解是数学中的一种重要技巧,它可以帮助我们简化计算,解决实际问题,并且还在数学竞赛中占有重要的地位。
因式分解就是把一个多项式分解为几个整式乘积的形式,它是一种重要的数学思维方法。
乙烯是一种重要的化学物质,广泛应用于许多工业领域。
本文将以“有关乙烯的知识点”为标题,一步步介绍乙烯的性质、制备方法、应用领域等内容。
乙烯的性质乙烯,化学式为C2H4,是一种无色、无味的气体。
它是一种不饱和碳氢化合物,具有双键结构,因此它的反应性较高。
乙烯比空气轻,可燃,能够与氧气反应产生二氧化碳和水。
乙烯的制备方法乙烯的制备方法主要有以下几种: 1. 石油蒸馏:乙烯是石油分馏过程中的一个副产物,通过对轻油进行分馏,可以获得乙烯。
2. 煤制乙烯:通过高温炼焦或煤气化过程,可以从煤中提取乙烯。
3. 乙烯裂解:将烃类化合物(如丙烷、丁烷等)加热至高温,使其发生裂解反应,产生乙烯和其他碳氢化合物。
乙烯的应用领域乙烯在工业领域有广泛的应用,包括以下几个方面: 1. 塑料制品:乙烯是合成聚乙烯的原料,聚乙烯是一种常见的塑料,广泛用于包装、建筑材料、电线电缆等领域。
2. 合成纤维:乙烯可以用来合成一些合成纤维,如聚丙烯纤维、聚酯纤维等,用于纺织和制衣。
3. 催化剂:乙烯被用作许多化学反应的催化剂,如乙烯可被氧化生成乙烯醇,用于制备乙二醇等化合物。
4. 医药化工:乙烯被用于制备一些医药化工产品,如乙烯醇和乙烯酮等,用于制药和化妆品工业。
乙烯的环境影响尽管乙烯在工业上有广泛的应用,但它也对环境产生一定的影响。
乙烯的燃烧产生的二氧化碳是一种温室气体,会导致气候变暖。
此外,乙烯的生产和加工也会产生一些有害物质,对环境造成污染。
因此,在乙烯的生产和使用过程中,需要采取一些环境保护措施,减少对环境的影响。
总结通过本文的介绍,我们了解到乙烯是一种重要的化学物质,具有广泛的应用领域。
我们了解了乙烯的性质、制备方法、应用领域以及其对环境的影响。
乙烯的应用在现代工业中不可忽视,然而,我们也应该意识到乙烯的生产和使用需要负责任,采取环境友好的措施,保护我们的环境。