碳的多样性(第一课时)导学案
- 格式:doc
- 大小:104.50 KB
- 文档页数:3

《碳的多样性》导学案一、学习目标1、了解同素异形体的概念,知道碳的同素异形体有金刚石、石墨和 C60 等,能从微观结构分析它们性质差异的原因。
2、掌握碳的各种单质的物理性质和用途。
3、了解含碳化合物的多样性,认识碳酸钠和碳酸氢钠的性质差异。
4、了解碳及其化合物之间的转化关系,体会化学变化的规律性。
二、知识梳理(一)同素异形体1、概念:由同种元素组成的不同单质互称为同素异形体。
2、碳的同素异形体(1)金刚石:结构特点:每个碳原子都与相邻的 4 个碳原子以共价键结合,形成正四面体结构。
物理性质:无色透明、硬度极大、不导电。
用途:用于制造钻石、切割玻璃和地质勘探的钻头等。
(2)石墨:结构特点:碳原子呈层状排列,每一层内的碳原子以共价键结合形成平面六边形结构,层与层之间存在范德华力。
物理性质:灰黑色、质软、能导电。
用途:作电极、润滑剂、铅笔芯等。
(3)C60:结构特点:由 60 个碳原子构成的分子,形似足球,又称足球烯。
性质:具有超导性等。
(二)含碳化合物1、种类繁多的碳氢化合物(烃)甲烷(CH4):最简单的烃,是天然气、沼气的主要成分。
乙烯(C2H4):重要的化工原料,可用于催熟水果。
苯(C6H6):一种重要的有机溶剂。
2、碳的氧化物(1)一氧化碳(CO):物理性质:无色、无味、难溶于水的气体。
化学性质:具有可燃性和还原性。
(2)二氧化碳(CO2):物理性质:无色、无味、能溶于水的气体。
化学性质:与水反应生成碳酸,能使澄清石灰水变浑浊。
3、碳酸盐和碳酸氢盐(1)碳酸钠(Na2CO3):俗名:纯碱、苏打。
物理性质:白色粉末,易溶于水。
化学性质:能与酸反应、能与某些碱反应、能与某些盐反应。
(2)碳酸氢钠(NaHCO3):俗名:小苏打。
物理性质:白色细小晶体,易溶于水。
化学性质:受热易分解,能与酸反应。
(三)碳及其化合物的转化1、自然界中的转化植物通过光合作用将二氧化碳转化为有机物。
动植物遗体经过微生物的分解作用将有机物转化为二氧化碳等物质。

第一节:碳单质和化合物预习学案(1课时)教师寄语:如果你想攀登高峰,切莫把彩虹当作梯子。
教学目标:1、了解碳元素在自然界的存在形态2、了解同素异形体的含义3、初步了解金刚石、C60、石墨的结构4、掌握Na2CO3和NaHCCh的主要性质【课前自修】1、同素异形体O碳元素的同素异形体有、、氧元素的同素异形体有、、2、证明石墨、金刚石都有碳元素构成的方法是 _______________________________________________[问题探究]⑴碳元素组成的这些单质物理性质为什么不同?⑵同学们还知道哪些物质之间属于同素异形体的关系?3、构成生物体的基本元素, 是形成化合物种类最多的元素。
碳在自然界中的存在形态:、,碳的常见化合价碳的氧化物有碳酸盐矿石有和等4、碳酸钠俗称或是白色固体,广泛应用于碳酸氢钠俗称________ 也是白色固体,是的主要成分之一。
5、写出下列方程式(1) Na2CO3 +HC1 _________________________________________(2) CaCO3 + HC1 _________________________________________(3) NaHCO3+HCl _________________________________________(4) NaHCO3+NaOH _______________________________________△⑸NaHCO3^= ______________________________________________ 思考:⑴如何鉴别NaHCO3溶液和Na2CO3溶液?⑵如何除去Na2CO3固体中的NaHCO3?课堂导学课前检测:写出下列方程式⑴ Na2CO3 +HC1 __________________________________________(2) CaCO3 + HC1 _________________________________________(3) NaHCO3+HCl _________________________________________(4) NaHCO3+NaOH _______________________________________△(5) NaHCO3^= ____________________________________________[问题探究1]预测碳酸钠和碳酸氢钠有哪些化学性质并设计实验探究实验用品:碳酸钠、碳酸氢钠、盐酸、澄清石灰水、、CaC12溶液、NaOH溶液碳酸盐和酸式碳酸盐(以碳酸钠和碳酸氢钠为例)碳酸钠(NazCOa) 碳酸氢钠(NaHCOa) 物性溶解度:S(Na2C03) S(NaHCO3)与向溶液中滴加现象现象方程式方程式向盐酸中滴加现象现象方程式方程式与NaOH反应与 Ca(0H)z 反应NaHCOa足量NaHC03不足量与氯化钙反应热稳定性互相转化主要用途[思考•练习]⑴如何区别已失去标签的两瓶无色溶液是碳酸钠还是稀盐酸⑵将50mL2mol/L的碳酸钠溶液逐滴滴入80mL2mol/L的稀盐酸中和将80mL2mol/L的稀盐酸逐滴滴入50mL2mol/L的碳酸钠溶液中产生的CO2一样多吗?为什么?⑶如何除去括号内的杂质?写出除杂试剂及有关反应的化学方程式Na2CO3溶液(NaHC03)____________________________________________________NaHC03溶液(NazCOa) __________________________________________________NazCOa 固体(NaHCOa)__________________________________________________⑷向饱和碳酸钠溶液中通入过量的二氧化碳气体,有何现象发生?请分析原因[问题探究2] Na2CO3和NaHCO3之间可以怎样相互转化?Na2CO3___________________ > NaHCO3[问题探究3]1、如何鉴别一瓶无色溶液是Na2CO3还是NaHCO3溶液?方法一: ___________________________________________________________________方法二:__________________________________________________________________ 2、如何证明NaHCO3与碱发生了反应?当堂检测1、下列叙述中,正确的是()A、由碳元素组成的物质一定是纯净物B、金刚石和石墨有相同的元素组成C、石墨转变为金刚石的反应属于氧化还原反应D、C60是新发现的一种碳的单质2、下列说法正确的是()A、石墨转化成金刚石不是化学变化B、C60是一种新型化合物c、C60的摩尔质量是7 2 0 D、C60和石墨互为同素异形体3、可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法是()A、加热时无气体放出B、滴加盐酸时有气泡放出B、溶于水后滴加氯化袱稀溶液有白色沉淀生成D、溶于水后滴加澄清的的石灰水有白色沉淀4、跟Na、Na2O, Na2O2^ NaOH、Na2CO3、NaHCO3六种物质都能发生反应的是()A 水B二氧化碳C硫酸液D氢氧化钙溶液5、碳酸钠溶液中的碳酸氢钠,可采用的方法为,离子反应方程式为O为除去碳酸氢钠溶液中的碳酸钠可采用的方法为,离子反应方程式为______________________________________________________________________。


鲁科版必修1第3章第1节碳的多样性(第1课时)学案1.掌握Na 2CO 3和NaHCO 3的主要性质。
2.掌握Na 2CO 3和NaHCO 3的鉴别与除杂。
细读教材记主干 一、多种多样的碳单质 1.碳在自然界中的存在碳元素的存在形状⎩⎪⎨⎪⎧游离态:如金刚石、石墨等化合态:如二氧化碳、大理石等2.同素异形体(1)概念:由同一种元素组成的性质不同的几种单质。
(2)实例:O 2与O 3、红磷与白磷、金刚石与石墨及C 60。
3.碳的同素异形体比拟1.含碳化合物(1)无机物:如CH 4、CH 3COOH 、淀粉等。
(2)2.Na 2CO 3和NaHCO 3 (1)两者都是白色固体。
(2)都能与盐酸反响。
Na2CO3与盐酸反响的离子方程式为:CO2-3+2H+===H2O+CO2↑。
NaHCO3与盐酸反响的离子方程式为:HCO-3+H+===H2O+CO2↑。
3.Na2CO3和NaHCO3性质的比拟331.Na2CO3溶液与盐酸反响Na2CO3溶液与盐酸反响时,滴加顺序不同,实验现象不同,发生的CO2的量也能够不同。
(2)不用其他试剂可将稀盐酸和Na2CO3溶液鉴别开。
[典例印证][例题1] 有15 mL 2 mol·L-1的H 2SO 4溶液与15 mL 3 mol·L-1的Na 2CO 3溶液,欲使其反响发生CO 2的量最多,那么正确的操作是( )A .把两种溶液快速混兼并不时搅拌B .把两种溶液缓慢混兼并不时搅拌C .把H 2SO 4溶液滴加到Na 2CO 3溶液中D .把Na 2CO 3溶液滴加到H 2SO 4溶液中 [解析] n (H +)=0.015×2×2 mol =0.06 mol ,n (CO 2-3)=0.015×3 mol =0.045 mol 。
因:CO 2-3――→H +HCO -3――→H +CO 2↑,且n (CO 2-3)<n (H +)<2n (CO 2-3),所以假定要使生成CO 2最多,须把Na 2CO 3溶液滴加到H 2SO 4溶液中。

第一节碳的多样性学案【学习目标】1、了解同素异形体的概念,知道碳有三种常见的同素异形体,它们的物理性质差异主要是由于碳原子的排列方式不同引起的。
2、知道含碳化合物种类繁多,一般为无机化合物和有机化合物。
3、认识Na2CO3和NaHCO3的主要性质,初步体会其性质差异。
4、了解碳及其化合物之间的转化和性质,并利用所学知识解释社会生活和自然现象。
体会化学在人类生产生活中的应用。
【学习内容】1.同素异形体的定义是:。
碳元素的同素异形体有:等。
在石墨中,碳原子呈排列,每一层上的碳原子以强的相互作用形成结构。
在金刚石中,碳原子之间以强的相互作用连接,形成结构。
C60分子形似足球,碳原子位于球的表面,呈排列。
不同,决定着碳的各种单质有着不同的性质。
2.含碳化合物可分为和。
含碳无机物中有两种重要的氧化物CO和CO2。
绿色植物通过作用吸收CO2,通过作用将CO2释放到大气中。
由于人类活动经由多途径增加大气中的CO2,使CO2的含量猛增,从而导致效应。
碳的另一氧化物CO在工业上常用做还原剂,高炉炼铁中CO还原Fe2O3的反应方程式:;含碳有机物也可以无机物为原料来合成,1828年,德国化学家用无机物NH4CNO合成出有机物(填化学式)。
3.Na2CO3俗称,是色体,广泛应用于玻璃、造纸等工业;NaHCO3俗称,也是色体,是发酵粉的主要成分之一。
Na2CO3分别与盐酸、澄清石灰水反应的离子方程式为、;NaHCO3分别与盐酸、NaOH溶液反应的离子方程式为、;鉴别Na2CO3和NaHCO3固体常用的方法是。
有关反应的化学方程式为。
4.Na2CO3和NaHCO3相互转化的化学方程式是:NaHCO3→Na2CO3:①②;Na2CO3→NaHCO3:。
5.用化学方程式表示钟乳石、石笋的成因:①②。
6.我们使用的自来水中往往含有碳酸氢钙,因此水壶内壁常含有水垢。
写出形成水垢的主要化学方程式,用食醋浸泡,再用水清洗可除之,写出有关的化学方程式。

碳的多样性导学案本资料为woRD文档,请点击下载地址下载全文下载地址第3章第1节碳的多样性(第1课时)【学习目标】.熟练掌握Na2co3和NaHco3的性质,能够分析解决生活中与之相关的问题。
2.独立思考,小组合作,会用研究物质性质的方法和程序实验探究Na2co3和NaHco3的性质差异。
3.激情投入,体会碳酸盐在人类生产、生活中的应用。
【使用说明与学法指导】.明确学习目标,仔细阅读教材62~65页,勾画碳及其化合物的主要知识,了解金刚石、石墨和c60的结构性质,初步完成导学案。
2.结合“活动•探究”栏目,明确实验内容,大胆预测实验现象,初步得出实验结论。
3.c层规范完成预习案并掌握课本相关的基础知识,AB 层在掌握预习案基础上进一步完成探究案和针对训练。
标有★的训练题目c层不做。
预习案.判断同素异形体的依据是什么?请列举二例说明。
2.比较Na2co3和NaHco3名称碳酸钠碳酸氢钠化学式俗名颜色、状态溶解性用途【我的疑问】对课本预习内容,你还有什么疑问?【预习自测】.下列叙述中正确的是()A.碳酸钠是焙制糕点所用的发酵粉的主要成分之一B.金刚石、石墨和c60在氧气中完全燃烧都生成二氧化碳c.碳酸氢钠俗称纯碱或苏打,是白色固体,广泛用于玻璃、造纸等工业D.H2o和H2o2互为同素异形体探究案探究点:碳酸钠和碳酸氢钠的化学性质【方法导引】碳酸钠和碳酸钙的都属于碳酸盐,你已经知道了碳酸钙的化学性质,碳酸钠是否具有类似的化学性质?碳酸氢钠与碳酸钠在组成上有相似之处,碳酸氢钠是否具有与碳酸钠类似的性质呢?性质预测:.碳酸钠可能与哪些物质发生反应?2.碳酸氢钠可能与哪些物质发生反应?。

碳是自然界中最丰富的化学元素之一。
它在地球生命的各个方面都扮演着重要的角色。
在化学和生物化学中,碳是最重要的元素之一,因为它可以形成的化合物数量和种类是最多的。
本文将介绍《碳的多样性》第一课时教案,从中了解碳的多种形式和多种化合物的形成。
第一节:碳的基本性质谈到碳,我们不得不首先了解碳的基本性质。
不同于其他元素,碳不仅可以形成原子间的键,而且还可以形成键的数量和类型非常多的化合物。
碳有四个价电子,可以参与到四个单键或多个共价键中,并形成链状,环状,和立体结构。
同时,此外,还应该了解碳的同素异形体,同分异构体,半胱氨酸和硫氨基酸等重要概念。
第二节:碳的多样性在碳的多样性方面,我们可以通过了解钻石和石墨的差异来进一步了解碳的多样性。
钻石由于其刚性和耐用性被广泛用于饰品和切割工具中。
而石墨由于其独特的的种族特征,可以用于很多不同的化学和物理应用中。
除此以外,二十世纪初,科学家萨克斯(H. Soros)发现了一个六元环(碳原子的环数是6),并称其为「苯」。
苯环中的碳原子在构型上是等价的,激发态的苯分子结构是拉链式的,针对苯分子的拉曼光谱对苯的光散射进行分析,可以解释苯环结构的对称性。
除了苯之外,还有许多其他碳的六元环结构,如邻二甲苯,苯的衍生物如萘、荧光基团等,在食品、香料、化妆品等产业有着广泛的应用。
第三节:碳的化学反应在第三节课程中,我们将会进一步了解碳的化学反应。
碳的化学性质是很活泼的,因此,碳经常会发生化学反应。
碳和氧气反应,可以形成CO2(二氧化碳)。
碳还可以形成与氢气结合的化合物,其典型的化合物为甲烷(CH4)。
此外,碳还可以在蒸氨的条件下与氮形成碳-氮化合物,如氰化物、兰可汀等。
结论《碳的多样性》第一课时教案详细地介绍了碳的基本性质、多样性和化学反应。
通过学习这些,我们可以深入了解碳在自然界和人类社会当中的重要性。
另外,通过学习,我们还可以了解到碳的多功能性,这对于未来的科学研究和工业生产都具有重要的意义。

3.1.1 碳的多样性学案(一)第一课时碳的物质家族课前学案知识回顾:_____________碳单质_____________的_____________一、物质_______________________家化合物_______________________族______________________________________________二、温室效应产生的原因大气中_______含量增多是引起温室效应的最主要原因。
新课预习:一、碳单质的多样性——同素异形体1.定义:_______________________________________________________。
2.常见碳元素的同素异形体有__________________。
填写下表:问题:理论上如何用实验证明金刚石、石墨和C60均由碳元素组成?3.你了解的其它同素异形体还有_______________________________二、碳的化合物的多样性1.碳元素的无机化合物的多样性(1)常见无机化合物:CO、CO2、H2CO3、碳酸钠、碳酸氢钠、大理石、方解石(______)、白云石[____________]、菱锌矿(______)、菱铁矿(______)、菱镁矿(______ )。
(2)碳酸盐的定义:像碳酸钠这样含的CO的盐称为碳酸盐。
自然界中常见的碳酸盐如________________________________________________________________________。
碳酸氢盐的定义:像碳酸氢钠这样含的HCO3-的盐称为碳酸氢盐。
中学化学中常见的碳酸氢盐有__________________________。
2.碳元素的有机化合物的多样性常见有机化合物:如蛋白质、淀粉、油脂、以及石油、液化气、天然气等的主要成分;课堂学案:重难点突破:一、CO与CO比较(用文字或化学方程式表示)233①热稳定性不同。

鲁科版必修1第一节《碳的多样性》学案高一化学课时预习学案知识梳理自主学习一、多种多样的碳单质1、金刚石:________________的晶体,正八面体结构,是最硬的天然物质。
可用于装饰品,切割玻璃、大理石等。
2、石墨:________色,有金属光泽__________________的固体,质软,_________性良好。
常用于做电极、铅笔芯。
3、C60分子:________色的固体,常储存在_________等有机溶剂中。
因其结构像足球,故名足球烯。
它在材料科学,超导体等方面有广泛的应用。
随着技术的发展,人们以发现了管状单质—纳米管,其用途也将不断扩大。
4、同素异形体由相同的_______组成的__________的几种单质,叫做该元素的同素异形体。
碳的同素异形体有________、________、________,氧的同素异形体有________、________,磷的同素异形体有________、________。
二、广泛存在的含碳化合物1、碳在自然界中的存在碳在自然界中主要以__________的形式存在。
有机物中如________、________、________中都含有碳元素,大气中的二氧化碳、各种碳酸盐矿石如________、________、白云石、菱镁矿、菱铁矿都是含碳元素的无机化合物。
2、碳酸钠和碳酸氢钠的性质比较碳酸钠碳酸氢钠俗名色态溶解性大较小稳定性难分解受热易分解与盐酸反应与氢氧化钠反应不反应与氯化钙反应不反应鉴别不分解;与氯化钙反应易分解;与氯化钙不反应转化用途预习自测1、下列各项是某科学工作者列举的说明金刚石和石墨两种单质是同素异形体的依据,你认为依据充分的是()A、高温、高压下,石墨能转化金刚石,且它们之间的转化是化学变化B、金刚石和石墨的化学性质差别和很大C、金刚石和石墨的物理性质差别和较大D、在一定温度下,金刚石和石墨在纯净的足量的氧气中燃烧都只产生二氧化碳2、有关的下列说法中,正确的是( )A、是一种新型的化合物B、是由60个碳原子构成的一种单质分子C、摩尔质量是720 gD、C60能导电3、下列叙述中,正确的是( )A、由碳元素单质组成的物质一定是纯净物B、金刚石和石墨具有相同的元素组成C、石墨转变为金刚石不属于化学变化D、C60是新发现的一种碳的单质4、除去混在碳酸钠粉末中的少量碳酸氢钠,最合理的方法是()A、加热B、加氢氧化钠溶液C、加盐酸D、加氯化钙溶液5、除去混在碳酸氢钠粉末中的少量碳酸钠的方法是()A、加热B、加氢氧化钠溶液C、加足量的盐酸D、通入足量的二氧化碳6、关于碳酸钠和碳酸氢钠的说法中,正确的是()A、碳酸钠的溶解度在相同条件下比碳酸氢钠大B、碳酸钠可与氯化钙溶液反应,碳酸氢钠也可与氯化钙溶液反应C、碳酸氢钠比碳酸钠稳定D、等物质的量的碳酸钠和碳酸氢钠与盐酸反应,消耗HCl的物质的量之比为2:1,而放出的气体的物质的量之比为1:1青云学府高一化学课时导学案第一节碳的多样性(第一课时)教学过程[阅读]教材P62的内容,了解碳元素的几种单质一、多种多样的碳单质同素异形体:2、不同的同素异形不同相似。

即墨二中2013-2014学年度高二文化学学案 编号:1使用时间:2014-2 编制:于雪云 审核: 高二化学备课组 领导签字: 班级: 小组: 学生姓名:碳的多样性【学习目标】(1)掌握碳及其化合物的化学性质.知识点一 多种多样的碳单质 【探究活动】1.自然界中的碳元素既有游离态又有化合态,举例说明哪些物质中碳元素以游离态存在?哪些物质中碳元素以化合态存在?2.同素异形体是指由同一种元素组成的性质不同的几种单质。
碳常见的同素异形体有哪些?3.同素异形体之间的转化是否属于氧化还原反应?以O 2与O 3之间的转化为例加以说明。
知识点二 广泛存在的含碳化合物 【探究活动】1.下列含碳元素的物质中,哪些属于有机物?哪些属于无机物? (1)酒精 (2)二氧化碳 (3)甲烷 (4)大理石 (5)淀粉 (6)碳酸镁(7)小苏打 2.如上图,按装置进行实验准备,然后将球泡内的等质量的碳酸钠和碳酸氢钠的粉末同时倒入等体积、等浓度的稀盐酸中。
仔细观察实验,完成下列填空。
(1)实验现象:__________________________________________________________ ________________________________________________________________________ ________________________________________________________________________。
(2)反应的化学方程式:______________________________________________________________________;______________________________________________________________________。
(3)离子方程式:_________________________________________________________; ______________________________________________________________________。
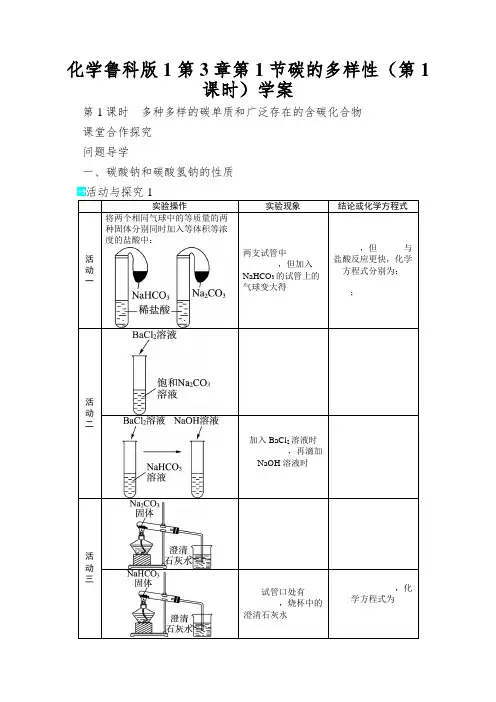
化学鲁科版1第3章第1节碳的多样性(第1课时)学案第1课时多种多样的碳单质和广泛存在的含碳化合物课堂合作探究问题导学一、碳酸钠和碳酸氢钠的性质活动与探究1摸索与交流1.Na2CO3和NaHCO3都易与盐酸反应,但NaHCO3与盐酸反应比碳酸钠更剧烈。
什么缘故?2.如何除去Na2CO3固体中的NaHCO3固体?3.你能从物质类别的角度归纳碳酸钠和碳酸氢钠的化学性质吗? 1.2.所有的碳酸盐都能够与盐酸反应放出CO2气体;3.所有的碳酸氢盐都溶于水,都具有受热易分解的性质,都既能与酸反应又能与碱反应(即HCO -3与H +和OH -都不能大量共存)。
二、物质的检验和鉴别 活动与探究2Na2CO3、NaHCO3均为白色固体,溶液均无色,请摸索讨论并交流如何鉴别这两种物质?()摸索与交流能否使用Ca(OH)2溶液或Ba(OH)2溶液来鉴别Na2CO3溶液和NaHC O3溶液?1.Na2CO3溶液与盐酸反应Na2CO3溶液与盐酸反应时,滴加顺序不同,实验现象不同,产生的C2.NaHCO3溶液与盐酸反应不管将NaHCO3溶液滴入盐酸中,依旧将盐酸滴入NaHCO3溶液中,都只发生反应:NaHCO3+HCl===NaCl +CO2↑+H2O ,即开始滴加就会有CO2气体生成。
迁移与应用某学校的实验室有一瓶碳酸氢钠,由于放置时刻过久,不知是否变质。
(1)请你利用所学过的知识,设计一简单的实验,确定这瓶碳酸氢钠是否变质。
你设计的实验方案:____________________________________。
(2)假如变质了,请你设计实验方案,确定其是否完全变质。
你设计的实验方案:________________________。
当堂检测1.下列叙述中正确的是( )A .仅由碳元素组成的物质一定是纯洁物B .金刚石和石墨具有相同的化学组成C .石墨转变为金刚石不属于化学变化D .只含有碳元素的物质可能是单质也可能是化合物 2.下列关于碳酸钠和碳酸氢钠的比较中,正确的是( ) A .热稳固性:Na2CO3<NaHCO3B.碱性:Na2CO3<NaHCO3C.在水中的溶解度:Na2CO3>NaHCO3D.与足量的盐酸反应产生的气体的体积:Na2CO3<NaHCO33.欲鉴别浓度均为3 mol·L-1的Na2CO3和NaHCO3两溶液,下列方法可行的有()①分别滴入澄清石灰水②分别用pH试纸测pH③分别滴入3 mol·L-1的盐酸④分别滴入NaOH溶液A.②③B.①②C.①②③D.①③④4.除去下列物质中的杂质。
《碳的多样性第一课时》导学案学习目标定位:•能记住同素异形体的概念,知道碳的三种同素异形体,它们的物理性质有较大的差别,导致物理性质相异的主要原因是碳原子的排列方式不同。
•知道含碳元素的化合物种类繁多,一般分为含碳的无机化合物和有机化合物两大类,通过活动探究认识碳酸钠和碳酸氢钠的主要性质,初步体会它们性质的差异。
知识点一多种多样的碳单质【探究活动】.自然界中的碳元素既有游离态又有化合态,举例说明哪些物质中碳元素以游离态存在?哪些物质中碳元素以化合态存在?F面分别是石墨、金刚石和的图片.同素异形体是指由同一种元素组成的性质不同的几种单质。
根据所学知识,你认为形成同素异形体的原因是什么?你能证明金刚石和石墨是同素异形体吗?如何证明?.同素异形体之间的转化是否属于氧化还原反应?以与之间的转化为例加以说明。
【学以致用】.下列说法中正确的是()•木炭和石墨都是由碳元素组成的纯净物•石墨能导电,木炭有吸附能力.造成金刚石和石墨物理性质的差异是由于组成两种物质的元素不同.是一种新型化合物知识点二广泛存在的含碳化合物【探究活动】.下列含碳元素的物质中,哪些属于有机物?哪些属于无机物?() 酒精() 二氧化碳() 甲烷() 大理石() 淀粉() 碳酸镁() 小苏打如上图,按装置进行实验准备,然后将球泡内的等质量的碳酸钠和碳酸氢钠的粉末同时倒入等体积、等浓度的稀盐酸中。
仔细观察实验,完成下列填空。
() 实验现象:() 反应的化学方程式:;。
() 离子方程式:;。
() 问题思考①为什么与稀盐酸的反应不如与稀盐酸的反应剧烈?②滴加盐酸后产生无色无味且能使澄清石灰水变浑浊的气体的溶液中是否一定含有?实验装置:如上图,用大试管盛装固体进行加热,用澄清石灰水对产物进行检验。
实验步骤:①按装置图进行仪器连接,②在烧杯内加入水,用酒精灯微热大试管进行气密性检验,③在大试管中装入固体(或固体),在烧杯内加入澄清石灰水,④用酒精灯加热药品,观察实验现象。
第一节《碳的多样性》【学习目标】1、了解同素异形体的概念,知道碳有三种同素异形体,它们的物理性质有较大的差异,导致物理性质相异的主要原因是碳原子的排列方式不同。
2、知道含碳元素的化合物种类繁多,一般分为无机含碳化合物与有机化合物两大类;认识Na2CO3与NaHCO3的主要性质,初步体会它们性质的差异。
【学习重难点】同素异形体的含义,Na2CO3与NaHCO3的性质。
预习教材,填写下表思考:同是由碳元素组成的单质,为什么金刚石、石墨、C60的物理性质有如此大的差异?一多种多样的碳单质1、同素异形体:由同组成的的几种,叫做该元素的同素异形体。
碳元素的同素有、、等,和是氧元素的同素异形体。
和是磷元素的同素异形体。
注意:a、同素异形体之间,性质不同,性质相似。
b、同素异形体之间的转化是物理变化还是为化学变化呢?二广泛存在的含碳化合物1、含碳化合物的分类、、、等为无机化合物。
2、Na2CO3和NaHCO3的物理性质比较注意:Na2CO3和NaHCO3虽然都属于类,但它们的溶液都显性,因此被用做。
【活动探究】碳酸钠与碳酸氢钠的化学性质方法导引:碳酸钠和碳酸钙都属于碳酸盐,你已经知道了碳酸钙的化学性质,碳酸钠是否具有类似的性质,碳酸氢钠与碳酸钠在组成上有相似之处,碳酸氢钠是否具有与碳酸钠类似的性质呢?试剂及相关仪器:Na2CO3固体、NaHCO3固体、Na2CO3溶液、NaHCO3溶液、稀HCl、CaCl2溶液等。
[注意事项]:1、试剂药品的取量;2、缓慢滴加试剂;3、操作正确;4、安全问题;[温馨提示]:小组内注意合作分工总结:Na2CO3和NaHCO3化学性质,写出相关反应的化学方程式和离子反应方程式。
思考1:为什么实验①中NaHCO3溶液与稀HCl反应比Na2CO3溶液与稀HCl反应更剧烈?思考2:如何鉴别一种白色固体粉末是Na2CO3还是NaHCO3?思考3:如何除去Na2CO3固体中的NaHCO3?思考4:NaHCO3与NaOH溶液反应,而Na2CO3则不能与NaOH溶液反应,若把NaOH换成Ba(OH)2溶液,情况如何呢?写出相关反应的化学方程式及离子方程式。
《碳单质的多样性》导学案一、学习目标1、了解碳单质的存在形式和物理性质。
2、理解碳单质的结构特点与物理性质之间的关系。
3、掌握碳单质的化学性质,并能解释相关现象。
二、学习重难点1、重点(1)金刚石、石墨和 C60 的物理性质和用途。
(2)碳单质的化学性质。
2、难点(1)碳单质的结构与物理性质的关系。
(2)碳与某些氧化物的反应。
三、知识梳理(一)碳单质的存在形式在自然界中,碳单质主要有金刚石、石墨和 C60 等,此外还有无定形碳,如木炭、焦炭、活性炭和炭黑等。
(二)金刚石1、物理性质金刚石是无色透明、正八面体形状的固体,是天然存在的最硬的物质。
2、用途常用于裁玻璃、切割大理石、加工坚硬的金属,以及装在钻探机的钻头上钻凿坚硬的岩层等。
(三)石墨1、物理性质石墨是深灰色的有金属光泽而不透明的细鳞片状固体,质软,有滑腻感,能导电。
2、用途石墨可用于制作铅笔芯、电极、润滑剂等。
(四)C601、结构C60 分子是由 60 个碳原子构成的,形似足球,这种足球结构的碳分子很稳定。
2、用途C60 在材料科学、超导体等方面有广阔的应用前景。
(五)无定形碳1、木炭具有疏松多孔的结构,因此具有吸附能力,可以吸附一些食品和工业产品中的色素、异味等。
2、活性炭吸附能力比木炭更强,常用于防毒面具、冰箱除味剂等。
3、焦炭用于冶金工业,如炼铁。
4、炭黑常用于制造油墨、油漆、橡胶制品中的填充剂等。
(六)碳单质的结构与物理性质的关系金刚石、石墨和 C60 等碳单质物理性质差异很大,是因为它们中碳原子的排列方式不同。
(七)碳单质的化学性质1、稳定性在常温下,碳单质的化学性质不活泼。
2、可燃性(1)碳在氧气充足的条件下燃烧生成二氧化碳,化学方程式为:C + O2 点燃 CO2(2)碳在氧气不充足的条件下燃烧生成一氧化碳,化学方程式为:2C + O2 点燃 2CO3、还原性(1)碳与氧化铜反应实验现象:黑色粉末逐渐变成红色,生成的气体能使澄清石灰水变浑浊。