物理化学习题课
- 格式:doc
- 大小:82.00 KB
- 文档页数:4

物理化学习题课1. 在密闭容器中,让NH4Cl(s)分解达到平衡后,体系中的相数是:( B )(A)1 (B)2 (C)3 (D) 42 气相中的大小相邻液泡相碰, 两泡将发生的变化是:( A )(A) 大泡变大, 小泡变小(B) 大泡变小, 小泡变大(C) 大泡、小泡均不变(D) 两泡将分离开3 半径为1×10-2 m 的球形肥皂泡的表面张力为0.025 N·m-1,其附加压力为:( D )(A) 0.025 N·m-2(B) 0.25 N·m-2(C) 2.5 N·m-2(D) 10 N·m-24 在同一温度下,微小晶粒的饱和蒸汽压和大块颗粒的饱和蒸压哪个大? ( A )(A) 微小晶粒的大(B) 大块颗粒的大(C) 一样大(D) 无法比较5 把细长不渗水的两张白纸互相靠近(距离为d ),平行地浮在水面上, 用玻璃棒轻轻地在两纸中间滴一滴肥皂液, 两纸间的距离将:( A )(A) 增大(B) 减小(C) 不变(D) (A).(B).(C)都有可能6 有两个电池,电动势分别为E1和E2:H2(p∃)│KOH(0.1 mol·kg-1)│O2(p∃) E1H2(p∃)│H2SO4(0.0l mol·kg-1)│O2(p∃) E2比较其电动势大小:( C )(A) E1< E2(B) E1> E2(C) E1= E2(D) 不能确定7下列电池不属于浓差电池的是:( D )(A) Tl(Hg)(a1)|Tl+(aq)|Tl(Hg)(a2)(B) Na(Hg)(a)|NaCl(m1)|| NaCl(m2)|Na(Hg)(a)(C) Na(Hg)(a)| NaCl(m1)|AgCl(s)|Ag(s)—Ag(s)|AgCl(s)| NaCl(m2)|Na(Hg)(a)(D) Ag(s)|AgCl(s)|NaCl(aq)|Na(Hg)(a)|NaCl(CH3CN溶液)|Na(s)9用铜电极电解0.1mol·kg-1的CuCl2水溶液,阳极上的反应为( B )(A) 2Cl- ─→Cl2+ 2e-(B) Cu ─→Cu2++ 2e-(C) Cu ─→Cu++ e-10. 将反应2Hg(l)+O2(g)+2H2O(l) = 2Hg2++4OH–设计成电池,当电池反应达到平衡时,电池的E必然是:( B )(A) E=E∃(B) E=0(C) E>0 (D) E<01. 在密闭容器中,让NH4CO3(s)分解达到平衡后,体系中的相数是:( C )(A)4 (B)3 (C )2 (D) 12在同一温度下,微小液滴的饱和蒸汽压和大块液体的饱和蒸压哪个大? ( A )(A) 微小液体的大(B) 大块液体的大(C) 一样大(D) 无法比较3 假如具有下列半衰期的等物质的量的放射性元素中, 哪一种对生态是瞬时最危险的? ( C )(A) 4.5×109 a (B) 65 a (C) 1 min (D) 12 d4催化剂能极大地改变反应速率,以下说法不正确的是:( C )(A) 催化剂改变了反应历程(B) 催化剂降低了反应的活化能(C) 催化剂改变了反应的平衡,以致使转化率大大地提高了(D) 催化剂能同时加快正向和逆向反应速率5 0.3 mol·kg-1Na2HPO4水溶液的离子强度是:( A )(A) 0.9 mol·kg-1(B) 1.8 mol·kg-1(C) 0.3 mol·kg-1(D)1.2 mol·kg-16有两个电池,电动势分别为E1和E2:H2(p∃)│KOH(0.2 mol·kg-1)│Cl2(p∃) E1H2(p∃)│H2SO4(0.5 mol·kg-1)│Cl2(p∃) E2比较其电动势大小:(C)(A) E1< E2(B) E1> E2(C) E1= E2(D) 不能确定7下列电池不属于浓差电池的是:(B )(A)Tl(Hg)(a1)|Tl+(aq)|Tl(Hg)(a2)(B)Na(Hg)(a)|NaCl(m1)|| MgCl2(m2)|Mg(Hg)(a)(C)Na(Hg)(a)| NaCl(m1)|AgCl(s)|Ag(s)—Ag(s)|AgCl(s)| NaCl(m2)|Na(Hg)(a)(D) Ag (s)│AgNO3(0.01mol.kg=0.90)║AgNO3(0.1mol.kg=0.72)│Ag (s)9用铜电极电解0.1mol·kg-1的ZnCl2水溶液,阳极上的反应为( B )(A) 2Cl- ─→Cl2+ 2e-(B) Zn ─→Zn2++ 2e-(C) Zn ─→Zn++ e-10. 将反应Ag (s),AgBr (s)│Br(a Br)║Cl(a Cl)│AgCl (s),Ag (s)设计成电池,当电池反应达到平衡时,电池的E必然是:(B)(A) E=E∃(B) E=0(C) E>0 (D) E<01浓度越大,摩尔电导率越大。


物理化学习题(相平衡)一.选择1.在α、β两相中均有A和B两种物质,达到相平衡时,下列各式正确的是(1)。
(1)μαB=μβB(2)μαA=μβA(3)μαB=μαA(4)μαB=μβA2.组分B从α相扩散到β相中,则下列说法中正确的是(4)。
(1)总是从浓度高的相扩散到浓度低的相(2)平衡时两相的浓度相等(3)总是从浓度低的相扩散到浓度高的相(4)总是从高化学势移向低化学势3. 室温下氨基甲酸铵分解反应为 NH2CO2NH4(s)====2NH3(g)+CO2 (g)若在300K时向系统中加入一定量的氨基甲酸铵固体,则此系统的物种数S和组分数C应为(3)。
(1)1,1(2)3,2(3)3,1(4)3,34.将克拉贝龙方程应用于水的液固两相,随压力的增长,水的凝固点将(2)。
(1)上升(2)下降(3)不变(4)无法判断5.在一定温度下,在水和CCl4组成的互不相溶的系统中,向水层中加入1:1的KI和I2,此系统的自由度是(2)。
(1)1(2)2(3)3(4)46.对于二组分系统,能平衡共存的最多相数为(4)。
(1)1(2)2(3)3(4)47.对于恒沸混合物,下列说法中错误的是(4)。
(1)不具有确定的组成(2)平衡时气相和液相组成相同(3)其沸点随外压的改变而改变(4)与化合物一样具有确定的组成二.填空1.在水的平衡相图中。
线是水的蒸发曲线,线是冰的升华曲线,线是冰的融化曲线,点是水的三相点。
.2.将过量NH4HCO3(s)放入密闭真空容器内,50℃时,按NH4HCO3(s)按下式进行分解:NH4HCO3(s)=NH3(g)+CO2(g)+H2O(g)。
达平衡后则该体系的相数P= ,独立组分数C= ,自由度数F= 。
(2,1,0)3.(2)最合适的组成应配成w(联苯醚)=0.78,这一组成具有最低共熔点12℃,其凝固点最低,所以不至于因为凝固而堵塞管道。
4. 求下列系统③从X B=0.5开始蒸馏,馏出物或残留物分别是什么?(1)T M,T N,(2)所处的T,p及气液相组成y B、x B,达两相平衡气液相的相对量不同,(3)0。




第1章 物质的pVT 关系和热性质习 题 解 答1. 两只容积相等的烧瓶装有氮气,烧瓶之间有细管相通。
若两只烧瓶都浸在100℃的沸水中,瓶内气体的压力为0.06MPa 。
若一只烧瓶浸在0℃的冰水混合物中,另一只仍然浸在沸水中,试求瓶内气体的压力。
解: 21n n n +=2212112RT V p RT V p RT V p +=⋅2111121222112p T p T T p T T T T =+⎛⎝⎜⎞⎠⎟=+ ∴112222p T T T p ⋅+=MPa0.0507=MPa 06.02)15.273100()15.2730(15.2730⎥⎦⎤⎢⎣⎡××++++=2. 测定大气压力的气压计,其简单构造为:一根一端封闭的玻璃管插入水银槽内,玻璃管中未被水银充满的空间是真空,水银槽通大气,则水银柱的压力即等于大气压力。
有一气压计,因为空气漏入玻璃管内,所以不能正确读出大气压力:在实际压力为102.00kPa 时,读出的压力为100.66kPa ,此时气压计玻璃管中未被水银充满的部分的长度为25mm 。
如果气压计读数为99.32kPa ,则未被水银充满部分的长度为35mm ,试求此时实际压力是多少。
设两次测定时温度相同,且玻璃管截面积相同。
解:对玻璃管中的空气,p V p V 2211=kPa 0.96=kPa )66.10000.102(35251212−×==p V V p ∴ 大气压力 = kPa 28.100kPa )96.032.99(=+·28· 思考题和习题解答3. 让20℃、20 dm 3的空气在101325 Pa 下缓慢通过盛有30℃溴苯液体的饱和器,经测定从饱和器中带出0.950 g 溴苯,试计算30℃时溴苯的饱和蒸气压。
设空气通过溴苯之后即被溴苯蒸气所饱和;又设饱和器前后的压力差可以略去不计。
(溴苯Br H C 56的摩尔质量为1mol g 0.157−⋅)解:n pV RT 131013252010831452027315==×××+⎡⎣⎢⎤⎦⎥−().(.) mol =0.832 mol n m M 209501570==..mol =0.00605mol p py p n n n 22212101325732==+=×= Pa 0.006050.832+0.00605 Pa4. 试用范德华方程计算1000 g CH 4在0℃、40.5 MPa 时的体积(可用p 对V 作图求解)。
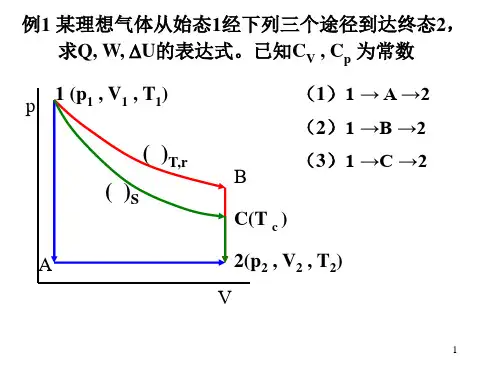


物理化学习题课答案(一)班级:_______________ 姓名:_______________ 学号:_______________一. 选择题1. 对于理想气体的内能有下述四种理解:(1) 状态一定,内能也一定(2) 对应于某一状态的内能是可以直接测定的(3) 对应于某一状态,内能只有一个数值,不可能有两个或两个以上的数值(4) 状态改变时,内能一定跟着改变其中正确的是:( D )(A)(1)(2)(B)(3)(4)(C)(2)(4)(D)(1)(3)2. 下列宏观过程:(1) p,273 K 下冰融化为水(2) 电流通过金属发热(3) 往车胎内打气(4) 水在 101 325 Pa, 373 K 下蒸发可看作可逆过程的是:( A )(A)(1)(4)(B)(2)(3)(C)(1)(3)(D)(2)(4)3. 一定量的理想气体从同一始态出发,分别经 (1) 等温压缩,(2) 绝热压缩到具有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有: ( C )(A) H1> H2 (B) H1= H2(C) H1< H2 (D) 不能确定4. 对于下列的四种表述:(1) 因为ΔH = Qp,所以只有等压过程才有ΔH(2) 因为ΔH = Qp,所以Qp也具有状态函数的性质(3) 公式ΔH = Qp只适用于封闭体系(4) 对于封闭体系经历一个不作其它功的等压过程,其热量只决定于体系的始态和终态上述诸结论中正确的是:( B )(A)(1)(4)(B)(3)(4)(C)(2)(3)(D)(1)(2)5. ΔH = Qp适用于下列哪个过程? ( B )(A) 理想气体从1×107Pa反抗恒定的外压1×105Pa膨胀到1×105Pa(B) 0℃、101325Pa下冰融化成水(C) 101325Pa下电解CuSO4水溶液(D) 气体从298K,101325Pa可逆变化到373K、10132.5Pa6. 在体系温度恒定的变化中,体系与环境之间: ( CD )(A) 一定产生热交换 (B) 一定不产生热交换(C) 不一定产生热交换 (D) 温度恒定与热交换无关7. 在一个刚性的绝热容器中燃 ( B ) C6H6(l) + (15/2) O2(g)6CO2(g)+ 3H2O(g)(A) ΔU = 0 ,ΔH < 0 , Q = 0(B) ΔU = 0 ,ΔH > 0 , W = 0(C) ΔU = 0 ,ΔH = 0 , Q = 0(D) ΔU ≠ 0 ,ΔH ≠ 0 , Q = 08. 体系的压力p(体系)与环境的压力p(环境)有何关系? ( D )(A) 相等 (B) 无关系(C) p(体系)> p(环境) (D) 可逆变化途径中p(体系)=p(环境)9. 如图,在绝热盛水容器中,浸有电阻丝,通以电流一段时间,如以电阻丝为体系,则上述过程的Q、W和体系的ΔU值的符号为: ( B )(A) W = 0, Q < 0,ΔU <0(B) W > 0, Q < 0,ΔU >0(C) W = 0, Q > 0,ΔU > 0(D)W < 0, Q = 0,ΔU > 010. 理想气体卡诺循环的图为下列四种情况中的哪一种? ( BC )11. 测定有机物燃烧热Qp,一般使反应在氧弹中进行,实测得热效应为QV。

习题课2一、 填空题1. A 、B 两液态形成理想液态混合物,温度为T 时纯A 和纯B 的饱和蒸汽压分别为p A *=40KPa 和p B *=120KPa ,该混合物在温度T 及压力100KPa 时开始沸腾,此时的液相和气相组成为x B = 0.75 y B = 0.92. 3.15K 时,苯和甲苯的蒸汽压分别为100KPa 和38.7KPa ,二者形成混合物,其平衡气相组成y(苯)为0.30,则液相组成x(苯)为 0.142( p(苯)/p=y(苯),p(苯)=0.3p. 又:p(苯)=p *(苯)x(苯),即0.3p=100x(苯),代入p=100x(苯)+38.7x(甲苯)=100x(苯)+38.7[1-x(苯)] 即可求得x(苯) )3. NaCl 的饱和溶液与其水蒸气在密闭容器中呈平衡,且有细小的NaCl 晶体存在,则该系统中组分数C= 2 ,相数P= 3 ,自由度数F= 14. 温度T 时,浓度均为0.01mol ·kg -1的NaCl, CaCl 2, LaCl 3三种电解质溶液,离子平均活度系数最小的是 LaCl 3(lg γ±=-0.509∣z +z -∣√I I=1/2∑b B z B 2 则I 值越大,γ±越小)5. 已知298K 时,Zn + Fe 2+===Zn 2+ + Fe 的E Θ=0.323V ,则平衡常数为 8.34×10106. 在溶剂中加入某溶质B ,能使该溶液的表面张力缩小,则该溶质的表面浓度 > 体相浓度, 发生 正 吸附7. 已知乙醇与玻璃的接触角小于90º,将玻璃毛细管下端插入乙醇中,平衡时管内液面呈凹 形,管中液面 高于 管外液面8. 某气体反应的速率方程为 -dp A /dt=3.66p A 2(KPa ·h -1)表示,其反应速率常数的单位是 KPa -1·h -1 ;若以 –dC A /dt=kC A 2(mol ·dm 3·h -1)表示,则反应速率常数的值为 RTk p =3.66RT(k p =k(RT)n-1 n=2)9. 反应)HCl(Ag(s)AgCl(s))(H 2H 2a p +=+可设计成电池:Pt , H 2(p )∣HCl(a )∣Ag(s) , AgCl(s)_。
10月16号习题课题目
1. 指出下列公式适用的条件
(1) dU=δQ-PdV
(2) ΔH=Q P ; ΔU=Q V
(3) 2
2
11;T T P V T T C dT U C dT ∆H =∆=⎰⎰ (4) 21ln
V W nRT V = (5) W=P ΔV
(6) PV γ=常数
(7) 1221ln ln
V V nR P P nR S ==∆ (8) ⎰=∆2
1P P Vdp G
(9) ln mix B B S R
n X ∆=-∑ (10) 12222111
ln ln ln ln p v p T V T S nR C nR C p T V T ∆=+=+ 答案:1. 封闭体系非膨胀功为0
2. ΔH=Q P , 封闭体系、平衡态,不作非膨胀功,等压过程
ΔU=Q V , 封闭体系、平衡态,不作非膨胀功,等容过程
3. 2
1T P T C dT ∆H =⎰,封闭体系、平衡态,状态连续变化的等压过程
2
1
T V T U C d T ∆=⎰,封闭体系、平衡态,状态连续变化的等容过程 对于理想气体,适用于一切过程。
4. 封闭体系、平衡态,不作非膨胀功,理想气体等温可逆过程。
(P11)
5. 封闭体系、平衡态,不作非膨胀功,等外压过程
6. 封闭体系、平衡态,不作非膨胀功,理想气体绝热可逆过程。
(P16)
7. 封闭体系、平衡态,理想气体,等温过程,不作其他功。
P35
8. 封闭体系、平衡态,状态连续变化的等温过程,不作其他功。
9.封闭体系、平衡态,理想气体等温等压混合。
10.理想气体从始态经历任何过程到终态
2. 判断下列说法是否正确
(1) 状态固定后,状态函数都固定,反之亦然。
(2) 状态函数改变后,状态一定改变。
(3) 状态改变后,状态函数一定都改变。
(4) 气缸内有一定量的理想气体,反抗一定外压作绝热膨胀,则ΔH =Q P =0
(5) 根据热力学第一定律,因为能量不能无中生有,所以一个体系若要对外做功,必须从
外界吸收热量。
(6) 在等压下,机械搅拌绝热容器中的液体,使其温度上升,则ΔH =Q P =0
(7) 理想气体绝热变化过程中,W (可逆)=-C V ΔT ,W (不可逆)=-C V ΔT ,所以两个状态之间,W (可逆)=W (不可逆)
(8) 对于只用两个热力学量描述的封闭体系,其P-V 图上任意两条恒温可逆线都不可能相交
(9)绝热循环过程一定是可逆过程
答案:1. 对。
2. 对。
3. 错。
4. 错。
由上题(2)。
这是个等外压的过程,不是等压过程,绝热膨胀后,P2<P1,T2<T1,
焓是温度的函数, 所以ΔH<0
5. 错
6. 错。
由于有非膨胀功的存在。
ΔH ≠Q P
7. 错。
由熵增加原理,绝热不可逆过程的ΔS>0,而绝热可逆过程的ΔS =0,从同一
始态出发,经历一个绝热不可逆过程后的熵值和经历一个绝热可逆过程后的熵值
永不相等,不可能达到同一终态。
8. 对,如果两条线相交,那么两条线具有相同的温度,因而除交点外,同一压力p
时,体系就有两个不同的体积。
此时T ,p 都固定,于只用两个独立变量描述体
系的假设矛盾。
9.对,如果其中有一个过程不可逆,则整个循环的熵必大于零,不可能回到初始的
状态
3. 根据计算说明以下两种状态的的水哪一个更稳定。
(1)H 2O (l,298.2K, p θ)(2) H 2O (g,
298.2K, p θ) 已知如下数据 (a) 水在298.2K 时的饱和蒸汽压是3167.7Pa (b )H 2O (l,298.2K, p θ)-> H 2O (g, 298.2K, p θ) 的1.01.44-=∆mol kJ H m r θ,C p,m (H 2O,g)=30.12+11.3*10-3T J.K -1.mol -1, C p,m (H 2O,l)=75.30J.K -1.mol -1
解:由Gibbs 判据P43,计算状态(1)到(2)的Gibbs 自有能变化就能判断哪种状态
更稳定。
根据题意可以有两种解法:
1.设计如下过程
H 2O (l,298.2K, p θ)(1)-> H 2O (l, 298.2K, 3167.7Pa) (2)-> H 2O (g, 298.2K,
3167.7Pa) (3)-> H 2O (g, 298.2K, p θ)
321G G G G ∆+∆+∆=∆
对于液体01≈∆G (P47),02=∆G
3G ∆=nRTlnp 2/p 1 P47
G ∆
=8591J>0 液态水更稳定。
2.已知H 2O (l,373K, p θ)(1)-> H 2O (g, 373K, p θ) 自有能变化为0
根据Gibbs -Helmholtz 公式(P49)
2T H T T G p
∆-=⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎣⎡∂⎪⎭⎫ ⎝⎛∆∂ ,298-3298(298)44010(30.1211.310T 75.3)T
r m r m p m T H H K C dT dT ∆=∆+∆=++⨯-⎰⎰ 基尔霍夫定律(P25)
=56974-45.19T+5.65*10-3T 3
333732
298(373)(298)5697445.19 5.6510373298r m r m G K G K T T dT K K T -∆∆-+⨯-=-⎰ 得(298)r m G K ∆=8560J>0
4.根据熵增加原理,请论证一个封闭体系由始态A 到同温的状态B ,在等温过程中,可逆过程吸热最多,做功最大。
且在该体系中所有恒温可逆过程中吸的热和做的功都相等。
(P11)
证明:1。
设体系由状态A 经任一等温不可逆过程(I )到达状态B ,吸热Q iR ,做功W iR ,
另外状态A 经等温可逆过程(II )到达状态B ,吸热Q R ,做功W R
用此两过程可以构成一个循环,A 经过程I 到B ,然后经II 的逆过程回到A
此时,系统复原,0=体S ∆,由于是等温过程,环境一定是温度为T 的热源,
T
Q Q S R iR +-∆=环,由于整个循环过程是不可逆的 0〉∆+∆环体S S ,所以Q R >Q iR
由热力学第一定律 iR iR R R W Q W Q U -=-=∆
所以W R >W iR
2. 同理用以上的思路设计包含两个恒温可逆过程的循环过程,而此过程是可逆的。
所以得出两个过程的Q 和W 都相等。
5. 一个绝热容器原处于真空状态,用针在容器上刺一微孔,使298.2K ,P θ的空气缓慢进入,直至压力达平衡。
求此时容器内空气的温度。
(设空气为理想的双原子分子)
解 设终态时绝热容器内所含的空气为体系,始终态与环境间有一设想的界面,始终态 下图所示
P=0 V 1 P=P θ V 1, T 2
P=P θ,
n mol
T 1=298K
在绝热相上刺一小孔后,n mol 空气进入箱内,在此过程中环境对体系做功为
P θV 1。
体系对真空箱内做功为0。
体系做的净功为P θV 1,绝热过程Q =0
ΔU =-W = -P θV 1=nRT 1
又理想气体任何过程:
ΔU = C v (T 2-T 1)
联立上式
nRT 1=C v (T 2-T 1)
对于双原子理想气体 C v =n*5/2R
则 T 2=7/5T 1=417.5K
6. 有一个礼堂容积为1000m 3,气压为P θ,室温为293K ,在一次大会结束后,室温升高了
5K ,问与会者们对礼堂内空气贡献了多少热量?
解:若选取礼堂内温度为293K 的空气为体系,则随着的温度升高,室内空气不断向外
排出,体系已经不在封闭了,实际上这是一个敞开体系,室内空气随着温度的升高 逐渐减少,现选取某一时刻礼堂内的空气为体系,在压力和体积维持恒定时,
n =PV/ RT
等压过程中的热量计算
,,1P P P m P m PV dQ C dT nC dT C dT R T
===
会议过程中的总热量 22112,,1
1ln T T P p P m P m T T T PV PV Q dQ C dT C R T R T ===⎰⎰ 空气为双原子分子,C P,m =7/2R ,P ,V ,R ,T 1均已知,T 2=T 1+5=298K
代入得 Q P =6000.8J
说明:5,6两题超出了要求的范围,只作一般性理解即可,考试中基本不会出现类似的题型。
1-4题中涉及到的内容要求掌握。