q《如何正确书写化学方程式》
- 格式:ppt
- 大小:2.22 MB
- 文档页数:13


如何正确书写化学方程式一、化学方程式1、定义: 用化学式来表示化学反应的式子2、书写原则:①以客观事实为依据②遵循质量守恒定律,等号两边各原子的种类和数目相等二、化学方程式的写法:①写:左边写出反应物的化学式,右边写出生成物的化学式。
如果反应物或者生成物不止一种,就用“+”连接,读作:“和”;反应物和生成物之间用短线连接,读作:“生成”2O P +— 52O P②配平:在化学式前面配上适当的化学计量数,使得反应前后每一种元素的原子总数相等 252O P + — 252O P③注明反应发生的条件,如:点燃、Δ、催化剂等;标出生成物的状态,如:↓,↑把短线改成等号252O P + 点燃 252O P知识点一:化学方程式书写原则 例1. 在炼铁工业中,常用石灰石将铁矿石中的杂质二氧化硅转化为炉渣除去,发生反应的化学方程式为:CaCO 3+SiO 2X+CO 2↑,其中X 的化学式是( ) A . CaSiO 4 B . Ca 2SiO 3 C . CaSi 2O 3 D . CaSiO 3例2.在一密闭容器中加入甲、乙、丙、丁四种物质,在运动条件下发生化学反应,测得反应前及t 1、t 2时各物质质量如图所示,下列说法中不正确的是( )A.该反应为化合反应B.丙可能为该反应的催化剂C.该反应中,乙、丁的质量变化之比为7:5D.该反应中,甲、乙的质量变化之比为1:4例3. 甲烷和水反应可以制备水煤气(混和气体),其反应的微观示意图如图所示:根据以上微观示意图得出的结论中,正确的是()A.水煤气的成分是一氧化碳和氧气B.反应中含氢元素的化合物有三种C.反应前后碳元素的化合价没有发生变化D.反应中甲和丙的质量之比为4:7例4.下列化学方程式书写正确的是()例5. (2015•益阳•11)下列化学方程式与对应反应类型均正确的是()化学方程式反应类型A H2O H2+O2↑分解反应B CaO+H2O═Ca(OH)2化合反应C 2Fe+6HCl═2FeCl3+3H2↑置换反应D SO3+2NaOH═Na2SO4+H2O 复分解反应例6. “题16图”为某化学反应的微观示意图。
如何正确书写化学方程式知识集结知识元化学方程式的书写知识讲解一、化学方程式的书写原则1、定义:用化学式来表示化学反应的式子2、书写原则:以客观事实为依据,不能凭空臆造事实上不存在的物质和化学反应例如铁在氧气中燃烧的产物是四氧化三铁,而不会是氧化铁或者氧化亚铁‚遵循质量守恒定律。
即化学变化前后原子的种类和数目不变。
(质量守恒定律的微观描述)二、化学方程式的书写步骤化学方程式的书写步骤(以高锰酸钾受热分解为例)①根据事实写出反应物和生成物的化学式,并在反应物和生成物之间画一条短线(或标出一个指向生成物的箭头)。
KMnO4-K2MnO4+MnO2+O2②配平化学方程式,并加以检查。
2KMnO4-K2MnO4+MnO2+O2③注明化学反应发生的条件(点燃、加热、催化剂等)标出生成物状态(气体用‘↓’表示、沉淀用‘↓’表示),把短线(或箭头)改成等号。
2KMnO4K2MnO4+MnO2+O2↑注意:当反应物中存在气体时,生成物中的气体无需标气体符号;当在溶液中反应物有固体存在时,生成物中的固体无需标沉淀符号。
例题精讲化学方程式的书写例1.下列化学方程式与对应反应类型均正确的是()化学方程式反应类型A.分解反应H2O H2+O2↑B.CaO+H2O═Ca(OH)化合反应2C.2Fe+6HCl═2FeCl3+3H2↑置换反应D.SO3+2NaOH═Na2SO4+H2O复分解反应A.A B.B C.C D.D例2.下列反应的化学方程式书写正确的是()A.电解水:2H2O2H2↑+O2↑B.镁在空气中燃烧:Mg+O2MgO2C.氯酸钾与二氧化锰共热制氧气:2KClO32KCl+3O2↑D.氧化汞受热分解:2HgO=2Hg+O2↑化学方程式的配平知识讲解一、化学方程式的基本原理化学方程式配平的基本原理是使得反应物中的原子种类和个数与生成物中的原子种类和个数相同。
即质量守恒定律。
例如:P+O2→P2O5使反应物中的原子个数等于生成物中的原子个数,则4P+5O2→2P2O5最后将箭头改为等号,标明条件4P+5O22P2O5二、化学方程式配平的一般方法(一)最小公倍数法这种方法适合常见的难度不大的化学方程式,具体步骤:(1)求出每一种原子在反应前后的最小公倍数;(2)使该原子在反应前后都为所求出的最小公倍数;(3)一般先从氧原子入手,再配平其他原子。


初中化学:正确书写化学方程式一、化学方程式的书写步骤1、翻译:正确书写反应物与生成物的化学式(注意左反应右生成);2、配平:配上适当的化学计量数(一般为整数);3、标注:①注明反应发生的外加条件(如加热、点燃、催化剂、高温、通电等);②用等号把反应物与生成物连接起来;③生成物中不同于反应物状态的气体和沉淀要用“↑”和“↓”标明。
二、化学方程式配平方法1、分数配平法特征是:有单质参加反应或有单质生成的化学反应方程式的“万能配平法”,即先将化学方程式中“单质外”元素原子配平,最后再添加适当分数配平“单质”元素原子。
例1(单质在方程式左侧):FeS2+O2 -- Fe2O3+SO2(单质O2在方程式左侧)简析:(1)观察配平“单质外”元素原子——Fe、S:2FeS2+O2—→Fe2O3+4SO2;(2)配平“单质”元素原子O——O2位置在方程式左侧,可根据右侧O的原子总数来确定O2的计量数为11/2:2FeS2+11/2O2→Fe2O3+4SO2;(3)分数系数化整并标。
4FeS2+11O22Fe2O3+8SO2例2(单质在方程式右侧):KMnO4+HCl—→KCl+MnCl2+Cl2+H2O简析:(1)观察配平“单质外”元素原子——K、Mn、H、O:KMnO4+8HCl—→KCl+MnCl2+Cl2+4H2O ;(2)配平“单质”元素原子Cl——Cl2位置在方程式右侧,可根据左侧Cl的原子总数来确定Cl2的计量数为5/2(此时KCl、MnCl2认为已配平):KMnO4+8HCl—→KCl+MnCl2+5/2Cl2+4H2O ;(3)分数系数化整并标注:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O 练习1. 配平(1)C2H2+ O2→CO2+ H2O (2、5、4、2)(2)CxHyOz+ O2→CO2+ H2O (1、x+y/2-z/2、x、y/2)2、观察法步骤有:(1)通过观察,从化学式比较复杂的一种生成物推求出有关反应物和生成物的计量数。
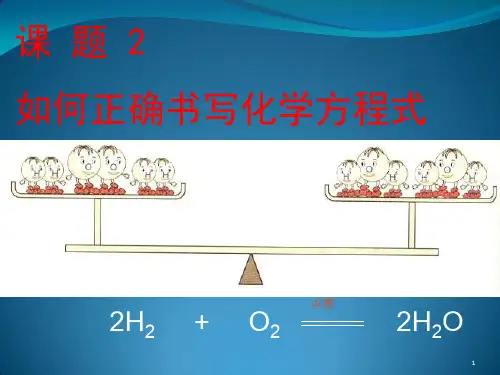

2 如何正确书写化学方程式一.化学方程式的书写方法1. 书写化学方程式必须遵循两个原则①必须以客观事实为基础,不能凭空臆造事实上不存在的物质和化学反应;②遵守质量守恒定律,“等号”两边各种原子的数目必须相等。
2. 书写化学方程式的四个步骤“一物质”:左边写反应物的化学式,右边写生成物的化学式,中间用“=”相连,读作“生成”。
反应物或生成物不止一种时,则在其间用“+”号相连,读作“和”。
“二配平”:依据质量守恒定律,使“等号”两边各种元素的原子总数相等。
(1)配平化学方程式应注意的事项:①不能随意改动化学式右下角的原子个数,只能在化学式前面配上适当数字;②配平后各物质前面的化学计量数不能是分数,必须是最简整数比。
(2)最小公倍数法配平化学方程式第一步,确定第一配平对象。
原则:①左右两边出现机会最少且原子个数不相等的原子;②左右两边原子个数相对较多、变化较大的原子。
第二步,计算选定原子的个数的最小公倍数,用最小公倍数除以该化学式中原子的个数,得到的数值即为化学式前的化学计量数,然后再依次配平其他原子的个数。
第三步,配平过程中,有时为了使左右两边某种原子个数相等,会引入分数,而且分数往往配在单质化学式的前边,待方程配平后,只要将各化学式前的系数同乘以该分数的分母,即可将分数消除(注意:消除分母后,各化学式前的系数应是最简整数比)。
第四步,化学计量数配出后要认真检查,确保左右两边各种原子的个数相等。
“三条件”:在等号上方或下方标明反应发生的条件。
有些化学反应在常温(室温)下就能进行,不用标示:有的化学反应必须在一定条件下才能进行,就需标明。
这些条件包括:点燃、加热、高温、催化剂、通直流电、加压或减压、光照等。
“四箭头”:表示生成物的状态。
如果生成物中有气体,在气体物质的化学式右边要注“↑”号;如果生成物中有固体,在固体物质的化学式右边要注“↓”;但如果反应物和生成物都有气体,气体生成物就不需注“↑”,同样,如果反应物和生成物中都有固体,固体生成物也不需注“↓”。

化学方程式的写法和平衡法则化学方程式是表示化学反应的数学表达式,它由反应物、生成物和反应条件组成。
化学方程式的写法遵循一定的规则,即平衡法则。
平衡法则要求化学方程式中的反应物和生成物的原子数目必须相等,以保持反应前后的原子守恒。
一、化学方程式的写法:1.反应物:反应物位于化学方程式的左侧,用“+”号分隔。
2.生成物:生成物位于化学方程式的右侧,用“+”号分隔。
3.反应条件:反应条件位于化学方程式的上方或下方,如温度、压力、催化剂等。
4.化学式:化学式表示化合物中元素的种类和数目,元素符号表示元素,下标表示原子数目。
5.状态符号:状态符号表示物质的状态,如(s)表示固体,(l)表示液体,(g)表示气体,(aq)表示溶液。
二、平衡法则:1.原子守恒:化学方程式中反应物和生成物的原子数目必须相等,以保持反应前后的原子守恒。
2.电荷守恒:化学方程式中反应物和生成物的总电荷数目必须相等,以保持反应前后的电荷守恒。
3.质量守恒:化学方程式中反应物和生成物的总质量数目必须相等,以保持反应前后的质量守恒。
三、化学方程式的平衡:1.平衡状态:当化学方程式中反应物和生成物的原子数目相等时,方程式达到平衡状态。
2.平衡常数:平衡常数(K)表示在平衡状态下反应物和生成物的浓度比值。
3.平衡移动:当平衡状态下反应物浓度增加或生成物浓度减少时,平衡会向生成物方向移动,反之亦然。
四、化学方程式的书写步骤:1.确定反应物和生成物:根据反应物和生成物的化学式。
2.写出未平衡的化学方程式:将反应物和生成物按照反应顺序写出来。
3.平衡原子数目:调整反应物和生成物的前缀,使得原子数目相等。
4.检查电荷守恒:确保反应物和生成物的总电荷数目相等。
5.确定平衡状态:当反应物和生成物的原子数目相等时,方程式达到平衡状态。
6.写出平衡常数:根据平衡状态下反应物和生成物的浓度比值,写出平衡常数(K)。
五、化学方程式的应用:1.预测反应产物:通过化学方程式可以预测反应生成的产物。

【化学方程式的书写原则】1)必须以客观事实为依据,不能凭空臆造事实上不存在的物质和化学反应.2)遵守质量守恒定律,使等号两边原子的种类和数目必须相等.2.化学方程式的书写步骤:书写化学方程式要按一定步骤进行,避免出现一些不必要的错误,如漏掉反应条件和“↑”“↓”等.书写化学方程式的一般步骤可概括为:“一写,二配,三注”(以高锰酸钾受热分解为例)【化学方程式的书写步骤】1)写:根据事实写出反应物和生成物的化学式(左反、右生),并在反应物和生成物之间画一条短线.2)配:配平化学方程式的目的是使等号两边的原子种类与数目相等,遵守质量守恒定律,配平后要加以检查.3)注:注明化学反应发生的条件(点燃、加热等),标出生成物状态(气体,沉淀等),把短线改成等号.【书写化学方程式的注意事项】1)化学反应的常见条件有“点燃”、“加热”(常用“△”表示)“高温”,“催化剂”等,写在等号上方;2)如果反应物没有气体而生成物中有气体,在气体物质的化学式右边要注“↑”;3)溶液中的反应如果生成物是固体,在固体物质化学式右边注“↓”.【书写化学方程式的口诀】左写反应物,右写生成物;写准化学式,系数(化学计量数)要配平;中间连等号,条件要注明;生成气体和沉淀,要用“↑”“↓”来标明.【化学方程式的配平】配平化学方程式就是在化学式前面配上适当的化学计量数使式子左、右两边的每一种元素的原子数目相等.常用的配平方法有最小公倍数法、观察法、奇数配偶法、归一法及得失电子守恒法.1)最小公倍数法:这种方法适合于常见的难度不大的化学方程式.例如在KClO3→KCl+O2↑这个反应式中右边氧原子个数为2,左边是3,则最小公倍数为6,因此KClO3前系数应配 2,O2前配 3,式子变为:2KClO3→2KCl+3O2↑,由于左边钾原子和氯原子数变为2个,则KCl 前应配系数2,短线改为等号,标明条件即可:2KClO32KCl+3O2↑(反应条件为二氧化锰催化和加热.“MnO2”写在等号上方;“△”写在等号下方)2)奇偶配平法:这种方法适用于化学方程式两边某一元素多次出现,并且两边的该元素原子总数有一奇一偶,例如:C2H2+O2→CO2+H2O,此方程式配平先从出现次数最多的氧原子配起.O2内有2个氧原子,无论化学式前系数为几,氧原子总数应为偶数.故右边H₂O的系数应配2(若推出其它的分子系数出现分数则可配4),由此推知C2H2前2,式子变为:2C2H2+O2→CO2+2H2O,由此可知CO2前系数应为4,最后配单质O2为5,把短线改为等号,写明条件即可:2C2H2+5O2=4CO2+2H2O3)3)观察法:有时方程式中会出现一种化学式比较复杂的物质,我们可通过这个复杂的分子去推其他化学式的系数,例如:Fe+H2O──Fe3O4+H2,Fe3O4化学式较复杂,显然,Fe3O4中Fe来源于单质Fe,O来自于H2O,则Fe前配3,H2O前配4,则式子为:3Fe+4H2O=Fe3O4+H2由此推出H2系数为4,写明条件,短线改为等号即可:3Fe+4H2O(g)Fe3O4+4H2↑4)归一法(或待定系数法):找到化学方程式中关键的化学式,定其化学式前计量数为1,然后根据关键化学式去配平其他化学式前的化学计量数.若出现计量数为分数,再将各计量数同乘以同一整数,化分数为整数,这种先定关键化学式计量数为1的配平方法,称为归一法.5)得失电子守恒法:电子得失法的原理是:氧化还原反应中,还原剂失去电子的总数必须等于氧化剂获得电子的总数.根据这一规则,可以配平氧化还原反应方程式.下面是配平的具体方法:1°从反应式里找出氧化剂和还原剂,并标明被氧化元素或还原元素的原子在反应前后化合价发生变化的情况,以便确定它们的电子得失数.2°使得失电子数相等,由此确定氧化剂和还原剂等有关物质化学式的系数.3°由已得的系数,判定其它物质的系数,由此得配平的反应式.。

化学方程式书写方法
化学方程式是化学反应的文字表示形式,正确书写化学方程式是掌握化学反应的关键。
下面就化学方程式的书写方法进行详细的介绍。
一、确定反应物和生成物
在书写化学方程式之前,首先需要确定反应物和生成物。
反应物是指进行化学反应的物质,生成物是指反应后生成的物质。
在确定反应物和生成物时,需要仔细分析反应的条件和机理,确保选择的物质准确无误。
二、配平化学方程式
配平化学方程式是书写化学方程式的重要步骤。
配平的方法有多种,如最小公倍数法、奇偶配平法等。
在选择配平方法时,需要根据反应的具体情况进行选择。
在配平过程中,需要注意原子守恒和电荷守恒,确保配平的准确性和合理性。
三、注明反应条件
反应条件是指进行化学反应所需的外界条件,如温度、压力、催化剂等。
在书写化学方程式时,需要注明反应条件,以便后续的分析和实验验证。
在注明反应条件时,需要使用特定的符号或缩写来表示,如加热符号“△”、压强符号“P”等。
四、注明生成物的状态
生成物的状态是指生成物的存在形式,如气体、液体、固体等。
在书写化学方程式时,需要注明生成物的状态,以便了解生成物的性质和特征。
在注明生成物状态时,需要使用特定的符号来表示,如气体符号“↑”、沉淀符号“↓”等。
总之,正确书写化学方程式是掌握化学反应的关键。
在书写化学方程式时,需要确定反应物和生成物、配平化学方程式、注明反应条件和生成物的状态等方面。
通过不断的练习和积累经验,我们可以熟练掌握化学方程式的书写方法,为后续的学习和工作打下坚实的基础。

如何正一、化学方程式的定义用化学式来表示化学反应的式子,叫做二、化学方程式表示的意义(1)质的意义:表示了化学反应中的(2)量的意义:表示了参加反应的物(3)粒子的意义:表示了反应物和生(4)反应条件:表明了该化学反应进以4P +5O 22P 2O 5为例:(1)表示反应物是磷和氧气;(2)表示生成物是五氧化二磷;(3)表示反应条件是点燃;(4)表示物质的微粒个数关系。
即4个磷原子和5个氧分子发生反应生(5)表示各物质间的质量关系。
即124份质量的磷和160份质量的氧气4P + 5O 2 2P 2O 54×31 5×32 2×142三、化学方程式的读法以木炭和氧气的反应为例:C+ O 2 (1)按质的方面读:碳和氧气在点燃(2)按量的方面读:每12份质量的碳(3)按粒子的方面读:每1个碳原子四、化学方程式的书写原则与步骤1.化学方程式的书写原则(1)以客观事实为依据,不能凭空设(2)遵循质量守恒定律,等号两边各2.化学方程式的书写步骤(1)写根据反应事实,在式子的左、右两边写(2)配如何正确书写化学方程式 叫做化学方程式。
应中的反应物和生成物。
应的物质种类以及各物质之间的质量关系,即各物质之物和生成物的粒子数的关系,即粒子的个数比。
反应进行的条件。
反应生成2个五氧化二磷分子。
的氧气恰好完全反应生成284份质量的五氧化二磷CO 2在点燃的条件下反应生成二氧化碳。
量的碳和32份质量的氧气在点燃条件下反应生成碳原子和1个氧分子发生反应生成1个二氧化碳分子步骤凭空设想或随意臆造事实上不存在的物质的化学式和化两边各种原子的种类和数目必须相等。
两边写出反应物和生成物的化学式,并在式子的左物质之间的质量比。
二磷。
成44份质量的二氧化碳。
分子。
式和化学反应。
的左、右两边之间画一条短线。
书写化学方程式时,在式子的左、右两边的化学式前面配上适当的化学计量数,使得每一种元素的原子总数相等,这个过程就是化学方程式的配平。
《如何正确书写化学方程式》讲义化学方程式是化学学习中的重要内容,它用简洁的符号和式子来表示化学反应的过程和本质。
正确书写化学方程式对于理解化学反应、进行化学计算以及解决化学问题都具有关键意义。
下面我们就来详细探讨如何正确书写化学方程式。
一、书写化学方程式的原则1、以客观事实为基础化学反应的发生是客观存在的,我们书写化学方程式时必须遵循实际发生的反应,不能凭空臆造不存在的化学反应。
2、遵循质量守恒定律质量守恒定律指出,在化学反应中,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
这就要求化学方程式左右两边的原子种类和数目必须相等。
二、书写化学方程式的步骤1、写出反应物和生成物的化学式首先,根据反应的描述,确定反应物和生成物。
然后,正确书写它们的化学式。
在书写化学式时,要注意元素符号的大小写、化合价的正确运用以及原子团的写法。
2、配平化学方程式配平是使化学方程式遵循质量守恒定律的关键步骤。
通过在化学式前添加适当的系数,使得方程式左右两边的原子种类和数目相等。
配平的方法有多种,如观察法、最小公倍数法、奇数配偶法等。
3、注明反应条件和生成物状态反应条件包括点燃、加热(用“△”表示)、高温、催化剂等。
生成物的状态用“↑”表示气体,“↓”表示沉淀。
如果反应物中已经有气体或固体,生成物中的相应状态则不用标注。
三、常见的配平方法1、观察法通过观察方程式两边原子的种类和数目,直接找出配平的系数。
这种方法适用于一些简单的化学方程式。
例如:H₂+ O₂ → H₂O方程式左边有 2 个氧原子,右边只有 1 个氧原子,所以在 H₂O 前面配上 2,得到 H₂+ O₂ → 2H₂O ,然后再在 H₂前面配上 2,配平为 2H₂+ O₂= 2H₂O 。
2、最小公倍数法找出方程式两边原子个数差异较大的元素,求出其原子个数的最小公倍数,然后在化学式前配上适当的系数。
例如:P + O₂ → P₂O₅氧原子在 O₂中是 2 个,在 P₂O₅中是 5 个,2 和 5 的最小公倍数是 10 。