药物合成反应
- 格式:ppt
- 大小:1.35 MB
- 文档页数:11

反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃;反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃;反应:将上面改为铜粉和氢卤酸;反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解有时在氟化钠或铜盐存在下加热,就可以制得较好收率的氟代芳烃;合成:醇在碱钠,氢氧化钠,氢氧化钾存在下与卤代烃反应生成醚;合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺;反应:用卤代烃与环六亚甲基四胺乌洛托品反应得季铵盐,然后水解可得伯胺;反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺;反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物;反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基;芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上;反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯;方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮;反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应;反应:以N-取代的甲酰胺化试剂在氧氯化磷作用下,在芳核或杂环上引入甲酰基;反应:将酚及某些杂环化合物与碱金属的氢氧化物溶液和过量的氯仿一起加热形成芳醛的反应;反应和Dieckmann反应:羧酸酯与另一分子具有α-活泼氢的酯进行缩合的反映称为Claisen缩合;若两个酯在同一分子之内,在上述条件下可发生分子内缩合,得环状β-酮酸酯,此反应称为Dieckmann反应;缩合:含有α-活泼氢原子的醛或酮,在碱或酸的催化下发生自身缩合,或与令一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物;该类化合物易脱水生成α,β-不饱和醛酮;反应:芳醛与含有α-活泼氢的醛、酮之间的缩合;芳醛和脂肪醛、酮在碱催化下缩合生成β-不饱和醛酮的就反应;缩合:甲醛在碱的催化下,可与含有α-活性氢的醛、酮进行醛醇缩合,在醛、酮的α-碳原子上引入羟甲基,产物是β-羟基醛或其脱水物——α,β-不饱和醛酮;反应:环和:酯环酮与α,β-不饱和酮的共轭加成产物所发生的分子内缩合反应,可以再原来环结构基础上在引入一个环;反应:烯烃与甲醛或其他醛在酸催化下加成而得1,3-丙二醇或其环状缩醛1,3-二氧六环及α-烯醇的反应;安息香缩合:芳醛在含水乙醇中,以氰化钾为催化剂,加热后发生双分子缩合生成α-羟基酮的反应;反应:醛或酮与α-卤代酸酯在金属锌粉存在下缩合而得β-羟基酸酯或脱水得α,β-不饱和酸酯的反应;反应:由有机卤素化合物卤代烃、活性卤代芳烃等与金属镁在无水乙醚存在下生成格式试剂,后者在与羰基化合物醛、酮等反应而得相应的醇类的反应;反应:芳烃在甲醛、氯化氢及无水二氯化锌三氯化铝、四氯化锡或质子酸等缩合剂的存在下,在芳环上引入卤烷基--CH2Cl的反应;反应:具有活性氢的化合物与甲醛或其他醛、胺进行缩合,生成胺甲基衍生物的反应;反应:β-芳乙胺与羰基化合物在酸性溶液中缩合生成1,2,3,4-四氢异喹啉的反应;反应:脂肪族或芳香族醛、酮类与氰化氢和过量氨或胺类作用生成α-氨基腈,再经酸或碱水解得到dl-α-氨基酸类的反应;反应:活性亚甲基化合物和α,β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合,生成β-羰烷基类化合物;反应:醛或酮与含磷试剂——烃代亚甲基三苯膦反应,醛、酮分子中的羰基的氧原子被亚甲基或取代亚甲基所取代,生成相应的稀类化合物及氧化三苯膦,此类反应称为羰基稀化反应;反应:利用膦酸酯与醛、酮类化合物在碱存在下作用生成烯烃的反应;反应:凡具有活性亚甲基的化合物在氨、胺或其羧酸盐的催化下,与醛、酮发生醛醇型缩合,脱水得α,β-不饱和化合物的反应;反应:丁二酸酯或α-烃基取代的丁二酸酯在碱性试剂存在下,与羰基化合物进行缩合而得α-烷烃或芳烃亚甲基丁二酸单酯的反应;常用碱性试剂有醇钠,叔丁醇钾,氰化钠和三苯甲烷钠等反应:芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合,生成β-芳基丙烯酸类化合物的反应;缩合:醛或酮与α-卤代酸酯在碱催化下缩合生成α,β-环氧羧酸酯的反应;反应:共轭二烯烃与烯烃、炔烃进行环加成,生成环己烯衍生物的反应;重排:在质子酸或lewis酸催化下生成的碳正离子中,烷基、芳基、或氢从一个碳原子通过过渡态,迁移至相邻带正电荷碳原子的反应;重排:在酸催化下,邻二叔醇失去一分子水,重排成醛或酮的反应;40.二苯基乙二酮-二苯基乙醇酸型重排:α-二酮用强碱处理发生重排,生成α-羟基乙酸盐;重排:α-卤代酮在碱氢氧化钠,醇钠,HNRR’催化下脱去卤原子,重排为羧酸或其衍生物的反应;重排:α-重氮酮经加热、光解或在某些金属等催化剂作用下脱去一分子氮气后重排成烯酮的反应;烯酮经进一步反应,生成羧酸、酯、酰胺或酮;反应:酰氯与重氮甲烷反应得α-重氮酮,再经Wolff重排,生成比原来酰氯多一个碳原子的羧酸;重排:醛肟与酮肟在酸催化剂作用下重排成取代酰胺的反应;重排:氮上无取代基的酰胺用卤素溴或氯及碱处理,脱羧生成伯胺的反应;由于产物比反应物少一个碳原子,所以又称为Hofmann降解;重排:酰基叠氮化合物加热分解生成异腈酸酯的反应;反应:在酸催化下,酸和酮或醛与氨或叠氮化钠反应生成伯胺、酰胺或腈的反应;氧化:在酸催化下,醛或酮与过氧酸作用,在烃基与羰基之间插入氧生成酯的反应;重排:α-位上具有吸电子基Z的季铵盐在强碱作用下,脱去一个α活泼氢生成叶立德,然后季氮上的烃基进行分子内1,2-迁移,生成叔胺的反应;重排:苄基季铵盐在强碱催化下,重排成邻位烃基取代的苄基叔胺的反应;重排:醚类化合物经强碱处理,分子中一个烃基发生迁移,生成醇的反应;重排:烯醇或酚的烯丙基醚加热,通过3,3-σ迁移使烯丙基自氧原子迁移到碳原子上的反应;重排:1,5-二稀连二烯丙基经过3,3-σ迁移,异构化成另一双烯丙基衍生物的反应;吲哚合成:醛或酮的芳腙在适当催化剂存在下,脱氨基生成吲哚类化合物的反应;氧化:仲醇与丙酮在烷氧基铝存在下一起回流,将仲醇氧化成酮;反应:在芳香醛中,当醛基的邻、对位有羟基等供电子基团时,与有机过氧酸反应,醛基经甲酸酯阶段,最后转换成羟基;环氧化反应:反应:在氯化钯、氯化铜存在下,利用空气中的氧气使烯烃转化成醛或酮的过程;还原:芳香族化合物在液氨中用钠还原,生成非共轭二烯的反应;反应:在酸性条件下,用锌汞齐或锌粉还原醛基、酮基为甲基和亚甲基的反应;кижер-黄鸣龙还原反应:醛酮在强碱条件下,与水合肼缩合成腙,进而放氮分解转化成甲基和亚甲基的反应;反应:将醛、酮等羰基化合物和异丙醇铝在异丙醇中共热,可还原得到相应的醇,同时将异丙醇氧化成丙酮;反应:在甲酸及其衍生物存在下,羰基化合物与氨、胺的还原胺化反应;反应:酰卤在适当的反应条件下,用催化氢化或金属氢化物选择性的还原为醛的反应;反应:将羧酸酯用金属钠和无水醇直接还原生成相应的伯醇,主要用于高级脂肪酸酯的还原;66.偶姻缩合:羧酸酯在惰性溶剂如醚、甲苯、二甲苯中与金属钠发生还原偶联反应,生成α羟基酮;67.脱苄反应:苄基或取代苄基与氧、氮或硫连接生成的醇、醚、酯、苄胺、硫醚等,均可以通过氢解反应脱去苄基生成相应的烃、醇、酸、胺等类化合物;反应:卤代烃、苯甲酰氯或芳基重氮盐等与乙烯基化合物的C-C偶联反应;交叉偶联反应:钯催化的有机硼化合物与卤代烃生成不对称联芳烃;。
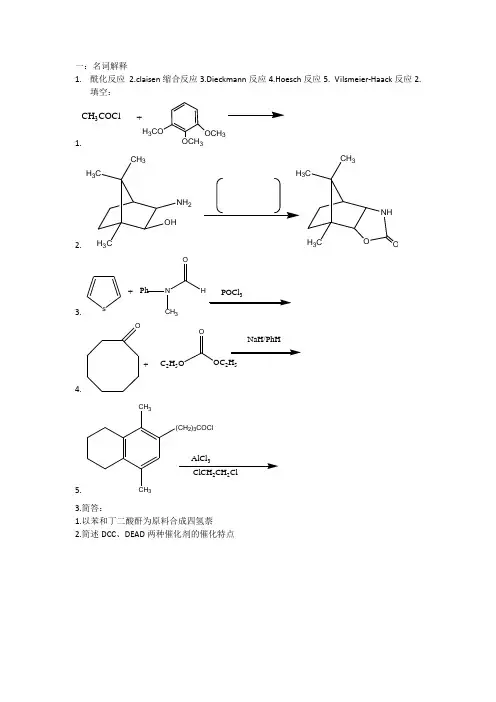
1.酰化反应2.claisen缩合反应3.Dieckmann反应4.Hoesch反应5. Vilsmeier-Haack反应2.填空:1.H3COOCH3OCH3CH3COCl+2. H3CCH3H3COHNH23CCH3H3CNHO O3. s +Ph NCH3HOPOCl4. O+C2H5OOOC2H5NaH/PhH5. CH3CH3(CH2)3COCl223.简答:1.以苯和丁二酸酐为原料合成四氢萘2.简述DCC、DEAD两种催化剂的催化特点1.重氮化反应2.Collins 试剂 ;3.Eatard 试剂:4.Jones 试剂5.Oppenmauer 氧化:6.Woodward 氧化7.Lindlar 催化剂8.Clemmensen 还原二、填空1. OHOH O HMnO 2CH 2Cl 22.3. H C H C COCH 3Zn-Hg HCl4. PhC Cl C Ph H LiAlH 45. ℃H/Ni100Kg/cm 200℃、 6.C NO 2OCF CO H7.CH 3CH 38.CH 3KMnO4CH2CH 2CH 39.10.11.12.13.三、简答1.KMnO4的氧化能力与反应的pH值之间的关系如何?其主要用途有哪些?2.比较LiAlH4与NaBH4在应用围反应条件的异同?3.以原料合成终产物4.由对二甲苯制备2-硝基-1,4-苯二甲酸。
5.以苯酚为起始原料合成解热镇痛药对乙酰氨基酚。
一、名词解释题1.亲核重排反应2.Beckmann重排3.Arndt-Eistert反应4.Fries重排5. -键迁移反应6.重排反应二、填空题1.2.3.4.5.6.7.8.9.10.三、简答题1. Pinacol重排属于哪类重排反应?简述其反应机制及影响反应的因素。
2.基团的迁移能力或顺序在不同重排反应中有所不同,写出Wagner-Meerwein重排和Stevens重排中各自基团的迁移顺序。

名词解释傅克烷基化反应:指在无水三氯化铝等路易斯酸存在下,芳烃与卤烷作用,在芳环上发生亲电取代反应,其氢原子被烷基取代,生成烷基芳烃的反应。
亲电加成反应:简称亲电加成,是亲电试剂(带正电的基团)进攻不饱和键引起的加成反应。
反应中,不饱和键(双键或三键)打开,并与另一个底物形成两个新的σ键。
亲电加成中最常见的不饱和化合物是烯烃和炔烃。
sn2反应:如果新化学键的形成在先,而旧化学键的断裂在后,那就要求两个分子先结合,即化学键的形成必然与两种反应物(浓度)都有关系,这类亲核取代反应为SN2反应;sn1反应:如果旧化学键的断裂在先,则化学反应速率只与断键的反应物(浓度)有关,与进入的另一反应物(浓度)无关,这类亲核取代反应称为SN1反应.ac2o:乙酸酐易燃,其蒸气与空气可形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。
与强氧化剂接触可发生化学反应。
能使醇、酚、氨和胺等分别形成乙酸酯和乙酰胺类化合物。
在路易斯酸存在下,乙酐还可使芳烃或烯烃发生乙酰化反应。
在乙酸钠存在下,乙酐与苯甲醛发生缩合反应,生成肉桂酸。
缓慢溶于水变成乙酸。
与醇类作用生成乙酸酯。
Claisen酯缩合反应:含有α-氢的酯在醇钠等碱性缩合剂作用下发生缩合作用,失去一分子醇得到β-酮酸酯。
如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合得到乙酰乙酸乙酯。
DMF:N,N-二甲基甲酰胺是一种有机化合物,分子式为C3H7NO,为无色透明液体。
既是一种用途极广的化工原料,也是一种用途很广的优良的溶剂。
除卤化烃以外能与水及多数有机溶剂任意混合,对多种有机化合物和无机化合物均有良好的溶解能力和化学稳定性。
亲电取代反应:是指化合物分子中的原子或原子团被亲电试剂取代的反应。
ncs:N-氯代丁二酰亚胺,是一种比较方便的亲电加成和亲电取代试剂,常用于硫化物、砜和酮的氯化,也可用来合成N-氯化胺。
羟醛缩合反应:具有α氢原子的醛或酮在一定条件下形成烯醇负离子,再与另一分子羰基化合物发生加成反应,并形成β-羟基羰基化合物。


四.缩合反应定义:两个及两个以上有机化合物通过反应形成一个新的较大分子或同一分子内部发生分子内的反应形成新分子的反应称为缩合反应。
Aldol:定义:在稀酸或稀碱催化下(通常为稀碱),一分子醛(或酮)的 氢原子加到另一分子醛(或酮)的羰基氧原子上,其余部分加到羰基碳上,生成 -羟基醛(或酮),这个增长碳链的反应称为α-羟烷基化反应。
但该类化合物不稳定,易消除脱水生成α,β-不饱和醛酮,又称Aldol缩合反应。
Aldol特点:酮:活性小于醛,反应速度慢。
1. 对称酮产物较单纯。
2. 不对称酮的自身缩合,在碱性或酸性催化下,反应都发生在取代较少的羰基碳原子上。
羟醛缩合催化剂碱:弱碱(如Na3PO4、NaOAc、Na2CO3、K2CO3、NaHCO3),强碱(如NaOH、KOH、NaOEt、NaH、NaNH2)酸:盐酸、硫酸、对甲苯磺酸、三氟化硼以及阳离子交换树脂等Cannizzaro反应(歧化反应)定义:凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇。
甲醛的羟甲基化反应和交叉Cannizzaro反应能同时发生,是制备多羟基化合物的有效方法。
定向醇醛(酮)缩合方法:A.烯醇盐法:醛或酮与具位阻的碱如LDA(二异丙胺锂)作用,形成烯醇盐再与另一分子醛或酮作用,B.烯醇硅醚法:醛、酮转变成烯醇硅醚,在TiCl4催化下与另一分子醛、酮分子作用。
C. 醛、酮与胺形成亚胺,与LDA形成亚胺锂盐,再与另一分子醛、酮作用。
Diels-Alder反应含有一个活泼的双键或叁键的烯或炔类和二烯或多烯共轭体系发生1,4-加成,形成六员环状化合物的反应称为Diels-Alder反应。
该反应易进行且反应速度快,应用范围广,是合成环状化合物的一个非常重要的方法。




药物合成反应》课程教学大纲《药物合成反应》课程教学大纲一、课程简介《药物合成反应》是一门专业核心课程,旨在培养学生掌握药物合成的基本理论和实践技能,为从事药物研究和开发打下坚实的基础。
本课程涵盖了有机合成反应、药物合成工艺和实验室实践操作等方面的内容,通过课堂教学、实验操作和案例分析等多种方式,使学生全面了解和掌握药物合成的反应机理、合成路线、实验技巧以及实际应用。
二、课程目标通过本课程的学习,学生将能够:1、掌握药物合成的基本理论、反应机理和合成路线设计原则;2、熟悉常见有机合成反应的类型、条件和产物结构特征;3、了解药物合成工艺流程、实验室实践操作和安全注意事项;4、具有独立进行药物合成实验的能力,能够分析和解决实验中出现的问题;5、了解药物研发的过程、最新进展和应用前景。
三、教学内容与课时分配第一章药物合成基本理论(8学时)1.1 药物合成的定义、发展历程和重要性; 1.2 药物合成的基本步骤和策略; 1.3 合成路线的评价与优化。
第二章常见有机合成反应(12学时)2.1 烷基化反应; 2.2 酰化反应; 2.3 羟基化反应; 2.4 磺化反应; 2.5 甲基化反应; 2.6 重排反应; 2.7 其他常见有机合成反应。
第三章药物合成工艺(8学时)3.1 药物合成工艺流程; 3.2 实验室实践操作规范; 3.3 合成工艺优化与成本控制。
第四章药物研发概述与最新进展(4学时)4.1 药物研发的基本过程; 4.2 药物研发的最新进展; 4.3 药物研发的应用前景。
四、教学方法1、采用多媒体教学,制作丰富的课件和视频素材,提高教学效果;2、通过案例分析,使学生了解实际生产中的问题与解决方案;3、开展实验室实践操作,加强学生的动手能力和实践技能;4、通过课堂讨论、小组作业等形式,促进学生的团队协作和交流能力。
五、考核方式1、课堂提问与回答(10%);2、作业与小组讨论(20%);3、期末考试(70%)。

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。

药物合成反应知识点总结药物合成是一门综合化学、生物学、医学等学科知识的交叉学科,在药物研发、制备方面有着重要的地位。
掌握合成反应知识对于开发新药物、改进药物生产工艺以及合成新型医用化合物有着重要的意义。
下面将对药物合成反应知识点进行总结。
一、酯化反应酯化反应是一种醇和酸酐进行酯键形成的反应,常用于制备药物中的酯类化合物。
酯化反应通常需要酸性催化剂,如硫酸、氯化锌等。
常见的酯化反应包括醋酸乙酯和苯酚反应,以及异丁酸和异丁醇反应等。
酯化反应在药物合成中具有重要的应用价值,可以制备许多重要的药物原料和药物分子。
二、取代反应取代反应是指一种功能团被另一种功能团取代的化学反应。
在药物合成中,取代反应可用于引入新的官能团或者进行位置选择性修饰。
常见的取代反应包括亲电取代反应、芳香核烷基取代反应、核烷基取代反应等。
取代反应技术在药物合成中的应用广泛,可以实现对目标分子的精准调控。
三、溴化反应溴化反应是一种以溴化试剂为催化剂,将氢原子直接溴化的反应。
在药物合成中,溴化反应通常用于芳香环的溴化,在合成多种药物原料和中间体中具有重要应用价值。
溴化反应可以通过光化学、热化学等多种途径进行,是药物合成中不可或缺的反应类型。
四、氢化反应氢化反应是指将双键或者芳香环上的芳香核加氢生成饱和化合物的化学反应。
在药物合成中,氢化反应通常用于去除分子中的双键或者芳香环,改变化合物的性质和活性。
常见的氢化反应包括氢气加压氢化反应、催化氢化反应等。
氢化反应在药物合成中应用广泛,可以制备众多的药物原料和合成中间体。
五、缩合反应缩合反应是指将两个或者更多的分子通过断裂键和形成新键,生成较大的分子的化学反应。
在药物合成中,缩合反应可以用于合成多种多样的药物原料和药物分子。
常见的缩合反应包括醛缩合、酮缩合、酰胺缩合等。
缩合反应技术在药物合成中的应用非常广泛,是药物研发和制备的重要手段之一。
六、水解反应水解反应是指利用水分子将化合物中的官能团断裂,生成新的化合物的化学反应。
药物合成反应知识点总结
1. 反应类型:药物合成反应包括的主要反应类型有酯化反应、烷基化反应、脱水反应、氧化反应、还原反应、加成反应、消除反应等。
2. 催化剂:药物合成反应中的催化剂通常有酸、碱、酶、金属催化剂等,催化剂的选择需考虑反应条件和底物的特性。
3. 反应条件:药物合成反应的反应条件包括温度、压力、溶剂、反应时间等。
合适的反应条件能够促进反应的进行并提高产率和选择性。
4. 底物结构:药物合成反应的底物结构对反应的结果具有决定性作用。
在合成过程中需要考虑控制底物的反应平衡、控制副反应的发生等。
5. 反应机理:药物合成反应的反应机理能够解释反应的过程和产物的形成。
熟悉反应机理有助于合理设计反应方案和优化反应条件。
6. 优化:药物合成反应需要在保证质量的前提下,尽可能提高产率和选择性。
反应过程中常用的优化手段包括溶剂优化、催化剂优化、反应条件优化、步骤优化等。
7. 安全:药物合成反应过程中需要注意安全问题,防止操作失误、燃爆等危险事故的发生。
正确选择催化剂、控制反应条件、严格执行实验操作规程等都是提高反应安全的措施。
第一章绪论1、药物合成反应中反应类型有哪些?①按有机分子的结构变换方式分:新基团的导入反应;取代基的转化反应;有机分子的骨架。
②按反应机制分:极性反应(a。
亲核试剂、b.亲电试剂);自由基反应;协同反应2、药物合成反应主要研究对象:化学合成药物3、化学品的安全使用说明书——MSDS4、原子经济性反应:“原子经济性"是指在化学品合成过程中,合成方法和工艺被设计成能把反应过程中使用的所有原料尽可能多的转化到最终产物中。
5、三废:废气、废水、废渣第二章硝化反应1、混酸硝化试剂的特点有哪些?①硝化能力强;②氧化性较纯硝酸小;③对设备的腐蚀性小2、硝化试剂的活泼中间离子为:硝酰正离子NO2○,+3、桑德迈尔反应定义及应用定义:在氯化亚铜或溴化铜的存在下,重氮基被氮或溴置换的反应;重氮基被氰基置换:将重氮盐与氰化亚铜的配合物在水介质中作用,可以使重氮基被氰基置换,该反应也称Sandmeyer反应。
应用:CuX+Ar-N2X Ar—X+N2 (X:Cl,Br,—CN)4、常用的重氮化试剂一般是由盐酸、硫酸、过氯酸和氟硼酸等无机酸与亚硝酸钠作用产生.5、硝化反应定义:指向有机分子结构中引入硝基(—NO2)的反应过程,广义的硝化反应包括生产(C-NO2、N-NO2和O—NO2)反应。
6、重氮化反应定义:含有伯氨基的有机化合物在无机酸的存在下与亚硝酸钠作用生成重氮盐的反应。
7、硝化剂:单一硝酸、硝酸和各种质子酸、有机酸、酸酐及各种Lewis酸的混合物。
8、生成硝基烷烃的难易顺序:卤代烃中卤素被取代的顺序:9、DMF:DMSO:10、常用的重氮化试剂有哪些? NaNO2+HCl/H2SO4第三章卤化反应1、Ph上取代基对卤化反应的影响①催化剂的影响;②芳环结构的影响;③反应温度的影响;④卤化剂的影响;⑤反应溶剂影响2、醇与HCl 发生卤置换反应活性顺序醇羟基的活性顺序:叔(苄基、烯丙基)醇>仲醇>伯醇氢卤酸的活性顺序:HI >HBr >HCL3、NBS 的应用(N —溴代丁二酸亚胺) ①N-卤代酰胺与不饱和烃的卤取代反应机制:RCH 2CH=CH 2+NBSRCHBrCH=CH 2本反应属自由基型反应,可在光照下引发自由基②N-卤代酰胺与不饱和烃的加成反应:在质子酸(醋酸、溴氢酸、高氯酸)的 催化下,N —卤代酰胺与烯烃加成易制备—卤代醇的重要方法。
药物合成反应知识点总结
药物合成反应是化学制药领域中的重要知识点,以下是一些可能有用的药物合成反应知识点总结:
1. 卤化反应:卤化反应是药物合成中常用的反应之一,主要用于将药物分子中的醇或酮羟基转化为卤代烃。
卤代烃的优点是具有广泛的药物合成应用,可以用于制备多种药物分子。
2. 烃化反应:烃化反应是将药物分子中的羟基或酮基转化为烃基的反应。
烃化反应可以用于制备多种药物分子,例如甾体激素、抗癌药物等。
3. 缩合反应:缩合反应是药物合成中常用的反应之一,主要用于将两个或多个分子缩合成为一个分子。
缩合反应可以用于制备多种药物分子,例如甾体激素、抗生素等。
4. 氧化反应:氧化反应是药物合成中常用的反应之一,主要用于将药物分子中的不饱和键氧化为饱和键。
氧化反应可以用于制备多种药物分子,例如杀虫剂、抗生素等。
5. 还原反应:还原反应是药物合成中常用的反应之一,主要用于将药物分子中的氧化剂还原为还原剂。
还原反应可以用于制备多种药物分子,例如维生素、甾体激素等。
6. 重排反应:重排反应是药物合成中常用的反应之一,主要用于将药物分子中的官能团进行重排。
重排反应可以用于制备多种药物分子,例如甾体激素、抗癌药物等。
7. 官能团保护反应:官能团保护反应是药物合成中常用的反应
之一,主要用于保护药物分子中的某些官能团,避免在合成过程中受到破坏。
官能团保护反应可以用于制备多种药物分子,例如甾体激素、抗生素等。
药物合成反应是化学制药领域中的重要知识点,掌握这些反应可以有助于更好地理解和设计药物合成路线。
药物合成反应重要人名反应整理1.Hunsdriecke反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3.Gattermann反应:将上面改为铜粉和氢卤酸。
4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
5.Williamson合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7.Delepine反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
10.Friedel-Crafts反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
11.Meerwein芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。