实验题汇编(含答案) 2013北京市高考化学一模27题
- 格式:doc
- 大小:2.33 MB
- 文档页数:5

第1页(共22页)
2013年北京市高考化学试卷(真题)
一、选择题(共7小题,每小题6分,满分42分)
1.(6分)下列设备工作时,将化学能转化为热能的是( )
A .A
B .B
C .C
D .D 2.(6分)下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
A .水中的钢闸门连接电源的负极
B .金属护拦表面涂漆
C
.汽车底盘喷涂高分子膜
D .地下钢管连接镁块
3.(6分)下列解释事实的方程式不准确的是( )
A .用浓盐酸检验氨:NH 3+HCl=NH 4Cl
B .碳酸钠溶液显碱性:CO 32﹣+H 2O ⇌HCO ﹣3+OH ﹣
C .钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe ﹣3e ﹣=Fe 3+
D .长期盛放石灰水的试剂瓶内壁出现白色固体:Ca (OH )2+CO 2=CaCO 3↓+H 2O
4.(6分)用石墨电极电解CuCl 2溶液(如图).下列分析正确的是( )
A .a 端是直流电源的负极。

2013年北京市高考化学试卷一、选择题(共7小题,每小题6分,满分42分)1.(6分)下列设备工作时,将化学能转化为热能的是()A B C D硅太阳能电池锂离子电池太阳能集热器燃气灶A.A B.B C.C D.D2.(6分)下列金属防腐的措施中,使用外加电流的阴极保护法的是()A.水中的钢闸门连接电的负极B.金属护拦表面涂漆C.汽车底盘喷涂高分子膜D.地下钢管连接镁块3.(6分)下列解释事实的方程式不准确的是()A.用浓盐酸检验氨:NH3+HCl=NH4ClB.碳酸钠溶液显碱性:CO32﹣+H2O⇌HCO﹣3+OH﹣C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe﹣3e﹣=Fe3+D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O 4.(6分)用石墨电极电解CuCl2溶液(如图).下列分析正确的是()A.a端是直流电的负极B.通电使CuCl2发生电离C.阳极上发生的反应:Cu2++2e﹣=CuD.通电一段时间后,在阴极附近观察到黄绿色气体5.(6分)实验:①0.1mol•L﹣1AgNO3溶液和0.1mol•L﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1mol•L﹣1I溶液,出现浑浊;③向沉淀c中滴加0.1mol•L﹣1I溶液,沉淀变为黄色.下列分析不正确的是()A.浊液a中存在沉淀溶解平衡:AgCl(s)⇌Ag+(aq)+Cl﹣(aq)B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶6.(6分)下列实验事实不能用平衡移动原理解释的是()A .将NO2球浸泡在冷水和热水中B.t/℃2550100W/10﹣14 1.01 5.4755.0C .D.0.10.01C(氨水)/(mol•L﹣1)pH11.110.67.(6分)用如图所示装置检验乙烯时不需要除杂的是()乙烯的制备试剂试剂YA CH3CH2Br与NaOH乙醇溶液共热水MnO4酸性溶液B CH3CH2Br与NaOH乙醇溶液共热水Br2的CCl4溶液C C2H5OH与浓H2SO4加热至170℃NaOH溶液MnO4酸性溶液D C2H5OH与浓H2SO4加热至170℃NaOH溶液Br2的CCl4溶液A.A B.B C.C D.D二、解答题(共4小题,满分58分)8.(17分)可降解聚合物P的合成路线如下:已知:(1)A的含氧官能团名称是.(2)羧酸a的电离方程是.(3)B→C的化学方程式是.(4)化合物D苯环上的一氯代物有2种,D的结构简式是.(5)E→F中反应①和②的反应类型分别是.(6)F的结构简式是.(7)聚合物P的结构简式是.9.(14分)NO是汽车尾气中的主要污染物之一.(1)NO能形成酸雨,写出NO2转化为HNO3的化学方程式:.(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:①写出该反应的热化学方程式:.②随温度升高,该反应化学平衡常数的变化趋势是:.(3)在汽车尾气系统中装置催化转化器,可有效降低NO的排放.①当尾气中空气不足时,NO在催化转化器中被还原成N2排出.写出NO被CO 还原的化学方程式:.②当尾气中空气过量时,催化转化器中的金属氧化物吸收NO生成盐.其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO.原因是:,元素的金属性逐渐增强,金属氧化物对NO的吸收能力逐渐增强.(4)通过NO传感器可监测NO的含量,其工作原理示意图如下:①Pt电极上发生的是反应(填“氧化”或“还原”).②写出NiO电极的电极反应式:.10.(12分)用含有Al2O3、SiO2和少量FeO•Fe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作和条件略):Ⅰ.向铝灰中加入过量稀H2SO4,过滤:Ⅱ.向滤液中加入过量MnO4溶液,调节溶液的pH约为3;Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:Ⅳ.加入MnSO4至紫红色消失,过滤;Ⅴ.浓缩、结晶、分离,得到产品.(1)H2SO4溶解Al2O3的离子方程式是.(2)将MnO4﹣氧化Fe2+的离子方程式补充完整:MnO4﹣+ Fe2+=Mn2+Fe3++(3)已知:生成氢氧化物沉淀的pHAl(OH)3Fe(OH)2Fe(OH)3开始沉淀时 3.4 6.3 1.5完全沉淀时 4.78.3 2.8注:金属离子的起始浓度为0.1mol•L﹣1根据表中数据解释步骤Ⅱ的目的:.(4)已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2,①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是.②Ⅳ中加入MnSO4的目的是.11.(15分)某学生对SO2与漂粉精的反应进行实验探究:操作现象部分固体溶解,溶液略有颜色取4g漂粉精固体,加入100mL水过滤,测漂粉精溶液的pH pH试纸先变蓝(约为12),后褪色i.液面上方出现白雾;ⅱ.稍后,出现浑浊,溶液变为黄绿色;ⅲ.稍后,产生大量白色沉淀,黄绿色褪去(1)Cl2和Ca(OH)2制取漂粉精的化学方程是。

绝密★启封前机密★使用完毕前2013年普通高等学校招生全国统一考试理科综合能力测试(北京卷)本试卷共16页,共300分。
考试时长150分钟。
考生务必将答案答在答题卡上,在试卷上作答无效。
考试结束后,将本试卷和答题卡一并交回。
以下数据可供解题时参考:可能用到的相对原子质量:H1 C12 O16 Cl35.5 Ca40第一部(选择题共120分)本部分共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.下列设备工作时,将化学能转化为热能的是【答案】D【解析】A、硅太阳能电池是将太阳能直接转化为电能,故错误;B、锂离子电池将化学能直接转化为电能,故错误;C、太阳能集热器是将太阳能转变为热能,故错误;D、燃料燃烧将化学能直接转化为热能,故正确。
7.下列金属防腐的措施中,使用外加电流的阴极保护法的是A.水中的钢闸门连接电源的负极B.金属护拦表面涂漆C.汽水底盘喷涂高分子膜D.地下钢管连接镁块【答案】A【解析】A、钢闸门连接电源的负极,为电解池的阴极,被保护,属于外加电流的阴极保护法,故正确;BC、是金属表面覆盖保护层,隔绝空气,故错误D、镁比铁活泼,构成原电池,铁为正极,被保护,是牺牲阳极的阴极保护法,故错误。
8.下列解释事实的方程式不准确的是A.用浓盐酸检验氨:NH3+HCl=NH4Cl+H2O HCO-3+OH-B.碳酸钠溶液显碱性:CO2-C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O 【答案】C【解析】A、盐酸具有挥发性,挥发出的HCl与氨气反应生成氯化铵,冒白烟,故正确;B、碳酸钠是强碱弱酸盐,溶液中存在CO2-3水解平衡:CO2-3+H2O HCO-3+OH-,使溶液呈碱性,故正确;C、钢铁发生吸氧腐蚀,铁作负极被氧化,电极反应式为Fe-2e-=Fe2+,故错误;D、石灰水与空气中的二氧化碳反应生成碳酸钙,故正确。

2013年普通高等学校招生全国统一考试理科综合能力测试(北京卷)化学试题可能用到的相对原子质量:H1 C12 O16 Cl35.5 Ca40第一部分(选择题共120分)本部分共20小题,每小题6分,共120分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
6.下列设备工作时,将化学能转化为热能的是A B C D硅太阳能电池锂离子电池太阳能集热器燃气灶7.下列金属防腐的措施中,使用外加电流的阴极保护法的是A.水中的钢闸门连接电源的负极B.金属护拦表面涂漆C.汽车底盘喷涂高分子膜D.地下钢管连接镁块8.下列解释事实的方程式不准确...的是A.用浓盐酸检验氨:NH3+HC1=NH4C1B.碳酸钠溶液显碱性:CO32—+H2O HCO3—+OH-C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O9.用石墨电极电解CuCl2溶液(见右图)。
下列分析正确的是直流电源b Cu2+Cl—Cl—aA.a 端是直流电源的负极B.通电使CuCl 2发生电离C.阳极上发生的反应:Cu 2++2e -=CuD.通电一段时间后,在阴极附近观察到黄绿色气体10.实验:①0.1mol ·L -1AgNO 3溶液和0.1mol ·L -1NaCl 溶液等体积混合得到浊液a , 过滤得到滤液b 和白色沉淀c ;② 向滤液b 中滴加0.1mol ·L —1KI 溶液,出现浑浊;③ 向沉淀c 中滴加0.1mol ·L —1KI 溶液,沉淀变为黄色。
下列分析不正确...的是 浊液a 中存在沉淀溶解平衡:AgCl(s) Ag +(aq) +Cl —(aq )B. 滤液b 中不含有Ag +C. ③中颜色变化说明AgCI 转化为AgID. 实验可以证明AgI 比AgCI 更难溶 11.下列实验事实不能用平衡移动原理解释的是A. B. C. D.12.用右图所示装置检验乙烯时不需要除杂的是乙烯的制备试剂X 试剂Y A CH 3CH 2Br 与NaOH 乙醇溶液共热 H 2O KMnO 4溶液 B CH 3CH 2Br 与NaOH 乙醇溶液共热H 2OBr 2的CCl 4溶液t/℃ 25 50 100 K W /10—141.015.4755.0C(氨水)/(mol ·L —1)0.1 0.01 pH11.110.625.(17分)可降解聚合物P的合成路线如下已知ⅰ.ⅱ.催化剂(R为烃基)(1)A的含氧官能团名称是____________。

2013北京市高考化学一模题目汇编·非选择题(二)【大兴2013】26.(13分)铁铜及其化合物与人类生活密切相关:Ⅰ:Fe2O3、Cu2O都是红色粉末,常用作颜料。
某校化学实验小组通过实验来探究某红色粉末是Fe2O3、Cu2O或二者混合物。
探究过程如下:查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设1:红色粉末是Fe2O3假设2:红色粉末是Cu2O(1)假设3:设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN 溶液。
(2)若滴加KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含Fe2O3。
你认为这种说法合理吗?。
简述你的理由。
(3)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物,实验小组欲用加热法测定红色混合物中Cu2O 的质量分数。
取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为。
Ⅱ:铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。
“速力菲”(主要成分:琥珀酸亚铁)是市场上一种常见的补铁药物。
该药品不溶于水但能溶于人体中的胃酸。
某化学实验小组同学为了检测“速力菲”药片中Fe2+的存在,设计了如下实验:(4) 试剂1是。
(5)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是。
(6)在实验中发现放置一段时间,红色溶液的颜色会逐渐褪去。
为了进一步探究溶液褪色的原因,甲、乙、26232(2)不合理Cu2O与稀H2SO4反应生成的Cu能将Fe3+还原为Fe2+(3)9()100%b aa-⨯或9()b aa-(4)稀盐酸(或稀硫酸);(5)少量的Fe2+被空气中的氧气氧化;(6)【朝阳2013】26.(14分)燃煤产生的烟气中的氮氧化物NO x(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放。
(1)用化学方程式表示NO形成硝酸型酸雨的反应。
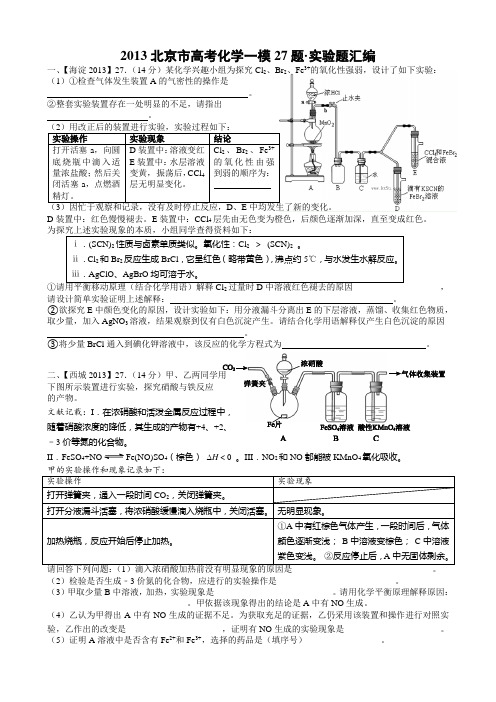
2013北京市高考化学一模27题·实验题汇编一、【海淀2013】27.(14分)某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:(1)①检查气体发生装置A的气密性的操作是。
②整套实验装置存在一处明显的不足,请指出。
实验操作实验现象结论打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。
D装置中:溶液变红E装置中:水层溶液变黄,振荡后,CCl4层无明显变化。
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
ⅰ.(SCN)2性质与卤素单质类似。
氧化性:Cl2>(SCN)2。
ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。
ⅲ.AgClO、AgBrO均可溶于水。
2,请设计简单实验证明上述解释:。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。
请结合化学用语解释仅产生白色沉淀的原因。
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为。
二、【西城2013】27.(14下图所示装置进行实验,探究硝酸与铁反应的产物。
文献记载:I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.FeSO4+NO Fe(NO)SO4(棕色)∆H<0 。
III.NO2和NO都能被KMnO4氧化吸收。
实验操作实验现象打开弹簧夹,通入一段时间CO2,关闭弹簧夹。
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。
无明显现象。
加热烧瓶,反应开始后停止加热。
①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。
②反应停止后,A中无固体剩余。
(2)检验是否生成﹣3价氮的化合物,应进行的实验操作是___________________________。
2013年高三化学一模试题(朝阳区)朝阳区高三一模理综化学试卷2013年4月可能用到的相对原子质量:选择题6.关于实现下列物品用途的主要物质的说法,不正确的是7.下列说法不正确的是A.H2N—CH2—COOH能与酸、碱反应生成盐B.葡萄糖既能发生银镜反应,又能发生水解反应C.浓硝酸和醋酸铅溶液均可使鸡蛋清溶液中的蛋白质变性D.1mol油脂完全水解的产物是1mol甘油和3mol高级脂肪酸(或盐)8.Se、Br两种元素的部分信息如右图所示,下列说法正确的是A.原子半径:Br>Se>PB.还原性:S2->Se2->Br-C.SeO2既有氧化性又有还原性D.在Se2Br2分子中只含有极性键9.下列解释实验现象的反应方程式不正确的是A.新制氯水中滴加NaOH溶液后,黄绿色褪去Cl2+2OH-=Cl-+ClO-+H2OB.向NaHCO3溶液中滴加酚酞溶液,溶液变红HCO3-H++CO32-C.向Mg(OH)2悬浊液中滴加FeCl3溶液,生成红褐色沉淀3Mg(OH)2+2Fe3+=2Fe(OH)3↓+3Mg2+D.向少量苯酚稀溶液中逐滴加入饱和溴水,生成白色沉淀10.右图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是ABCD喷洒液酚酞紫色石蕊酸性重铬酸钾酸化的KI-淀粉通入的气体NH3Cl2CH3CH2OH(g)O2预测的颜色变化变为红色最终褪色无明显变化变为蓝色11.已知:H2(g)+I2(g)2HI(g)ΔH=-14.9kJ/mol。
某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示。
甲中反应达到平衡时,测得c(H2)=0.008mol/L。
下列判断正确的起始浓度c(H2)/mol/Lc(I2)/mol/Lc(HI)/mol/L甲0.010.010乙0.020.020A.平衡时,乙中H2的转化率是甲中的2倍B.平衡时,甲中混合物的颜色比乙中深C.平衡时,甲、乙中热量的变化值相等D.该温度下,反应的平衡常数K=0.2512.室温下,用0.100mol/LNaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如右图所示。
2013年北京高考化学真题模拟一相对原子质量:H1 C12 N 14O16S 32I127 Cl35.5Al27 Ca 40Cu 63.5 Fe 56K 39 Mg 24Na 23 Zn 65Li 7 Mn 556.下列关于有机物的叙述中,正确的是A. 液化石油气、汽油和石蜡的主要成分都是碳氢化合物B. 油脂在人体内水解为氨基酸和甘油等小分子被吸收C. 乙醇和乙酸都能使酸性KMnO4溶液褪色D. 聚酯纤维、光导纤维都属于有机高分子7.下列离子方程式中正确的是A. FeO溶于稀硝酸中:FeO +2H+ = Fe2++H2OB. 过量CO2通入NaOH溶液中:OH-+CO2 = HCO3-C. 金属钠溶于水中:Na +H2O = Na++OH-+H2↑D. 过量氨水加入AlCl3溶液中:Al3++3OH- = Al(OH)3↓8.Q、W、X、Y、Z都是短周期元素。
X、Y、Q在周期表中的位置关系如图。
W、Z的最外层电子数相同,Z的核电荷数是W的2倍。
则下列说法不正确...的是Array A.非金属性:W > ZB.原子半径:X >Y > ZC.最高价氧化物对应水化物的碱性:X > YD.氢化物稳定性:Q > W9.下列涉及有机物的说法正确的A.乙烯、氯乙烯、苯乙烯都是不饱和烃,均可用于合成有机高分子材料B.丙烷是一种清洁燃料,可用作燃料电池的燃料C.苯能与溴发生取代反应,因此不能用苯萃取溴水中的溴D.糖类、蛋白质、脂肪都是重要的营养物质,它们都属于高分子化合物10.下列实验方法正确的是A.除去NaCl溶液中的Cl2,可加入酒精后分液B.滴定管用蒸馏水洗净后,直接装入标准浓度的溶液滴定C.用排水法收集稀HNO3和Cu反应产生的NO气体D.用KSCN溶液和氯水鉴别FeCl3溶液中是否含有FeCl211. 25℃时下列叙述正确的是A.0.10mol·L-1的三种溶液:①NaCl、②NaOH、③CH3COONa,其pH大小顺序为:③>②>①B.0.10mol·L-1NaHCO3溶液中:2c(CO32-)+c(HCO3-)+c(H2CO3)=0.10mol·L-1 C.pH=2的盐酸和pH=12的NaOH溶液中,水的离子积Kw相同D.与体积相同、pH=2的盐酸和醋酸完全反应,需要0.010mol·L-1 NaOH的体积相同12.从下列实验事实中得到的结论,正确的是25.(15分)CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g);ΔH= -867 kJ·mol-1。
绝密★启封并使用完毕前2013年普通高等学校招生全国统一考试理科综合能力测试(北京卷)化学部分一、选择题(共7小题,每小题6分,满分42分)1.(6分)下列设备工作时,将化学能转化为热能的是()A B C D硅太阳能电池锂离子电池太阳能集热器燃气灶A.A B.B C.C D.D2.(6分)下列金属防腐的措施中,使用外加电流的阴极保护法的是()A.水中的钢闸门连接电源的负极B.金属护拦表面涂漆C.汽车底盘喷涂高分子膜D.地下钢管连接镁块3.(6分)下列解释事实的方程式不准确的是()A.用浓盐酸检验氨:NH3+HCl=NH4ClB.碳酸钠溶液显碱性:CO32﹣+H2O⇌HCO﹣3+OH﹣C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe﹣3e﹣=Fe3+D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O 4.(6分)用石墨电极电解CuCl2溶液(如图).下列分析正确的是()A.a端是直流电源的负极B.通电使CuCl2发生电离C.阳极上发生的反应:Cu2++2e﹣=CuD.通电一段时间后,在阴极附近观察到黄绿色气体5.(6分)实验:①0.1mol•L﹣1AgNO3溶液和0.1mol•L﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1mol•L﹣1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol•L﹣1KI溶液,沉淀变为黄色.下列分析不正确的是()A.浊液a中存在沉淀溶解平衡:AgCl(s)⇌Ag+(aq)+Cl﹣(aq)B.滤液b中不含有Ag+C.③中颜色变化说明AgCl转化为AgID.实验可以证明AgI比AgCl更难溶6.(6分)下列实验事实不能用平衡移动原理解释的是()A.将NO2球浸泡在冷水和热水中B.t/℃2550100K W/10﹣14 1.01 5.4755.0C.D.C(氨水)/(mol•L﹣1)0.10.01pH11.110.67.(6分)用如图所示装置检验乙烯时不需要除杂的是()乙烯的制备试剂X试剂YA CH3CH2Br与NaOH乙醇溶液共热水KMnO4酸性溶液B CH3CH2Br与NaOH乙醇溶液共热水Br2的CCl4溶液C C2H5OH与浓H2SO4加热至170℃NaOH溶液KMnO4酸性溶液D C2H5OH与浓H2SO4加热至170℃NaOH溶液Br2的CCl4溶液A.A B.B C.C D.D二、解答题(共4小题,满分58分)8.(17分)可降解聚合物P的合成路线如下:已知:(1)A的含氧官能团名称是.(2)羧酸a的电离方程是.(3)B→C的化学方程式是.(4)化合物D苯环上的一氯代物有2种,D的结构简式是.(5)E→F中反应①和②的反应类型分别是.(6)F的结构简式是.(7)聚合物P的结构简式是.9.(14分)NO x是汽车尾气中的主要污染物之一.(1)NO x能形成酸雨,写出NO2转化为HNO3的化学方程式:.(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:①写出该反应的热化学方程式:.②随温度升高,该反应化学平衡常数的变化趋势是:.(3)在汽车尾气系统中装置催化转化器,可有效降低NO X的排放.①当尾气中空气不足时,NO x在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式:.②当尾气中空气过量时,催化转化器中的金属氧化物吸收NO x生成盐.其吸收能力顺序如下:12MgO<20CaO<38SrO<56BaO.原因是:,元素的金属性逐渐增强,金属氧化物对NO x的吸收能力逐渐增强.(4)通过NO x传感器可监测NO x的含量,其工作原理示意图如下:①Pt电极上发生的是反应(填“氧化”或“还原”).②写出NiO电极的电极反应式:.10.(12分)用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作和条件略):Ⅰ.向铝灰中加入过量稀H2SO4,过滤:Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:Ⅳ.加入MnSO4至紫红色消失,过滤;Ⅴ.浓缩、结晶、分离,得到产品.(1)H2SO4溶解Al2O3的离子方程式是.(2)将MnO4﹣氧化Fe2+的离子方程式补充完整:MnO4﹣+Fe2+=Mn2+Fe3++(3)已知:生成氢氧化物沉淀的pHAl(OH)3Fe(OH)2Fe(OH)3开始沉淀时 3.4 6.3 1.5完全沉淀时 4.78.3 2.8注:金属离子的起始浓度为0.1mol•L﹣1根据表中数据解释步骤Ⅱ的目的:.(4)已知:一定条件下,MnO4﹣可与Mn2+反应生成MnO2,①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是.②Ⅳ中加入MnSO4的目的是.11.(15分)某学生对SO2与漂粉精的反应进行实验探究:操作现象取4g漂粉精固体,加入100mL水部分固体溶解,溶液略有颜色过滤,测漂粉精溶液的pH pH试纸先变蓝(约为12),后褪色i.液面上方出现白雾;ⅱ.稍后,出现浑浊,溶液变为黄绿色;ⅲ.稍后,产生大量白色沉淀,黄绿色褪去(1)Cl2和Ca(OH)2制取漂粉精的化学方程是。
2013北京市高考化学一模27题·实验题汇编一、【海淀2013】27.(14分)某化学兴趣小组为探究Cl 2、Br 2、Fe 3+的氧化性强弱,设计了如下实验:(1)①检查气体发生装置A 的气密性的操作是。
②整套实验装置存在一处明显的不足,请指出。
D 装置中:红色慢慢褪去。
E 装置中:CCl 4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
2,请设计简单实验证明上述解释: 。
②欲探究E 中颜色变化的原因,设计实验如下:用分液漏斗分离出E 的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO 3溶液,结果观察到仅有白色沉淀产生。
请结合化学用语解释仅产生白色沉淀的原因 。
③将少量BrCl 通入到碘化钾溶液中,该反应的化学方程式为 。
二、【西城2013】27.(14下图所示装置进行实验,探究硝酸与铁反应的产物。
文献记载:I .在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II .FeSO 4+NO Fe(NO)SO 4(棕色) ∆H <0 。
III .NO 2和NO 都能被KMnO 4氧化吸收。
(2)检验是否生成﹣3价氮的化合物,应进行的实验操作是___________________________。
(3)甲取少量B 中溶液,加热,实验现象是___________________________。
请用化学平衡原理解释原因: ________________________________。
甲依据该现象得出的结论是A 中有NO 生成。
(4)乙认为甲得出A 中有NO 生成的证据不足。
为获取充足的证据,乙仍.采用该装置和操作进行对照实验,乙作出的改变是______________________,证明有NO 生成的实验现象是______________________。
(5)证明A 溶液中是否含有Fe 2+和Fe 3+,选择的药品是(填序号)_________________。
a .铁粉b .溴水c .鉄氰化钾溶液d .硫氰化钾溶液三、【丰台2013】27.(15分)为验证氧化性Cl 2>Fe 3+>SO 2,某小组用下图所示装置进行实验(夹持仪器D N 2 ← N N 2 3 和 A 中加热装置已略,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹K 1~K 4,通入 一段时间N 2,再将T 型导管插入B 中, 继续通入N 2,然后关闭K 1、K 3、K 4。
Ⅱ.打开活塞a ,滴加一定量的浓盐酸, 给A 加热。
Ⅲ.当B 中溶液变黄时,停 止加热,夹紧弹簧夹K 2。
Ⅳ.打开活塞b , 使约2mL 的溶液流入D 试管中,检验其中的离子。
Ⅴ.打开弹簧夹K 3、活塞c , 加入70%的硫酸,一段时间后夹紧弹簧夹K 3。
Ⅵ.更新试管D ,重复过程Ⅳ,检验B (1)过程Ⅰ的目的是。
(2)棉花中浸润的溶液为。
(3)A中发生反应的化学方程式为。
(4)用70%的硫酸制取SO 2,反应速率比用98%的硫酸快,原因是 。
(5)过程Ⅵ,检验B 溶液中是否含有SO 42-的操作是。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl 2>Fe 3+>SO 2的是 (填“甲”“乙”“丙”)。
(7)进行实验过程Ⅴ时,B 中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料:Fe 2+(aq)+SO 32-(aq)FeSO 3(s)(墨绿色)提出假设:FeCl 3与 SO 2的反应经历了中间产物FeSO 3,溶液的红棕色是FeSO 3(墨绿色)与FeCl 3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:浅绿色红棕色 4 mL 1mol/LFeCl 2溶液 墨绿色① 溶液E 和F 分别为 、 。
② 请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
四、【房山2013】27.(15分)某黄铜矿样品标注显示:主要成分为CuFeS 2(含81.5%),其余多为脉石(SiO 2)。
为检验该黄铜矿的纯度是否与标注一致,设计了如下实验:已知:①在空气存在下煅烧黄铜矿,生成Cu 、Fe 3O 4和SO 2气体。
②亚硫酸易被氧化:2H 2SO 3+O 2=2H 2SO 4请回答下列问题:(1)检验装置气密性后,称取研细的黄铜矿样品1.150g ,放入硬质玻璃管中,研细的目的是。
(2)通入空气一段时间后,点燃酒精喷灯加热样品,充分反应,装置B 、装置C 中反应的化学方程式分别是、 。
(3)反应过程中,装置A 的作用是 (填序号)。
① 除去空气中的二氧化碳 ② 除去空气中的水蒸气③ 使空气成分均匀混合 ④ 用于观察、控制空气流速(4)反应结束前的操作是:先撤掉酒精喷灯,再 ,其目的是 。
(5)取装置C 中溶液的1/10置于锥形瓶中,用0.05 mol•L -1标准碘溶液进行滴定,反应的离子方程式为 ;判断滴定达到终点的现象是 ;若滴定中消耗标准碘溶液20.00 mL ,则该黄铜矿的纯度测定结果比标注值 (偏低或偏高),造成该结果的原因之一可能是 ,改进的建议是 。
(6)还有什么方法能证明氧化性Cl 2>S ,用一种相关事实说明 。
五、【朝阳2013】27.(16分)实验室制乙烯时,产生的气体能使Br 2 的四氯化碳溶液褪色,甲、乙同学用下列实验验证。
(气密性已检验,部分夹持装置略)。
实验操作和现象:(1)烧瓶内产生乙烯的化学方程式是 _____________________________________ 。
(2)溶液―渐渐变黑‖,说明浓硫酸具有 性。
(3)分析使B 中溶液褪色的物质,甲认为是C 2H 4,乙认为不能排除SO 2的作用。
① 根据甲的观点,使B 中溶液褪色反应的化学方程式是 。
② 乙根据现象Ⅲ认为产生了SO 2,在B 中与SO 2 反应使溶液褪色的物质是 。
③ a. 根据甲的设计,洗气瓶中盛放的试剂是____________________。
b. 根据乙的设计,C 中盛放的试剂是___________________。
c. 能说明确实是SO 2使E 中溶液褪色的实验是________________________。
d. 乙为进一步验证其观点,取少量D 中溶液,加入几滴BaCl 2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是________________________________。
(4)上述实验得到的结论是 。
六、【东城2013】27. (13分)某化学小组同学用下列装置(气密性已检验)进行实验。
(1)探究O 2与KI 溶液发生反应的条件。
甲、乙两同学选用以下试剂进行实验(0.1 mol·L -1 KI 溶液,30% H 2O 2溶液、0.1 mol·L -1 H 2SO 4溶液、淀粉溶液、MnO 2固体、KMnO 4固体),实验记录如下。
Ⅳ甲制取O 2的化学方程式是 。
乙实验中O 2与KI 溶液反应的离子方程式是 。
甲用Ⅱ加入试剂替换Ⅰ后,Ⅳ中仍加入KI 、淀粉溶液,再次实验时Ⅳ中溶液不变蓝。
由此他猜测第一次实验时可能是Ⅰ中的白雾使溶液变蓝。
甲又将Ⅰ中产生的气体直接通入下列 溶液(填序号),证明了白雾中含有H 2O 2。
酸性KMnO 4 b. FeCl 2 c. Na 2S③ 由甲、乙两同学的实验,可得出结论: 。
K 1 K 2 K 3 K 4 (2)资料显示:KI 溶液在空气中被缓慢氧化时CO 2参与了反应。
丙、丁两同学为探究该反应中CO 2的作丙实验的目的是 。
丁实验的Ⅲ中加入试剂的化学式是 。
③ 为证明CO 2所起的作用,可进行的操作是:取上述丁实验后Ⅳ中溶液, 。
七、【顺义2013】27.(16分)亚硝酸钠是重要的防腐剂。
某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠(夹持装置和A中加热装置已略,气密性已检验)。
查阅资料:Ⅰ.HNO 2为弱酸,室温下存在反应3HNO 2=HNO 3+2NO↑+H 2OⅡ.在酸性溶液中,NO 2-可将MnO 4-还原为Mn 2+且无气体生成Ⅲ.NO 不与碱反应,可被酸性KMnO 4溶液氧化为硝酸实验操作:①关闭弹簧夹,打开A 中分液漏斗活塞,滴加一定量浓硝酸,加热;②一段时间后停止加热; ③从C 中取少量固体,检验是否是亚硝酸钠。
(1)A 中反应的化学方程式是 。
(2)B 中观察的主要现象是 , D 装置的作用是 。
(3)检验C 中产物有亚硝酸钠的操作是 。
(4)经检验C 产物中亚硝酸钠含量较少。
a. 甲同学认为C 中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。
生成碳酸钠的化学方程式是 _。
为排除干扰,甲在B 、C 装置间增加装置E ,E 中盛放的试剂是__________________(写名称)。
b. 乙同学认为除上述干扰因素外,还会有氧气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是________________________________________________________。
(5)实验经改进后可制得较纯亚硝酸钠,下列关于亚硝酸钠的说法正确的是________。
a. 亚硝酸钠有咸味,可代替食盐食用b. 室温下,0.1 mol/L 亚硝酸钠溶液pH > 7c. 0.1 mol/L 亚硝酸钠溶液中存在:c (Na +) + c (H +) = c (NO 2- ) + c (OH - )d. 0.1 mol/L 亚硝酸钠溶液中存在:c (NO 2— ) > c (Na +) > c (OH - ) > c (H +)八、【通州2013】27.(14分)某研究性学习小组将一定浓度的NaHCO 3溶液加入到CuSO 4溶液中,发现生成了沉淀。
他们对沉淀的成分进行了如下探究,请填写相关内容:(1)提出假设:假设Ⅰ:沉淀是CuCO 3;假设Ⅱ:沉淀是Cu(OH)2;假设Ⅲ:____________________。
(2)验证假设:该小组同学利用下图所示装置进行实验并对CuCO 3的质量分数进行测定:①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。
具体操作依次为 、洗涤、干燥; ②B 装置中反应结束后,装置A 中通a .关闭K 1、K 3,打开K 2、K 4,充分反应;b .打开K 1、K 4,关闭K 2、K 3,通入过量空气;c .打开K 1、K 3,关闭K 2、K 4,通入过量空气。
正确的顺序是 (填字母);⑤通过以上实验,测得沉淀中CuCO 3的质量分数为81.7%,由此可知假设______成立,写出生成CuCO 3的离子方程式 。
(3)总结反思:除了以上方案,还可以通过测量____________________________来测定沉淀中CuCO 3的质量分数。