现代分析化学期末试卷B汇编
- 格式:doc
- 大小:201.36 KB
- 文档页数:6

分析化学期末试题班级学号姓名一、单项选择题(15分,每小题1分)1、在以EDTA 为滴定剂的络合滴定中,都能降低主反应能力的一组副反应系数为( )。
A 、αY(H),αY(N),αM(L);B 、αY(H),αY(N),αMY ;C 、αY(N),αM(L),αMY ; D 、αY(H),αM(L),αMY 。
2、在EDTA 络合滴定中,使滴定突跃增大的一组因素是( )。
A 、C M 大,αY(H)小,αM(L)大,K MY 小; B 、C M 大,αM(L)小,K MY 大,αY(H) 小; C 、C M 大,αY(H)大,K MY 小,αM(L)小;D 、αY(H)小,αM(L)大,K MY 大,C M 小;3、以EDTA 为滴定剂,下列叙述错误的是( )。
A 、在酸度较高的溶液中,可形成MHY 络合物。
B 、在碱性较高的溶液中,可形成MOHY 络合物。
C 、不论形成MHY 或MOHY ,滴定反应进行的程度都将增大。
D 、不论溶液pH 值的大小,只形成MY 一种形式络合物。
4、在络合滴定中,有时出现指示剂的“封闭”现象,其原因为( )。
(M :待测离子;N :干扰离子;In :指示剂)A 、''NY MY K K >;B 、''NY MY K K <; C 、''MY MIn K K >; D 、''MYNIn K K >。
5、在用EDTA 测定Ca 2+、Mg 2+的含量时,消除少量Fe 3+、Al 3+干扰的下述方法中,哪一种是正确的( )。
A 、于pH=10的氨性缓冲溶液中直接加入三乙醇胺;B、于酸性溶液中加入KCN,然后调至pH=10;C、于酸性溶液中加入三乙醇胺,然后调至pH=10的氨性溶液;D、加入三乙醇胺时,不需要考虑溶液的酸碱性。
6、在1mol·L-1HCl介质中,滴定Fe2+最好的氧化-还原方法是()。


试卷一一、选择题:(每题2 分,共40 分)(说明:将认为正确答案的字母填写在每小题后面的括号内)1. 在定量分析中,精密度和准确度之间的关系是:()A.精密度高,准确度必然高;B. 精密度是保证准确度的前提;B.准确度是保证精密度的前提。
2. 若HAc的pKa=4.74,则Ka值为:()A. 2×10-5;B. 1.8×10-5;C. 2.0×10-5;D. 1.82×10-5。
3. 浓度相同的下列物质水溶液pH最高的是:()A.NaCl; B. NaHCO3;C. NH4Cl;D. Na2CO3。
4. 强酸滴定弱碱,以下指示剂不适用的是:()A.甲基橙;B. 甲基红;C. 酚酞;D. 溴酚蓝(pKa=4.0)。
5. 若S1,S2,S3依次为CaC2O4在纯水中、Na2C2O4稀溶液中、稀HCl溶液中的溶解度那么:()A. S3>S2>S1;B. S1>S2>S3;C. S3>S1>S2;D. S1>S3>S2。
6 下列情况引起随机误差的是:()A.使用不纯的Na2CO3来标定HCl溶液;B.在称量分析中,杂质与被测成分共沉淀;C.滴定分析中,终点与等量点不一致;D.在获得测量值时,最后一位数字估测不准。
7. 下列物质中可用直接法配制标液的是:()A. 固体NaOH;B. 固体K2Cr2O7;C. 固体Na2S2O3•5H2O;D. 浓HCl 。
8. H2PO4-的共轭碱是:()A. PO43-;B. HPO42-;C. H2PO4-;D. H3PO4。
9. 用重量法测定样品中SiO2含量时能引起系统误差的是:()A.称量样品时天平零点稍有变动;B. 析出硅酸沉淀时酸度控制稍有差别;C.加动物胶凝聚时的温度稍有差别;D. 硅酸的溶解损失。
10. 浓度相同的下列物质水溶液pH最高的是:()A.NaCl; B. NaHCO3;C. NH4Cl;D. Na2CO3。

《分析化学》课程期末考试试卷一.单选题。
每题1分,共20分。
1、根据“四舍六入五留双”的修约原则,下列哪项是错误的() [单选题] *A、保留五位有效数字:7.28355→7.2836B、保留四位有效数字:17.4551→17.45(正确答案)C、保留三位有效数字:2.005→2.00D、保留四位有效数字:14.446→14.45E、保留四位有效数字:15.0250→15.022、下列哪种情况应采用返滴定法() [单选题] *A、用AgNO3标准溶液测定NaCl试样含量B、用HCl标准溶液测定Na2CO3试样含量C、用EDTA标准溶液测定Al3+试样含量(正确答案)D、用Na2S2O3标准溶液测定K2Cr2O7试样含量E、用EDTA标准溶液测定骨钙3、下列各项所造成的误差那一项属于系统误差() [单选题] *A、滴定管的读数15.05ml记为15.50mlB、滴定时温度有变化C、称重时天平的平衡点有变动D、用1:10的HCl代替1:1的HCl(正确答案)E、滴定过程中有溶液溅出4、下列滴定分析法的特点哪一项是错误的() [单选题] *A、操作简便、快速B、应用范围广C、准确度高D、可测痕迹量组分(正确答案)E、相对误差可达到0.1%5、强碱滴定强酸时,浓度均增大10倍,则滴定突跃范围将() [单选题] *A、增大0.5个pH单位(正确答案)B、增大1个pH单位C、增大1.5个pH单位D、增大2个pH单位E、不变6、将pH=1和pH=14的两种强电解质溶液按等体积混合,混合溶液pH为() [单选题] *A、1B、7C、7.5D、13E、13.65(正确答案)7、配制HClO4-冰醋酸溶液要加入计算量的醋酐,其目的是() [单选题] *A、增大样品溶解能力B、增大样品的酸碱性C、除去HClO4冰醋酸中的水分(正确答案)D、增大突跃范围使终点敏锐E、增强溶剂的区分(均化)效应8、在EDTA标准溶液的标定过程中采用的缓冲溶液是() [单选题] *A、醋酸-醋酸盐缓冲溶液B、磷酸-磷酸盐缓冲溶液C、硼酸-硼酸盐缓冲溶液D、枸橼酸-枸橼酸钠缓冲溶液E、氨-氯化铵缓冲溶液(正确答案)9、EDTA在什么酸度下主要以Y4-的形式存在() [单选题] *A、pH<2.0B、pH=2.7-6.2C、pH=2.0-2.7D、pH=6.2-10.2E、pH>10.2(正确答案)10、标定Na2S2O3标准溶液,常用下列何种基准物质() [单选题] *A、重铬酸钾(正确答案)B、铬酸钾C、草酸D、碳酸钠E、高锰酸钾11、引起酸差的溶液,其pH() [单选题] *A、pH<1(正确答案)B、pH>1C、pH>9D、pH<9E、pH<212、能级跃迁所需能量最小的是() [单选题] *A、σ→σ*B、σ→π*C、π→π*D、n→σ*E、n→π*(正确答案)13、激发光、荧光、磷光三者的波长关系正确的是() [单选题] *A、λ激发光>λ荧光>λ磷光B、λ激发光<λ荧光<λ磷光(正确答案)C、λ激发光=λ荧光=λ磷光D、λ激发光>λ磷光>λ荧光E、λ磷光>λ激发光>λ荧光14、在一般的质谱图上出现非整数质核比的峰,它可能是() [单选题] *A、分子离子峰B、碎片离子峰C、亚稳离子峰(正确答案)D、同位素峰E、同位素峰或碎片离子峰15、红外光谱上的特征区的波数范围是() [单选题] *A、4000~1300cm-1(正确答案)B、3000~1300cm-1C、2000~1300cm-1D、1375~720cm-1E、1300~400cm-116、在CH3CH2CH3 的高分辨NMR谱上,CH2质子的吸收峰分裂为() [单选题] *A、三重峰B、四重峰C、六重峰D、七重峰(正确答案)E、八重峰17、某化合物的质谱图中,检测出分子离子峰的质荷比m/z为115,化合物含有() [单选题] *A.偶数个氮原子B、奇数个氮原子(正确答案)C.任意数目的氮原子D.没有氮原子E、都不对18、对称峰的拖尾因子符合要求的范围是() [单选题] *A、0.85~1.15B、0.90~1.10C、0.95~1.05(正确答案)D、0.99~1.01E、0.2~0.819、用气相色谱法进行定量时,要求混合物中每一个组分都出峰的是() [单选题] *A、外标法B、内标法C、内标对比法D、归一化法(正确答案)E、外标一点法20、高效液相色谱法的定性指标是() [单选题] *A、峰面积B、保留时间(正确答案)C、半高峰宽D、峰高E、标准偏差二、判断题(每题2分,共30分)1、定量分析中,系统误差影响测定结果的精密度,偶然误差影响测定结果的准确度。

分析化学期末考试试题2008—2009第一学期分析化学期末试题(A)一、选择题 ( 每题2分,共40分 )1(可以用下列中哪些方法减小分析测定中的偶然误差…().A(进行对照试验 B(进行空白试验 C(进行仪器校准 D(增加平行试验的次数2。
为标定KMnO4溶液的浓度宜选择的基准物是--——-—---- ( ) A Na2S2O3 B Na2SO3 C FeSO4?7H2O D Na2C2O4 3(已知某标准NaOH溶液在保存过程中吸收了少量CO2,用此溶液标定HCl溶液的浓度,若以酚酞为指示剂,则对所标定的HCl溶液的浓度的影响是( )A。
偏高 B.偏低 C.无影响 D.难预测4. 0。
05 mol/L SnCl2溶液 10 mL 与 0。
10 mol/L FeCl3溶液 20 mL 相混合,平衡时体系的电,,,,, (Fe3+/Fe2+)= 0。
68 V,, (Sn4+/Sn2+)= 0。
14 V] ()位是[已知此条件时A 0.14 VB 0。
32 VC 0.50 VD 0.68 V5. 以下溶液稀释10倍时,pH改变最小的是—-—-—--————-—--——-——--—-—--- ()A 0.1mol/L HAcB 0.1mol/L NH4AcC 0.1mol/L NaAcD 0。
1mol/L NH4Cl6(当金属离子M和N共存时,欲以EDTA滴定其中的M,若 CM=10CN,TE=0(1,,pM=0(2,则要求lgK为…()A 5B 6C 4D 77。
(1)用 0.02 mol/L KMnO4溶液滴定 0.1 mol/L Fe2+溶液 (2) 用 0。
002 mol/L KMnO4溶液滴定 0。
01 mol/L Fe2+溶液,上述两种情况下其滴定突跃将是—--—-—( )A 一样大B (1)>(2)C (2)〉(1)D 缺电位值, 无法判断 8采用BaSO4重量法测Ba2+时,洗涤沉淀用的洗涤剂是( )A 稀H2SO4B 稀HClC 冷水D 乙醇9 pH=4时有莫尔法滴定含量,将使结果( )A 偏高B 偏低C 忽高忽低D 无影响10用同一NaOH溶液分别滴定体积相等的H2SO4和HAc溶液,消耗的体积相等,说明H2SO4和HAc两溶液中的( )A.氢离子浓度(mol/L下同)相等; B。
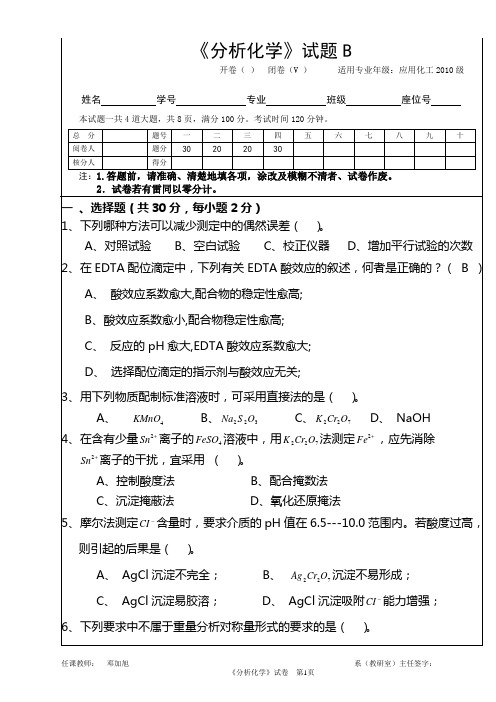
《分析化学》期末考试试卷1(A)学号姓名院(系)分数一.填空(每空1分。
共35分)1.写出下列各体系的质子条件式:(1)c1(mol/L) NH4 H2PO4(2)c1(mol/L)NaAc+ c2(mol/L)H3BO32.符合朗伯-比尔定律的有色溶液,当有色物质的浓度增大时,其最大吸收波长,透射比。
3. 检验两组结果是否存在显著性差异采用检验法,检验两组数据的精密度是否存在显著性差异采用检验法。
4.二元弱酸H2B,已知pH=1.92时,δH2B =δHB-;pH=6.22时δHB-=δB2-, 则H2B的p K a1=,p K a2=。
5.已知ϕΦ(Fe3+/Fe2+)=0.68V,ϕΦ(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中用0.1000 mol/L Ce4+滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为,化学计量点电位为,电位突跃范围是。
6.以二甲酚橙(XO)为指示剂在六亚甲基四胺缓冲溶液中用Zn2+滴定EDTA,终点时溶液颜色由___ ______变为________。
7.某溶液含Fe3+10mg,用等体积的有机溶剂萃取一次后,该溶液中剩余0.1mg,则Fe3+在两相中的分配比= 。
8.容量分析法中滴定方式有, , 和。
9.I2与Na2S2O3的反应式为。
10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最大处的波长叫做,可用符号表示。
11.紫外可见分光光度计主要由 , , , 四部分组成.12.桑德尔灵敏度以符号表示,等于;桑德尔灵敏度与溶液浓度关,与波长关。
13.在纸色谱分离中,是固定相。
14..定量分析过程包括 , ,, 和。
二、简答题(每小题 4分,共20 分,答在所留空白处)1.什么是基准物质?什么是标准溶液?2.分别简单阐述酸碱滴定指示剂,络合滴定指示剂, 氧化还原滴定指示剂和沉淀滴定指示剂指示滴定终点的原理.3.在进行络合滴定时,为什么要加入缓冲溶液控制滴定体系保持一定的pH?4.吸光光度法中测量条件的选择应注意哪几点?5. 分析化学中常用的分离和富集方法有哪些?(回答不能少于8种方法)三、分析方法设计(共15分,写在答题纸上)1. 设计测定含有中性杂质的Na2CO3与Na3PO4混合物中二组分质量分数的分析方案。
分析化学期末试题及参考答案————————————————————————————————作者:————————————————————————————————日期:分析化学期末试题班级 学号 姓名一 二 三 四 五 总分一、单项选择题(15分,每小题1分)1、在以EDTA 为滴定剂的络合滴定中,都能降低主反应能力的一组副反应系数为( A )。
A 、αY(H), αY(N),αM(L);B 、αY(H), αY(N),αMY ;C 、αY(N), αM(L),αMY ;D 、αY(H),αM(L),αMY 。
2、在EDTA 络合滴定中,使滴定突跃增大的一组因素是( B )。
A 、C M 大,αY(H)小,αM(L)大,K MY 小;B 、C M 大,αM(L)小,K MY 大,αY(H) 小; C 、C M 大,αY(H)大, K MY 小,αM(L)小;D 、αY(H)小,αM(L)大,K MY 大,C M 小;3、以EDTA 为滴定剂,下列叙述错误的是( D )。
A 、在酸度较高的溶液中,可形成MHY 络合物。
B 、在碱性较高的溶液中,可形成MOHY 络合物。
C 、不论形成MHY 或MOHY ,滴定反应进行的程度都将增大。
D 、不论溶液pH 值的大小,只形成MY 一种形式络合物。
4、在络合滴定中,有时出现指示剂的“封闭”现象,其原因为( D )。
(M :待测离子;N :干扰离子;In :指示剂)A 、''NY MY K K >;B 、''NY MY K K <; C 、''MY MIn K K >; D 、''MY NIn K K >。
5、在用EDTA 测定Ca 2+、Mg 2+的含量时,消除少量Fe 3+、Al 3+干扰的下述方法中,哪一种是正确的( C )。
A 、于pH=10的氨性缓冲溶液中直接加入三乙醇胺;B、于酸性溶液中加入KCN,然后调至pH=10;C、于酸性溶液中加入三乙醇胺,然后调至pH=10的氨性溶液;D、加入三乙醇胺时,不需要考虑溶液的酸碱性。
分析化学课试卷 (B卷)一.选择题(每题2分,共30分。
把正确选项的字母写在题后的括号内)1. 定量分析中,精密度与准确度之间的关系是 ( )(A)精密度高,准确度必然高(B)准确度高,精密度也就高(C)精密度是保证准确度的前提(D)准确度是保证精密度的前提2. 可用下列何种方法减免分析测试中的系统误差()(A)进行仪器校正(B)增加测定次数(C)认真细心操作(D)测定时保证环境的湿度一致3. 测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA标准溶液20.50mL,以下结果表示正确的是 ( )(A)10% (B)10.1% (C)10.08% (D)10.077%4. 在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。
这一点称为()(A)化学计量点(B)滴定误差(C)滴定终点(D)滴定分析5. 滴定管可估读到±0.01mL,若要求滴定的相对误差小于0.1%,至少应耗用体积()mL(A) 10 (B) 20 (C) 30 (D) 406. 共轭酸碱对的Ka 与Kb的关系是()(A)Ka Kb= 1 (B)KaKb=Kw(C)Ka/Kb=Kw(D)Kb/Ka=Kw7. 酸碱滴定中选择指示剂的原则是()(A)指示剂变色范围与化学计量点完全符合(B)指示剂应在pH =7.00时变色(C)指示剂的变色范围应全部或部分落入滴定pH突跃范围之内(D)指示剂变色范围应全部落在滴定pH突跃范围之内8. 测定(NH4)2SO4中的氮时,不能用NaOH直接滴定,这是因为()(A)NH3的Kb太小(B)(NH4)2SO4不是酸(C)(NH4)2SO4中含游离H2SO4(D)NH4+的Ka太小9. 一般情况下,EDTA与金属离子形成的配合物的配位比是()(A)1:1 (B)2:1 (C)1:3 (D)1:210. 铝盐药物的测定常用配位滴定法。
加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定。
计算题1.分析铁矿中铁的含量,得如下数据:37.45%,37.40%,37.50%,37.00%,37.25%。
计算此结果的平均值、平均偏差、标准偏差、变异系数。
2.某弱酸的pka=9.00,现有其共轭碱NaA溶液20.00mL,浓度为0.1000 mol·L-1,当用0.1000 mol·L-1HCl溶液滴定时,化学计量点的PH值为多少?其附近的滴定突跃为多少?3.已知高锰酸钾溶液浓度为g/mL,求此高锰酸钾溶液的浓度及它对铁的滴定度。
4.标定浓度约为0.1mol·L-1的NaOH,欲消耗NaOH溶液20mL左右,应称取基准物质H2C2O4·2H2O多少克?其称量的相对误差能否达到0. 1%?若不能,可以用什么方法予以改善?若改用邻苯二甲酸氢钾为基准物,结果又如何?5.计算0.20mol/LNa2CO3的PH值。
(已知碳酸的pKa1=6.38 pKa2=10.25)6. 在500 mL溶液中,含有9.21g K4Fe(CN)6。
计算该溶液的浓度及在以下反应中对Zn2+的滴定度:(Mzn=65 Mk=39 MFe=56)3 Zn2+ +2 [Fe(CN)6]4-+ 2K+=== K2Zn3[Fe(CN)6]27.测定铁矿石中铁的质量分数(以表示),5次结果分别为:67.48%,67.37%,67.47%,67.43%和67.40%。
计算:(1)平均偏差(2)相对平均偏差(3)标准偏差;(4)相对标准偏差;(5)极差。
8. 将一弱碱0.950 g溶解成100mL溶液,其pH为11.0,已知该弱碱的相对分子质量为125,求弱碱的pKb。
9. 测定石灰中铁的质量分数(%),4次测定结果为:1.59,1.53,1.54和1.83。
(1)用Q检验法判断第四个结果应否弃去?(2)如第5次测定结果为1.65,此时情况又如何(Q均为0.90,Q0.90,4=0.76,Q0.90,5=0.64)?10. 已知浓硝酸的相对密度1.42,其中含HNO3约70%,求其浓度.如欲配制1L0.25mol/L HNO3溶液,应取这种浓硝酸多少毫升?11. 欲配制pH=10.0的缓冲溶液1L。
学习-----好资料
大连理工现代分析化学模拟试卷2
姓名:学号:院系:
级班
课程名称:现代分析化学
考试日期:2006 年 5 月 25 日试卷共 7 页
一二三四总分
100 20 30 30 标准分 10
分得
分,共10分)一、判断题(每题2 1.
符合比耳定律的有色溶液稀释时,其最大吸收峰的波长位置不移2.
)动但吸收峰强度发生浅色效应。
(
以外,还包括化学发光分荧光和磷光分析3.发光分析除光致发光() 析、电化学发光分析和生物发光分析等。
()紫外—可见吸收光谱是分子中电能能级变化产生的,振动能级和4.
)
转动能级不发生变化。
(
第一激发单重态与三重态的区别在于电子自旋方向不同,激发三5.
)重态具有较高能级。
(
光子的能量没有变化。
6.拉曼散射被视为分子和光子间的弹性碰撞,)(分)二、单项选择题(每题2分,共20 1.
) ( 2.分子的紫外-可见吸收光谱呈带状光谱,其原因是什么
A.分子中价电子运动的离域性质;.分子振动能级的跃迁伴随着转动能级的跃迁;B C.分子中价电子能级的相互作用; D.分子电子能级的跃迁伴随着振动、转动能级的跃迁。
更多精品文档.
学习-----好资料
3.光谱分析法与其他分析法的不同点在于光谱分析法涉及到( )
A.试样通常需要预处理以消除干扰组分;
B.光电效应;
C.复杂组分的分离和两相分配;
D.辐射光与试样间的相互作用与能级的跃迁
4.红外光可引起物质的能级跃迁是()
A.分子的电子能级的跃迁,振动能级的跃迁,转动能级的跃迁;
B.分子内层电子能级的跃迁;
C.分子振动能级及转动能级的跃迁;
D.分子转动能级的跃迁。
5.碳谱如果不采用标识技术很难解析的原因是()
A.碳谱灵敏度低; B.碳核之间有偶合裂分;
C.碳谱分辨率高; D.碳核和氢核之间有偶合裂分。
6.在质谱图谱中,CHBr的M+2峰的强度约为M峰的()3A. 1/3; B. 1/2;
C. 1/4;
D. 相当。
7.
8.在质谱图的中部质量区,一般来说与分子离子质荷比奇偶相同的碎片离子是()
A.由简单开裂产生的;
B. 由重排反应产生的;
C.在无场区断裂产生的;
D. 在飞行过程中产生的。
9.
10.2D-NOE相关谱提供()。
A.提供相邻核的相关信息?
B.空间距离相近核的相关信息
C.提供同一自旋体系的所有相关峰信息
D.提供偶合常数的相关信息
11.
12.1 )。
HSQCH检测异核化学位移相关谱主要用于(
113C核H核直接相联的归属与A.
113C核归属与核间接相联的H B.C.提供通过空间作用的核相关信息
D.提供相邻偶合氢之间的相关信息
更多精品文档.
学习-----好资料
13.顺磁共振的超精细结构是由何种相互作用引起的: ( )
A.电子自旋─电子自旋
B.核自旋─核自旋
C.电子轨道─电子自旋
D.电子自旋─核自旋
14.有机化合物成键电子的能级间隔越小,受激跃迁时吸收电磁辐射的()A.能量越大; B.波数越大; C.波长越长; D.频率越高。
三、简答题(每题5分,共10分)
1.简述有机光波谱谱图的基本构成三要素。
2.分离技术与光波谱检测技术联用的主要特点是什么?
四、谱图解析(共30分)
1. 某化合物MS谱图如下,试确定其结构,并写出断裂反应方程式。
(5分)
)
分结构,并说明依据。
OHCNMR2. 根据如下谱图确定化合物(5248更多精品文档.
学习-----好资料
)
(5谱图确定结构,并说明依据。
分C化合物HO,根据如下IR3. 129
13谱图确定结构,并说明某含氧化合物分子无对称性,根据如下NMRC 4. 依据(5分)。
?
根据下列谱图解析此化合物的结构,并说某化合物5. CHNO (M =149)119 10明依据。
(分)
更多精品文档.
学习-----好资料
30四、综合解析题(分))结构,并说明依据。
M=150根据如下谱图确定化合物
(
更多精品文档.
学习-----好资料
:答案:试卷2
一、判断题
1.√
2.√
3.×
4.×
5.×
更多精品文档.
学习-----好资料
二、单项选择题
1. D
2. D
3. C
4. D
5. D
6. B
7. B
8. A
9. D 10. C
三、谱图解析(共30分)
1.
2.
3.
4.
5. 四、综合解析题
更多精品文档.。