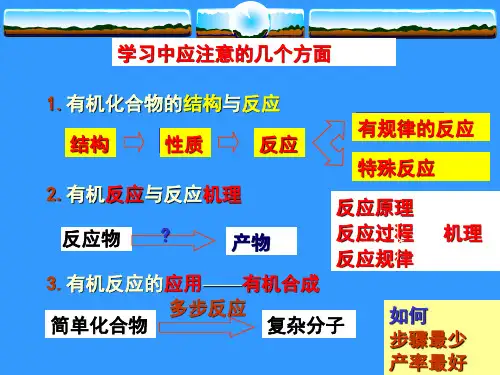
有机化合物和有机化学
- 格式:ppt
- 大小:13.36 MB
- 文档页数:27




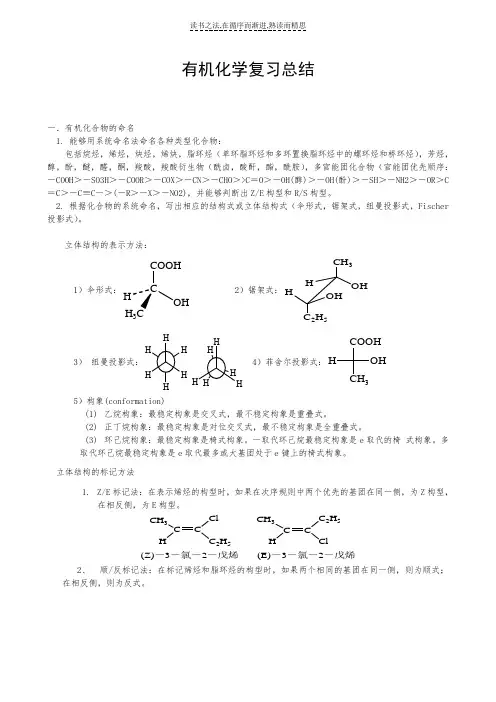
有机化学复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C ≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)伞形式:COOHOHH 3 2)锯架式:CH 3OHHHOH 2H 53)纽曼投影式:H H 4)菲舍尔投影式:COOH3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C H C 2H 5CH 3C CH 2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3C CHCH 3HCH 3CCH HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。


有机化学有机化学是研究有机化合物的一门基础学科,是研究有机化合物的来源、制备、结构、性能、应用及有关理论、变化规律和方法学的科学。
它是有机学工业的理论基础,与经济建设和国防建设密切相关,不论是化学工业、能源工业、材料工业还是国防工业的发展,都离不开有机化学的成就。
同时,有机化学的基本原理对于掌握和发展其他学科也是必不可少的。
一、有机化学的发展有机化学的发展可分为初期、中期和后期三个阶段。
初期主要是应用和提取时期。
在这一时期,人们利用掌握的化学知识发现了很多药物,提取出了尿素、吗啡等重要的有机化合物。
中期是简单合成时期和经典结构理论创立时期。
在这一时期,不仅合成了乙酸、油脂等化合物,很多经典的理论也被创立,例如凯库勒提出了苯的构造式、拜耳的张力学说等。
后期,即从二十世纪初至今是以量子力学为基础的现代结构理论的建立、现代物理测试方法、复杂天然物的合成、有机合成工业。
二、有机化学的现状1有机化学的分类有机化学已经形成许多成熟的分支学科,并同物理、生物、医学、药学等学科相互渗透和交叉,产生出许多交叉学科。
其中,分支学科包括有机合成化学、天然有机化学、金属与元素有机化学、生物有机化学、物理有机化学和分析有机化学。
交叉学科包括生物有机化学、药物化学、香料化学、农药化学、有机新材料化学等。
天然有机化学是研究动植物及生物体内源性生理活性物质的有机化学。
目的是希望发掘有生理活性的天然化合物,作为发展新药先导化合物,或者直接用于临床或为农业生产服务。
天然有机化学是植物化学、基础医学、药物化学、农业化学的基础。
同时,天然有机化学的研究为有机化合物新的分离分析方法,新的专一性和立体选择性合成方法和立体化学等方面作出了重要贡献。
元素有机化学是当代有机化学研究中最为活跃的领域之一。
有机磷化学、有机氟化学、有机硼化学和有机硅化学是当前元素有机化学中四个主要支柱。
金属有机化学是近代化学前沿领域之一。
金属有机化合物的合成、结构和反应性能的研究以及新型基元反应的开发和以有机合成为目标的金属有机化学都是金属有机化学的主要研究内容。

有机化学和有机化合物有机化学是研究有机化合物的分子结构、性质、合成方法和反应机理的学科,是化学领域的重要分支之一。
有机化合物是由碳(C)和氢(H)元素组成的化合物,通常也含有氧(O)、氮(N)、硫(S)等元素。
1. 有机化学的历史和发展有机化学的发展可以追溯到18世纪,当时人们发现有机化合物通常是从生物体中提取出来的,因此称之为有机化合物。
19世纪初,化学家开始研究有机化合物的合成方法,如通过蒸馏、萃取等手段得到纯度较高的化合物。
随着化学分析技术的不断进步,人们逐渐揭示了有机化合物的分子结构和性质,有机化学得以迅速发展。
2. 有机化合物的特点有机化合物的主要特点是碳元素的存在。
由于碳元素具有较高的电负性和较小的原子半径,它能够与多种其他元素形成共价键,构成多样化的分子结构。
这种多样性使得有机化合物能够存在于自然界中的各种生物体内,并具有丰富的化学性质和广泛的应用领域。
3. 有机化合物的分类有机化合物可以根据它们的结构特点进行分类。
常见的分类方法有碳链结构分类、官能团分类和骨架分类等。
碳链结构分类是根据碳原子的连接方式将有机化合物分为直链烷烃、支链烷烃、脂环烃等。
官能团分类是根据有机化合物中含有的官能团(如羟基、羧基、酮基等)来进行分类。
骨架分类是根据有机化合物分子的骨架结构(如环烷烃、脂环烃、芳香烃等)进行分类。
4. 有机化合物的重要性和应用有机化合物在生活中的应用非常广泛。
例如,石油是一种富含有机化合物的化石能源,能够用于生产汽油、柴油等燃料。
医药行业也广泛应用有机化合物,用于合成药物,治疗各种疾病。
此外,有机化合物还用于塑料制品、颜料、染料、香料等工业领域。
5. 有机化学的发展趋势随着科学技术的不断进步,有机化学也在不断发展。
一方面,有机化学家致力于合成更复杂、更高效的有机化合物,以满足不同行业的需求。
另一方面,有机化学也与其他学科相结合,如生物学、材料科学等,开展交叉研究,探索有机化学在新领域的应用。

《有机化学》(第六版)讲稿第一章绪论(Introduction )教学要求:掌握:碳原子的三种杂化轨道(sp3 sp2 sp)的特点;分子极性与偶极矩的关系;分子轨道与原子轨道的关系; 成键轨道与反键轨道的差异;共振式与共振杂化体的区别;熟悉:有机化合物和有机化学的含义;键长、键角、键能和共价键的极性的含义;官能团的含义和圭要官能团;有机反应中共价键断裂的主要方式; 实验式、分子式和结构式的含义。
了解:有机化合物分子中,原子间主要以共价键相结合。
掌握共价键的本质是学习和理解有机化合物结构与性质关系和反应机制以及化合物稳定性的基础。
因此本章对路易斯结构和现代价键理论作一简要回顾;有些化合物的结构用单一路易斯结构式不能准确表达,然而运用共振结构却有它的独到之处,为此对共振结构作一简介;掌握路易斯酸碱概念对理解有机反应十分有用,故将其作为一个知识点加以阐述。
了解有机化合物分类和反应类型及确定结构式的步骤与方法对提高学习有机化学的综合分析能力也是十分必要的,本章对此方面内容作一扼要介绍。
第一节有机化合物和有机化学一、有机化合物和有机化学下面是一些简单而熟悉的有机化合物,他们在化学组成上有什么共同点?◆有机化合物含碳的化合物或碳氢化合物及其衍生物。
◆有机化学:有机化学的现代定义是指研究含碳化合物的化学。
第二节共价键一、现代共价键理论路易斯的共价键理论虽然揭示了共价键与离子键的区别,但未能说明共价键是怎样形成的,也不能解释共价键为什么具有饱和性和方向性等诸多问题。
现代共价键理论指出:当两个原子互相接近到一定距离时,自旋方向相反的单电子相互配对(即两原子轨道重叠)。
使电子云密集于两核之间,降低了两核间正电荷的排斥,增加了两核对电子云密集区域的吸引。
因此使体系能量降低,形成稳定的共价键;共价键有以下特点:第一、每个原子所形成共价键的数目取决于该原子中的单电子数目,这就是共价键具有饱和性。
第二、当形成共价键时,原子轨道重叠越多,核间电子云越密集,形成的键就越强,这种关系称为最大重叠原理。

第一章绪论一.有机化合物和有机化学有机化合物是指碳氢化合物及其衍生物。
有机化学是研究有机合物的结构特征.合成方法和理化性质等的化学。
二.有机化合物的特点碳原子的价电子层1S22S22P2因此,有机物分子是共价键结合。
1.可燃性:绝大多数有机物都是可燃的。
2.耐热性、熔点、沸点低:3.水溶性:小,原理依据,相似相溶原理、与水形成氢键的能力。
4.导电性能:差。
5.反应速度:慢。
6.反应产物:常有副产物,副反应。
7.普遍在同分异构体同分异构体是指分子式相同结构式不同,理化性质不同的化分物。
三.有机化合物的结构理论1858年凯库勒和古柏尔提出有机化合物分子中碳原子是四价及碳原子之间相互连接成碳链的概念,成为有机化合物分子结构的,最原始和最基础的理论。
1861年布特列洛夫对有机化合物的结构提出了较完整的的概念,提出原子之间存在着相互的影响。
1874年范荷夫和勒贝尔建立分子的立体概念,说明了对映异构和顺反异构现象。
*碳原子总是四价的,碳原子自相结合成键,构造和构造式分子中原子的连接顺序和方式称为分子的构造.表示分子中各原子的连接顺序和方式的化学式叫构造式(结构式).用两小点表示一对共用电子对的构造式叫电子式,用短横线(-)表示共价键的构造式叫价键式.有时可用只表达官能团结构特点的化学式,既结构简式.四.共价键的性质1. 键长:形成共价键的两个原子核间距离。
2. 键角:两个共价键之间的夹角。
3. 键能:指断单个特定共价键所吸收的能量,也称为该键的离解能。
共价键的键能是断裂分子中全部同类共价键所需离解能的平均值。
4. 键的极性:键的极性与键合原子的电负性有关,一些元素电负性数值大的原子具有强的吸电子能力。
常见元素电负性为:H C N O F Si P S Cl Br I2.1 2.53.0 3.54.0 1.8 2.1 2.5 3.0 2.5 2.0对于两个相同原子形成的共价键来说,可以认为成键电子云是均匀的分布在两核之间,这样的共价键没有极性,为非极性共价键。
常见有机化合物官能团常见有机化合物官能团1、苯基苯(benzene, C6H6)有机化合物,就是组成构造最简洁的芳香烃,在常温下为一种无色、有甜味的透亮液体,并具有猛烈的芳香气味。
可燃, 有毒,为 IARC 第一类致癌物。
苯具有的环系叫苯环,就是最简洁的芳环。
苯分子去掉一个氢以后的构造叫苯基,用 Ph 表示。
因此苯也可表示为PhH2、羟基羟基,又称氢氧基。
就是由一个氧原子与一个氢原子相连组成的一价原子团,化学式-OH。
在无机物中在无机物中,通常含有羟基的为含氧酸或其的酸式盐。
含羟基的物质溶解于水会电离出氢离子 ,因此含羟基的物质水溶液多成偏酸性。
在有机物中在有机化学的系统命名中,在简洁烃基后跟着羟基的称作醇,而糖类多为多羟基醛或酮。
羟基直接连在苯环上的称作酚。
具体命名见 OH 原子团的命名。
注:乙醇为非电解质,不显酸性。
羟基的性质1、复原性,可被氧化成醛或酮或羧酸2、弱酸性,醇羟基与钠反响生成醇钠,酚羟基与氢氧化钠反响生成酚钠3、可发生消去反响,如乙醇脱水生成乙烯OH 原子团的命名此原子团在有机化合物中称为羟基,就是醇(ROH)、酚(ArOH)等分子中的官能团;在无机化合物水溶液中以带负电荷的离子形式存在(OH-1),称为氢氧根。
当羟基与苯环相连形成苯酚时,可使苯环致活,显弱酸性。
再进基主要进入其邻位、对位。
羟基与氢氧根的区分在很多状况下,由于在示性式中,羟基与氢氧根的写法一样,因此羟基很简洁与氢氧根混淆。
虽然氢氧根与羟基均为原子团,但羟基为官能团,而氢氧根为离子。
而且含氢氧根的物质在水溶液中呈碱性,而含羟基的物质的水溶液则多呈偏酸性。
氢氧根与羟基在有机化学上的共性就是亲核性。
有机合成中羟基的保护羟基就是有机化学中最常见的官能团之一,无论就是醇羟基还就是酚羟基均简洁被多种氧化剂所氧化。
因此在多官能团化合物的合成过程中,羟基或者局部羟基需要先被保护,阻挡它参与反响,在适当的步骤中再被转化。
3、烃基烃分子(碳氢化合物)中少掉一个或几个氢原子而成的基团。
第一章1.现代有机化合物和有机化学的含义是什么?答:有机化合物:含碳化合物或碳氢化合物及其衍生物。
2.常见的有机化合物的官能团有哪些?答:常见的有机化合物的官能团有:碳碳双键、碳碳三键、卤素、羟基、醚键、羰基、羧基、氨基等。
3.写出下列化合物或基团的路易斯结构式。
①CH 3OH: :CH 3-O-H :②CH 3CH 2OCH 2CH 3: :CH 3-CH 2-O-CH 2-CH 3:③CCl 4:④CH 3CH 3: CH 3-CH 3 ⑤C 2H 4: C=CH HHH⑥-NO 2:⑦HCN :4.已知化合物A 含有C 、H 、N 、O 四种元素,其重量百分含量分别为49.3%、9.6%、19.6%和22.7%;又知质谱测得该化合物的相对分子质量为146,写出该化合物的实验式和分子式。
解:49.3/12.01=4.105 9.6/1.008=9.524 19.6/14.008=1.399 22.7/16.00=1.419 4.105:9.524:1.399:1.419=3:7:1:1所以A 的实验式为C 3H 7NO 。
其相对质量为73,而A 的分子量为146,所以A 的分子式为C 6H 14N 2O 2 。
5.指出下列化合物中标有*的碳原子的杂化方式(sp 3?sp 2?sp?)。
答:⑴ 是sp 3杂化 ⑵ 是sp 2杂化 ⑶ 是sp 杂化6.将下列化合物中标有字母的碳-碳键按照键长增加排列其顺序。
答:c 、b 、d 、a 、e7.写出下列酸的共轭碱。
答:相应的共轭碱是:⑴ CH 3OH ⑵ H 2O ⑶ CH 3O - ⑷ CH 3S - ⑸ HO - ⑹ CH 3COO - ⑺ HCO 3- ⑻ Cl -8.指出下列化合物或离子哪些是路易斯酸,哪些是路易斯碱。
答:H +、BF 3、AlCl 3 是路易斯酸,NH 3、C 2H 5O -、CH 3CH 2OCH 2CH 3 是路易斯碱。