第十章 胶体的稳定性
- 格式:ppt
- 大小:499.50 KB
- 文档页数:4

化学药剂(混凝剂)投加化学药剂(混凝剂)使得胶体分散体系脱稳和凝聚的过程称为化学混凝。
在混凝过程中,含有微小悬浮微粒和胶体杂质被聚集成较大的固体颗粒,使颗粒性的杂质与水分离的过程,称为混凝澄清处理。
1.混凝澄清处理的机理(1)胶体的稳定性和ξ电位胶体在水溶液中能持久地保持其悬浮的分散状态的特性叫做稳定性。
水中的胶体物质的自然沉降速度十分缓慢,不易沉降的原因是由于同类胶体带有相同的电荷(天然水和废水中胶体带负电),彼此之间存在着电性斥力,使之不能聚合,保持其原有颗粒的分散状态。
胶体颗粒保持其稳定性的另一个原因是,表面有一层水分子紧紧地包围着,称为水化层,它阻碍了胶体颗粒间的接触,使得胶体颗粒在热运动时不能彼此碰撞而粘合,从而使其颗粒保持悬浮状态。
使胶体失去稳定性的过程就称为脱稳。
胶体所带的电荷影响胶体的凝聚。
当胶体颗粒和流体之间呈相对运动时,剪切面(滑动面)上的电位,称之为ζ电位。
若ζ电位愈大,则胶体就愈稳定;若ζ电位等于零,胶体不带电荷,这时胶体极不稳定,易于彼此聚合成大块而沉降。
水中的胶体物质的自然沉降速度十分缓慢,不易沉降的原因是由于同类胶体带有相同的电荷(天然水和废水中胶体带负电),彼此之间存在着电性斥力。
另外,胶体表面总是有一层水分子包围着,它妨碍了胶体颗粒之间的接触粘合。
溶液主体与双电层滑动界面的电位差称为ξ电位。
(2)胶体的脱稳、凝聚和絮凝改变胶体颗粒的某些特性,使之失去稳定性称之为胶体的脱稳。
在布朗运动的作用下,相互凝聚成细小絮凝物的反应过程称为凝聚。
细小絮凝物在范德华引力的作用下或在絮凝剂的吸附架桥作用下,相互粘合成较大絮状物的过程称为絮凝。
向水中投加混凝剂后,经过混合、凝聚、絮凝等综合作用,可使胶体颗粒和其它微小颗粒聚合成较大的絮状物。
细小絮凝物在速度梯度??的作用下或在絮凝剂的吸附架桥作用下,相互粘合成较大絮状物的过程称为絮凝。
凝聚和絮凝的全过程称为混凝。
a.胶体的脱稳凝聚向水中投加电解质,可起到压缩双电层使胶体脱稳的作用。



第⼗章药物制剂的稳定性第⼗章2分药物制剂的稳定性考点摘要注意:⽼师为⽅便⼤家理解,对本章内容进⾏了重新整理,对部分知识点进⾏了扩充讲解,希望⼤家认真学习第⼀节概述⼀、药物制剂稳定:药物制剂从制备到使⽤期间质量发⽣变化的速度和程度,是评价药物制剂质量的重要指标之⼀。
⼆、研究内容:考察不稳定的影响因素——寻找避免或延缓不稳定因素的⽅法——增加药物稳定性——预测有效期。
三、药物制剂的基本要求:安全、有效、质量可控四、药物制剂稳定性研究的意义在于:1.保证药品质量,作到安全、有效、稳定2.⽤于指导新药及其剂型的研制开发3.减少损失,创造经济效益五、稳定性的两个⽅⾯药物制剂的稳定性主要包括化学、物理两个⽅⾯1.化学稳定性:药物由于⽔解、氧化等化学降解反应,使药物含量、⾊泽产⽣变化,产⽣毒副作⽤。
2.物理稳定性⽅⾯,如混悬剂中药物颗粒结块、结晶⽣长,乳剂的分层、破裂,胶体制剂的⽼化,⽚剂崩解度、溶出速度的改变等,主要是制剂的物理性能发⽣变化。
六、药物稳定性以化学动⼒学为基础⽤化学动⼒学的⽅法可以:1.药物降解机理的研究2.药物降解速度的影响因素的研究3.药物制剂有效期的预测及其稳定性的评价4.防⽌(或延缓)药物降解的措施与⽅法的研究七、化学动⼒学中反应级数的概念:-dC/dt=kC nK:反应速度常数C:反应物的浓度⼤多数药物的降解反应可⽤零级、⼀级(或伪⼀级)反应进⾏处理。
研究药物的降解速度:n:反应级数,n=0,为零级反应;n=1,为⼀级反应;n=2 为⼆级反应,以此类推。
1.零级反应速率⽅程:-dC/dt=k0积分得:C=C0-K0t零级反应速度与反应物浓度⽆关,⽽受其他因素的影响,如反应物的溶解度,或某些光化反应中光的照度等。
2.⼀级反应速率⽅程:-dC/dt=kC积分得:lgC=-kt/2.303+lgC0⼀级反应速度与反应物浓度有关半衰期(t1/2):是药物分解⼀半所需时间t1/2=0.693/k恒温时,⼀级反应的半衰期与反应物浓度⽆关有效期(t0.9):药物降解10%所需的时间,恒温时:t0.9=0.1054/k例:预测发⽣⼀级反应的药物,其半衰期()A.与初始浓度C0⽆关B.与t时反应物浓度有关C.与反应常数k⽆关-----与反应常数k乘反⽐D.与初始浓度C0有关-------与初始浓度C0⽆关E.与反应时间有关t1/2=0.693/k例:某药物降解服从⼀级反应,其消除速度常数K=0.0096(天-),其半衰期为()A.5天B.72.2天C.11天D.33天E.95天t1/2=0.693/k例:某药物以⼀级反应速度分解,其分解速度常数K=2﹡10-3(天-1),那么此药物的有效期是()A.10天B.27天C.40天D.53天E.60天t0.9=0.1054/k⼗的负3次⽅=1/103=1/1000等于0.0010.1054÷2×0.001=52.7天⼋、制剂中药物的化学降解途径(降解途径有哪些;每⼀类降解中的适⽤对象是什么,以及典型药物)药物降解的途径:⽔解,氧化,.异构化,,聚合,脱羧每⼀类降解中的适⽤对象是什么⽔解适⽤对象是:(1)酯类药物:(2)酰胺类药物:氧化适⽤对象是(1)酚类药物:(2)烯醇类药物(3)芳胺类(4)吡唑酮类(5)噻嗪类:异构化适⽤对象是,聚合适⽤对象是脱羧适⽤对象是每⼀类降解中的典型药物⽔解降解中的典型药物:酯类药物:盐酸普鲁卡因、⼄酰⽔杨酸的⽔解是此类药物⽔解反应的代表内酯:⽑果芸⾹碱、华法林钠氧化降解中的典型药物(1)酚类药物:肾上腺素、左旋多巴、吗啡、去⽔吗啡、⽔杨酸钠(2)烯醇类药物:维⽣素C(抗坏⾎酸)(3)芳胺类:如磺胺嘧啶钠(4)吡唑酮类:如氨基⽐林、安乃近(5)噻嗪类:如盐酸氯丙嗪、盐酸异丙嗪异构化降解中的典型药物,光学异构化:左旋肾上腺素(易氧化)、⽑果云⾹碱(内酯类药物,可以发⽣⽔解);麦⾓新碱⼏何异构化:维⽣素A,肾上腺素聚合降解中的典型药物:氨苄青霉素脱羧降解中的典型药物:对氨基⽔杨酸钠,对氨基苯甲酸1.⽔解是药物降解的主要途径之⼀,易⽔解的药物主要有酯类(包括内酯)和酰胺类(包括内酰胺)等。

胶体的稳定性
答案:
胶体(Colloid)又称胶状分散体,是一种分散质粒子直径介于粗分散体系和溶液之间的一类分散体系[1]。
胶体不一定都是胶状物,也不一定是液体,常见的胶体有有色玻璃、果冻、鸡蛋清、血液等。
介稳性:
胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系。
胶体具有介稳性的两个原因:
原因一:胶体粒子可以通过吸附而带有电荷,同种胶粒带同种电荷,而同种电荷会相互排斥(要使胶体聚沉,就要克服排斥力,消除胶粒所带电荷)。
原因二:胶体粒子在不停地做布朗运动,与重力作用相同时便形成沉降平衡的状态。
结构:
根据法扬斯规则(能与晶体的组成离子形成不溶物的离子将优先被吸附.优先吸附具有相同成分的离子),胶体粒子是胶粒,胶粒与扩散层在一起组成了胶团,而胶粒又包括胶核与吸附层。




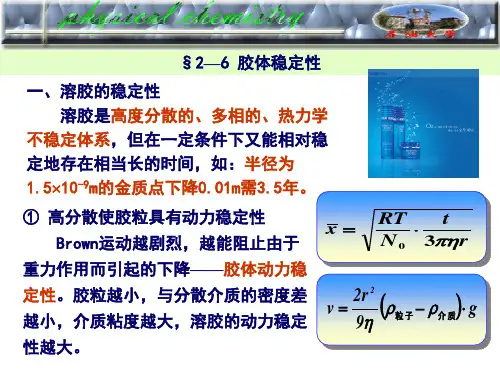
胶体稳定性一、胶体的分类所谓胶体是一种分散质粒子直径介于粗分散体系和溶液之间的一类分散体系,其值通常在1nm—100nm之间,这是一种高度分散的多相不均匀体系。
按分散剂的不同可分为气溶胶、固溶胶、液溶胶;按分散质的不同可分为粒子胶体、分子胶体。
二、胶体的稳定及不稳定性胶体因质点很小,强烈的布朗运动使它不致很快沉降,故具有一定的动力学稳定性;另一方面,疏液胶体是高度分散的多相体系,相界面很大,质点之间有强烈的聚结倾向,所以又是热力学不稳定体系。
一旦质点聚结变大,动力学稳定性也随之消失。
因此,胶体的聚集稳定性是胶体稳定与否的关键。
三、双电层与zeta电位由于分散粒子表面带有电荷而吸引周围的反号离子,这些反号离子在两相界面呈扩散状态分布而形成扩散双电层。
根据双电层理论可将双电层分为Stern层和扩散层。
当分散粒子在外电场的作用下,稳定层与扩散层发生相对移动时的滑动面即是剪切面,该处对远离界面的流体中的某点的电位称为Zeta电位。
即Zeta电位是连续相与附着在分散粒子上的流体稳定层之间的电势差。
四、聚集沉降理论影响因素起聚沉作用的主要是电荷与胶体相反的离子(称为反离子)。
反离子的价数越高,则聚沉效率越高,聚沉值越低。
一价反离子的聚沉值约为25~150,二价的为0.5~2,三价的为0.01~0.1。
聚沉值大致与反离子价数的六次方成反比,这称为舒尔茨-哈代规则。
五、胶体稳定性疏液胶体的稳定性理论通称DLVO理论。
此理论的出发点是:胶体质点间因范德瓦耳斯力而相互吸引,质点在相互接近时又因双电层的重叠而产生排斥作用,胶体的稳定程度取决于上述两种作用的相对大小。
DLVO理论计算了各种形状质点之间的范德瓦耳斯吸引能与双电层排斥能随质点间距离的变化。
在质点相互接近的过程中,如果在某一距离上质点间的排斥能大于吸引能,胶体将具有一定的稳定性;若在所有距离上吸引皆大于排斥,则质点间的接近必导致聚结,胶体发生聚沉。
溶液中的离子浓度或反离子的价数增加时,质点间的范德瓦耳斯力几乎不受影响,但双电层的排斥能却因双电层的压缩而大大降低,因此胶体的稳定性下降,直至发生聚沉。

胶体与溶液的特性
一、胶体特性:
1、丁达尔效应:能发生丁达尔现象(丁达尔效应),产生聚沉,盐析,电泳,布朗运动等现象,渗析作用等性质。
2、介稳性:胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系。
3、结构:根据法扬斯规则(能与晶体的组成离子形成不溶物的离子将优先被吸附.优先吸附具有相同成分的离子),胶体粒子是胶粒,胶粒与扩散层在一起组成了胶团,而胶粒又包括胶核与吸附层。
4、其他:具有聚沉、盐析、电泳现象、渗析等性质。
二、溶液的特性:
1、均一性:溶液各处的密度、组成和性质完全一样;
2、稳定性:温度不变,溶剂量不变时,溶质和溶剂长期不会分离(透明);
3、混合物:溶液一定是混合物。
溶液是由至少两种物质组成的均一、稳定的混合物,被分散的物质(溶质)以分子或更小的质点分散于另一物质(溶剂)中。
物质在常温时有固体、液体和气体三种状态。
因此溶液也有三种状态,大气本身就是一种气体溶液,固体溶液混合物常称固溶体,如合金。
不属于胶体稳定的原因
1. 引力作用:胶体由分散相颗粒悬浮在分散介质中,引力作用有可能导致颗粒聚集。
例如,重力会导致颗粒沉降,减弱胶体稳定性。
2. 热运动:分散相颗粒在分散介质中受到热运动的影响,颗粒之间的碰撞和随机热运动有可能导致聚集。
高温会增加颗粒之间的碰撞频率,从而减弱胶体稳定性。
3. 溶剂效应:一些溶剂对胶体稳定性有影响。
例如,一些有机溶剂对胶体表面的有机物会发生溶解,导致胶体破坏。
4. pH值变化:当胶体中存在可溶性离子或羧基等表面活性物质时,pH值的变化可能会影响它们的电荷性质。
当pH值变化时,表面电荷的变化可能导致颗粒之间的吸引力增加,从而使胶体不稳定。
5. 添加高浓度电解质:高浓度的电解质可引起电荷中和现象,从而减弱胶体颗粒之间的静电排斥力,促使胶体不稳定。
需要注意的是,以上只是一些不利于胶体稳定的因素,实际情况会因胶体的性质和环境条件的不同而有所差异。
65胶体稳定性的DLVO 理论胶体(憎液溶胶)是一个高度分散的系统,它有很大的表面自由能,且具有自发降低表面自由能的倾向,这就是说,在本质上,憎液溶液胶属于热力学不稳定系统。
某些物理条件的改变,特别是电解质的加入,会显著地影响它的稳定性,使它聚集而沉淀。
早在一个世纪前,Schulze(舒尔茨)和Hardy(哈迪)就经验发现,异号离子的电荷数对溶胶的聚沉影响很大。
电荷数(价数)愈高,聚沉能力愈大。
如果将使溶胶聚沉的电解质最低浓度称为聚沉值,则一价、二价和三价异号离子的聚沉值之比约为66)31(:)21(:1,这个规律称为Schulze —Hardy 规则。
怎样解释这个规则,就成了胶体稳定性理论必须面对的首要任务。
直到上个世纪的四十年代,这个问题才被两位前苏联学者Дерягин(杰里亚金)、Ландау(朗道)和两位荷兰学者Verwey(弗威)和Overbeek(奥弗比克)所解决,因此,称为DLVO 理论。
本专题就专门来介绍这个理论。
鉴于理论是建立在数学解析的基础上,下面的介绍只取推导的结果,而将介绍的重心放在物理意义上。
1.DLVO 理论这个理论完全着眼于溶胶粒子的作用势能与粒子间距的关系。
认为粒子间存在着两个相互制约的作用力,一是van der Waals 引力,它要使粒子兼并而聚沉。
另一是扩散双电层重迭所引起的静电斥力,它是维护溶胶稳定的原因。
因此,溶胶是否能够相对地稳定就取决于这两种力谁占据优势,DLVO 理论的首要任务便是分别计算粒子之间的引力和斥力势能与粒子间距的定量关系。
(1) 粒子间的van der Waals 引力势能如所周知,分子之间是存在短程的van der Waals 引力的,这种力的大小与分子间距的7次方成反比。
它包括分子间的偶极—偶极作用,偶极与诱导偶极的作用和分子间的色散作用。
后者亦称London 力,在胶体中常常起着主要的作用,量子力学算得,London 力的引力势能与分子间距的关系可由下式表示662A 43−−−=−=x x h V βνα (65-1) 式中h 为Planck 常数, ν为分子的特征振动频率,α为分子的极化率,x 为分子间距,负号表示吸引。