25水的总硬度及钙镁离子含量的测定
- 格式:ppt
- 大小:728.50 KB
- 文档页数:19

自来水的总硬度及钙镁含量的测定一、实验目的本实验旨在通过测定自来水的总硬度及钙镁含量,掌握水质分析的基本方法和技能,了解自来水中钙镁含量对人体健康的影响。
二、实验原理1.总硬度的测定原理总硬度是指水中钙、镁离子的总浓度,通常用钙的浓度表示。
测定总硬度的方法有多种,其中以EDTA络合滴定法最为常用。
EDTA是一种强螯合剂,它与钙、镁等金属离子形成配合物,使之转化为稳定的螯合物。
在pH=10左右的条件下,EDTA与钙、镁离子形成的络合物是稳定的,通过滴定EDTA溶液,即可测定水中钙、镁离子的含量。
2.钙镁含量的测定原理钙、镁是人体必需的微量元素,但如果摄入过量,会对人体健康产生不良影响。
测定自来水中钙镁含量的方法有多种,其中以原子吸收光谱法最为常用。
该方法是利用钙、镁原子在炉管中被蒸发、电离、激发后产生的特定波长的光谱线进行测定,从而得到钙、镁元素的含量。
三、实验步骤1.总硬度的测定步骤(1)取100ml水样,加入2ml NH3-NH4Cl缓冲液和10ml 0.01mol/LEDTA溶液,用Erlenmeyer瓶摇匀。
(2)加入1~2滴酚酞指示剂,溶液呈现粉红色。
(3)滴定0.01mol/L CaCl2溶液,直至溶液变成稳定的蓝色。
(4)记录滴定所用的CaCl2溶液体积V1。
2.钙镁含量的测定步骤(1)取100ml水样,加入2ml HNO3和2ml HCl,用蒸馏水定容至1000ml。
(2)在原子吸收光谱仪中设置好钙、镁的波长,调节火焰高度和炉管温度。
(3)将水样注入炉管,测定钙、镁的含量。
四、实验结果本次实验测得自来水的总硬度为200mg/L,钙、镁含量分别为50mg/L和30mg/L。
五、实验结论自来水中的总硬度和钙、镁含量都是影响水质的重要指标。
总硬度高的水会使水垢增多,影响水的使用寿命;而钙、镁含量过高则会对人体健康产生不良影响。
因此,我们应该注重自来水的水质检测,选择适合自己的饮用水源。
六、实验体会通过本次实验,我了解了水质分析的基本原理和方法,掌握了总硬度和钙镁含量的测定技能。


《自来水的总硬度及钙镁含量的测定》实验综述报告(一)实验综述:《自来水的总硬度及钙镁含量的测定》一、实验目的•了解水的硬度概念及计算方法•掌握EDTA滴定法测定水中钙镁离子含量的方法•掌握复合指示剂法测定水的硬度的方法二、实验原理1. 水的硬度水的硬度是指水中的钙镁离子含量。
硬度分为临时硬度和总硬度两种,其中临时硬度反映水中碳酸盐类离子的含量,易通过沸腾使其析出消除;而总硬度既包括临时硬度,也包括水中的非碳酸盐类离子。
### 2. EDTA滴定法这种测定方法是利用EDTA(乙二胺四乙酸)分别与水中的钙、镁离子配位形成螯合络合物,用酚酞作指示剂,在逐渐加入EDTA及调节pH值的过程中,在EDTA配位反应达到终点时,出现颜色的转变。
从此可以计算出水样中钙、镁离子的含量。
### 3. 复合指示剂法这种测定方法是将一种称为“EDTA- 红色三原酸盐”的复合指示剂溶于水中,与以EDTA为溶解剂的固体EDTA作测量,根据指示剂的颜色变化来反映水的硬度。
三、实验步骤1. EDTA滴定法1.取约50mL样品,通入气泡。
2.用pH计调节样品pH值为10±0.2。
3.加入2-3滴酚酞指示剂,然后用标准0.01mol/L的EDTA溶液从滴定管中滴加。
4.每次滴加后充分搅拌,并观察溶液的颜色变化,当溶液从红色变为洋红色时,停止滴定。
5.记录滴定体积,并计算水样中钙离子和镁离子的含量以及总硬度。
### 2. 复合指示剂法6.取约100mL样品,滴加20%碳酸钠溶液,搅拌均匀并过滤。
7.将滤液从容器中的体积标尺读数调整至100mL,并加入2mL复合指示剂。
8.分步加入标准的EDTA水溶液,并搅拌均匀。
9.待颜色从蓝色变为洋红色,再加入2-3滴1%的硫酸铵指示剂,并继续滴定至颜色变为蓝色为止。
10.记录需要的EDTA滴定体积,并计算水样中的总硬度。
四、实验注意事项1.实验过程中应保证仪器干净和精准度。
2.EDTA溶液中可加入少量的2-5g/L的NaOH,调节pH值,有助于反应快速达到终点。

实验十四水硬度的测定一实验目的1、了解硬度的常用表示方法;2、学会用配位滴定法测定水中钙镁含量,钙含量的原理和方法3、掌握铬黑T,钙指示剂的使用条件和终点变化。
二、实验原理1、总硬度、钙硬度、镁硬度的概念及表示方法;水的硬度主要是指水中含可溶性的钙盐和镁盐。
总硬度通常以每L 水中含的碳酸钙的mg 数,即mg/L.钙硬度即每1L水中含的钙离子的mg数,mg/L.镁硬度即每1L水中含的镁离子的mg数,mg/L2 总硬度的测定条件与原理测定条件:以NH-NHCI缓冲溶液控制溶液pH= 10,以铬黑T为指示剂,用EDTA 滴定水样。
原理:滴定前水样中的钙离子和镁离子与加入的铬黑T指示剂络合,溶液呈现酒红色,随着EDTA勺滴入,配合物中的金属离子逐渐被EDTA夺出,释放出指示剂,使溶液颜色逐渐变蓝,至纯蓝色为终点,由滴定所用的EDTA勺体积即可换算出水样的总硬度。
3 钙硬度的测定条件与原理;测定条件:用NaOH溶液调节待测水样的pH为13,并加入钙指示剂,然后用EDTA 滴定。
原理:调节溶液呈强碱性以掩蔽镁离子,使镁离子生成氢氧化物沉淀,然后加入指示剂用EDTA滴定其中的钙离子,至酒红色变为纯蓝色即为终点,由滴定所用的EDTA勺体积即可算出水样中钙离子的含量,从而求出钙硬度。
4、相关的计算公式总硬度=(CV1) EDT/M laCo/0.1 钙硬度=(CV) ED T MM0.1镁硬度=C(V1-V2)M Mg/0.1四实验数据记录与处理总硬度的测定镁硬度=C(V I-V2)M M/0.1五、思考题1、水硬度的测定包括哪些内容?如何测定?〈1〉水硬度的测定包括总硬度与钙硬度的测定,镁硬度则根据实验结果计算得到;〈2〉可在一份溶液中进行,也可平行取两份溶液进行;①•在一份溶液中进行;先在pH=12时滴定CaT,再将溶液调至pH=10(先调至pH=3,再调至pH=10,以防止Mg(0H2或MgC3等形式存在而溶解不完全),滴定Mg2+。

水中钙镁离子含量及总硬度旳测定目旳1、理解水旳硬度旳测定意义和水硬度常用表达措施。
2、掌握EDTA法测定水中Ca2+、Mg2+含量旳原理和措施。
原理工业中将具有较多钙、镁盐类旳水称为硬水,水旳硬度是将水中Ca2+、Mg2+旳总量折合成CaO或CaCO3来计算。
每升水中含1mg CaO定为1度,每升水含10mgCaO称为一种德国度(°)。
水旳硬度用德国度(°)作为原则来划分时,一般把不不小于4°旳水称为很软水,4°~8°旳水称为软水,8°~16°旳水称为中硬水,16°~32°旳水称为硬水,不小于32°旳水称为很硬水。
用EDTA进行水旳总硬度及Ca2+、Mg2+含量旳测定期可先测定Ca2+、Mg2+旳总量,再测定Ca2+量,由总量与Ca2+量旳差求得Mg2+旳含量,并由Ca2+、Mg2+总量求总硬度。
Ca2+、Mg2+总量旳测定:用NH3-NH4Cl缓冲溶液调节溶液旳PH =10,在此条件下,Ca2+、Mg2+均可被EDTA精确滴定。
加入铬黑T批示剂,用EDTA原则溶液滴定。
在滴定旳过程中,将有四种配合物生成即CaY、MgY、MgIn、CaIn,它们旳稳定性顺序为:CaY ﹥MgY﹥MgIn﹥CaIn(略去电荷)由此可见,当加入铬黑T后,它一方面与Mg2+结合,生成红色旳配合物MgIn,当滴入EDTA时,一方面与之结合旳是Ca2+,另一方面是游离态旳Mg2+,最后,EDTA夺取与铬黑T结合旳Mg2+,使批示剂游离出来,溶液旳颜色由红色变为蓝色,达到批示终点。
设消耗EDTA 旳体积为V1。
Ca2+含量旳测定:用氢氧化钠溶液调节待测水样旳PH=12,将Mg2+转化为Mg(OH)2沉淀,使其不干扰Ca2+旳测定。
滴加少量旳钙批示剂,溶液中旳部分Ca2+立即与之反映生成红色配合物,使溶液呈红色。
当滴定开始后,随着EDTA旳不断加入,溶液中旳Ca2+逐渐被滴定,接近计量点时,游离旳Ca2+被滴定完后,EDTA则夺取与批示剂结合旳Ca2+使批示剂游离出来,溶液旳颜色由红色变为蓝色,达到批示终点。


水的总硬度及钙镁含量的测定【定义】水的硬度最初是指钙、镁离子沉淀肥皂的能力。
水的总硬度指水中钙、镁离子的总浓度,其中包括碳酸盐硬度(即通过加热能以碳酸盐形式沉淀下来的钙、镁离子,故又叫暂时硬度)和非碳酸盐硬度(即加热后不能沉淀下来的那部分钙、镁离子,又称永久硬度)。
硬度的表示方法硬度的表示方法尚未统一,目前我国使用较多的表示方法有两种:一种是将所测得的钙、镁折算成CaO的质量,即每升水中含有CaO的毫克数表示,单位为mg·L-1;另一种以度( °)计:1硬度单位表示10万份水中含1份CaO(即每升水中含10mgCaO),1°=10ppm CaO。
这种硬度的表示方法称作德国度。
【工业用水和生活饮用水对水的硬度的要求】我国生活饮用水卫生标准规定以CaCO3计的硬度不得超过450mg·L-1。
钙镁总量的测定方法在一份水样中加入pH=10.0的氨性缓冲溶液和少许铬黑T指示剂,溶液呈红色;用EDTA标准溶液滴定时,EDTA先与游离的Ca2+配位,再与Mg2+配位;在计量点时,EDTA 从MgIn-中夺取Mg2+,从而使指示剂游离出来,溶液的颜色由红变为纯蓝,即为终点。
注意:当水样中Mg2+极少时,由于CaIn-比MgIn-的显色灵敏度要差很多,往往得不到敏锐的终点。
为了提高终点变色的敏锐性,可在EDTA标准溶液中加入适量的Mg2+(在EDTA标定前加入,这样就不影响EDTA与被测离子之间的滴定定量关系),或在缓冲溶液中加入一定量的Mg—EDTA盐。
水的总硬度可由EDTA标准溶液的浓度cEDTA和消耗体积V1(ml)来计算。
以CaO 计,单位为mg/L.ρCaO=cEDTA*V1*MCaO/Vs*1000水中钙含量的测定另取一份水样,用NaOH调至pH=12.0,此时Mg2+生成Mg(OH)2沉淀,不干扰Ca2+的测定。
加入少量钙指示剂,溶液呈红色;用EDTA标准溶液滴定至溶液由红色变为蓝色即为终点,所消耗的EDTA的体积为V2(EDTA),则Ca2+的质量浓度(mg·L-1 )可用下式计算:ρCaO=cEDTA*V2*MCaO/Vs*1000镁含量=总硬度-钙含量水中溶解氧的测定碘量法一、实验原理水中溶解氧的测定,一般用碘量法。

矿泉水硬度的测定姓名:祖广权专业:应化班级:101 学号: 2010014032 实验日期:2013年 06 月19日成绩:摘要:水是人类最为宝贵的自然资源,也是人类以及所有动植物生存的基础。
现阶段水污染却成了全世界的主要问题。
污染水给工业、农业及生命健康带来了很大的危害。
本实验介绍了以EDTA络合滴定对矿泉水总硬度,钙、镁硬度的测定方法。
关键词:水硬度 EDTA 滴定1引言水硬度是水质的一个重要监测指标,通过监测可以知道其是否可以用于工业生产及日常生活,如硬度高的水可使肥皂沉淀使洗涤剂的效用大大降低,纺织工业上硬度过大的水使纺织物粗造且难以染色;烧锅炉易堵塞管道,引起锅炉爆炸事故;高硬度的水,难喝、有苦涩味,饮用后甚至影响胃肠功能等;喂牲畜可引起孕畜流产等。
因此水硬度的测定方法研究是不容忽视的。
目前的分析测定方法很多,主要可分为化学分析法和仪器分析法,其中化学分析法以EDTA络合滴定法为主。
[1]EDTA络合滴定法是一种普遍使用的测定水的硬度的化学分析方法。
它是在一定条件下,以铬黑T为指示剂,NH3·H2O—NH4Cl为缓冲溶液,EDTA与钙、镁离子形成稳定的配合物,从而测定水中钙、镁总量。
但是该方法易产生指示剂加入量、指示终点与计量点、人工操作者对终点颜色的判断等误差。
在分析样品时,如水样的总碱度很高时,滴定至终点后,蓝色很快又返回至紫红色,此现象是由钙、镁盐类的悬浮性颗粒所致,影响测定结果。
可将水样用盐酸酸化、煮沸,除去碱度。
冷却后用氢氧化钠溶液中和,再加入缓冲溶液和指标剂滴定,终点会更加敏锐。
[2]由于指示剂铬黑T 易被氧化,加铬黑T 后应尽快完成滴定,但临终点时最好每隔2~3 s 滴一滴并充分振摇;并且在缓冲溶液中适量加入等当量EDTA 镁盐,使终点明显;滴定时,水样的温度应以20~30℃为宜。
[3]通常采用间接法配制EDTA 标准溶液。
标定EDTA 溶液的基准物有Zn 、ZnO 、CaCO 3、Bi 、Cu 、MgSO 4 · 7H 2O 、Ni 、Pb 等。

自来水总硬度及钙镁离子含量的测定一、教学要求1、练习移液管、滴定管的使用;2、学会EDTA法测定水的总硬度的原理和方法;3、掌握铬黑T指示剂及钙指示剂的应用及指示剂终点的原理;4、了解金属指示剂的特点5、掌握配位滴定过程,突跃范围及指示剂的选择原理。
二、预习内容1、EDTA滴定钙镁离子的原理;2、金属指示剂的应用及变色的原理;3、移液管的规格、使用;4、滴定管的规格、洗涤、涂油、润洗等操作步骤;三、基本操作1、移液管的使用(1)定义移液管是用于准确量取一定体积溶液的量出式玻璃量器。
(2)润洗:使用前用吸水纸将尖端内外的水除去,然后用待吸液润洗三次:左手持洗耳球,右手拇指和中指拿住标线以上部分,将移液管管尖插入约溶液1~2cm,将待吸液吸至球部1/4处,移出,荡洗,弃去(切记从尖口放出,应保持上管口和食指干燥)。
(3)移液:左手持洗耳球,右手拇指和中指拿住标线以上部分,将移液管管尖插入约溶液1~2cm,将待吸液吸至标线以上,迅速移去洗耳球,同时用右手食指堵住管口,左手改拿盛待吸液的容器。
然后,将移液管往上提起,使之离开液面,并将原深入溶液部分沿容器内部轻转两圈,以除去管壁上的溶液。
使容器倾斜30度,其内壁与移液管尖紧贴,同时右手食指微微松动,使液面缓慢下降,直到管内溶液的弯月面与标线相切,这时应立即用食指按紧管口,移开待吸液容器,左手改拿接受溶液的容器,并将接受容器倾斜,使内壁紧贴移液管尖,成30度左右,然后放松右手食指,使溶液自然顺壁流下,待液面下降到管尖后,等15秒左右,移出移液管。
(除特别注明,管尖残留溶液不吹入接受容器中)。
用移液管吸取溶液从移液管放出溶液2、滴定管的使用:(1)定义:滴定管是可准确测量滴定剂体积的玻璃量器。
(2)类别:酸式滴定管:(特征—玻璃旋塞)用于盛放酸性溶液、中性溶液和氧化性溶液。
碱式滴定管:(特征—橡皮管+玻璃珠)用于盛放碱性和无氧化性溶液。
(3)滴定管的准备:a、用前检查:检查是否漏水,旋塞转动是否灵活;酸式管涂凡士林;碱式管更换胶皮管或玻璃球。

实验目的:测量水中钙、镁离子的总含量1.了解配位滴定法基本原理和方法。
2.了解水的硬度的概念及其表示方法。
实验原理含有钙、镁离子的水叫硬水。
测定水的总硬度就是测定水中钙、镁离子的总含量,可用EDTA配位滴定法测定:滴定前: M + EBT M-EBT(红色)主反应: M + Y MY终点时: M-EBT + Y MY + EBT(红色) (蓝色)滴定至溶液由红色变为蓝色时,即为终点。
滴定时,Fe3+、Al3+等干扰离子可用三乙醇胺予以掩蔽;Cu2+、Pb2+、Zn2+等重属离子,可用KCN、Na2S或巯基乙酸予以掩蔽。
水的硬度有多种表示方法,本实验要求以每升水中所含Ca2+、Mg2+总量(折算成CaO的质量)表示,单位mg・L-1。
器材和药品1.器材天平(0.1g、0.1mg),容量瓶(100mL),移液管(20mL),酸式滴定管(50mL),锥形瓶(250mL)等。
2.药品 HC1(1∶1),乙二胺四乙酸二钠(Na2H2Y・2H2O,A.R.),碱式碳酸镁[Mg(OH)2・4MgCO3・6H2O,基准试剂],NH3-NH4Cl缓冲溶液(pH=10.0),三乙醇胺(1∶1),铬黑T指示剂(0.2%氨性乙醇溶液)等。
实验方法一、Mg2+标准溶液的配制(约0.02mol・L-1)准确称取碱式碳酸镁基准试剂0.2~0.25g,置于100mL烧杯中,用少量水润湿,盖上表面皿,慢慢滴加1∶1 HC1使其溶解(约需3~4mL)。
加少量水将它稀释,定量地转移至100mL容量瓶中,用水稀释至刻度,摇匀。
其浓度计算:二、EDTA标准溶液的配制与标定1.EDTA标准溶液的配制(约0.02mol・L-1)称取2.0g乙二胺四乙酸二钠(Na2H2Y・2H2O)溶于250mL蒸馏水中,转入聚乙烯塑料瓶中保存。
2.EDTA标准溶液浓度的标定用20mL移液管移取Mg2+标准溶液于250mL锥形瓶中,加入10mL氨性缓冲溶液和3~4滴EBT指示剂,用0.02mol・L-1EDTA标准溶液滴定,至溶液由紫红色变为蓝色即为终点。
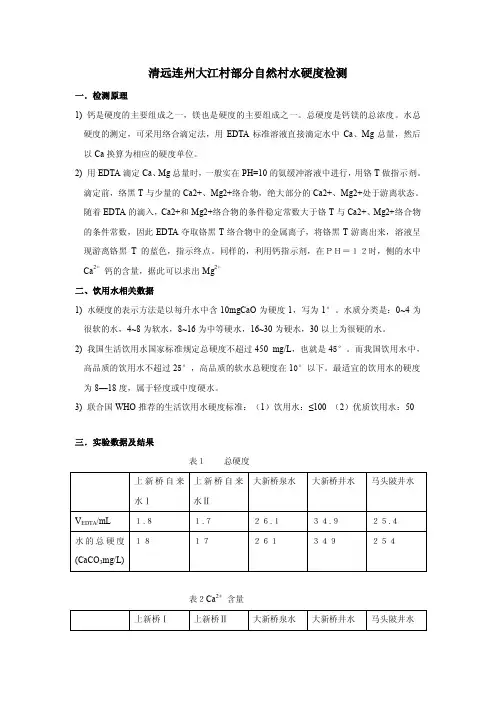
清远连州大江村部分自然村水硬度检测一.检测原理1) 钙是硬度的主要组成之一,镁也是硬度的主要组成之一。
总硬度是钙镁的总浓度。
水总硬度的测定,可采用络合滴定法,用EDTA标准溶液直接滴定水中Ca、Mg总量,然后以Ca换算为相应的硬度单位。
2) 用EDTA滴定Ca、Mg总量时,一般实在PH=10的氨缓冲溶液中进行,用铬T做指示剂。
滴定前,络黑T与少量的Ca2+、Mg2+络合物,绝大部分的Ca2+、Mg2+处于游离状态。
随着EDTA的滴入,Ca2+和Mg2+络合物的条件稳定常数大于铬T与Ca2+、Mg2+络合物的条件常数,因此EDTA夺取铬黑T络合物中的金属离子,将铬黑T游离出来,溶液呈现游离铬黑T的蓝色,指示终点。
同样的,利用钙指示剂,在PH=12时,侧的水中Ca2+钙的含量,据此可以求出Mg2+二、饮用水相关数据1) 水硬度的表示方法是以每升水中含10mgCaO为硬度1,写为1°。
水质分类是:0~4为很软的水,4~8为软水,8~16为中等硬水,16~30为硬水,30以上为很硬的水。
2) 我国生活饮用水国家标准规定总硬度不超过450 mg/L,也就是45°。
而我国饮用水中,高品质的饮用水不超过25°,高品质的软水总硬度在10°以下。
最适宜的饮用水的硬度为8—18度,属于轻度或中度硬水。
3) 联合国WHO推荐的生活饮用水硬度标准:(1)饮用水:≤100 (2)优质饮用水:50三.实验数据及结果表1总硬度表2Ca2+含量表3Mg2+含量四、数据分析(根据国家饮用水标准,并未对钙镁离子做定量限制,此部分只分析总硬度)1)上新桥水样上新桥所取两个水样中,均为同一源头的自来水。
检测结果水中总硬度分别为18 mg/L、17mg/L,即为1.8°和1.7°,其水中所含钙镁离子量很低,属于很软的水。
长期饮用过低硬度水,对人体生理功能也有负面作用。
水中适量的硬度是我们日常摄取钙镁离子的主要方式之一。
水的总硬度及钙镁含量的测定一、实验的目的1.了解水的硬度的测定的意义和常用的硬度表示方法2.掌握配位滴定法的基本原理、方法和计算3.掌握铬黑T和钙指示剂的应用。
二、实验原理水的硬度是指水中含钙盐和镁盐的量。
硬度的表示方法是钙镁离子的总量折合成钙离子的量。
常用CaCO3(mg/L)或CaCO3(m mol/L)表示。
计算公式:总硬度=c(EDTA)V(EDTA)M(CaCO3)V s或:总硬度=c(EDTA)V(EDTA)V s测定水的总硬度,一般采用EDTA滴定法。
在pH值为10的氨性缓冲溶液中,以铬黑T为指示剂,用EDTA标准溶液直接滴定溶液的Ca2+、Mg2+,终点时溶液由红色变为纯蓝色,用EDTA的体积为V1,反应式如下:滴定前:Mg2++HIn2-⇌MgIn-+H+计量点前:Ca2++H2Y2-⇌Ca Y2-+2 H+计量点后:MgIn-+H2Y2-⇌Mg Y2-+2 H+当水样中Mg2+含量较低是,终点不敏锐,这时可在缓冲溶液中加入少量Mg—EDTA盐。
由EDTA标准溶液的用量V1,计算水的总硬度。
测定水中钙含量时,用NaOH调节溶液pH值至12,Mg2+形成Mg(OH)2,加入钙指示剂,用EDTA标准溶液滴定至由红色变为纯蓝色,即达终点。
用去EDTA 标准溶液的体积V2。
从EDTA标准溶液滴定钙镁的总用量V1减去滴定钙时的用量V2,即可计算镁的含量。
水样若含有Fe3+、Al3+等干扰离子,可加入三乙醇胺掩蔽。
Cu2+、Pb2+、Zn2+等干扰离子,可用Na2S或KCN掩蔽。
三、仪器和试剂1.仪器锥形瓶(250mL),酸式和碱式滴定管(50mL),烧杯(250mL、500mL),容量瓶(250mL),移液管(25mL、50mL),表面皿,电炉,洗瓶。
2.试剂NH3—NH4Cl缓冲溶液(pH=10,)NaOH溶液(6mol/L),EDTA二钠盐固体,Mg2+(0.01mol/L)标准溶液或高纯金属锌,铬黑T指示剂,钙指示剂,二甲酚橙指示剂(0.2%),三乙醇胺(1:2),HCL(1:1),六次甲基四铵(20%)四、实验内容1.EDTA标准溶液的配制与标定EDTA标准溶液,一般用标定法配制。
水中钙镁离子含量及总硬度的测定目的1、了解水的硬度的测定意义和水硬度常用表示方法。
2、掌握EDTA法测定水中Ca2+、Mg2+含量的原理和方法。
原理工业中将含有较多钙、镁盐类的水称为硬水,水的硬度是将水中Ca2+、Mg2+的总量折合成CaO或CaCO3来计算。
每升水中含1mgCaO定为1度,每升水含10mgCaO称为一个德国度(°)。
水的硬度用德国度(°)作为标准来划分时,一般把小于4°的水称为很软水,4°~8°的水称为软水,8°~16°的水称为中硬水,16°~32°的水称为硬水,大于32°的水称为很硬水。
用EDTA进行水的总硬度及Ca2+、Mg2+含量的测定时可先测定Ca2+、Mg2+的总量,再测定Ca2+量,由总量与Ca2+量的差求得Mg2+的含量,并由Ca2+、Mg2+总量求总硬度。
Ca2+、Mg2+总量的测定:用NH3-NH4Cl缓冲溶液调节溶液的PH=10,在此条件下,Ca2+、Mg2+均可被EDTA准确滴定。
加入铬黑T指示剂,用EDTA标准溶液滴定。
在滴定的过程中,将有四种配合物生成即CaY、MgY、MgIn、CaIn,它们的稳定性次序为:CaY﹥MgY﹥MgIn﹥CaIn(略去电荷)由此可见,当加入铬黑T后,它首先与Mg2+结合,生成红色的配合物MgIn,当滴入EDTA时,首先与之结合的是Ca2+,其次是游离态的Mg2+,最后,EDTA 夺取与铬黑T结合的Mg2+,使指示剂游离出来,溶液的颜色由红色变为蓝色,到达指示终点。
设消耗EDTA的体积为V1。
Ca2+含量的测定:用氢氧化钠溶液调节待测水样的PH=12,将Mg2+转化为Mg(OH)2沉淀,使其不干扰Ca2+的测定。
滴加少量的钙指示剂,溶液中的部分Ca2+立即与之反应生成红色配合物,使溶液呈红色。
当滴定开始后,随着EDTA的不断加入,溶液中的Ca2+逐渐被滴定,接近计量点时,游离的Ca2+被滴定完后,EDTA 则夺取与指示剂结合的Ca2+使指示剂游离出来,溶液的颜色由红色变为蓝色,到达指示终点。
【知识点】配位滴定法测定水中钙镁离子含量 [1]水硬度测定方法原理水的硬度是水质的重要指标之一,对工业及生活影响很大,因此测定水的硬度有很重要的实际意义。
自来水常形成锅垢,这是由于水中钙、镁的碳酸盐、酸式碳酸盐、硫酸盐、氯化物等所致。
水中钙、镁盐等的含量用“硬度”表示,其中Ca 2+、Mg 2+含量是计算硬度的主要指标。
钙盐和镁盐含量多的水称为硬水,含量较少的则称为软水。
常用水(自来水、河水、井水等)都是硬水。
水的总硬度包括暂时硬度和永久硬度。
在水中以碳酸盐及酸式碳酸盐形式存在的钙盐、镁盐,加热能被分解、析出沉淀而除去,这类盐所形成的硬度称为暂时硬度,而钙、镁的硫酸盐或氯化物等所形成的硬度称为永久硬度。
总硬度是指水中Ca 2+、Mg 2+的总含量,其单位用每升水中含有CaO 或CaCO 3的质量(mg )来表示,可写成CaOmg/L 或CaCO 3mg/。
水中钙硬度是指Ca 2+的含量,镁硬度则是指Mg 2+含量。
(1)总硬度的测定 用EDTA 配位滴定法测定水的硬度是一个准确而快速的方法,它是在pH=10的氨性缓冲溶液中,以铬黑T 为指示剂,用EDTA 标准溶液直接测定水中的Ca 2+和Mg 2+。
pH=10时,Ca 2+、Mg 2+与EDTA 生成无色配合物,铬黑T 则与Ca 2+、Mg 2+生成红色配合物。
由于MgIn CaInK K '<'lg lg ,当溶液中加入铬黑T 先与Mg 2+配位生成MgIn -,溶液呈红色,反应如下: Mg 2+ +HIn 2- = MgIn - + H + 用EDTA 滴定时,由于MgYCaY K K '>lg lg ,EDTA 首先和溶液中Ca 2+配位,然后再与Mg 2+配位,反应如下: Ca 2+ + H 2Y 2- = CaY 2- + 2H + Mg 2+ + H 2Y 2- = MgY 2- + 2H +到达化学计量点时,由于MgIn MgYK K '<'lg lg ,稍过量的EDTA 夺取MgIn -中的Mg 2+,使指示剂释放出来,显示指示剂的纯蓝色,从而指示终点,反应如下: MgIn - + H 2Y 2- = MgY 2- + HIn 2- +2H + 红色 蓝色根据所消耗的EDTA 标准滴定溶液的体积,计算水的总硬度。
水硬度和钙镁离子含量的测定【水硬度和钙镁离子含量的测定】一、引言水是我们生活中不可或缺的重要物质,不仅滋润着我们的身体,也发挥着关键的作用。
然而,水的质量却因地域和源头的不同而有所差异,其中水硬度是其中一个重要的指标。
水硬度主要是指水中的钙和镁离子含量,对于水的质量和使用有着深远的影响。
本文将深入研究水硬度的测定方法与意义,以及钙镁离子在水质中的影响。
二、水硬度的测定方法1. 理论基础水硬度的测定是通过测量水中钙镁离子的含量来实现。
钙和镁离子是地壳中最常见的阳离子,通常由浸润于水源中的矿物质溶解而来。
以钙离子为例,其在水中以Ca2+的形式存在,通过化学反应可以与试剂反应生成可见的沉淀,进而通过测量沉淀的质量或浓度来间接测定水中的钙镁离子含量。
2. 实验方法(1)滴定法滴定法是一种常用的测定水硬度的方法。
它基于钙镁离子与EDTA(乙二胺四乙酸)的络合反应,通过溶液中钙镁离子与EDTA形成的螯合络合物的可见性质来测定水中的硬度。
这种方法精确度较高,但需要较复杂的实验步骤和仪器设备。
(2)色度法色度法是一种简单且常用的测定水硬度的方法。
该方法通过石碱紫等指示剂与钙镁离子生成有色化合物,根据颜色的深浅来判断水中钙镁离子的含量。
色度法操作简便,但相对来说对于测定结果的精确度稍逊于滴定法。
三、水硬度与钙镁离子的影响1. 对水质的影响(1)影响饮用水质量:高水硬度可能使水呈现难以接受的味道,且会导致水垢的产生,降低水质的口感和可饮用性。
(2)影响洗涤效果:高水硬度会导致肥皂等洗涤剂难以起泡,降低洗涤效果,增加洗衣机和洗涤用具的磨损。
2. 对健康的影响(1)心血管疾病:长期饮用高硬度水可能与心血管疾病的患病风险增加相关,尤其是心肌梗死和高血压。
(2)骨质疏松:适量的钙镁离子对于骨骼的发育和健康至关重要,但高水硬度的水质可能导致钙镁沉积在组织中,增加骨质疏松的风险。
四、个人观点与总结个人观点来说,水硬度和钙镁离子含量的测定是水质评估的重要指标之一。
实验十四水硬度的测定一实验目的1、了解硬度的常用表示方法;2、学会用配位滴定法测定水中钙镁含量,钙含量的原理和方法3、掌握铬黑 T,钙指示剂的使用条件和终点变化。
二、实验原理1、总硬度、钙硬度、镁硬度的概念及表示方法;水的硬度主要是指水中含可溶性的钙盐和镁盐。
总硬度通常以每 L 水中含的碳酸钙的 mg数,即 mg/L.钙硬度即每 1L 水中含的钙离子的mg数, mg/L.镁硬度即每 1L 水中含的镁离子的mg数, mg/L2总硬度的测定条件与原理测定条件:以 NH3-NH4Cl 缓冲溶液控制溶液 pH= 10,以铬黑 T 为指示剂,用 EDTA 滴定水样。
原理:滴定前水样中的钙离子和镁离子与加入的铬黑 T 指示剂络合,溶液呈现酒红色,随着 EDTA的滴入,配合物中的金属离子逐渐被 EDTA夺出,释放出指示剂,使溶液颜色逐渐变蓝,至纯蓝色为终点,由滴定所用的 EDTA的体积即可换算出水样的总硬度。
3钙硬度的测定条件与原理;测定条件:用 NaOH溶液调节待测水样的 pH为 13,并加入钙指示剂,然后用EDTA 滴定。
原理:调节溶液呈强碱性以掩蔽镁离子,使镁离子生成氢氧化物沉淀,然后加入指示剂用 EDTA滴定其中的钙离子,至酒红色变为纯蓝色即为终点,由滴定所用的EDTA的体积即可算出水样中钙离子的含量,从而求出钙硬度。
4、相关的计算公式总硬度= (CV1) EDTA M CaCO3/0.1 钙硬度= (CV2) EDTA M Ca/0.1 镁硬度= C(V1-V2)M Mg/0.1三实验步骤实验步骤思考题总硬度的测定1、水硬度的测定包括哪些内容?如何用 100mL吸管移取三份水测定?样,分别加 5mL NH3-NH4Cl 缓冲溶液, 2~3 滴铬黑 T 指示剂,用我国如何表示水的总硬度,怎样换2、EDTA标准溶液滴定,溶液由酒红算成德国硬度?色变为纯蓝色即为终点。
3、用 Zn2+标准溶液标定 EDTA标准溶液有二种方法,水硬度的测定实验中所用 EDTA应用哪种方法标定?4、怎样移取 100mL水样?5、为什么测定钙、镁总量时,要控制pH=10?叙述它的测定条件。