酶作用机制和酶调节
- 格式:ppt
- 大小:4.67 MB
- 文档页数:15


第十章酶的作用机制和酶的调节目的和要求:理解、掌握酶活性部位的相关概念和特点;掌握酶催化高效性的相关机理;了解几种酶的催化机制,理解结构和功能的适应性;了解酶活性的调节方式,掌握酶活性的别构调节、可逆共价调节和酶原激活调节方式及生物代谢中的作用。
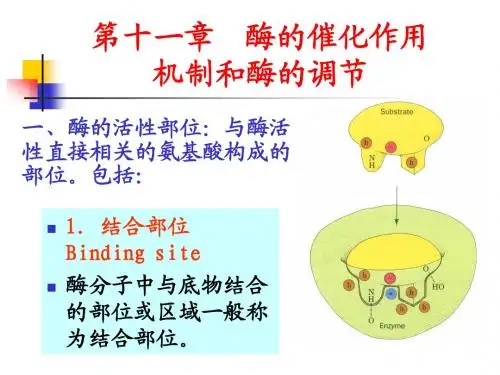
一、酶的活性部位㈠酶的活性部位的特点1、概念:三维结构上比较接近的少数特异的氨基酸残基参与底物的结合与催化作用,这一与酶活力直接相关的区域称酶的活性部位。
结合部位:专一性催化部位:催化能力,对需要辅酶的酶分子,辅酶或其一部分就是活性中心的组成部分;组成酶活性部位的氨基酸数目对不同酶而言存在差异,占整个酶氨基酸残基小部分酶活性部位的基团:亲核性基团,丝氨酸的羟基,半胱氨酸的巯基和组氨酸的咪唑基。
酸碱性基团:天冬氨酸和谷氨酸的羧基,赖氨酸的氨基,酪氨酸的酚羟基,组氨酸的咪唑基和半胱氨酸的巯基等。
2、特点⑴活性部位在酶分子的总体中只占相当小的部分(1%~2%)⑵酶的活性部位是一个三维实体⑶酶的活性部位并不是和底物的形状互补的⑷酶的活性部位是位于酶分子表面的一个裂隙内⑸底物通过次级键结合到酶上⑹酶活性部位具有柔性㈡研究酶活性部位的方法1、酶分子基团的侧链化学修饰⑴非特异性共价修饰:活力丧失程度与修饰剂浓度有正比关系;底物或可逆的抑制剂可保护共价修饰剂的修饰作用。
⑵特异性共价修饰:分离标记肽段,可判断活性部位的氨基酸残基,如二异丙基氟磷酸(DFP)专一性与胰凝乳蛋白酶活性部位丝氨酸残基的羟基结合。
⑶亲和标记:利用底物类似物和酶活性部位的特殊亲和力将酶加以修饰标记来研究酶活性部位的方法。
修饰剂的特点:①结构与底物类似,能专一性引入到酶活性部位;②具活泼化学基团,能与活性部位某一氨基酸共价结合,相应的试剂称“活性部位指示剂”。
胰凝乳蛋白酶和胰蛋白酶,TPE是酶的底物,TPCK是酶的亲和试剂,当酶与TPCK温浴后,酶活性丧失,这种结合具有空间结构的需求,同时也阻止其他试剂如DFP结合。



酶的作用和调控酶是一种生物催化剂,可以加速化学反应的速率,而且在反应过程中自身不发生改变。
酶在生物体内起着极其重要的作用,参与了几乎所有的生物反应,包括新陈代谢的调节、信号传导、DNA复制等等。
本文将重点讨论酶的作用和调控机制。
一、酶的作用酶具有高度特异性,只能催化特定的底物。
它们通过在底物分子上形成暂时的键合,降低活化能,从而使反应速率增加。
酶的作用主要可以从以下几个方面来理解。
1. 催化底物转化酶可以催化底物转化为产物,如淀粉酶能将淀粉分解为葡萄糖单元,蛋白酶能加速蛋白质的降解,而核酸酶能剪切DNA链。
这些反应都是通过酶与底物的特定结合来实现的。
2. 降低活化能酶可以通过形成酶-底物复合物来降低反应的活化能。
这是因为酶能够在底物的特定位置形成特定的电荷分布或空间结构,从而使底物分子更容易发生化学反应。
3. 提高反应速率由于降低了反应的活化能,酶可以使反应速率大大增加。
一般来说,酶催化的反应速率比非酶催化的速率快几百到几百万倍。
二、酶的调控为了维持生物体内的稳态,酶的活性需要得到严格调控。
酶的调控可以分为两类:遗传调控和非遗传调控。
1. 遗传调控遗传调控是通过改变酶的基因表达水平来调控酶的活性。
这可以通过以下几种方式实现。
a. 转录调控转录调控是通过调控酶基因的转录来控制酶的产量。
这可以通过激活或抑制酶基因的转录因子来实现。
转录因子是一类能够结合到基因启动子上的蛋白质,它们可以增强或抑制酶基因的转录,从而影响酶的产量。
b. 翻译调控翻译调控是通过调控酶基因的转录产物的翻译过程来调控酶的产量。
这可以通过调控转录产物的稳定性或翻译速率来实现。
例如,一些miRNA可以与转录产物相互作用,从而降解转录产物或阻止其翻译。
c. RNA剪接调控RNA剪接调控是通过调控基因转录产物的剪接方式来调控酶的活性。
不同的剪接方式会生成不同的转录产物,从而影响酶的功能。
2. 非遗传调控非遗传调控是通过调控已存在的酶分子的活性、稳定性或定位来调控酶的活性。



酶的作用与调节酶是生物体内一种特殊的蛋白质,具有催化化学反应的功能。
酶在生物体内起着至关重要的作用,参与了代谢过程中几乎所有的生化反应。
本文将探讨酶的作用机制以及它们是如何被调节的。
一、酶的作用机制酶能够催化化学反应的原因是因为它们具有一种特殊的结构,称为活性中心。
活性中心是酶分子中的一个小结构,与底物分子结合,促进其转化成产物。
酶与底物之间的结合是非常具体和高度选择性的,这是因为活性中心中的氨基酸残基与底物之间能够形成氢键、离子键和范德华力等相互作用。
酶催化反应的过程可以分为两步:底物结合和催化反应。
在底物结合阶段,底物与酶的活性中心发生相互作用,形成酶底物复合物。
在催化反应阶段,酶改变了底物的化学键,使其转化成产物。
酶并不参与反应本身,因此,在反应完成后,酶可以再次被使用。
二、酶的调节方式酶的活性受多种因素的调节,这些调节机制有助于维持生物体内化学反应的平衡,使代谢过程能够适应外部环境的变化。
1. 温度调节酶的活性受温度的影响。
随着温度的升高,酶的活性增加,因此在生物体内,温度的变化会影响酶催化反应的速率。
然而,当温度超过酶的特定温度范围时,酶的结构可能会受到破坏,导致其失去活性。
这种现象被称为酶的热变性。
2. pH值调节酶的活性还受pH值的调节。
不同的酶对pH值的依赖程度不同,有些酶对酸性环境敏感,而另一些酶则对碱性环境敏感。
这是因为不同的pH值能够改变酶的活性中心的电离状态,从而影响酶底物复合物的形成。
3. 底物浓度调节酶的活性还受底物浓度的调节。
当底物浓度较低时,酶与底物之间的碰撞几率较小,限制了酶催化反应的速率。
随着底物浓度的增加,酶与底物之间的碰撞次数增加,酶催化反应的速率也随之增加。
然而,当底物浓度过高时,酶活性可能达到饱和状态,酶催化反应速率停止增加。
4. 抑制剂与激活剂抑制剂和激活剂是调节酶活性的重要因素。
抑制剂能够结合到酶的活性中心,阻止底物与酶的结合,从而降低酶活性。
激活剂则能够增加酶与底物的亲和力,促进酶活性。

酶的催化作用及调控机制酶是生物体内的一类特殊蛋白质,在维持生物体正常代谢中起着重要的催化作用。
它通过与底物结合形成酶-底物复合物,降低活化能并加速反应速率。
酶的催化作用不仅仅局限于生理过程中,还可以应用于工业生产和药物研发等领域。
本文将从酶的催化原理、催化机制以及调控方法等方面进行详细探讨。
一、酶的催化原理酶的催化原理主要可以归结为两个方面:构象适配和过渡态稳定。
首先,酶与底物之间的结合需要通过构象适配来实现。
酶通过调整自身结构,使其与特定的底物相互作用,形成酶-底物复合物。
这种构象适配能够降低活化能,从而促进反应的进行。
其次,酶通过过渡态稳定来提高反应速率。
在催化反应中,底物需要经历一个过渡态才能转变为产物。
酶通过与过渡态形成稳定的酶-过渡态中间体,降低反应过程中的能垒,从而加速反应速率。
这种过渡态稳定通常涉及酶与底物之间多种强弱不同的相互作用,如氢键、离子键和范德华力等。
二、酶的催化机制酶的催化机制主要可以分为三类:酸碱催化、共价催化和金属离子催化。
酸碱催化是指酶通过提供或接受质子来促进反应进行。
酸催化和碱催化通常涉及到游离氨基酸残基的质子化或去质子化过程,从而调节反应的酸碱度。
共价催化是指酶通过与底物形成共价键来催化反应。
这种催化机制通常涉及到酶与底物之间的亲核或电子云吸引力作用。
金属离子催化是指酶中含有金属离子辅助反应进行。
金属离子可以提供额外的配位位点,形成酶-金属离子-底物复合物,从而促进反应进行。
此外,金属离子还可以通过与底物中的某些基团相互作用,改变底物的构象,降低反应的能垒。
三、酶的调控机制酶的活性可以通过多种方式进行调控,包括底物浓度、pH值、温度、离子浓度和酶抑制剂等。
底物浓度对酶的活性有直接影响,较高的底物浓度通常能够提高反应速率。
pH值和温度对酶的催化活性同样有重要的影响。
不同酶对pH值和温度的适应范围不同,超出适应范围将影响酶的催化效率。
离子浓度对酶的活性也具有调控作用。

酶的作用机制和调节酶是一类生物催化剂,它在生物体内起着至关重要的作用。
酶能够加速化学反应的进行,降低活化能,使生物体内的代谢过程更加高效。
本文将探讨酶的作用机制以及调节机制。
一、酶的作用机制酶的催化作用主要通过两个机理实现,即酶与底物的结合和酶催化反应。
1. 酶与底物的结合酶与底物之间的结合是通过酶的活性位点来完成的。
活性位点是酶分子上具有特定结构和氨基酸残基的区域,与底物结构相互吻合。
酶与底物结合的特异性是酶高效催化的基础。
酶与底物的结合可以通过“钥匙-锁”模型来描述。
即酶的活性位点(“锁孔”)与底物的结构(“钥匙”)相互适配,形成酶底物复合物。
这种结合使得底物的活化能降低,从而促进酶催化反应的进行。
2. 酶催化反应酶催化反应是指酶通过调整反应路径、提供催化剂或者转移化学基团而加速化学反应的过程。
酶能够调整底物的构象,使得底物更容易进行特定的化学转化。
此外,酶还可以提供催化剂,如辅因子或金属离子,来促进反应的进行。
同时,酶还可以通过转移化学基团的方式来调节反应,例如酶可以将底物中的氢离子或者电子转移给另一个底物分子。
这些机制使得酶能够高效地催化反应,提高反应速率。
二、酶的调节机制为了适应生物体内不同的环境和代谢需求,酶的活性需要被调节。
酶的调节机制主要分为两种类型:可逆性调节和不可逆性调节。
1. 可逆性调节可逆性调节是指酶的活性可以在不同条件下被逆转或者恢复的调节机制。
可逆性调节主要包括以下几种形式。
(1)反馈抑制:产物在代谢途径中的积累可以抑制酶的活性,从而调节代谢途径的进行。
这种调节机制可以保证代谢途径的稳定性和平衡性。
(2)物质的结合:某些物质(如激活剂或抑制剂)可以结合到酶上,通过改变酶的构象或者酶与底物的结合能力来调节酶的活性。
(3)共价修饰:酶可以通过化学修饰(如磷酸化、乙酰化等)来调节自身的活性。
这种修饰可以通过激酶和磷酸酶等酶的协同作用来实现。
2. 不可逆性调节不可逆性调节是指酶的活性受到不可逆的结构变化或者修饰的调节机制。
酶的作用及其调节方式酶是一类生物催化剂,在生物体内起着至关重要的作用。
它们能够促进化学反应的进行,降低活化能,并加速反应速率。
酶的作用机理及其调节方式是生物学中非常重要的研究内容。
本文将详细探讨酶的作用机理以及其调节方式,以期对读者有所启发和帮助。
一、酶的作用机理酶是由特定的蛋白质分子组成的,因此它们具有特定的立体结构和活性位点。
酶与底物结合后,在活性位点上发生一系列的化学反应,从而转化底物成为产物。
酶的作用机理主要包括以下几个方面:1. 底物结合:酶与底物以一种“锁和钥”的方式结合,即酶的活性位点与底物的结构互补。
这种结合使得底物分子能够稳定存在于活性位点上,形成酶-底物复合物。
2. 底物转变:在酶-底物复合物的稳定结构中,酶能够对底物分子进行特定的化学反应。
这些反应包括裂解、合成、转移等等,有助于底物分子的转变。
3. 产物释放:反应完成后,产物分子在酶的作用下脱离酶-底物复合物,使得酶重新恢复活性,为下一个反应做准备。
产物的释放也是酶作用的最终目标之一。
二、酶的调节方式酶的活性受到许多因素的调控,包括温度、 pH 值、底物浓度、抑制剂等等。
下面将详细介绍几种常见的酶调节方式:1. 温度调节:酶的活性与温度密切相关,在适宜的温度范围内,酶的活性会逐渐增加。
高温可能导致酶的变性,使其失去活性,而低温则会降低酶的催化效率。
2. pH 值调节:酶对于 pH 值的敏感度较高,不同的酶对于适宜的pH 值有不同的要求。
过高或过低的 pH 值都会影响酶的三维结构,从而影响其活性。
通过调节 pH 值,可以调节酶的活性。
3. 底物浓度调节:在一定范围内,底物浓度的增加会增加酶催化反应的速率。
然而,当底物浓度超过一定限制时,酶的催化速率将达到饱和,不再增加。
这是因为酶分子有限,无法在极高的底物浓度下继续承载反应。
4. 抑制剂:抑制剂可以通过多种方式抑制酶的活性。
竞争性抑制剂与酶活性位点竞争结合,阻碍底物的进入。
非竞争性抑制剂则与酶的其他部位结合,改变酶的构象,使其失去活性。