如何分析琼脂糖凝胶电泳图
- 格式:doc
- 大小:23.00 KB
- 文档页数:1

琼脂糖凝胶电泳详细过程与步骤分析琼脂糖凝胶电泳(agarose gel electrophoresis)是一种常见的分离和鉴定DNA和RNA分子的实验技术。
它基于DNA和RNA分子在电场中对琼脂糖凝胶的移动速率的差异来进行分离。
以下是琼脂糖凝胶电泳的详细过程与步骤分析:1.准备琼脂糖凝胶:-准备琼脂糖溶液:按照规定比例在缓冲液中加入适量的琼脂糖并混匀。
-加热琼脂糖溶液:将琼脂糖溶液加热至完全溶解,通常在微波炉或水浴中进行。
-倒入模具:在凝胶电泳槽中设置模具,倒入热琼脂糖溶液并待其凝固。
2.准备样品:-提取DNA或RNA:采用适当的提取方法从待测样品中提取所需的DNA 或RNA。
-混合DNA或RNA与加载缓冲液:将提取的DNA或RNA与适量的加载缓冲液混合,以增加样品密度并提供电泳所需的离子浓度。
3.加载样品:-打开模具和样品孔:在琼脂糖凝胶上方打开模具,使用注射器或微量吸管在样品孔中加入适量的样品。
-加载DNA或RNA标记物:如果需要对DNA或RNA进行标记,则需要在样品中加入适量的荧光标记物,并在加载完样品后用紫外灯进行可视化检测。
4.进行电泳:-连接电极:将电泳槽连接到电源,将阳极和阴极电极分别插入缓冲液中的两端。
-调节电流:将所需电流值设置在电源上,并进行预运行电流以使电流通过样品和凝胶。
-进行电泳:打开电源,开始电泳过程,直到样品达到适当的分离位置。
5.可视化与分析结果:-停止电泳:当DNA或RNA样品达到预期位置时,关闭电源并断开电极。
-可视化:用染料(如乙溴橙)染色凝胶电泳的凝胶,或使用紫外灯照射凝胶以可视化DNA或RNA标记物的荧光。
-分析结果:使用图像捕捉设备(如凝胶图像系统)记录凝胶的图像,并根据DNA或RNA标记物的迁移距离和大小进行结果分析。


琼脂糖凝胶电泳检测实验报告一、实验目的本实验旨在通过琼脂糖凝胶电泳检测方法,对DNA分子进行分离和检测,掌握琼脂糖凝胶电泳技术的操作步骤和原理,并了解其在生物学领域中的应用。
二、实验原理琼脂糖凝胶电泳是一种常用的分离DNA分子的方法。
其原理是利用电场作用力将DNA分子从样品中移动到凝胶中,并根据DNA分子大小不同,在凝胶中形成不同迁移距离的带状图案。
根据带状图案可以得到DNA片段大小及其相对含量。
三、实验步骤1.制备琼脂糖凝胶:将1g琼脂糖加入100ml TAE缓冲液中,加热搅拌至溶解,冷却至60℃左右时倒入模具中,待冷却成固体后取出。
2.制备DNA样品:将待检测DNA样品加入适量TAE缓冲液中,使其浓度为50ng/ul。
3.装载样品:取出制备好的琼脂糖凝胶,将其置于电泳槽中,加入适量TAE缓冲液,然后将DNA样品注入琼脂糖凝胶孔中。
4.进行电泳:将电泳槽盖好,接通电源,设定电压和时间,进行电泳。
5.染色和成像:取出琼脂糖凝胶,进行染色处理,然后用成像仪拍摄带状图案。
四、实验结果通过琼脂糖凝胶电泳检测方法,成功分离出待检测DNA样品中的DNA分子,并形成了带状图案。
根据带状图案可以看出不同大小的DNA片段在凝胶中形成了不同迁移距离的带状图案。
五、实验分析1.影响DNA迁移距离的因素:DNA片段大小、琼脂糖浓度、电场强度等因素都会影响DNA分子在凝胶中的迁移距离。
一般来说,较小的DNA片段在相同条件下迁移距离较大。
2.应用领域:琼脂糖凝胶电泳技术广泛应用于生物学领域中对DNA分子的检测和分析。
例如,可以用于分析DNA序列、检测基因突变等。
六、实验总结通过本次实验,我们掌握了琼脂糖凝胶电泳技术的操作步骤和原理,并了解了其在生物学领域中的应用。
同时,我们也发现琼脂糖凝胶电泳技术具有操作简单、成本低廉、结果可靠等优点,是一种常用的DNA分子检测方法。

实验一:琼脂糖凝胶电泳对DNA提取实验目的:学习使用水平式琼脂糖凝胶电泳进行DNA的提取。
实验原理:琼脂糖凝胶电泳是利用琼脂糖溶化再凝固后能形成带有一定孔隙的固体基质的特性。
DNA分子在琼脂糖凝胶中泳动时有电荷效应和分子筛效应。
根据DNA分子量不同,采用外加电场使其分开,用生物染料嵌入DNA分子后在紫外下显色。
1)在电场的作用下及中性pH的缓冲条件下,带负电的核酸分子向正极迁移。
由于糖一一磷酸骨架在结构上的重复性质,相同数量的双链DNA几乎具有等量的净电荷,因此它们能以同样的速度向正极方向移动。
2)在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应,即DNA分子木身的大小和构型。
具有不同的相对分子质量和不同构型的DNA片段泳动速度不一样,可进行分离。
3)生物染料在紫外光照射下能发射荧光,当D\A样品在琼脂糖凝胶中从负极向正极泳动时,生物染料从正极向负极移动,就会嵌入DNA分子中形成络合物,使DNA在紫外光下发射很强的荧光。
在生物染料足够的情况下,荧光的强度正比于DNA的含量,这样就可以检测DNA的浓度。
实验材料:微量移液器(2 U1和4叮),高压灭菌锅,电泳仪,琼脂糖平板电泳装置,微波炉等。
TAE电泳缓冲液,琼脂糖凝胶,PCR 扩增样品实验步骤:1胶液的制备:称取0.2g琼脂糖,置于200ml锥形瓶中,加入20ml TAE稀释缓冲液,放入微波炉里加热至琼脂糖全部熔化,沸腾。
取出摇匀。
加热时应盖上封口膜,以减少水份蒸发。
2胶板的制备:将有机玻璃胶槽两端分别用透明胶带(宽约1cm)紧密封住。
将封好的胶槽置于水平支持物上,插上样品梳子。
3向冷却至50-60°C的琼脂糖胶液中小心地倒入胶槽内,使胶液形成均匀的胶层。
检查有无气泡。
4室温下约20分钟后,琼脂糖溶液完全凝固,小心垂直拔出梳子和挡板,注意不要损伤梳底部的凝胶,清除碎胶。
将凝胶放入电泳槽中。
5加入电泳缓冲液(TAE)至电泳槽中,使液面高于胶面约lmm。

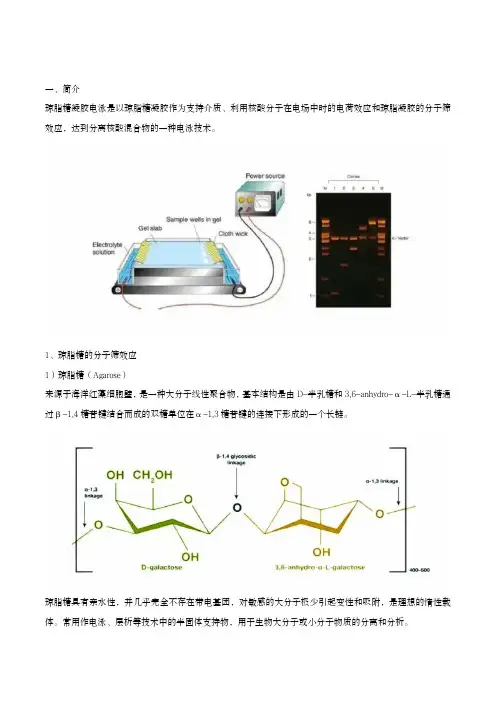
一、简介琼脂糖凝胶电泳是以琼脂糖凝胶作为支持介质、利用核酸分子在电场中时的电荷效应和琼脂凝胶的分子筛效应,达到分离核酸混合物的一种电泳技术。
1、琼脂糖的分子筛效应1)琼脂糖(Agarose)来源于海洋红藻细胞壁,是一种大分子线性聚合物,基本结构是由D-半乳糖和3,6-anhydro-α-L-半乳糖通过β-1,4糖苷键结合而成的双糖单位在α-1,3糖苷键的连接下形成的一个长链。
琼脂糖具有亲水性,并几乎完全不存在带电基团,对敏感的大分子极少引起变性和吸附,是理想的惰性载体。
常用作电泳、层析等技术中的半固体支持物,用于生物大分子或小分子物质的分离和分析。
琼脂糖在水中一般加热到90℃以上溶解,温度下降到40℃左右形成良好的半固体状凝胶。
琼脂糖加热溶解后分子呈随机线团状分布,当温度降低时链间糖分子上的羟基通过氢键作用相连接,形成直径从50nm-200nm不等的孔径结构,孔径的大小由凝胶浓度控制。
琼脂糖凝胶中孔径的大小,影响了通过的核酸分子的大小以及通过的速度。
通常来说,琼脂糖凝胶的浓度越高,孔径越小,能够通过的核酸分子越小,迁移速度也越慢。
DNA片段越小,所需的胶浓度越大;而DNA 片段越长,所需的胶浓度则越小。
选择合适的胶浓度才能更好的分离片段。
2)琼脂的质量评价琼脂糖通常通过其凝胶强度和电内渗情况判断质量好坏。
强度越高,凝胶性能越好。
质量较好的琼脂糖强度通常在1200g/cm2以上,硫酸根含量在0.2%以下,电内渗在0.13以下。
琼脂糖是从琼脂中分离而来的。
琼脂由琼脂糖和琼脂果胶组成的,琼脂果胶是由许多更小的分子组成的异质混合物,和琼脂糖结构相似,但带硫酸根和羧基组分,凝胶能力差。
在琼脂糖制备过程中需要把琼脂果胶尽量去除,否则琼脂糖有可能存在极微量硫酸根和丙酮酸取代电离基团,附着到琼脂糖的多糖基质上,造成电内渗(EEO)。
电内渗会导致缓冲液中产生正电荷反向离子,它们向负极移动,从而造成与DNA反方向迁移的液流,使DNA的分离效果变差。


琼脂糖凝胶电泳实验报告一、实验目的琼脂糖凝胶电泳是分子生物学实验中常用的技术之一,其目的主要包括以下几个方面:1、分离和鉴定 DNA 片段:通过电泳可以将不同大小的 DNA 片段在琼脂糖凝胶中按照分子量大小进行分离,从而能够直观地观察到DNA 样品的组成和纯度。
2、检测 DNA 的质量:通过观察电泳图谱中 DNA 条带的亮度、清晰度和完整性,可以评估 DNA 样品的质量,判断是否存在降解、杂质污染等情况。
3、定量分析 DNA 浓度:结合已知浓度的 DNA 标准品,通过比较样品条带与标准品条带的亮度,可以对 DNA 样品的浓度进行大致的估算。
二、实验原理琼脂糖是一种从海藻中提取的线性多糖聚合物。
当琼脂糖溶液加热到沸点后冷却凝固,会形成网状的凝胶结构。
由于琼脂糖凝胶具有分子筛效应,DNA 分子在电场中会向正极移动,其迁移速度取决于 DNA 分子的大小和构象。
较小的 DNA 分子在凝胶中受到的阻力较小,迁移速度较快;较大的 DNA 分子受到的阻力较大,迁移速度较慢。
因此,不同大小的 DNA 分子在琼脂糖凝胶中会被分离成不同的条带。
在电泳过程中,通常使用溴化乙锭(EB)等荧光染料对 DNA 进行染色。
EB 能嵌入DNA 分子的碱基对之间,在紫外线照射下发出荧光,从而使 DNA 条带得以显现。
三、实验材料与设备1、实验材料DNA 样品:本次实验使用的是经过提取和纯化的λDNA 样品。
琼脂糖:选用高纯度的琼脂糖粉末。
电泳缓冲液:5×TBE 缓冲液(Tris硼酸EDTA),使用时稀释至1×TBE 工作液。
上样缓冲液(Loading Buffer):含有甘油、溴酚蓝等成分,用于增加样品密度,便于样品沉入加样孔,并指示电泳进程。
核酸染料:溴化乙锭(EB)溶液。
2、实验设备电泳仪:提供稳定的直流电源,用于产生电场。
水平电泳槽:放置琼脂糖凝胶,容纳电泳缓冲液。
凝胶成像系统:用于观察和拍摄电泳结果。


PCR产物的琼脂糖凝胶电泳分析【实验目的】1.学习琼脂糖凝胶电泳检测DNA的方法和技术;2.掌握群体遗传学基因频率与基因型频率的计算方法。
【实验原理】1. 凝胶电泳是分离、鉴定、纯化及制备DNA片段最常用的方法,可分为两类,一类是琼脂糖凝胶电泳,适用于l kb和大于l kb以上DNA;另一类是聚丙烯酰胺凝胶电泳,适用于小于l kb的DNA。
琼脂糖凝胶电泳是一种简便易行的分离、纯化和鉴定DNA片段的方法。
分为水平板和垂直板两种,一般采用水平电泳。
2. 琼脂糖凝胶在DNA分子泳动时兼有“分子筛”和“电荷”的双重作用。
3. DNA分子在碱性环境中带负电荷,在外加电场作用下向正极泳动。
4. 由于琼脂糖凝胶具有网络结构,因此电泳时,带电颗粒的分离速度不仅取决于净电荷的性质和数量,而且还取决于分子大小。
5. 由于实验中相同数量的双链DNA几乎具有等量的净电荷,因此他们能以同样的速度向正极移动。
6. 相对分子质量小者泳动快,大的泳动慢。
7. 溴化乙锭是分子生物学实验中常用的DNA荧光染料,含有一个可以嵌入DNA堆积碱基之间的一个三环平面基团,它与DNA的结合几乎没有碱基序列特异性。
DNA吸收254nm处的紫外辐射并传递给染料,被吸收的能量在可见光谱红橙区的590nm处重新发射出来。
溴化乙锭-DNA复合物的荧光产率比没有结合DNA的染料高出20-30倍。
所以当凝胶中含有游离的溴化乙锭(0.5μg/mL)时,可以检测到少至10ng的DNA条带8. TBE(成分:Tris,EDTA,硼酸,蒸馏水)的作用:a.稳定体系酸碱度(正负极氧化还原反应,使正极变酸、负极变碱性)b. 使溶液具有导电性,以利于DNA分子的迁移c. 其中的EDTA螯合镁离子,防止电泳时激活DNA酶9.引物二聚体: 引物二聚体是引物的3’端间相互错配扩增形成的。
引物二聚体的出现是必然的,只是或多或少的问题,电泳时看不到引物二聚体带也不代表没有二聚体出现,只是含量低我们的肉眼看不到而已。

琼脂糖凝胶电泳检测PCR产物实验报告引言PCR(聚合酶链式反应)是一种常用的分子生物学技术,可用于扩增目标DNA序列。
在PCR步骤完成后,需要通过琼脂糖凝胶电泳检测PCR产物的大小和纯度。
本实验旨在使用琼脂糖凝胶电泳技术检测PCR产物。
材料与方法材料•PCR反应体系:包括模板DNA,引物,dNTPs,聚合酶等•1×TAE缓冲液:含有0.04 M醋酸,0.001 M EDTA,pH 8.0•琼脂糖:用于制备琼脂糖凝胶•DNA分子量标记物:用于确定PCR产物的大小•Agarose:用于制备琼脂糖凝胶•紫外透射仪:用于检测琼脂糖凝胶电泳结果方法1.准备琼脂糖凝胶:–在适当容器中加入适量的1×TAE缓冲液。
–加入适量的琼脂糖粉末,充分搅拌溶解。
–将溶液加热至高温,直到琼脂糖完全溶解。
–待溶液温度降至50°C左右时,将其倒入凝胶模具中。
–待凝胶完全凝固后,将模具固定在琼脂糖凝胶槽中。
2.准备PCR产物样品:–将PCR反应管中的产物转移到无菌离心管中。
–根据需要,将样品进行浓缩或稀释,以保证电泳结果的准确性。
3.加载样品和DNA分子量标记物:–在琼脂糖凝胶上刻槽,使其能够容纳样品和DNA分子量标记物。
–将PCR产物样品与适量的DNA分子量标记物混合,加入刻槽中。
–加入适量的1×TAE缓冲液,以保证样品完全浸泡在缓冲液中。
4.进行电泳:–将琼脂糖凝胶槽连接至电源,并设置合适的电压和时间。
–经过适当时间后,关闭电源,取出琼脂糖凝胶。
5.检测结果:–将琼脂糖凝胶置于紫外透射仪下,观察DNA条带的迁移情况。
–根据DNA分子量标记物的迁移情况,估计PCR产物的大小。
结果与讨论经过琼脂糖凝胶电泳检测,我们成功地获得了PCR产物的电泳图。
根据DNA分子量标记物的迁移情况,我们可以初步估计PCR产物的大小。
在实验过程中,我们发现PCR反应的特定引物和模板DNA的选择对于产物大小的确定非常重要。
一、实验目的琼脂糖凝胶电泳是常用的检测核酸的方法,学习DNA琼脂糖凝胶电泳的使用技术,掌握有关的技术和识读电泳图谱的方法。
二、实验原理琼脂糖凝胶电泳是常用的用于分离、鉴定DNA、RNA分子混合物的方法,这种电泳方法以琼脂凝胶作为支持物,利用DNA分子在泳动时的电荷效应和分子筛效应,达到分离混合物的目的。
DNA分子在高于其等电点的溶液中带负电,在电场中向阳极移动。
在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应,即分子本身的大小和构型是主要的影响因素。
DNA分子的迁移速度与其相对分子量成反比。
不同构型的DNA分子的迁移速度不同。
如环形DNA分子样品,其中有三种构型的分子:共价闭合环状的超螺旋分子(cccDNA)、开环分子(ocDNA)、和线形DNA分子(IDNA)。
这三种不同构型分子进行电泳时的迁移速度大小顺序为: cccDNA>IDNA>ocDNA核酸分子是两性解离分子,pH3.5是碱基上的氨基解离,而三个磷酸基团中只有一个磷酸解离,所以分子带正电,在电场中向负极泳动;而 pH8.0-8.3时,碱基几乎不解离,而磷酸基团解离,所以核酸分子带负电,在电场中向正极泳动。
不同的核酸分子的电荷密度大致相同,因此对泳动速度影响不大。
在中性或碱性时,单链DNA与等长的双链DNA的泳动率大致相同。
影响核酸分子泳动率的因素主要是:1、样品的物理性状即分子的大小、电荷数、颗粒形状和空间构型。
一般而言,电荷密度愈大,泳动率越大。
但是不同核酸分子的电荷密度大致相同,所以对泳动率的影响不明显。
对线形分子来说,分子量的常用对数与泳动率成反比,用此标准样品电泳并测定其泳动率,然后进行DNA分子长度(bp)的负对数——泳动距离作标准曲线图,可以用于测定未知分子的长度大小。
DNA分子的空间构型对泳动率的影响很大,比如质粒分子,泳动率的大小顺序为:cDNA>ID NA>ocDNA但是由于琼脂糖浓度、电场强度、离子强度和溴化乙锭等的影响,会出现相反的情况。
琼脂糖凝胶电泳进行PCR结果分析琼脂糖凝胶电泳是一种常用的PCR结果分析方法,它可以用来检测PCR扩增产物的大小和纯度。
在分子生物学研究中,琼脂糖凝胶电泳是非常重要的一步,因为它可以帮助研究人员确定PCR反应的成功与否,并分析PCR产物的质量。
首先,琼脂糖凝胶电泳电泳是一种以琼脂糖为基质的凝胶,通过电场作用将DNA分子在凝胶中进行分离的方法。
琼脂糖凝胶由琼脂糖和缓冲剂混合而成,再通过加热、冷却形成凝胶。
凝胶中的琼脂糖会形成一种网状结构,用来限制DNA分子的流动,使得不同大小的DNA分子能够分离开来。
在进行PCR结果分析时,首先需要将PCR反应产物与DNA标记物混合在一起。
DNA标记物通常是一种特定长度的DNA分子,可以用来作为参照物来确定PCR扩增产物的大小。
常用的DNA标记物有DNA ladder,它是一种包含了多个不同长度DNA片段的混合物。
在琼脂糖凝胶电泳中,DNA标记物会在电场作用下在琼脂糖凝胶中移动,并形成一个长度标记的图案。
将PCR反应产物和DNA标记物加载到琼脂糖凝胶槽中后,接通电源进行电泳。
电泳时间和电压需要根据实验需要进行调节,一般来说,电泳运行时间为30分钟至2小时,电压为50-150V。
在电泳结束后,需要对凝胶进行染色,以可视化DNA分子的位置。
常见的染色剂有乙溴化锂(EB)和SYBR Green。
这些染色剂可以与DNA分子结合并发出荧光,使得DNA分子能够被观察到。
染色后,凝胶通常在紫外光下进行观察和记录。
根据琼脂糖凝胶电泳的结果,可以进行PCR产物的大小和纯度分析。
通过与DNA标记物的比较,可以确定PCR扩增产物的大小范围。
如果PCR扩增产物的大小与预期一致,则说明PCR反应成功。
另外,通过观察PCR 产物带的强度,可以初步判断PCR产物的丰度和纯度。
高强度的PCR产物带通常表示PCR扩增产物的丰度高,纯度好,反之则表示存在杂交DNA或PCR扩增产物不纯的情况。
总之,琼脂糖凝胶电泳是一种常用的PCR结果分析方法,在分子生物学研究中具有重要的应用价值。
凝胶电泳结果分析常见问题原因对策DNA条带模糊DNA降解实验过程中应避免核酸酶污染。
电泳缓冲液陈旧电泳缓冲液多次使用后,离子强度降低,PH值上升,缓冲能力减弱,从而影响电泳效果。
TBE建议使用10就更换。
所用电泳条件不合适电泳时电压不应超过20V/cm,温度<30℃,巨大DNA链电泳,温度<15℃,检查所用电泳缓冲液的缓冲能力,注意经常更换。
DNA上样量过多减少凝胶中DNA上样量DNA含盐过高电泳前通过乙醇沉淀去除多余盐分。
有蛋白污染电泳前酚抽提去除蛋白。
DNA变性电泳前勿加热,用20mM NaCl缓冲液稀释DNA。
出现片状拖带或涂抹带PCR扩增时出现涂抹带、片状带或地毯样带,往往由于酶量多或者酶的质量差,dNTP浓度高,Mg2+浓度高,退火温度过低,循环次数多。
减少酶量或更换酶,减少dNTP浓度,适当降低Mg2+浓度,增加模板量,减少循环次数。
不规则DNA 带迁移电泳条件不合适电泳时电压不应超过20V/cm,温度<30℃,巨大DNA链电泳,温度<15℃,检查所用电泳缓冲液的缓冲能力,注意经常更换。
DNA变性电泳前勿加热,用20mM NaCl缓冲液稀释DNA。
带弱或无DNA 带DNA上样量不够增加DNA上样量,聚丙烯酰胺凝胶电泳比琼脂糖电泳灵敏度高,上样量可适当降低。
DNA降解实验过程中应避免核酸酶污染。
DNA跑出凝胶缩短电泳时间,降低电压,增加凝胶浓度。
EB染色的DNA所用光源不合适应用短波长(254nm)的紫外光源。
DNA带缺尖DNA跑出凝胶缩短电泳时间,降低电压,增加凝胶浓度。
分子大小相近的DNA带不易分辨增加电泳时间,核准正确凝胶浓度DNA变性电泳前勿加热,用20mM NaCl缓冲液稀释DNA。
DNA链大,常规电泳不合适。
在脉冲凝胶电泳上个分析。
电泳时ladder 扭曲配胶的缓冲液与电泳的缓冲液不是同时配制。
同时配制,电泳缓冲液高出胶的1-2mm即可。
电泳时电压过高电泳时电压不应超过20V/cm。
凝胶电泳结果分析
常见问题原因对策
DNA条带模糊DNA降解实验过程中应避免核酸酶污染。
电泳缓冲液陈旧电泳缓冲液多次使用后,离子强度降低,
PH值上升,缓冲能力减弱,从而影响电
泳效果。
TBE建议使用10就更换。
所用电泳条件不合适电泳时电压不应超过20V/cm,温度
<30℃,巨大DNA链电泳,温度
<15℃,检查所用电泳缓冲液的缓冲能力,
注意经常更换。
DNA上样量过多减少凝胶中DNA上样量
DNA含盐过高电泳前通过乙醇沉淀去除多余盐分。
有蛋白污染电泳前酚抽提去除蛋白。
DNA变性电泳前勿加热,用20mM NaCl缓冲液稀
释DNA。
出现片状拖带或涂抹带PCR扩增时出现涂抹带、片状
带或地毯样带,往往由于酶量多
或者酶的质量差,dNTP浓度高,
Mg2+浓度高,退火温度过低,
循环次数多。
减少酶量或更换酶,减少dNTP浓度,适
当降低Mg2+浓度,增加模板量,减少循
环次数。
不规则DNA 带迁移电泳条件不合适电泳时电压不应超过20V/cm,温度
<30℃,巨大DNA链电泳,温度
<15℃,检查所用电泳缓冲液的缓冲能力,
注意经常更换。
DNA变性电泳前勿加热,用20mM NaCl缓冲液稀
释DNA。
带弱或无DNA 带DNA上样量不够增加DNA上样量,聚丙烯酰胺凝胶电泳
比琼脂糖电泳灵敏度高,上样量可适当降
低。
DNA降解实验过程中应避免核酸酶污染。
DNA跑出凝胶缩短电泳时间,降低电压,增加凝胶浓度。
EB染色的DNA所用光源不合
适
应用短波长(254nm)的紫外光源。
DNA带缺尖DNA跑出凝胶缩短电泳时间,降低电压,增加凝胶浓度。
分子大小相近的DNA带不易分
辨
增加电泳时间,核准正确凝胶浓度
DNA变性电泳前勿加热,用20mM NaCl缓冲液稀
释DNA。
DNA链大,常规电泳不合适。
在脉冲凝胶电泳上个分析。
电泳时ladder 扭曲配胶的缓冲液与电泳的缓冲液
不是同时配制。
同时配制,电泳缓冲液高出胶的1-2mm
即可。
电泳时电压过高电泳时电压不应超过20V/cm。