EDTA的标定(二甲酚橙)及锡铜中锌的测定-讲解
- 格式:doc
- 大小:106.01 KB
- 文档页数:10

EDTA标定锌标准溶液一、实验目的。
本实验旨在通过EDTA对锌的标定,掌握EDTA对金属离子的螯合滴定方法,了解锌的含量测定方法。
二、实验原理。
EDTA(乙二胺四乙酸)是一种螯合剂,它的四个羧基和两个氨基可以与金属离子形成稳定的络合物。
在适当的pH条件下,EDTA与金属离子形成的络合物是1:1的配位化合物。
因此,可以通过EDTA对金属离子的螯合滴定,来确定金属离子的含量。
锌是一种重要的金属元素,广泛应用于工业生产中。
锌的含量测定对于质量控制和工艺改进具有重要意义。
本实验中,我们将利用EDTA对锌进行标定,从而测定锌的含量。
三、实验步骤。
1.配制EDTA标准溶液,取一定质量的分析纯EDTA,溶解于蒸馏水中,稀释至1000ml,得到1mol/L的EDTA标准溶液。
2.取一定质量的氯化锌溶液,加入NH3·H2O和EDTA标准溶液,使得pH=9-10,形成络合物。
3.用甲基红指示剂作为指示剂,进行螯合滴定,直至溶液由红色变为蓝色。
4.记录滴定消耗的EDTA标准溶液的体积V1(ml)。
5.重复上述步骤,直至滴定结果的相对偏差小于0.5%。
四、实验数据处理。
根据滴定结果,可以计算出锌的含量。
设氯化锌溶液的体积为V2(ml),浓度为C(mol/L),则锌的含量可以通过下式计算:n(Zn) = n(EDTA) = C(EDTA) × V1。
其中,n(Zn)为锌的摩尔数,n(EDTA)为EDTA的摩尔数,C(EDTA)为EDTA 标准溶液的浓度。
五、实验注意事项。
1.实验操作中要注意配制溶液的准确性和精确性,避免误差的产生。
2.在滴定过程中,要控制滴液的速度,以免过量滴定或者过度滴定。
3.实验结束后,要及时清洗实验器皿,保持实验环境整洁。
六、实验结果分析。
通过实验数据处理,我们可以得到锌的含量。
实验结果的准确性和可靠性对于工业生产具有重要意义。
因此,在实验操作中,要严格控制实验条件,准确记录实验数据,确保实验结果的准确性。

EDTA络合滴定法测定黄铜中高含量锌李冬梅;程晓寅;张学彬【摘要】建立了EDTA络合滴定法测定黄铜中高含量锌的分析方法.试样以盐酸、过氧化氢溶解,用硫酸钾和氯化钡沉淀分离Pb,用氟化钾掩蔽Sn4+、Fe3+、Al3+,用硫脲掩蔽Cu2+,在pH=5.5的六次甲基四胺缓冲溶液中,以二甲基酚橙作指示剂,用EDTA络合滴定溶液由红色变为亮黄色为终点,测得的结果即为锌含量.采用该方法对样品进行精密度实验,锌测定结果的相对标准偏差(RSD,n=10)为0.17%~0.20%.该方法应用于4个黄铜标准物质中高含量锌的测定,测定值与认定值相一致.【期刊名称】《山东冶金》【年(卷),期】2019(041)004【总页数】3页(P41-43)【关键词】EDTA络合滴定;黄铜;高含量锌【作者】李冬梅;程晓寅;张学彬【作者单位】宁波市食品检验检测研究院,浙江宁波315048;宁波市产品质量检验研究院,浙江宁波315048;宁波市产品质量检验研究院,浙江宁波315048【正文语种】中文【中图分类】O655.21 前言黄铜是制造机械零件的良好材料,常用于制造阀门、散热器和空调内外机连接管等。
黄铜主要成分为铜、锌,锌含量高达5%~35%,同时含有少量的铅、锡、铁、铝和其它杂质等元素。
GB/T 5231—2012对高含量锌的要求以“余量”显示,而对杂质含量有具体要求。
在日常检验分析中,黄铜中各杂质元素含量通过GB/T 5121.1~26—2008分别测定,操作步骤复杂烦琐,试剂消耗多,测试速度慢,检测流程长,不能满足大批量检测及快速检测的要求;而且有时杂质成分无法确认测定,杂质含量只能采用100%减去铜、锌及已规定元素含量的方法求得。
然而目前黄铜合金中高含量锌的测定方法有:GB/T 5121.11—2008[1]标准规定的4-甲基-戊酮-2萃取分离-Na2EDTA[A1]滴定法,其锌的测定范围为0.000 05%~6.00%;GB/T 5 121.27—2008[2]标准规定锌的测定范围为0.000 05%~7.00%,均不能满足黄铜中高含量锌(5%~35%)的测定。

《EDTA配位滴定法测定锌的含量》1. 引言在化学分析中,测定金属离子的含量是一项非常重要的工作。
针对锌离子含量的测定,常常会采用EDTA配位滴定法进行分析。
本文将深入探讨EDTA配位滴定法测定锌含量的原理、方法和应用。
2. 原理EDTA(乙二胺四乙酸)是一种强螯合剂,它的分子中含有四个羧基,可以和金属离子形成稳定的络合物。
在EDTA滴定锌含量的过程中,首先将待测溶液中的锌离子与EDTA配位生成络合物,随着EDTA溶液逐渐滴入,当锌离子被完全络合后,自由态的锌离子消失,反应终点达到。
通过反应前后络合物的不同颜色和吸光度的变化,即可确定锌离子的浓度。
3. 方法进行EDTA配位滴定法测定锌含量,首先需要准备待测的锌溶液,并按照一定的稀释比例进行稀释。
接下来,将适量的pH缓冲液加入至溶液中,使pH值稳定在特定范围内。
加入几滴Eriochrome Black T指示剂,此指示剂在pH=6-8时呈红色,但在EDTA与锌形成络合物后,则变为蓝色。
使用标准的EDTA滴定试剂进行滴定,记录滴定过程中EDTA溶液的体积。
当溶液由红色转为蓝色时,达到了反应终点,此时所滴加的EDTA容量即为所需的锌离子溶液中的含量。
4. 应用EDTA配位滴定法测定锌含量的方法广泛用于工业生产和科研实验室中。
锌是一种重要的金属元素,广泛用于电镀、合金制造和建筑材料等领域。
通过EDTA配位滴定法,可以准确地测定不同类型和含量的锌,保证产品质量,监测环境中锌的污染程度,对相关领域的生产和研究具有重要意义。
5. 个人观点和理解EDTA配位滴定法测定锌含量是一种简单、准确且广泛应用的分析方法。
通过此方法,我们可以快速了解样品中锌离子的含量,并且在实际应用中具有较高的可操作性。
然而,在进行EDTA配位滴定法实验时,需注意 pH 值、指示剂的选择和溶液中金属离子的相互影响等因素,以确保结果的准确性和可靠性。
6. 总结EDTA配位滴定法测定锌含量是一项重要的化学分析技朧。


锌的测定EDTA滴定法方法提要试样经氢溴酸、盐酸、硝酸分解后,在氟化钾存在下用氯化铵沉淀分离铁、铅、铋等元素.用过氧化氢使锰呈二氧化锰沉淀,过滤、分取部分溶液,加硫氰酸钾、硫代硫酸钠、硫脲等掩蔽剂,在PH5—6的乙酸—乙酸铵缓冲溶液中,以二甲酚橙为指示剂,用EDTA标准溶液滴定,测得的结果为锌镉合量,扣除镉含量即为锌量。
试剂盐酸(1+1)氟化钾(20%)氯化铵(20%)二甲酚橙(0.5%)乙酸—乙酸铵缓冲溶液:500克乙酸铵(1瓶)溶于水,加33毫升冰乙酸,用水稀释至3.3升,摇匀,此溶液PH为5.5。
锌标准溶液:称取1.0000克金属锌(99.99%)于400毫升烧杯中,加30毫升盐酸(1+1),微热使其溶解,冷后,移入1升容量瓶中,用水定溶。
此溶液1毫升含有1毫克锌。
EDTA标准溶液[C(EDTA)=0.01mol/L]:称取37.2克乙二胺四乙酸二钠(EDTA)溶于水,再用水稀释至10升摇匀。
标定:取1毫升含1毫克锌标准溶液25毫升于锥形瓶中,加1—2滴二甲酚橙指示剂,用氨水(1+1)调至溶液出现橙色(PH3—3.5),加10毫升乙酸—乙酸铵缓冲溶液,用EDTA标准溶液滴定至溶液呈现亮黄色为终点。
分析步骤:称取0.2000~0.5000克试样于250毫升烧杯中,加溴氢酸2毫升,盖上表面皿,加热至刚冒烟,取下加入5毫升盐酸,5毫升硝酸,继续加热分解至1~2毫升,用水吹洗表面皿及杯壁(体积控制在20毫升左右)加入10毫长20%氯化铵溶液,加热使盐类溶解,加15毫升氨水,5~10毫升20%氟化钾溶液,微热2分钟,冷至室温,加0.5~1毫升过氧化氢,摇匀,放置至反应平静为止,再补加10毫升氨水,移入100毫升容量瓶中,以水定容,用普通滤纸干过滤。
用25毫升容量瓶接取滤液至刻度,转入250毫升烧杯中,在低温下加热驱尽氨后吹少许水,加入0.5克硫代硫酸钠、0.5克硫氰酸钾、0.1克硫脲、0.2克抗坏血酸等掩蔽剂,加1~2滴二甲酚橙指示剂。

锌的测定(EDTA滴定法)试样用硝酸、氯酸钾溶解,使锰呈二氧化锰析出,然后加硫酸铵、氟化钾、乙醇和氨水沉淀分离铁、铝、铅等元素.在PH5~6的乙酸-乙酸钠缓冲溶液中,以二甲酚橙作指示剂,用EDTA标准溶液滴定锌.其反应式如下:H2Y2-+Zn2+→ZnY2-+2H+铜、镍、钴、镉对测定有干扰,但铜可在滴定前加入硫代硫酸钠来掩蔽.本法适用于铜铅锌矿石中1%以上锌的测定.【试剂配制】乙酸-乙酸钠缓冲溶液PH5~6 称取200g结晶乙酸钠,用水溶解后,加入10ml冰乙酸,用水稀释至1L,摇匀.EDTA标准溶液c(EDTA)≈0.015mol/L 称取5.7g乙二胺四乙酸二钠于烧杯中,加水加热溶解,冷却后移入1L容量瓶中,用水定容.锌标准溶液称取1.0000g 金属锌(99.99%)于烧杯中,加20ml盐酸(1+1),加热溶解后移入1L 容量瓶中,用水定容.此溶液含锌1mg/ml.标定:吸取20ml锌标准溶液于250ml烧杯中,加1滴甲基橙指示剂,用氨水(1+1)中和,使溶液由橙色变为刚显黄色,以少量水冲洗杯壁,加20ml乙酸-乙酸钠缓冲溶液,1滴二甲酚橙指示剂,用EDTA标准溶液滴定至溶液由酒红色至亮黄色,即为终点.标定时须作空白试验.【分析步骤】称取0.2000~0.50000g试样于300ml烧杯中,加15~20ml硝酸,低温加热5~6min,稍冷加1~2g氯酸钾,继续加热蒸发至溶液体积为5~6ml,取下加水使溶液体积保持在100ml左右,加入10ml300g/L硫酸铵溶液,加热煮沸,用氨水中和并过量15ml,加10ml200g/L氟化钾溶液,加热煮沸约1min,取下加5ml氨水,10ml乙醇,冷却后移入250ml容量瓶中,用水定容.干过滤,弃去最初流下的15~20ml滤液,吸取100或50ml溶液于250ml锥形瓶中(试样锌含量小于20%时吸取100ml,大于20%时吸取50ml).加热煮沸以驱除大部分氨(但勿使氢氧化锌白色沉淀析出),冷却,加1滴1g/L甲基橙指示剂,用盐酸(1+1)中和至甲基橙变红色,然后加1滴氨水(1+1),使其变黄,加入15ml乙酸-乙酸钠缓冲溶液,加2~3ml100g/L硫代硫酸钠溶液,混匀.加入2~3滴二甲酚橙指示剂,用EDTA标准溶液滴定至溶液由酒红色至亮黄色,即为终点.【计算】Zn(%)=100TV/G式中T→与1.00mlEDTA标准溶液相当的以克表示的锌的质量;V→滴定时消耗EDTA标准溶液的体积,ml;G→称取试样量,g.【注意事项】1、二甲酚橙溶液须在半个月左右更换一次.2、本法基于使锌呈锌氨络离子状态与干扰元素分离,如氨的含量不足,锌不能完全形成锌氨络离子会使结果偏低.3、当试样中铅含量大于40%时,应在用氨水中和大量酸后,加20ml饱和碳酸铵以下操作与分析步骤相同。

锌和二甲酚橙标定edta的原理以锌和二甲酚橙标定EDTA的原理为标题锌和二甲酚橙是常用的标准物质,用于标定EDTA(乙二胺四乙酸)浓度和测定金属离子的含量。
本文将介绍锌和二甲酚橙标定EDTA 的原理及其应用。
1. 锌的标定原理锌是一种常见的金属元素,可以用于标定EDTA的浓度。
锌溶液中的锌离子会与EDTA形成稳定的络合物,其反应方程式如下所示:Zn2+ + EDTA → Zn-EDTA在标定过程中,首先需要将锌溶液与适量的二甲酚橙溶液混合,二甲酚橙是一种指示剂,可以通过颜色变化来判断络合反应的终点。
在溶液中,二甲酚橙与锌离子形成红色络合物。
当EDTA与锌离子发生络合反应时,络合物的形成会使溶液颜色由红色转变为无色。
通过观察颜色变化,可以确定反应终点。
2. 二甲酚橙的标定原理二甲酚橙是一种指示剂,用于判断金属离子与EDTA络合反应的终点。
它能与锌离子形成红色络合物,但与EDTA形成的络合物呈无色。
二甲酚橙与EDTA络合反应的方程式如下所示:HIn + EDTA → In- + H2In在标定过程中,首先将二甲酚橙与适量的EDTA溶液混合,其中HIn为二甲酚橙的酸性形式,呈红色。
当EDTA与金属离子发生络合反应时,EDTA优先与金属离子反应,使溶液中的金属离子浓度降低,导致HIn转变为无色的In-。
通过观察颜色变化,可以确定反应终点。
3. 应用锌和二甲酚橙标定EDTA的原理广泛应用于化学分析、环境监测和食品检测等领域。
例如,可以利用锌和二甲酚橙标定EDTA来测定水样中重金属离子的含量。
在实验中,首先将待测水样与适量的二甲酚橙溶液和锌溶液混合,然后加入EDTA溶液,观察溶液颜色的变化来判断金属离子的含量。
锌和二甲酚橙标定EDTA的原理还可应用于药物分析和质量控制中。
例如,可以利用该方法测定药物中金属离子的含量,判断药物质量的优劣。
锌和二甲酚橙标定EDTA的原理是通过观察颜色变化来判断络合反应的终点,从而实现对EDTA浓度和金属离子含量的测定。

EDTA络合滴定法测定黄铜中铜和锌
刘和连;许方;黄海平
【期刊名称】《冶金分析》
【年(卷),期】2015(035)005
【摘要】对EDTA络合滴定法测定黄铜中的铜和锌条件进行了研究,并建立了一种连续测定黄铜中铜和锌的简单方法.通过硫代硫酸钠对铜离子的配位掩蔽,在pH5.5时,以1-(2-吡啶偶氮)-2-萘酚(PAN)作指示剂,用EDTA标准溶液滴定溶液中的锌,
根据消耗EDTA标准溶液的体积得到锌的含量;同时以PAN作指示剂,用EDTA标
准溶液滴定溶液中铜和锌,根据滴定铜和锌与滴定锌消耗EDTA标准溶液的体积差值,得到铜的含量.方法应用于黄铜标准物质中铜和锌的测定,测定值与认定值相一致.对样品进行精密度试验,得到铜和锌测定结果的相对标准偏差(RSD)均不大于0.55%(n=10).
【总页数】4页(P70-73)
【作者】刘和连;许方;黄海平
【作者单位】江西理工大学分析测试中心,江西赣州341000;江西理工大学分析测
试中心,江西赣州341000;江西理工大学分析测试中心,江西赣州341000
【正文语种】中文
【相关文献】
1.EDTA络合滴定法直接测定锌镉试样中锌 [J], 奚长生;陈慧琴;梁凯;罗翠环;赵慧;
易飞鸿
2.《农业用硫酸锌》标准中锌含量测定方法—EDTA络合滴定法的改进 [J], 商照
聪;纪胜
3.《农业用硫酸锌》行业标准中锌含量测定方法——EDTA络合滴定法的改进 [J], 商照聪;纪胜
4.EDTA络合滴定法测定彩钢板中锌层质量 [J], 刘守琼;刘迪;周西林
5.EDTA络合滴定法测定黄铜中高含量锌 [J], 李冬梅;程晓寅;张学彬
因版权原因,仅展示原文概要,查看原文内容请购买。

edta标准溶液的标定方法
EDTA(乙二胺四乙酸)是一种常用的配位试剂,可用于金属离子的分析。
标定EDTA标准溶液的方法是确保其准确性和可靠性的重要步骤。
下面将介绍一种常用的EDTA标准溶液的标定方法。
首先,准备所需材料,包括EDTA标准溶液、铜硫酸溶液、二甲基橙指示剂溶液。
接下来,取一定体积的EDTA标准溶液,使用滴定管将其转移至锥形瓶中。
然后,加入适量的二甲基橙指示剂溶液,溶液颜色会由无色变为红色。
然后,用铜硫酸溶液进行滴定。
将铜硫酸溶液滴加到瓶中的溶液中,每滴一滴后,用玻璃杯轻轻搅拌一下,直到溶液颜色由红色变为橙色。
橙色的溶液表示EDTA与金属离子形成的络合物已经完全消耗。
记录滴定所用的铜硫酸溶液的体积。
重复以上步骤,进行至少三次滴定,直到滴定结果的差异小于0.1mL为止。
计算平均滴定体积。
最后,计算EDTA标准溶液的浓度。
根据铜硫酸溶液的浓度,可以根据滴定反应的化学方程式以及滴定过程中EDTA与金属离子的化学计量关系计算出EDTA 的浓度。
以上就是一种常用的EDTA标准溶液的标定方法。
在实际操作中,注意仪器、药品和试剂的准确性和纯度,保持实验环境的洁净和干燥,严格按照操作规程进行操作,以确保标定结果的准确性和可靠性。
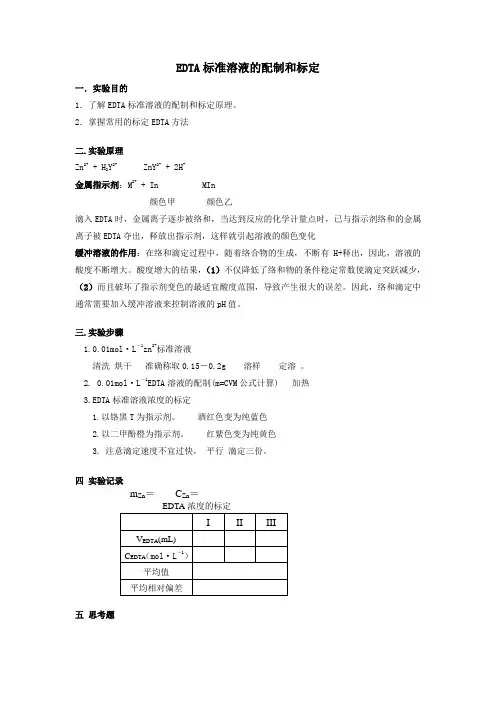
EDTA标准溶液的配制和标定一.实验目的1.了解EDTA标准溶液的配制和标定原理。
2.掌握常用的标定EDTA方法二.实验原理Zn2+ + H2Y2- ZnY2- + 2H-金属指示剂:M2+ + In MIn颜色甲颜色乙滴入EDTA时,金属离子逐步被络和,当达到反应的化学计量点时,已与指示剂络和的金属离子被EDTA夺出,释放出指示剂,这样就引起溶液的颜色变化缓冲溶液的作用:在络和滴定过程中,随着络合物的生成,不断有H+释出,因此,溶液的酸度不断增大。
酸度增大的结果,(1)不仅降低了络和物的条件稳定常数使滴定突跃减少,(2)而且破坏了指示剂变色的最适宜酸度范围,导致产生很大的误差。
因此,络和滴定中通常需要加入缓冲溶液来控制溶液的pH值。
三.实验步骤1.0.01mol·L-1zn2+标准溶液清洗烘干准确称取0.15-0.2g 溶样定溶。
2. 0.01mol·L-1EDTA溶液的配制(m=CVM公式计算) 加热3.EDTA标准溶液浓度的标定1.以铬黑T为指示剂。
酒红色变为纯蓝色2.以二甲酚橙为指示剂。
红紫色变为纯黄色3. 注意滴定速度不宜过快,平行滴定三份。
四实验记录m Zn=C Zn=五思考题缓冲溶液是对一种溶液的酸度起稳定作用的溶液。
向该溶液中加入少量酸或碱;或因化学反应产生少量酸或碱,或将溶液稍加稀释,溶液的酸度能基本维持不变............。
滴定误差在滴定分析中,相对误差应小于0.2%。
因此,如何减小滴定分析的误差,提高分析的准确度,是值得我们注意的问题。
1.称量误差称取的量越大,称量的相对误差越小。
为了将误差控制在允许范围内,试样的称取量应大于或等于0.1g 。
2.读数误差在滴定分析中常用滴定管、移液管和容量瓶等来测量溶液的体积,读数不准所引起的误差是滴定分析误差的来源之一。
如:滴定管读数是估计值,常有±0.02m l 的绝对误差,因此读数的相对误差的大小取决于滴定剂体积的用量。

一、EDTA容量法试样用王水分解,用乙酸钠—氢氧化铵—过硫酸铵先将铜、锌与铁、锰、铅等分离。
滤液进行铜、锌的测定。
即先用硫脲掩蔽铜,在pH5.6的缓冲溶液中,以二甲酚橙为指示剂,用EDTA滴定锌。
然后加入过氧化氢,以PAR为指示剂,用EDTA滴定铜。
沉淀用硝酸—过氧化氢混合溶解,加氟化铵掩蔽铁,在pH5.6的缓冲溶液中,以二甲酚橙为指示剂,用EDTA滴定铅。
二、分析手续称取0.1~0.5克试样,置于150毫升烧杯中,加入盐酸10毫升,于电热板上加热煮沸。
加硝酸3毫升,继续加热使试样完全分解,蒸发至近干。
加入乙酸钠1克及少量水,摇动使盐类溶解。
加入过硫酸铵1克、氨水15毫升,煮沸3分钟。
取下稍冷,用致密滤纸过滤,用5%氢氧化铵溶液洗涤沉淀6~8次。
滤液用150毫升烧杯承接,将滤液加热至无氨味,加入硝酸3毫升,再煮沸3分钟(以破坏过硫酸铵)。
取下冷却至室温,加入氟化铵0.5~1克、10%硫脲溶液5毫升、0.1%对硝基酚溶液1滴,用氢氧化铵中和至黄色,再用稀硝酸调至无色。
加入乙酸钠—乙酸缓冲溶液10~15毫升、0.3%二甲酚橙溶液3滴,用1毫升相当于0.5毫克锌的EDTA标准溶液滴定至黄色为终点。
此为锌量。
在滴定完锌的溶液中,加入过氧化氢1.5~2毫升、0.1%PAR溶液2滴,用1毫升相当于0.2毫克铜的EDTA标准溶液滴定至黄绿色为终点。
此为铜量。
用5N硫酸洗涤沉淀8~10次后,将滤纸连同沉淀移入原烧杯中,加5%硝酸—3%过氧化氢混合液5毫升溶解沉淀。
加0.1%对硝基酚溶液1滴,用氨水中和至黄色,再用稀硝酸调节至无色。
加入乙酸钠—乙酸缓冲溶液20毫升、氟化铵1克、25%硫氰酸钾溶液2.5毫升及0.3%二甲酚橙指示剂3滴,用1毫升相当于0.5毫克铅的EDTA标准溶液滴定至黄色为终点。
此为铅量。
锌标准溶液标定edta锌是一种重要的金属元素,在工业生产和日常生活中都有着广泛的应用。
为了准确测定样品中锌的含量,我们通常会采用标定法来确定锌的浓度。
本文将介绍如何使用edta标准溶液对锌进行标定的方法和步骤。
首先,准备工作。
我们需要准备好所需的试剂和仪器设备,包括edta标准溶液、pH试剂、指示剂、容量瓶、分析天平、磁力搅拌器等。
确保所有试剂和仪器设备的清洁和准确性。
其次,制备样品。
将待测样品溶解于适量的溶剂中,使其达到适当的浓度。
在进行标定前,需要对样品进行适当的预处理,如过滤、稀释等操作,以确保实验结果的准确性。
接下来,进行标定实验。
首先,取适量的标准溶液,加入适量的pH试剂和指示剂,使其达到适当的pH值和指示剂的颜色变化。
然后,将样品溶液与标准溶液进行滴定反应,直至指示剂的颜色发生明显变化。
记录所需的数据,包括标定溶液的用量和样品的浓度。
最后,计算锌的含量。
根据标定实验的结果,我们可以通过计算得出样品中锌的含量。
根据化学方程式和滴定反应的数据,进行适当的计算,得出锌的浓度或含量。
在进行锌标准溶液标定edta的实验过程中,需要注意以下几点,首先,保证实验操作的准确性和稳定性,避免实验误差。
其次,注意试剂的保存和使用,避免试剂的污染和变质。
最后,及时清洗和维护仪器设备,确保实验的顺利进行。
总之,锌标准溶液标定edta是一项重要的实验操作,在锌的分析和测定中具有广泛的应用。
通过本文介绍的方法和步骤,相信大家可以更加准确地进行锌的标定实验,为相关领域的研究和应用提供可靠的数据支持。
希望本文能对大家有所帮助,谢谢阅读!。
EDTA的标定(二甲酚橙)及锡铜中锌的测定一.实验目的1.学习配制Zn2+标准溶液,EDTA标准溶液;2.学会以六亚甲基四胺-盐酸为缓冲溶液,二甲酚橙为指示剂标定EDTA标准溶液;3.了解黄铜片的组成,学会铜合金的溶解方法; 干扰离子的掩蔽方法;、4.掌握铜合金中Zn的测定方法二.实验原理:1.EDTA配置及标定原理:⑴用EDTA二钠盐配制EDTA标准溶液的原因:EDTA是四元酸,常用H4Y表示,是一种白色晶体粉末,在水中的溶解度很小,室温溶解度为0.02g/100g H2O。
因此,实际工作中常用它的二钠盐Na2H2Y·2H2O, Na2H2Y·2H2O的溶解度稍大,在22℃(295K)时,每100g水中可溶解11.1g.⑵标定EDTA标准溶液的工作基准试剂,基准试剂的预处理;实验中以纯金属Zn为工作基准试剂。
预处理:称量前一般应先用稀盐酸洗去氧化层,然后用水洗净,烘干。
⑶滴定用的指示剂是可以选用铬黑T和二甲酚橙,本次实验选用二甲酚橙与后面黄铜中Zn的滴定的指示剂保持一致,减小误差。
二甲酚橙有6级酸式解离,其中H6In至H2In4-都是黄色,HIn5-至In6-是红色。
H2In4-=H++ HIn5-(p K a=6.3)黄色红色从平衡式可知,pH>6.3指示剂呈现红色;pH<6.3呈现黄色。
二甲酚橙与M n+形成的配合物都是红紫色,因此,指示剂只适合在pH<6的酸性溶液中使用。
测定Zn2+的适宜酸度为pH=5.5,终点时,溶液从红紫色变为纯黄色。
化学计量点时,完成以下反应:MIn + H2Y2-→ MY + H2In4-⑷ EDTA浓度计算公式:C(EDTA)= m(Zn)/10MZnVEDTA2.黄铜片中Zn测定原理:⑴黄铜片的溶解:使用1:1的盐酸和30%的H2O2溶解黄铜片Cu+ H2O2+2HCl=CuCl2+2H2O⑵干扰离子的掩蔽:黄铜的主要成分是铜,铅,锡,锌还可能有少量铁铝等杂质。
锌含量的测定-EDTA滴定法FCL YSCo0067钴锌含量的测定EDTA 滴定法F-CL-YS-Co-0067钴锌含量的测定EDTA 滴定法1范围本法适用于金属钴中1%以上的锌含量的测定。
2原理试样用、硝酸、氢氟酸溶解,在氢氧化钠-过氧化氢介质中,进行锌与铜、钴、镍、镉等定量分离。
加入少量磷酸三钠以消除因大量钙、镁存在对锌的吸附。
以半二甲酚橙为指示剂,用EDTA 标准滴定溶液滴定锌。
由所消耗的EDTA 标准滴定溶液的体积,计算锌的含量。
3试剂3.1硫脲。
3.2抗坏血酸。
3.3盐酸,?2约1.19g/mL 。
3.4盐酸,1+1。
3.5硝酸,?约1.42g/mL 。
3.6氢氟酸,?约1.15g/mL 。
3.7过氧化氢,质量分数约30%。
3.8氢氧化钠溶液,300g/L 。
3.9氨水,1+1。
3.10乙酰丙酮-磺基水杨酸混合溶液称取100g 磺基水杨酸,溶解于水后加入15mL 乙酰丙酮,用水稀至500mL ,混匀。
3.11乙酸-乙酸钠缓冲溶液,pH ≈5.9称取100g 无水乙酸钠,溶解于200mL 水中,加入15mL 冰乙酸,用水稀至1000mL ,混匀。
3.12半二甲酚橙指示剂溶液,2.5g/L 。
3.13对硝基酚溶液,2gL 。
3.14锌标准溶液,2.50mg/mL称取2.5000g 纯锌(质量分数≥99.99%,预先用酸洗去表面氧化物,水洗净,低温干燥1h)于500mL 烧杯中,缓缓加入50mL 盐酸(1+1),盖上表皿,低温加热至完全溶解。
冷却后,用水移入1000mL 容量瓶中并稀释至刻度,混匀。
3.15EDTA 标准滴定溶液,c(EDTA)≈0.016mol/L标定:吸取10.00mL 锌标准溶液(2.50mg/mL )于250mL 烧杯中,用水稀至40mL 左右,加入2滴半二甲酚橙指示剂(2.5g/L ),用氨水(1+1)和盐酸(1+1)调整至溶液为橙色,再加入10mL 乙酸乙酸钠缓冲溶液,用EDTA 标准滴定溶液滴定至亮黄色即为终点。
化学化工C hemical EngineeringEDTA滴定法直接测定锌精矿中锌量李建芝(云南黄金矿业集团贵金属检测有限公司,云南 昆明 650000)摘 要:结合本地区锌精矿的特点和生产实际需求,在参考锌精矿测定锌量国标方法的基础上建立了锌精矿中锌量的快速测定方法。
试样经盐酸、硝酸、硫酸、高氯酸分解后,氟化氢铵消除硅,铅生成硫酸铅沉淀,过硫酸铵氧化锰成二氧化锰沉淀,饱和氟化氢铵掩蔽三价铁,硫代硫酸钠掩蔽铜,氟化钾掩蔽铝,碘化钾掩蔽镉,以二甲酚橙为指示剂,在PH=5~6的六次甲基四胺缓冲溶液中,用EDTA标准溶液滴定至溶液由红色变为亮黄色为终点,测定结果即为锌量。
该方法无需沉淀过滤分离铁,避免了氢氧化物铁沉淀对锌的吸附和包裹,操作过程简单、快速,分析结果准确可靠,更好的满足了生产实际的需求。
关键词:滴定法;直接测定;锌精矿;锌中图分类号:P575 文献标识码:A 文章编号:1002-5065(2020)03-0155-2Zinc content in zinc concentrate was directly determined by EDTA titrationLI Jian-zhi(Yunnan Gold Mining Group Precious Metal Testing Co., Ltd., Kunming 650000,China)Abstract: Based on the characteristics of zinc concentrate in this region and the actual production demand, a rapid determination method of zinc content in zinc concentrate was established on the basis of reference to the national standard method of measuring zinc content in zinc concentrate. Sample by hydrochloric acid, nitric acid, sulfuric acid and perchloric acid decomposition, ammonium hydrogen fluoride silicon, lead generation lead sulfate precipitation, ammonium persulfate oxidation manganese manganese dioxide precipitation, hidden ferric iron saturated ammonium hydrogen fluoride, sodium thiosulfate masking copper, potassium fluoride masking aluminum, cadmium, potassium iodide masking with xylenol orange as the indicator, in the PH=5~6 six methyl tetramine in the buffer solution, titration with EDTA standard solution to solution changed from red to bright yellow for the finish line, the determination results is the amount of zinc. This method eliminates the need of precipitation and filtration to separate iron, avoids the adsorption and encapsulation of zinc by the precipitation of hydroxide iron, and the operation process is simple, fast, and the analysis results are accurate and reliable, which better meets the actual demand of production.Keywords: titration; direct determination; zinc concentrate; zinc锌精矿一般是由铅锌矿或含锌矿石经破碎、球磨、泡沫浮选等工艺而生产出的达到国家标准的含锌量较高的矿石,是锌冶炼行业的重要原料,为了较好的监控冶炼工艺过程,保证锌产品质量,必须对锌精矿中锌量进行准确的分析测定。
EDTA的标定(二甲酚橙)及锡铜中锌的测定一.实验目的1.学习配制Zn2+标准溶液,EDTA标准溶液;2.学会以六亚甲基四胺-盐酸为缓冲溶液,二甲酚橙为指示剂标定EDTA标准溶液;3.了解黄铜片的组成,学会铜合金的溶解方法; 干扰离子的掩蔽方法;、4.掌握铜合金中Zn的测定方法二.实验原理:1.EDTA配置及标定原理:⑴用EDTA二钠盐配制EDTA标准溶液的原因:EDTA是四元酸,常用H4Y表示,是一种白色晶体粉末,在水中的溶解度很小,室温溶解度为0.02g/100g H2O。
因此,实际工作中常用它的二钠盐Na2H2Y·2H2O, Na2H2Y·2H2O的溶解度稍大,在22℃(295K)时,每100g水中可溶解11.1g.⑵标定EDTA标准溶液的工作基准试剂,基准试剂的预处理;实验中以纯金属Zn为工作基准试剂。
预处理:称量前一般应先用稀盐酸洗去氧化层,然后用水洗净,烘干。
⑶滴定用的指示剂是可以选用铬黑T和二甲酚橙,本次实验选用二甲酚橙与后面黄铜中Zn的滴定的指示剂保持一致,减小误差。
二甲酚橙有6级酸式解离,其中H6In至H2In4-都是黄色,HIn5-至In6-是红色。
H2In4-=H++ HIn5-(p K a=6.3)黄色红色从平衡式可知,pH>6.3指示剂呈现红色;pH<6.3呈现黄色。
二甲酚橙与M n+形成的配合物都是红紫色,因此,指示剂只适合在pH<6的酸性溶液中使用。
测定Zn2+的适宜酸度为pH=5.5,终点时,溶液从红紫色变为纯黄色。
化学计量点时,完成以下反应:MIn + H2Y2-→ MY + H2In4-⑷ EDTA浓度计算公式:C(EDTA)= m(Zn)/10MZnVEDTA2.黄铜片中Zn测定原理:⑴黄铜片的溶解:使用1:1的盐酸和30%的H2O2溶解黄铜片Cu+ H2O2+2HCl=CuCl2+2H2O⑵干扰离子的掩蔽:黄铜的主要成分是铜,铅,锡,锌还可能有少量铁铝等杂质。
锌的分析实验报告,EDTA法EDTA滴定法测定锌EDTA滴定法测定锌Determination of Zinc by EDTA Titration一、方法原理样品经王水分解后,在FeCl3存在条件下,使得猛以二氧化锰形式沉淀,用NH3·H2O、(NH4)2SO4、(NH4)2S2O8沉淀分离铁、铝、铅等元素,在pH=5.4~5.9的乙酸-乙酸钠缓冲溶液条件下以Na2S2O3、KF掩蔽Cu、,以二甲酚橙作指示剂进行EDTA络合滴定。
反应式如下:H2Y2-+Zn2+Zn2-+2H+铜、镍、钴、镉对测定有影响,但铜可用Na2S2O3掩蔽。
本法适用于含1%以上锌矿样的分析。
二、试剂1、5%FeCl3溶液2、0.2%二甲酚橙水溶液3、HAc-NaAc缓冲溶液:200g NaAc溶于1000mL水中,加冰醋酸10mL,混匀4、NH3·H2O-(NH4)2SO4-NH4Cl洗液:20g (NH4)2SO4溶于1000mL热水中,加20g NH4Cl、20mL NH3·H2O5、EDTA标准溶液(CEDTA=0.015mol/L):称取5.7g乙二胺四乙酸二钠于250ml烧杯中,加水加热溶解,冷却后定容至1000ml。
6、锌标准溶液:称取1.000g金属锌(99.99%)于250ml烧杯中,加20ml盐酸(1+1),加热溶解后定容至1000ml。
7、EDTA溶液的标定:移取20.00ml锌标准溶液于250ml三角瓶中,加1滴甲基橙作指示剂,用氨水中和至溶液由红变为黄色,用少许水冲洗瓶壁,加20mlNaAc-HAc缓冲溶液,加1滴二甲酚橙作指示剂,用EDTA滴定至溶液由酒红色变至亮黄色即为终点,做空白试验。
CEDTA=CZnVZn/VEDTA三、分析手续称样0.2g于150mL烧杯中,以少量水润湿,加入15mL HCl,低温加热分解5-6min,逐去H2S,再加入5mL HNO3,继续加热分解,蒸至小体积后,加入1mL FeCl3溶液,继续蒸发至湿盐状,取下,加入5g (NH4)2SO4(使Pb沉淀)、1g (NH4)Fe、Mn、Al)、1g NH4Cl,拌成砂粒状。
EDTA的标定(二甲酚橙)及锡铜中锌的测定一.实验目的1.学习配制Zn2+标准溶液,EDTA标准溶液;2.学会以六亚甲基四胺-盐酸为缓冲溶液,二甲酚橙为指示剂标定EDTA标准溶液;3.了解黄铜片的组成,学会铜合金的溶解方法; 干扰离子的掩蔽方法;、4.掌握铜合金中Zn的测定方法二.实验原理:1.EDTA配置及标定原理:⑴用EDTA二钠盐配制EDTA标准溶液的原因:EDTA是四元酸,常用H4Y表示,是一种白色晶体粉末,在水中的溶解度很小,室温溶解度为0.02g/100g H2O。
因此,实际工作中常用它的二钠盐Na2H2Y·2H2O, Na2H2Y·2H2O的溶解度稍大,在22℃(295K)时,每100g水中可溶解11.1g.⑵标定EDTA标准溶液的工作基准试剂,基准试剂的预处理;实验中以纯金属Zn为工作基准试剂。
预处理:称量前一般应先用稀盐酸洗去氧化层,然后用水洗净,烘干。
⑶滴定用的指示剂是可以选用铬黑T和二甲酚橙,本次实验选用二甲酚橙与后面黄铜中Zn的滴定的指示剂保持一致,减小误差。
二甲酚橙有6级酸式解离,其中H6In至H2In4-都是黄色,HIn5-至In6-是红色。
H2In4-=H++ HIn5-(p K a=6.3)黄色红色从平衡式可知,pH>6.3指示剂呈现红色;pH<6.3呈现黄色。
二甲酚橙与M n+形成的配合物都是红紫色,因此,指示剂只适合在pH<6的酸性溶液中使用。
测定Zn2+的适宜酸度为pH=5.5,终点时,溶液从红紫色变为纯黄色。
化学计量点时,完成以下反应:MIn + H2Y2-→ MY + H2In4-⑷ EDTA浓度计算公式:C(EDTA)= m(Zn)/10MZnVEDTA2.黄铜片中Zn测定原理:⑴黄铜片的溶解:使用1:1的盐酸和30%的H2O2溶解黄铜片Cu+ H2O2+2HCl=CuCl2+2H2O⑵干扰离子的掩蔽:黄铜的主要成分是铜,铅,锡,锌还可能有少量铁铝等杂质。
在实验条件下Cu2+、Pb2+、Sn4+、Fe3+、Al3+等离子会干扰锌的测定。
可以用配位掩蔽、沉淀掩蔽、氧化还原掩蔽等方法,选择在适当的pH下,将待测离子之外的其他离子进行化学掩蔽。
采用的掩蔽方法如下:Ⅰ。
沉淀掩蔽法掩蔽Pb2+在微酸性溶液中,加入适量的氯化钡和硫酸钾溶液,使生成硫酸钡沉淀,当Ba2+的量超过Pb2+量10倍以上时,Pb2+即会全部渗入硫酸钡晶格中去,形成硫酸铅钡混晶沉淀,这种沉淀比单纯的硫酸铅沉淀稳定得多。
因此,可以有效地掩蔽Pb2+。
Ⅱ。
氧化还原、配位掩蔽法掩蔽Cu2+在一定酸度(pH=2~6)下,Cu2+被硫脲还原成Cu+:8Cu2+ + CS(NH2)2+ 5H2O = 8Cu+ + CO(NH2)2+ SO42- + 10H+Cu+再与硫脲形成配合物而被掩蔽。
Ⅲ.配位掩蔽法掩蔽Sn(IV)、Fe3+、Al3+用氟化钾(或氟化铵)将Sn(IV)、Fe3+、Al3+形成氟的配合物(SnF62-、FeF63-、AlF63-)而加以掩蔽。
3计算Zn的含量:三.主要仪器与试剂主要仪器:分析天平,250m烧杯,50mL滴定管,称量瓶, 移液管,干燥器,量筒,250mL容量瓶。
主要试剂:黄铜片,二甲酚橙指示剂,30%H2O2,0.1mol·L-1 HCl溶液,Na2H2Y·2H2O四.操作步骤:五.实验结果及分析1.EDTA的标定:2.黄铜片中锌的测定:序号1234 mCu/ g初体积V/ ml终体积V/mlV/mlW%舍前平均W%ST舍后平均W%六.问题及思考题★思考题1. 如何判断过氧化氢是否除尽?如果溶解后过剩的过氧化氢未完全分解,将有何种影响?答:溶液中小而密的气泡(O2)变少,最后消失,继而出现大而少的气泡(水蒸气),再加热片刻(2~3min),可保证H2O2完全除去。
如果没有完全去除,它会氧化指示剂二甲酚橙。
2. 试述用六亚甲基四胺作缓冲溶液的基本原理。
答:六亚甲基四胺为弱碱,p K b=8.87。
结合一个质子后形成质子化六亚甲基四胺:(CH2)6N4+ H+= (CH2)6N4H+质子化六亚甲基四胺为弱酸,p K a=5.15。
弱酸和它的共轭碱组成缓冲溶液,缓冲溶液的pH主要决定于p K a,当c酸=c碱时,pH=p K a=5.15,改变c酸、c碱的比例,缓冲溶液的pH可在p K a±1的范围调节,因此,六亚甲基四胺-盐酸缓冲溶液符合测定Zn2+时pH=5.5的要求。
3. 实验中如何掩蔽干扰离子?答:参见实验原理。
4. 能否先加硫脲,后加氟化物?答:不能。
若先加硫脲,则还原剂硫脲将Fe3+、Sn(IV)还原为低价Fe2+、Sn2+,由于F-形成的配合物为离子型,金属离子的电荷越高形成的配合物越稳定,因此金属离子电荷的降低,使Fe2+、Sn2+不能被F-有效掩蔽而干扰Zn2+的测定(Fe2+,b= 0.8;Fe3+,b1=5.18,b2=9.07,b3=12.1;Sn2+,b3= 9.5;Sn(IV),b6=25)。
5. 加入掩蔽剂后如未混匀,对实验有何影响?答:如果没有混匀,掩蔽不完全,滴定时就会消耗过多的EDTA使得测得的锌的含量偏高。
6. 本实验中锌的测定条件是什么?当用纯锌作基准物质试剂标定EDTA溶液时,采用何种指示剂,为什么?答:在本实验中,以二甲酚橙为指示剂,pH=5.5的条件下测定锌,由于标定应与被测物的测定条件一致,所以用纯锌作基准物质标定EDTA时需在pH=5.5的条件下,以二甲酚橙为指示剂重新标定EDTA溶液。
这样做是为了减少在不同PH 条件下,用不同指示剂引起的系统误差。
4、在“EDTA标准溶液配制与标定”实验中,已测定EDTA标准液的浓度,为什么还要重新标定?答:在“锡青铜中锌的测定”中,以二甲酚橙为指示剂,pH=5.5的条件下测定锌,由于标定应与被测物的测定条件一致,所以需在pH=5.5的条件下,以二甲酚橙为指示剂重新标定EDTA溶液。
减少在不同PH条件下,用不同指示剂引起的系统误差。
5说明二甲酚橙指示剂使用的最适宜pH范围,滴定时终点的颜色变化。
答:⑴二甲酚橙有6级酸式解离,其中H6In至H2In4-都是黄色,HIn5-至In6-是红色。
H2In4-=H++ HIn5-(p K a=6.3)黄色红色从平衡式可知,pH>6.3指示剂呈现红色;pH<6.3呈现黄色。
二甲酚橙与M n+形成的配合物都是红紫色,因此,指示剂只适合在pH<6的酸性溶液中使用。
测定Zn2+的适宜酸度为pH=5.5,其他M n+离子测定时要求的pH值如下:pH<1,ZrO2+;pH=1~2(HNO3),Bi3+;pH=2.5~3.5(HNO3),Th4+;pH=5~6,La3+、Pb2+、Cd2+、Hg2+、Te3+;⑵终点时,溶液从红紫色变为纯黄色。
化学计量点时,完成以下反应:MIn + H2Y2-→ MY + H2In4-6为什么选用六亚甲基四胺-盐酸作为缓冲溶液?答:六亚甲基四胺为弱碱,p K b=8.87。
结合一个质子后形成质子化六亚甲基四胺:(CH2)6N4+ H+= (CH2)6N4H+质子化六亚甲基四胺为弱酸,p K a=5.15。
弱酸和它的共轭碱组成缓冲溶液,缓冲溶液的pH主要决定于p K a,当c酸=c碱时,pH=p K a=5.15,改变c酸、c碱的比例,缓冲溶液的pH可在p K a±1的范围调节,因此,六亚甲基四胺-盐酸缓冲溶液符合测定Zn2+时pH=5.5的要求7在盐酸-六亚甲基四胺缓冲溶液中,只加了六亚甲基四胺,HCl从哪里来?答:虽然在溶液中只加了六亚甲基四胺,未同时加HCl溶液,但溶解锡青铜试样时加了过量HCl,所以溶液中同时存在HCl与六亚甲基四胺,六亚甲基四胺与HCl反应生成(CH2)6N4H+,它与过量的六亚甲基四胺组成了(CH2)6N4H+ - (CH2)6N4缓冲对。
因此,在高酸度的溶液中加入六亚甲基四胺,就组成了缓冲溶液,可使溶液的pH稳定在5~6的范围内。
8二甲酚橙为指示剂时,如何确定终点?答:在化学计量点时,由于H2Y2-夺取MIn(红紫)中的Zn2+而释放出指示剂H2In4-(黄色),因此近终点时,随着滴定剂的逐滴加入,溶液的颜色从红紫→橙(红紫与黄的中间色)→红的成分继续减少→终点的黄色。
当滴落点暂时黄色,溶液出现橙色表示已近终点,要1滴多搅,如仍有透红的现象,则终点未到,小心滴加半滴,多搅动,直至纯黄。
注意:近终点要1滴多搅,否则终点易过,因过了终点溶液仍是黄色。
9怎样称取锡青铜试样?答:⑴如试样是很小的颗粒,放在称量瓶中用减量法称量。
⑵如试样是螺旋状的铜丝,则在电子天平上用直接称量法称量。
将小称量纸折成盒状,称量,按去皮键显示“0.0000g”后,用镊子取试样放在称量纸上,直至质量在0.13g-0.16g的范围内,关上天平门,称量,记录。
取出称量纸将试样小心转移到锥形瓶内(要保证试样转移入锥形瓶内,不能洒落在外)。
10铜试样转移到锥形瓶内,有些试样沾在锥形瓶壁,如何处理?答:利用加酸的机会,将铜试样带到瓶底,若用洗瓶吹洗,会降低酸与H2O2的浓度,使反应速度减慢。
11、为什么H2O2溶液要用定量加液器加?怎样加?答:由于质量百分比大于30% 的H2O2溶液会灼伤皮肤(呈白色),所以用定量加液器加。
加液器由塑料瓶与试管组成,手捏塑料瓶使流出的溶液至试管的标线即可。
因试管已成倾斜状态,转移溶液时,先将试管口靠在锥形瓶口,再稍倾斜塑料瓶就行,否则溶液会倒在容器外。
如万一不小心,H2O2沾到手上,立即用水冲洗干净,灼烧的白色皮肤过几天也会脱落。
12、加入5mL 1:1 HCl、2~3mL30%H2O2后,为什么待Cu反应完后才加热?答:由于有氧化剂H2O2存在,铜试样溶解在HCl和H2O2混合溶液中,有气泡产生,溶液逐渐变绿,因此不加热反应就可完成。
反应后再加热可以减少溶剂水的损失。
13加热的目的是什么,加热过程的注意事项有哪些?答:⑴铜溶解完后,加热的目的是除H2O2,H 2O2= H2O + 1/2 O2↑⑵注意事项:① 加热时,锥形瓶决不能塞上塞子,否则会因瓶内压力增加而冲出塞子,甚至锥形瓶也炸裂。
② H2O2受热分解放出O2,可看到大量小而密的气泡产生,此时把煤气灯移去,以免反应过于激烈溶液溅失。
③ 待大部分O2放出后,继续用小火加热使H2O2完全分解,记住:要小火,以防止溶液烧干。
此时人不要离开。
建议:平行测定的试样在溶样时尽量条件相同,如加的酸量、溶样后的体积大致相等,便于后续pH的调节。
14如H2O2还未赶完,溶液体积已很小,但未烧干,怎么办?答:等锥形瓶稍冷后,补加稀盐酸10mL。
冷后加是为了避免热的锥形瓶遇冷的酸而破裂15如何判断H2O2已除净,冷却时为什么不能塞上塞子?答:⑴溶液中小而密的气泡(O2)变少,最后消失,继而出现大而少的气泡(水蒸气),再加热片刻(2~3min),可保证H2O2完全除去。