糖化酶的固定化
- 格式:docx
- 大小:40.00 KB
- 文档页数:8


一、实验目的1. 了解糖化酶的特性和催化机理。
2. 掌握糖化酶的固定化技术。
3. 学习通过实验测定糖化酶的活力和半衰期。
二、实验原理糖化酶是一种内切酶,能够将淀粉分子水解成葡萄糖。
固定化酶技术是将酶固定在固体载体上,以提高酶的稳定性和重复使用性。
本实验采用戊二醛交联法固定糖化酶,并通过测定固定化酶的活力和半衰期来评估固定化效果。
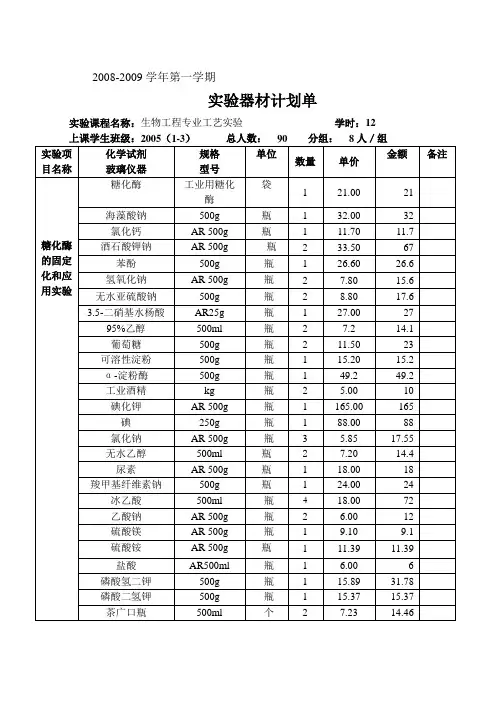
三、实验材料与仪器材料:1. 马铃薯淀粉2. 葡萄糖3. 戊二醛4. 交联剂5. 硫酸铵6. 碳酸钠7. pH试纸8. 红外测温枪9. 试管10. 烧杯11. 移液器仪器:1. 研钵2. 恒温水浴锅3. 酶标仪4. 分析天平四、实验步骤1. 酶的制备:1.1 称取适量糖化酶粉末,加入适量蒸馏水溶解。
1.2 将溶解后的酶液加入戊二醛,交联剂和硫酸铵,进行固定化处理。
1.3 将固定化酶用碳酸钠溶液洗涤,去除未固定的酶和杂质。
2. 酶活力测定:2.1 准备一定浓度的淀粉溶液,加入固定化酶,在恒温水浴锅中反应。
2.2 定时取样,用碘液检测淀粉浓度,计算酶活力。
2.3 重复实验,求平均值。
3. 半衰期测定:3.1 在恒温水浴锅中,将固定化酶与淀粉溶液混合,定时取样,测定酶活力。
3.2 以酶活力为纵坐标,时间(min)为横坐标,绘制酶活力随时间变化的曲线。
3.3 根据曲线计算半衰期。
五、实验结果与分析1. 酶活力测定结果:实验结果显示,固定化酶的活力与未固定化酶相近,说明固定化过程对酶活力影响较小。
2. 半衰期测定结果:实验结果显示,固定化酶的半衰期为30min,明显高于未固定化酶,说明固定化技术提高了酶的稳定性。
六、结论1. 糖化酶固定化技术是一种提高酶稳定性和重复使用性的有效方法。
2. 本实验中,戊二醛交联法成功固定了糖化酶,固定化酶的活力和稳定性均得到了提高。
七、实验讨论1. 实验过程中,固定化酶的活力和稳定性与固定化条件(如交联剂浓度、交联时间等)密切相关。
2. 在实际应用中,可根据需要选择合适的固定化方法和条件,以获得最佳的固定化效果。
![固定化酶的四种方法[整理版]](https://uimg.taocdn.com/b7b86d0ab6360b4c2e3f5727a5e9856a56122632.webp)
1吸附法:利用各种吸附剂将酶或含酶菌体吸附在其表面上而使酶固定的方法。
通常有物理吸附法和离子吸附法。
常用吸附剂有活性炭、氧化铝、硅藻土、多孔陶瓷、多孔玻璃等。
采用吸附法固定酶,其操作简便、条件温和,不会引起酶变性或失活,且载体廉价易得,可反复使用。
该方法最显著的优点是操作简便,但酶与载体结合不牢,极易脱落,所以它的使用受到一定的限制。
因此,人们不断尝试使用新的载体来解决这易脱落的问题。
通常,吸附法分为物理吸附法和离子吸附法。
物理吸附法:酶被载体吸附而固定的方法称为物理吸附法。
从载体对酶的适应性来看,这个方法效果是好的,酶蛋白的活性中心不易受破坏,酶的高级结构变化也不明显,但其缺点是酶与载体的相互作用较弱,被吸附的酶极易从载体表面上脱落下来,不能获得较高活力的固定化酶。
该方法常用的载体有活性炭、多孔陶瓷、纤维素及其衍生物、甲壳素及其衍生物等。
离子吸附法:将酶与含有离子交换基团的水不溶性载体以静电作用力相结合的固定化方法。
该方法的处理条件温和,且酶的高级结构和活性中心的氨基酸很少发生变化,因而可以得到较高活性的固定化酶。
采用此法固定的酶有葡萄糖异构酶、糖化酶、B一淀粉酶、纤维素酶等。
2交联法是用双功能试剂或多功能试剂进行酶分子之间的交联,使酶分子和双功能试剂或多功能试剂之间形成共价键。
常用的交联剂是戊二醛,但单用戊二醛等试剂交联制备的固定化酶活力较低,因此常将此法与吸附法、包埋法结合使用,可以达到既提高固定化酶的活力,又起到加固的效果.酶蛋白的游离氨基、酚基、咪唑基及巯基均可参与交联反应。
3载体结合法最常用的是共价结合法,即酶蛋白的非必需基团通过共价键和载体形成不可逆的连接。
在温和的条件下能偶联的蛋白质基团包括:氨基、羧基、半胱氨酸的巯基、组氨酸的咪唑基、酪氨酸的酚基、丝氨酸和苏氨酸的羟基。
参加和载体共价结合的基团,不能是酶表现活力所必需的基团。
此法曾先后用于3′-核糖核酸酶、5′-磷酸二酯酶和葡萄糖淀粉酶等的固定化。

糖化酶的生产工艺糖化酶是一种催化糖化反应的酶,可以将淀粉、纤维素等多糖分解成简单的糖类。
由于其广泛的应用于食品、饲料、制糖、生物燃料等领域,糖化酶的生产工艺变得越来越重要。
糖化酶的生产工艺一般分为以下几个步骤:1. 酶源的筛选和培养糖化酶可以从多种微生物中获得,如真菌、细菌、酵母等。
首先需要筛选出具有高效酶活性的酶源,并进行毒力测试排除可能的有害物质。
接着,将所选的酶源进行大规模培养,为后续酶的提取和纯化做准备。
2. 酶的提取和纯化培养出的菌液会经过离心等操作将酶从菌体中分离出来。
接下来,可以利用重组工程技术将酶基因引入适当的宿主细胞进行表达和分泌。
经过多次过滤、层析、浓缩等步骤,可以获得纯化后的糖化酶产品。
3. 酶活力的测试和调整酶的活力是衡量其催化能力的重要指标,因此需要对纯化后的酶进行活力测定。
如果发现酶活力较低或不稳定,可以通过改变培养条件、酶提取和纯化过程中的参数来进行调整,如改变pH值、温度、金属离子浓度等。
4. 酶的固定化处理(可选)为了提高酶在反应体系中的稳定性和重复使用性,可以将酶固定在某种载体上,如多孔陶瓷、聚合物凝胶或生物膜等。
固定化酶可以增加酶的使用寿命和催化效率,减少废液处理的复杂性。
5. 酶活性的保存和包装为了保持酶活性和延长保存期限,酶产品通常会经过冷冻干燥或冷藏等工艺进行保存。
同时,酶产品还需要进行适当的包装,以便在运输和储存过程中保护酶的完整性和稳定性。
总结起来,糖化酶的生产工艺包括酶源的筛选和培养、酶的提取和纯化、酶活力的测试和调整、酶的固定化处理以及酶活性的保存和包装等步骤。
每个步骤都需要进行精确控制,以确保酶产品的质量和稳定性。
随着科技的发展,糖化酶的生产工艺也在不断改进,可以预见未来糖化酶的生产将更加高效、环保和经济。




糖化酶的制备工艺流程英文回答:Enzyme immobilization is a widely used technique in various industries, including the production of sugar enzymes. The preparation process of sugar enzymes involves several steps, including enzyme extraction, purification, and immobilization.Firstly, the enzyme extraction process involves obtaining the enzyme from a natural source. For example, if we are preparing invertase, which is a commonly used sugar enzyme, we can extract it from yeast or bacteria. The extraction process usually involves breaking down the microbial cells and separating the enzyme from other cellular components. This can be done through various methods such as cell disruption, centrifugation, and filtration.Once the enzyme is extracted, the next step is topurify it. Purification is necessary to remove any impurities or contaminants that may interfere with the enzyme's activity. This can be achieved through techniques such as chromatography, filtration, and dialysis. For example, chromatography can separate the enzyme from other proteins or molecules based on their different properties, such as size, charge, or affinity.After purification, the enzyme needs to be immobilized. Immobilization refers to the process of attaching or confining the enzyme to a solid support, which can be a matrix or a carrier material. Immobilization offers several advantages, such as enhanced stability, reusability, and easier separation of the enzyme from the reaction mixture. There are various methods available for enzyme immobilization, including physical adsorption, covalent binding, and entrapment. For instance, physical adsorption involves the attachment of the enzyme to the surface of the support through weak interactions, such as hydrogen bonding or hydrophobic interactions.Once the enzyme is immobilized, it can be used invarious applications, such as the production of high-fructose corn syrup or the hydrolysis of sucrose in the food industry. The immobilized enzyme can be packed in a reactor or a column, and the substrate solution can be continuously passed through it. The immobilized enzyme catalyzes the desired reaction, and the product can be collected from the effluent.In conclusion, the preparation process of sugar enzymes involves several steps, including enzyme extraction, purification, and immobilization. These steps are crucialin obtaining a pure and active enzyme that can be used in various industrial applications. Immobilization offers several advantages, making it a preferred technique for enzyme production.中文回答:糖化酶的制备工艺流程包括酶的提取、纯化和固定化等几个步骤。

糖化酶的固定化实验一实验目的1、掌握制备固定化酶的方法、原理及固定化酶的特点2、在固定化糖化酶作用下测定底物糊精转化成糖的转化率二实验原理1、固定化酶(细胞),就是把游离的水溶性酶(细胞),限制或固定于某一局部的空间或固体载体上。
2、与游离酶(细胞)相比,固定化酶(细胞)具有如下优点:①容易将固定化酶(细胞)与底物、产物分开,产物溶液中没有酶(细胞)的残留,简化了提纯工艺;②可以在较长时间内反复使用,有利于工艺的连续化;③反应过程可控性提高,有利于工艺自动化和微电脑化;④在绝大多数情况下提高了酶(细胞)的稳定性;⑤较能适应于多酶反应;⑥酶的使用效率、产物得率提高,产品质量有保障。
3、酶的固定化方法:通常的固定化方法可以概括为三种:a、载体结合法b、交联法c、包埋法4、包埋法包埋法是将酶(细胞)包在凝胶微小格子内,或是将酶(细胞)包裹在半透性聚合物膜内的固定化方法。
该法的优点是:酶分子(细胞)本身不参加格子的形成,大多数酶都可用该法固定化,且方法较为简便;酶分子(细胞)仅仅是被包埋起来而未受到化学作用,故活力较高。
其缺点是不适用于大分子底物。
凝胶包埋d微胶囊包埋三固定化糖化酶催化糊精生成葡萄糖的反应固定化糖化酶催化淀粉液化产物——糊精反应生成葡萄糖。
本实验操作的工艺流程如下:糖化酶2%的淀粉溶液I I缓冲液溶解糊精I I海藻酸钠f溶解f混合…造粒…固定糖化酶颗粒…混合…催化反应pH4.6f葡萄糖标准曲线公式:还原糖(葡萄糖)计算公式思考题:1、固定化酶(细胞)的方法有哪些?并分别简要说明。
2、结合本实验说明固定床固定化酶反应器的优缺点。
点名、检查预习报告、写一份报告样本。

糖化酶固定化的研究进展姓名:王永明院系:食品化工系专业:食品生物技术班级:12食品生物技术学号:2012030119日期:2013年12月日糖化酶固定化的研究进展摘要:主要从包埋法、共价结合法、吸附法和交联法四个方面介绍了固定化糖化酶的研究进展情况,并提及其他固定化方法,论述了固定化糖化酶的稳定性的研究进展,指出了糖化酶的研究方向和发展趋势。
以及糖化酶的研究趋势。
关键词:白酒生产固定化固定化方法稳定性研究糖化酶是酶制剂工业中应用最广泛,用量传统白酒生产所使用的曲中微生物是依靠最大的一种淀粉酶,其主要作用是分解淀粉,产自然界带入的,未经筛选,其糖化力较低,生葡萄糖。
我国传统白酒的生产大多使用淀粉酸耐热性能都较差,这在客观上减弱了对杂雀质原料,一般以曲为糖化剂,成本高,出酒率危害的自卫能力。
随着白酒工业的发展,利用糖化酶代替部上的陈曲,以减少曲本身的杂菌含量,却又阶分曲,以提高出酒率,降低生产成本,已被众低了糖化力;传统白酒的制曲温度很高,如雀多白酒企业普遍采用,尤其近几年活性干酵母香型曲顶温高达65 C,有益微生物在高温下大的出现,更使糖化酶在白酒中的用量飞速增长,量死亡,必然导致糖化力的急剧下降,所以传即使一向在工艺技术上十分谨慎的名酒厂也都统白酒的用曲量很大,浓香型酒用曲量为原料在生产中使用了糖化酶,或者在丢糟中应用了的25%左右,酱香型酒高达80%左右。
然而,由于我国白酒企业的技术水平但是,用曲量也不能无限制地增加,用胜参差不齐,各种白酒的生产工艺千差万别,因量增加后,曲中杂菌数量也相应加大,不仅刘而糖化酶在我国传统白酒生产中的应用就很难出酒无益,而且对酒质有影响,行业有“曲大有一个科学规范的标准,有些企业应用时比较酒苦”之说。
所以,出于对传统白酒的香味、冈盲目,在使用的方法、用量、目的上显得很混格、质量考虑,在不彻底改变传统工艺的情次乱,最终的使用效果自然不够理想。
为了真正下,利用糖化酶改善传统白酒的糖化发酵状玩发挥科学技术第一生产力的作用,让糖化酶这提高出酒率是可行的,也是必要的。
实验2 固定化糖化酶活力的测定1 实验目的(1)学习固定化糖化酶活力的测定方法。
(2)了解糖化型淀粉酶活力大小对工艺生产的指导意义。
2 实验原理糖化型淀粉酶是一类酶的总称。
共同特点是可以将淀粉水解成麦芽糖或葡萄糖,包括淀粉β-1,4-麦芽糖苷酶(β-淀粉酶)、淀粉α-1,4-葡萄糖糖苷酶(糖化酶)和淀粉β-1,6-葡萄糖苷酶(异淀粉酶)。
本实验的研究对象是淀粉α-1,4-葡萄糖苷酶,它有催化淀粉水解的作用,从淀粉分子非还原性末端开始,分解α-1,4-糖苷键生成葡萄糖,反应生成的葡萄糖用碘量法定量测定,以表示糖化性淀粉酶的活力。
碘量法原理:淀粉经糖化酶水解生成葡萄糖,葡萄糖具有还原性,其醛基易被弱氧化剂次碘酸盐所氧化。
I2+2NaOH→NaIO+NaI+H2ONaIO+CH2OH(CHOH)4CHO→CH2OH(CHOH)4COOH+ NaI体系中加入过量的碘,氧化反应完成用硫代硫酸钠标准溶液滴定过量的碘,则可计算出酶的活力。
I2+2Na2S2O3→Na2S4O6+2NaI3 仪器和试剂3.1 主要仪器吸管(25ml、10ml、5ml、2ml)、定碘瓶、碱式滴定管、恒温水浴锅、分析天平。
3.2 试剂(1)2%可溶性淀粉称取可溶性淀粉2g(预先100℃烘干约2h至恒重),用少量蒸馏水调匀,徐徐倾入已沸的蒸馏水中,煮沸至透明,冷却定容至l00ml,此溶液需当天配制。
(2)0.2mol/L pH4.6醋酸钠缓冲液称取醋酸钠(CH3COONa·3H2O)2.72g,用蒸馏水溶解,定容至100m1。
冰醋酸(CH3COOH)1.17m1定容至100ml。
分别取醋酸钠49ml和醋酸51ml 混匀。
缓冲液以酸度计或精密试纸校正pH。
(3)20%氢氧化钠溶液(4)0.1mol/L碘液称取碘化钾35g和碘13g溶解在100m1蒸馏水中,定容至1000ml贮存于棕色瓶中。
(5)0.1mo1/L氢氧化钠溶液称取4g氢氧化钠加蒸馏水溶解,定容至1000ml。
酶固定化名词解释酶固定化,这可是个在生物化学领域里相当重要的概念呢!您知道吗?酶就像一群活跃的小精灵,在生物体内忙忙碌碌,发挥着各种神奇的作用。
但这些小精灵有时候不太听话,不太稳定,难以掌控。
这可咋办?于是,聪明的科学家们就想出了酶固定化这个妙招!那啥是酶固定化呢?简单来说,就是把这些调皮的酶小精灵给“抓”住,让它们老老实实地待在一个地方,好好干活。
打个比方,酶就像是一群到处乱跑的小孩子,精力无限但难以管理。
而酶固定化呢,就像是给这些孩子建了一个游乐场,让他们只能在这个特定的区域里玩耍,这样既方便看着他们,又能让他们的精力得到充分利用。
咱们具体来聊聊酶固定化的方法。
有一种叫做吸附法,这就好比是用一块有魔力的磁铁,把酶给吸住,让它们乖乖待在那里。
还有一种叫共价结合法,这就好像是给酶和载体之间系上了一条牢固的绳子,怎么都挣脱不开。
酶固定化有啥好处呢?这可多了去了!它能让酶重复使用,就像一把耐用的好工具,用了一次还能用第二次、第三次,多划算啊!而且还能提高酶的稳定性,让酶不再那么“娇气”,经得起各种环境的考验。
这就好比是给酶穿上了一层坚固的铠甲,让它们能在恶劣的条件下依然英勇作战。
再想想,如果没有酶固定化,那在工业生产中,得费多大的劲儿去不断获取新的酶,成本得多高啊!有了酶固定化,生产效率大大提高,产品质量也更有保障,这难道不是一件大好事吗?酶固定化在很多领域都发挥着重要作用。
在食品工业中,它能让食品加工更高效、更安全;在医药领域,能帮助生产更有效的药物;在环境保护中,能助力处理各种污染物。
所以说,酶固定化可真是个了不起的技术!它让酶变得更听话、更有用,为我们的生活带来了诸多便利和好处。
您说,这是不是很神奇呢?。
糖化酶的固定化实验一、实验目的本实验为酶工程综合实验。
由教师给定题目,学生通过查阅文献,并结合所学知识自行设计实验方案,列出所需试剂和材料及仪器等,然后在教师知道下根据自己设计的实验方案进行实验;从而培养学生独立实验的能力;并掌握酶活测定方法,米氏常数测定,学习固定化酶的常用方法及固定化酶的表征。
二、实验原理糖化酶是一种用途广泛的酶,粮食工业、食品工业、发酵工业都经常使用。
随着生物技术的迅速发展,糖化酶的生产和使用水平也有了进一步的提高。
固定化技术是近年来迅速发展的一种崭新技术,固定化酶同游离酶相比有很多优点,它开辟了酶的许多新用途。
游离酶可通过各种固定化方法,增加其稳定性并且有利于连续化生产和重复使用。
酶固定化后可用各种理化性质的变化来表征其效果。
糖化酶活力的测定采用次碘酸钠法。
糖化酶能从淀粉分子非还原性末端开始,分解α-1, 4葡萄糖苷键生成葡萄糖。
葡萄糖分子中含有醛基,能被次碘酸钠氧化,过量的次碘酸钠酸化后析出碘,再用硫代硫酸钠标准溶液滴定,由此可计算酶活力。
次碘酸钠法的原理为在碱性介质(NaOH )中,碘歧化为次碘酸钠和碘化钠,次碘酸钠氧化溶液中游离的醛基为酸基。
适当酸化,剩余的次碘酸钠与碘酸钠又生成碘,以淀粉为指示剂,用硫代硫酸钠标准溶液滴定。
根据总碘量和硫代硫酸钠的用量,可对应获得甲醛的量。
反应为: I2+2OH-=OI-+I-+H2O HCHO+OI-+OH-=HCOO-+I-+H2O OI-+I-+2H+= I2+H2O I2+2S2O32-=S4O62-+2I-米氏常数Km 为当酶促反应速度是最大反应速度一半时的底物浓度。
将米氏方程[][]S Km S Vmax v +=,两边取倒数得公式: []Vmax 1S 1Vmax Kmv1+⎪⎪⎭⎫ ⎝⎛=,此式即为Lineweaver-Burk 方程,这一线性方程,用v 1对[]S 1作图即得一条直线,直线的斜率为Km/Vmax ,1/v 的截距为1/Vmax 。
糖化酶的固定化及其在葡萄糖生产中的应用工艺姓名:吴启华 12生物工程1班学号:1214200027指导老师:柯德森、姚焱;同组者:严少杰,李海毅;时间:2015/11/30---2015/12/14摘要:利用有关固定化酶的理论和方法,研究固定化糖化酶的效率与糖化酶的浓度的关系。
本实验中测定固定化糖化酶偶联率、相对活力、活力回收来衡量其生产工艺的优劣,并探讨糖化酶的浓度对固定化效果及结合牢固程度的影响和验证固定化糖化酶催化生产葡萄糖的重复使用能力及其效率。
制备固定化糖化酶的方法为离子吸附法,并且使用DNS法测定固定化酶的活力。
结果显示:在该次实验中,固定化的效果较好;加入20g离子交换剂固定化酶的活力回收为79.1%,偶联率为90.46%,相对活力为82.58%,加入25g离子交换剂固定化酶的活力回收为85.2%,偶联率为92.76%,相对活力为92.54%。
重复使用葡萄糖固定化酶的过程中,固定化酶的利用效率降低。
酶与载体的浓度比例较高固定化酶葡萄糖生产效率高。
关键词:固定化,糖化酶,葡萄糖,酶活力1、前言:糖化酶也称葡萄糖淀粉酶(glucoamylase, EC.3.2.1.3)(淀粉-α-1,4-葡聚糖葡萄糖水解酶),它能够催化淀粉液化产物---糊精及低聚糖进一步水解成葡萄糖。
糖化酶对底物的作用是由非还原端开始,将α-1,4-键和α-1,6键逐一水解,酶作用时糖苷键在C1-6间断裂,所产生的葡萄糖为 构型,几乎100%转变为葡萄糖。
工业生产使用的糖化酶主要来自曲霉、根霉及拟内孢霉,它被广泛应用于酿酒、制糖等行业,是非常重要的酶制剂。
酶的固定化方法通常按照用于结合的化学反应的类型进行分类,大致有三种:非共价结合法(结晶法、分散法、物理吸附法及离子结合法);化学结合法(包括共价结合法及交联法);包埋法(包括微囊法及网络法)。
本实验利用离子结合法制备固定化糖化酶。
离子结合法就是酶通过离子键结合于具有离子交换基的不溶性载体的固定化方法,常用的载体有:葡聚糖凝胶、离子交换树脂、纤维素等。
本实验以离子交换树脂为载体,应用离子交换结合法制备固定化酶,该法操作简便,处理条件温和,酶的高级结构和活性中心的氨基酸残基不易被破坏,酶的活性回收率高,可反复连续生产,对稀酶有浓缩作用,载体可再生使用。
其缺点是:载体和酶的结合力弱,容易受缓冲液种类或pH的影响,在高离子强度下进行反应时,酶易从载体上脱落。
使用共价结合法不会使酶容易脱落,国外研究者已研究出用氧化锆涂层多孔玻璃或多孔陶瓷,然后硅烷化,最后用重氮基、醛基和异硫氰基衍生物偶联糖化酶,结果使酶活较高,并且能连续生产3个酶半衰期。
在此次实验中还使用用DNS法测定固定化酶、残留酶、原酶的活力。
2、材料与方法:2.1材料:(1)糖化酶液,GF-201大孔强碱阴离子交换剂,葡萄糖,可溶性淀粉(20g/L),CuSO4.5H2O,次甲基兰,酒石酸钾钠,氢氧化钠,亚铁氰化钾,乙酸,乙酸钠(配制pH4.6缓冲液),无水乙醇,盐酸。
硫代硫酸钠(0.05M),碘溶液(次碘酸钠,0.1M)。
硫酸2M。
(2)酶液、固定化酶及固定化后的残留酶液2.2实验仪器:恒温水浴锅(可达99℃,5个),酸度计(3个),容量瓶,量筒,烧杯,移液管,比色管,漏斗,玻璃棒,锥形瓶,试管架,吸耳球,pH试纸,滤纸,离心机,离心管,分光光度计等。
2.3试剂:(1)标准葡萄糖溶液(1mg/mL):精确称取100mg葡萄糖,用蒸馏水溶解并定容至100mL。
(2)3,5-二硝基水杨酸试剂:精确称取3,5-二硝基水杨酸1g,溶于20mL 2mol/L NaOH溶液中,加入50mL蒸馏水,再加入30g酒石酸钾钠,待溶解后用蒸馏水定容至100mL。
盖紧瓶塞,勿使CO2进入。
若溶液混浊可过滤后使用。
(3)0.1mol/L pH5.6的柠檬酸缓冲液A液:(0.1mol/L 柠檬酸):称取C6H8O7·H2O 21.01g,用蒸馏水溶解并定容至1L。
B液:(0.1mol/L柠檬酸钠):称取Na3C6H5O7·2H2O 29.41g,用蒸馏水溶解并定容至1L。
取A液55mL与B液145mL混匀,既为0.1mol/LpH5.6的柠檬酸缓冲液。
(4)1%淀粉溶液:称取1g淀粉溶于100mL 0.1mol/L pH5.6的柠檬酸缓冲液中。
2.4操作步骤:2.4.1.试剂的配制:糖化酶液:市售商品化糖化酶,去离子pH7的磷酸缓冲液配制,根据标称的活力单位配制为1万单位/ml的溶液,离心去除不溶性杂质,共配4000ml, 4℃备用。
2mol/L氢氧化钠:8gNaOH-----100ml,共配3000ml,2mol/LHCL:17ml浓盐酸------100ml,共配3000ml,2.4.2.固定化酶实验步骤:载体的预处理:A:乙醇处理:15克湿离子交换剂---50ml烧杯加入30ml去离子水,搅拌,倒去水。
注入2倍体积无水乙醇,乙醇浸泡过夜(12h),然后用去离子水连续冲洗以除去乙醇。
B:碱处理:2倍体积(50ml)的2mol/lNaOH浸泡并充分搅拌,再以去离子水冲至pH6.0-7.0 C:酸处理:用2倍体积的2mol/L HCl溶液处理阴离子交换树脂,然后用去离子水洗至pH6.0。
D:重复B固定化酶实验:酶的固定化:100ml糖化酶液倒入贮液槽中,加入预处理的离子交换剂20g和25g,不断轻轻搅拌,开始进行酶的固定化,30min后过滤去未固定的酶液,测量固定化酶及反应后残留酶液活性。
2.4.3.葡萄糖标准曲线的制作取7支干净的具塞刻度试管(可用封口胶代替),编号,按表1加入试剂:表1 葡萄糖标准曲线制作试剂管号1 2 3 4 5 6 7葡萄糖标准液(mL)0 0.2 0.6 1.0 1.4 1.8 2.0 蒸馏水(mL) 2.0 1.8 1.4 1.0 0.6 0.2 0葡萄糖含量(mg)0 0.2 0.6 1.0 1.4 1.8 2.03,5-二硝基水杨酸(mL)2.0 2.0 2.0 2.0 2.0 2.0 2.0摇匀,置沸水浴中煮沸5min。
取出后流水冷却,加蒸馏水定容至20mL。
以1号管作为空白调零点,在540nm波长下比色测定光密度。
以葡萄糖含量为横坐标,光密度为纵坐标,绘制标准曲线。
2.4.4.酶活力的测定:取6支干净的试管,编号,按表2进行操作。
表2 酶活力测定取样表操作项目淀粉酶活力测定固定化酶活力测量1%淀粉溶液(mL) 1.0 1.0 1.0 1.0 1.0 1.0预保温将各试管和淀粉溶液置于40℃恒温水浴中保温10min淀粉酶原液0.1 mL 0.1 mL 0.1 mL 0.2g0.2g0.2g(1,4二个空白,原酶空白和固定化酶空白的酶预先煮沸失活)保温在40℃恒温水浴中准确保温5min取反应液0.1ml,加入1.9ml水,迅速加入以下DNS 3,5-二硝基水杨酸(mL) 0 2.0 2.0 0 2.0 2.0将各试管摇匀,显色后进行比色测定光密度,记录测定结果,操作同标准曲线(煮沸,定容)。
根据以上反应吸光值的大小调整显色时加入的反应液的量,再加DNS显色,目的是使其达到合理的吸光值,以后者为准计算酶的活力。
2.5酶液浓度对固定化效率及固定化酶质量的研究方法制备固定化糖化酶,100ml糖化酶中分别加入预处理的离子交换剂20g和25g,不断轻轻搅拌,开始进行酶的固定化,30min后过滤去未固定的酶液,测量固定化酶及反应后残留酶液活性。
2.6固定化糖化酶生产葡萄糖工艺研究方法(1)制备固定化糖化酶。
(2)取20ml淀粉溶液,迅速倒入贮液槽中,控制其流出速度为1ml/min,用烧杯接流出的葡萄糖液。
测其葡萄糖含量。
(3)重复步骤(2)。
2.7结果计算在标准曲线上查出相应的葡萄糖含量(mg),按下列公式计算酶的活力。
酶活力单位(U)=1 mg葡萄糖产生量/min酶活力单位的定义:在55C,pH4.6的条件下,在上述反应体系中水解可溶性淀粉产生1μmol葡萄糖,即为一个酶活力单位。
对固定化酶以μmol/(min.mg)表示(或U/( mg));对液相酶以U/ml或μmol/(min.ml)表示。
活力回收=固定化酶总活力/加入酶总活力*100%偶联率=载体上固定的蛋白量占加入蛋白总量的百分比(加入蛋白活力-上清液蛋白活力)/加入蛋白总活力*100%相对活力=固定化酶总活力/(加入酶总活力-上清液中末偶联的酶活力)*100%计算第二次重复使用固定化酶的生产效率为第一次使用的百分比3、结果与讨论:3.1葡萄糖标准曲线表3 葡萄糖标准曲线制作(葡萄糖含量/mg)试管号 1 2 3 4 5 6 7A540 0 0.034 00.58 0.141 0.250 0.370 0.465图1 葡萄糖标准曲线3.2酶活力测定下表中试管2为稀释10倍的淀粉酶原液取0.1mL测量所得的分光值,试管3为稀释5倍淀粉酶原液取0.1mL测量所得的分光值。
表4 淀粉酶催化淀粉产生葡萄糖分光值试管号空白25g 20gA5400 0.253 0.160表5固定化酶催化淀粉产生葡萄糖分光值试管号空白25g 20gA5400 0.124 0.115表6残留酶液催化淀粉产生葡萄糖分光值试管号空白25g 20gA5400 0.168 0.130数据处理:(1)淀粉酶(原酶):试管2:葡萄糖的含量:(0.253+0.0011)/0.2344*100=110.4mg每ml酶液酶活力单位(U):110.4/5=22.88原酶液总活力单位(U):22.88*30=640.4试管3:葡萄糖的含量:(0.160+0.0011)/0.2344*100=68.2mg每ml酶液酶活力单位(U):68.2/5=13.64原酶液总活力单位(U):13.64*30=409.2(2)固定化酶:试管2:葡萄糖的含量:(0.124+0.0011)/0.2344*100=50.6mg每mL反应液酶活力单位(U):50.6/5=10.120.2g样品酶活力单位(U):10.1211g样品酶活力单位(U):10.12*11/0.2=556.6试管3:葡萄糖的含量:(0.115+0.0011)/0.2344*100=66.69mg每mL反应液酶活力单位(U):66.69/5=13.340.2g样品酶活力单位(U):13.3410.2g样品酶活力单位(U):13.34*10.2/0.2=680.19(3)残留酶液试管2:葡萄糖的含量:(0.0131+0.0011)/0.2344*110=6.66mg每ml酶液酶活力单位(U):6.66/5=1.3327mL样品酶活力单位(U):1.33*27=35.98试管3:葡萄糖的含量:(0.0152+0.0011)/0.2344*110=7.65mg每ml酶液酶活力单位(U):7.65/5=1.5327mL样品酶活力单位(U):1.53*27=41.31活力回收:试管2:固定化酶总活力/加入酶总活力*100%=556.6/686.4*100%=85.2% 试管3:固定化酶总活力/加入酶总活力*100%=680.2/745.8*100%=79.1%相对活力:试管2:固定化酶总活力/(加入酶总活力-上清液中末偶联的酶活力)*100%=556.6/(686.4-35.98)*100%=92.54%%试管3:固定化酶总活力/(加入酶总活力-上清液中末偶联的酶活力)*100%=680.2/(745.8-41.31)*100%=82.5%偶联率:试管2:(加入蛋白活力-上清液蛋白活力)/加入蛋白总活力*100%=(686.4-35.98)/686.4*100%=92.76%试管3:(加入蛋白活力-上清液蛋白活力)/加入蛋白总活力*100%=(745.8-41.31)/745.8*100%=90.46%分析以上所得结果可知:分析以上所得结果可知:加入25g交换剂固定化酶的活力回收为85.2%,偶联率为92.76%,相对活力为92.54%,加入20g交换剂固定化酶的活力回收为79.1%,偶联率为90.46%,相对活力为82.5%。