第十四章 细胞增殖调控与癌细胞
- 格式:ppt
- 大小:10.58 MB
- 文档页数:4

一、简述p34^cdc2/cyclin B蛋白激酶的发现过程。
Tim Hunt 为代表的科学家以海胆卵为材料,对细胞周期调控进行了深入研究。
JR.Evans 等人于1983年报道,在海胆卵细胞中含有两种特殊蛋白,它们的含量随周期过程变化而变化,一般在细胞间期内积累,在细胞分裂期内消失,在下一个周期有重复这一过程,因而它们将其命名为周期蛋白。
随后的研究证明:周期蛋白为诱导蛋白进入M期所必须。
各种生物之间的周期蛋白在功能上有着广泛的互补性。
将海胆cyclin B的mrna引入到非洲爪蟾卵非细胞系中,其翻译产物可诱导该非细胞体系进行多种细胞周期循环。
接下来的一系列实验提示周期蛋白可能参与MPF的功能调节。
二、举例说明CDK在细胞周期中是如何执行调节功能的?细胞周期调控包括正调控、负调控和信号反应。
CDK激酶是正调控因子,它是细胞沿周期运行的引擎蛋白。
以MPF为例阐述:MPF是一种使多种底物磷酸化的蛋白激酶,即CDK1激酶,由p34蛋白和周期蛋白B结合而成。
CDK1激酶活性首先依赖于周期蛋白B含量的积累。
周期蛋白B一般在G1期的晚期开始合成,通过S期,其含量不断增加,达到G2期,其含量达到最大值,CDK1激酶的活性随着周期蛋白B浓度变化而变化。
CDK1激酶的活化还受到激酶与磷酸酶的调节。
活化的CDK1激酶可使更多的CDK1激酶活化。
随着周期蛋白B 含量达到一定程度,CDK1激酶活性开始出现,到G2晚期阶段,CDK1激酶活性达到最大值并一直维持到M期的中期阶段。
活化的CDK1激酶促使分裂期细胞在分裂前期执行下列生化事件:(1)染色质开始浓缩形成有丝分裂染色体;(2)细胞骨架解聚,有丝分裂纺锤体开始组装;(3)高尔基复合体、内质网等细胞器解体,形成小的膜泡。
在有丝分裂的后期,活化的后期促进因子APC主要介导两类蛋白降解:后期抑制因子和有死分裂周期蛋白。
前者维持姐妹染色单体粘连,抑制后期启动;后者的降解意味着CDK1激酶失去活性,有死分裂即将结束,即染色体开始去凝集,核膜重建。


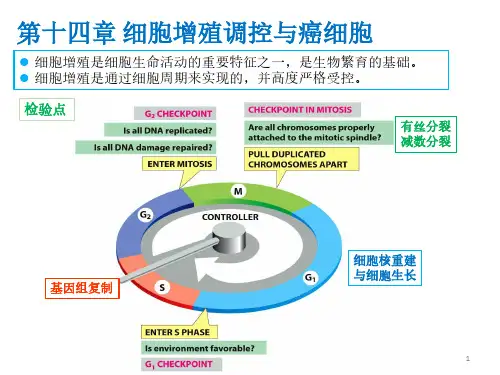


第十四章细胞增殖调控与癌细胞细胞周期的有序运转第十四章细胞增殖调控与癌细胞第一节细胞增殖调控Clock Theory Domino Theory一、MPF的发现及其作用研究背景1970s Rao和Johnson发现与M期细胞(Hela)融合的间期细胞染色体发生凝缩,称为早熟凝集染色体(prematurelycondensed chromosome,PCC)。
–G1期PCC为单线状,因DNA未复制。
–S期PCC为粉末状,因DNA由多个部位开始复制。
–G2期PCC为双线染色体,说明DNA复制已完成。
甚至不同类的M期细胞也可诱导PCC产生,说明M期细胞具有促进间期细胞进行分裂的因子,即成熟促进因子(maturation promoting factor,MPF)。
G期细胞与M期细胞融合S期细胞与M期细胞融合1G 2期细胞与M期细胞融合PCC成熟促进因子(maturation promoting factor,MPF ),早期称为M-期促进因子(M-phase promoting factor, MPF),是指M期细胞中存在的促进细胞分裂的因子MPF的发现及组成卵细胞提取物注射实验把M 期细胞的细胞质注射到卵细胞,发现可以促进卵细胞成熟分裂,继续用该卵细胞细胞质诱导新的卵细胞,仍然可以促进卵细胞成熟分裂。
因而他们推测M 期细胞中必然有一种物质可以诱导卵细胞成熟分裂,即促细胞成熟因子(maturation promoting factor, MPF )。
1960s Leland Hartwell,1970s Paul Nurse 以芽殖酵母和裂殖酵母为实验材料,利用温度敏感突变株,发现许多与细胞分裂有关的基因(cell division cycle gene, CDC)。
如:–裂殖酵母cdc2、芽殖酵母cdc28突变型在限制温度下无法分裂;–wee1突变型则提早分裂,cdc25突变型细胞体积增大而不分裂;–cdc2和cdc28都编码一个34KD的蛋白激酶,促进细胞周期的进行,weel和cdc25分别表现为抑制和促进CDC2的活性。



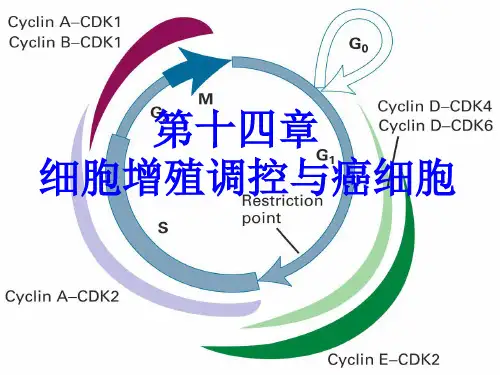
细胞13.细胞增殖调控与癌细胞●细胞增殖调控●调控因子●mitosis-promoting factor, MPF 细胞有丝分裂促进因子定义:也称卵细胞成熟促进因子或M期促进因子,是催化亚基cdc2蛋白和调节亚基周期蛋白共同组成的蛋白质复合物,具有蛋白激酶活性,促进细胞从G_2期进入M期●(1970年)Johnson&Rao将Hela细胞的M期细胞与间期细胞融合,发生了形态各异的早熟染色体凝缩(premature chromosome condensation, PCC)早熟凝缩染色体定义:将M期细胞与G_1、S、G_2期细胞融合并继续培养一定时间后,融合细胞的染色体提前凝缩,形态各异G_1期PCC为细单线S期PCC为粉末状G_2期PCC为双线染色体状提示可能存在诱导染色体凝缩的因子●(1971年)Masui&Markert,非洲爪蟾卵,孕酮刺激生发泡破裂注射诱导卵母细胞成熟●p34^{Cdc2}激酶(MPF的催化亚单位)●Cdc2:CDC基因调控酵母细胞分裂和细胞周期,Cdc2是第一个被分离出来的CDC基因,Cdc2基因突变导致细胞停留在G_2/M期交界处●p34^{Cdc2}是Cdc2基因的表达产物,具有蛋白激酶活性,在裂殖酵母细胞周期调控过程中促进G_2/M期转换●Cdc28:芽殖酵母中的一个关键性CDC基因,其产物p34^{Cdc28}也是一种蛋白激酶,调节G_2/M期和G_1/M期转换●验证得知p34^{Cdc2}是MPF的同源物●本身不具有激酶活性,只有当其与有关蛋白质结合后,其激酶活性才能够表现出来●cyclin 周期蛋白(MPF的调节亚单位)定义:在细胞中的含量随细胞周期进程变化而变化的蛋白质,对细胞周期循环具有调节作用●分类●G_1期周期蛋白定义:某些只在G_1期表达并只在G_1期和S期转化过程中执行调节功能的周期蛋白,如cyclin C、D、E、Cln1、Cln2、Cln3等●M期周期蛋白定义:某些虽然在间期表达和积累,但到M期时才表现出调节功能的周期蛋白,如cyclin A、B等●特点●存在时间:G_1期周期蛋白在细胞周期中存在的时间相对较短,M期周期蛋白在细胞周期中则相对稳定●结构●均含有一段相当保守的氨基酸序列,成为cyclin box 周期蛋白框,其功能是介导周期蛋白与CDK结合●M期周期蛋白近N端含有一段由9个氨基酸残基组成的特殊序列,称为destruction box 破坏框,参与泛素依赖性的cyclin A、B的降解●G_1期周期蛋白分子中不含破坏框,但其C端含有一段特殊的PEST序列,与G_1期周期蛋白的更新有关●与CDK结合特点:不同的周期蛋白在细胞周期中表达的时期不同,并与不同的CDK结合,调节不同的CDK活性●cyclin A在G_1期的早期即开始表达并逐渐积累,到达G_1/S期交界处,其含量达到最大值并一直维持到G_2/M期●cyclin B从G_1期的晚期开始表达并逐渐积累,到G_2期后期阶段达到最大值并一直维持到M期的中期阶段,然后迅速降解●cyclin D在细胞周期中持续表达●cyclin E在M期的晚期和G_1期早期开始表达并逐渐积累,到达G_1期的晚期其含量达到最大值,然后逐渐下降,到达G_2期的晚期,其含量降到最低值●cyclin-dependent kinase, CDK 周期蛋白依赖性蛋白激酶、(CKI)CDK抑制因子●CDK定义:可以与周期蛋白结合,并以周期蛋白作为调节亚单位,表现出蛋白激酶活性●mitosis-promoting factor, MPF 细胞有丝分裂促进因子是一种CDK(CDK1)●特点●各种CDK分子均含有一段类似的CDK激活结构域●不同的CDK所结合的周期蛋白不同,在细胞周期中执行的调节功能也不相同●细胞内存在多种因子,修饰CDK的分子结构,参与CDK活性的调节●CKI:对CDK活性起负调控的蛋白质●细胞周期运转调控●G_2/M期检查点(cyclin B-Cdk1)●Cdk1(MPF)由p34^{Cdc2}和cyclin B(A)结合而成●p34^{Cdc2}在细胞周期中的含量相对稳定,主要变化在于周期蛋白含量●(主)cyclin B(A)的含量呈现周期性变化在G_1期的晚期开始合成,通过S期,其含量不断增加,到达G_2期,其含量达到最大值●(副)进一步的修饰:在Wee1/Mik1激酶和CDK活化激酶作用下发生3次磷酸化,在蛋白磷酸水解酶Cdc25C作用下发生2次去磷酸化三个磷酸化位点:Thr14、Tyr15、Thr161 Thr161位点保持磷酸化使Cdk1活性表现所必需的●下游作用使某些底物蛋白磷酸化,改变其下游的某些靶蛋白的结构和启动其功能,实现其调控细胞周期的作用●磷酸化组蛋白H1:促进染色质凝缩●磷酸化核纤层蛋白:促使核纤层解聚●磷酸化核仁蛋白:促使核仁解体●磷酸化p60^{c-Src}蛋白:促使细胞骨架重排●磷酸化c-Abl蛋白:促使细胞形态调整●中/后期检查点(APC)●anaphase-promoting complex, APC 后期促进复合物●定义:在分裂间期表达,M期表现出活性,可以调节M期周期蛋白泛素化依赖降解途径,以及其他一些与细胞周期调控有关的非周期蛋白类蛋白质的降解●在APC的作用下,M期cyclin A&B通过泛素化依赖途径被蛋白酶体降解这一过程中破坏框起着重要的调节作用●Mad2的负调控作用(有丝分裂中后期转换)Cdc20能活化APC并降解抑制分离酶的securin,进而导致中后期转换●Mad2定位在早中期和错误排列的中期染色体的动粒上,纺锤体组装不完全,动粒不能被动粒微管捕捉,Mad2则不能从动粒上解离下来●当纺锤体组装完成以后,动粒全部被动粒微管捕捉,Mad2从动粒上消失,从而解除对Cdc20的抑制作用,促使APC活化,导致M期周期蛋白降解●G_1/S期检查点(cyclin E/A-Cdk2、cyclin D-Cdk4/6)●主要的G_1期周期蛋白-CDK●cyclin D-Cdk4/6●cyclin D为细胞G_1/S期转化所必需●Cdk4/6的底物Rb蛋白是转录因子E2F的抑制因子,是G_1/S期转化的负调控因子,在G_1期的晚期阶段通过磷酸化而失活如果细胞Rb突变,失去对E2F的抑制,使细胞无法停留在G_1期,会导致细胞过度增殖●cyclin E-Cdk2●主要出现在G_1期晚期到S期的早期阶段,为S期启动所必需●transforming growth factor β, TGFβ 转化生长因子β可以有效地抑制cyclin E-Cdk2活性,进而将细胞阻止在G_1期●cyclin E-Cdk2与类Rb蛋白p107和E2F结合形成复合物,Cdk2催化p107磷酸化,使其不能抑制E2F,E2F促进有关基因的转录,促使细胞周期由G_1期向S期转化●cyclin A-Cdk2●cyclin A的合成开始于G_1/S期转化时期●进入S期后,cyclin A-Cdk2激酶成为该时期主要的CDK●cyclin A-Cdk2与DNA复制有关,位于DNA复制中心●G_1期周期蛋白通过SCF泛素化途径降解●同时需要G_1期CDK活性的参与●SCF具有E3泛素连接酶的功能,它可以被F-box蛋白活化,进而催化底物蛋白的泛素化●其他DNA复制起始活动的调控●DNA复制起始点的识别(ORC、Cdc6、Cdc45)●DNA复制执照因子学说(Mcm蛋白)●S/G_2/M期转换与DNA复制检查点将细胞停滞在S期和G_2/M期●intra-S phase checkpoint S期内部检查点定义:在S期内发生DNA损伤如DNA双链发生断裂时,S期内部检查点被激活,从而抑制复制起始点的启动,使DNA复制速度减慢,S期延长,同时激活DNA修复和复制叉的恢复等机制●通过染色体结构维持蛋白Smc1的磷酸化,从而实现S期的延长●通过ATM/ATR介导的Cdc25A磷酸酶过磷酸化而降解,从而抑制cyclinE/A-Cdk2活性●replication checkpoint DNA复制检查点由于停滞的复制叉导致的S期的延长的机制,主要是由ATR/Chk1激活来介导的●ATR/Chk1介导Cdc25A降解进而抑制cyclin E/A-Cdk2的通路,减缓整体DNA复制的效率●DNA损伤检查点p53含量提高→ p21表达→ cyclin E-CDK2失活●抑癌基因p53表达产物p53蛋白对细胞增殖起负调节作用●调控机制:p53本在细胞中含量极少(被Mdm2泛素化降解),DNA受损后,Chk1&Chk2使p53磷酸化并与Mdm2解离,p53蛋白浓度上升,作为转录因子调控p21表达,使cyclin E-Cdk2失活,不能进入S期●多细胞生物:若DNA无法修复,则发生p53介导的细胞凋亡●癌细胞●cancer cell 癌细胞●定义:脱离了细胞社会制约,表现出细胞增殖失控,并且有侵袭和转移等特征的细胞,癌细胞会破坏组织和器官的正常生理功能●分类●tumor cell 肿瘤细胞动物体内因细胞分裂调节失控而无限增殖的细胞●malignancy 恶性肿瘤具有转移能力的肿瘤●cancer 癌源于上皮组织的恶性肿瘤●benign tumor 良性肿瘤分裂缓慢,具有结缔组织包膜而不扩散的肿瘤●基本特征●细胞生长与分裂失去控制癌细胞失去控制,称为“不死”的细胞,核质比例增大,分裂速度加快,破坏了正常组织的结构与功能●具有浸润性和扩散性癌细胞细胞间黏着性下降,易于浸润周围健康组织,或通过血液循环和淋巴途径转移并在其他部位黏着和增殖。
细胞周期调控与癌细胞增殖抑制细胞是生命的基本单位,具有自我复制和分化的能力。
正常细胞的增殖受到严格的调控,以保持组织和器官的稳态。
然而,在癌症中,这种调控机制发生了异常变化,导致癌细胞无限增殖并形成恶性肿瘤。
了解细胞周期调控与癌细胞增殖抑制之间的关系对于癌症治疗非常重要。
一、细胞周期调控的概述1. 细胞周期是指一个完整的细胞生命周期,包括从某个特定时刻开始直到其分裂为两个新生物体。
2. 细胞周期包括四个阶段:G1期(第一次生长期)、S期(DNA复制期)、G2期(第二次生长期)和M期(有丝分裂期)。
3. 细胞周期调控主要由多个蛋白激酶、蛋白激酶抑制剂和转录因子等调节因子共同作用完成。
4. 关键调控点包括G1/S转变处、G2/M转变处和M期的控制点,通过这些关键调控点,细胞周期得以严格控制。
二、癌细胞增殖过程中的异常细胞周期调控1. 高度失控的增殖:癌症细胞通过无限增殖、忽略外界信号和形成肿瘤来表现出对细胞周期调控失效。
2. 细胞周期检查点缺陷:某些癌症类型存在着与特定阶段检查点相关的突变,导致DNA损伤未能引发阻滞性减数分裂,使异常细胞得以存活和扩张。
3. 增强正常通路活性:研究表明,一些关键细胞周期调节蛋白在肿瘤中被过度表达或激活,从而促进异常增殖。
同时,异常信号传导也可以通过上调这些蛋白来促进癌症发展。
三、抑制癌细胞增殖的策略1. 靶向关键维持恶性转化所需功能的基因和蛋白质:如靶向TGF-beta信号通路、EGFR、HER2等相关分子,可以有效阻断癌细胞的生长和扩散。
2. 激活抗癌免疫应答:通过激发机体自身免疫系统,以克服肿瘤组织对宿主的免疫逃避和耐受性。
3. 抑制血管生成:肿瘤细胞通常具有促进血管生成的能力,靶向这些信号通路可以阻断癌细胞对氧气和营养物质的供应,限制其生长和扩散能力。
4. 抑制癌基因表达:通过RNA干扰技术或药物靶向转录因子等方式来阻断或降低癌基因在癌细胞中的表达。
四、细胞周期调控与治疗创新1. 组合治疗策略:针对多个调控位点同时使用治疗手段,可以增加治愈概率并减少药物抵抗性。
细胞周期调控与癌细胞增殖的联系细胞周期调控是维持正常细胞生长和分裂的关键机制之一。
准确无误的细胞周期调控是细胞代谢和生长的基础,也是细胞增殖的关键步骤。
然而,当某些异常事件发生,例如遗传突变或外部因素的侵袭,细胞周期调控可能失去平衡,导致癌细胞的不受控制的增殖。
本文将探讨细胞周期调控与癌细胞增殖之间的联系,并着重介绍几种常见的调控机制。
细胞周期分为四个主要阶段:G1阶段(细胞增长阶段)、S阶段(DNA 复制阶段)、G2阶段(前期)和M阶段(有丝分裂)。
这些阶段由多个调控因子和分子互相配合,确保细胞在合适的时间和环境下进行一系列的代谢和分裂过程。
一个重要的细胞周期调控机制是Rb蛋白(Retinoblastoma,遗传疾病)的功能。
在G1阶段,Rb蛋白与转录因子E2F结合,阻止细胞进入S阶段。
一旦细胞接受到外部刺激或内部信号,Rb蛋白被磷酸化并失去抑制E2F的作用,细胞便进入S阶段开始DNA的复制。
然而,在某些癌症中,Rb基因发生突变或功能缺陷,导致Rb蛋白无法正常发挥阻止细胞增殖的作用,进而使癌细胞无法受约束地增殖。
另一个重要的调控因子是p53蛋白。
p53蛋白作为一种转录因子,在细胞受到DNA损伤或其他压力时被激活。
一旦激活,p53蛋白能够抑制细胞周期的进展,通过调控相关基因的表达,如p21,从而启动细胞凋亡或修复受损的DNA。
然而,在许多癌症中,p53基因发生突变,导致p53蛋白功能失常。
这使得癌细胞能够逃避受损DNA的修复和凋亡信号,进而继续不受控制地增殖。
除了Rb蛋白和p53蛋白,细胞周期调控中还涉及一系列激活和抑制蛋白质的变化。
这些蛋白质包括细胞周期蛋白依赖性激酶(CDK)和其配体细胞周期蛋白(Cyclin)。
CDK与Cyclin结合形成复合物,通过相互作用和磷酸化调节细胞周期的进行。
当细胞准备进入下一个阶段时,特定的Cyclin将被合成并与CDK结合,促进细胞周期的进展。
然而,在某些癌症中,CDK或Cyclin的功能受到突变或异常表达的影响,导致细胞周期的失调和癌细胞的无限增殖。
细胞增殖及其在癌症发生中的作用分析细胞增殖是一个复杂的生物学过程,它使原始单个细胞分裂成两个或更多细胞。
此过程十分重要,因为对于生命的生长、修复和更新都扮演着关键的角色。
但是,如果细胞增殖过程被扭曲或失调,无限制的细胞分裂可能会导致一系列的疾病,包括癌症。
细胞增殖的调控细胞增殖的调控是一个高度复杂的过程,需要许多不同的信号和因素的相互作用。
其中两种重要的调节因子是细胞周期和细胞增殖信号。
细胞周期涉及四个不同的阶段:G1、S、G2和M期。
在G1期,细胞获得必要的营养和生长因子,以为接下来的S期做好准备。
在S期,细胞增殖到DNA复制的阶段。
在G2期,细胞开始准备进入M期,核分裂和细胞分裂的阶段。
细胞增殖涉及许多生物分子的复杂互动,特别是细胞增殖信号。
生长因子和反义肽是细胞增殖信号的一部分,它们会通过与细胞表面上的受体相互作用,从而影响细胞增殖。
激素、神经递质和细胞因子等细胞增殖信号也能够通过细胞表面受体发挥同样的作用。
许多蛋白激酶也在细胞增殖调控中扮演重要的角色,包括MAPK和PI3K-Akt等。
这些激酶的一个常见作用就是在细胞外环境和内环境之间进行信号转导。
癌症细胞癌症是一种体内发生细胞突变的疾病。
癌症细胞继续增殖并扩散,导致脏器和组织的破坏。
癌症细胞的独特特征是它们能够无限制地增殖。
癌细胞的DNA突变可能导致癌症发生,而这些DNA突变可能是由不同的因素引起的,包括遗传、环境和生活方式因素等。
例如,吸烟、酗酒、过度暴露于紫外线和接触致癌物质等因素可能会导致癌症发生。
癌症细胞与正常细胞不同的一点是,它们忽略了体内的细胞周期和细胞增殖信号以及其他控制因素。
这意味着,癌症细胞可以无限制地分裂和增殖,导致肿瘤的形成。
除了无限制的细胞增殖,癌症细胞还具有不同的形态、结构和生理特征,与正常细胞不同。
治疗癌症在过去的几十年里,人们对癌症的治疗方法已经取得了重大进展。
这包括传统的化疗、放疗和手术治疗,同时也涉及到靶向治疗和免疫疗法等。
细胞增殖与癌症研究细胞增殖是细胞分裂和增殖的过程,是生物体生长和发育的基础。
然而,当细胞增殖失控时,会导致癌症的发生。
癌症是一种恶性肿瘤,以不受控制的细胞增殖和恶性转移为特征,成为全球范围内最常见的疾病之一、因此,深入研究细胞增殖与癌症之间的关系,对于癌症的预防和治疗具有重要意义。
细胞增殖正常受到调控,其中关键的分子是细胞周期蛋白依赖激酶(CDK)与细胞周期蛋白(Cyclin)复合物。
CDK与Cyclin复合物促进细胞周期的进行,从而让细胞可以顺利进入细胞分裂的过程。
另一个重要的调控因子是肿瘤抑制基因p53,它在细胞受到DNA损伤时可以停止细胞增殖,保护细胞免受进一步的损伤。
然而,癌症中常常出现细胞周期调控异常或p53抑制失效的情况,导致细胞不受控制地增殖。
细胞增殖与癌症的研究中,一项重要的发现是肿瘤抑制基因和促癌基因的突变。
肿瘤抑制基因是一类正常的细胞基因,它们通过调节细胞周期以及DNA修复等机制来抑制肿瘤的发生。
突变会导致肿瘤抑制基因失去功能,从而不能有效地抑制细胞增殖。
促癌基因是另一类与细胞增殖紧密相关的基因,它们通过增强细胞增殖或抑制细胞凋亡来促进肿瘤发生。
这些突变使得细胞无法正常停止增殖,最终导致癌症的发生。
近年来,细胞增殖与癌症研究已取得了许多重要的进展。
例如,研究人员发现了一些与细胞增殖相关的调控信号通路,如细胞表面受体与细胞内信号通路之间的交互作用,这些通路可以调节细胞增殖和凋亡。
另外,针对癌症的新型治疗策略也在不断地发展,如靶向肿瘤细胞的药物、免疫疗法以及基因治疗等。
这些新的治疗手段有望在未来为癌症的治疗提供更多的选择。
总之,细胞增殖与癌症是一个复杂的研究领域,深入探索其机制对于癌症的预防和治疗具有重要意义。
随着研究的不断深入,相信我们能够更好地理解细胞增殖与癌症之间的关系,并为癌症的治疗提供更有效的策略。