化学8个实验活动
- 格式:ppt
- 大小:5.99 MB
- 文档页数:46
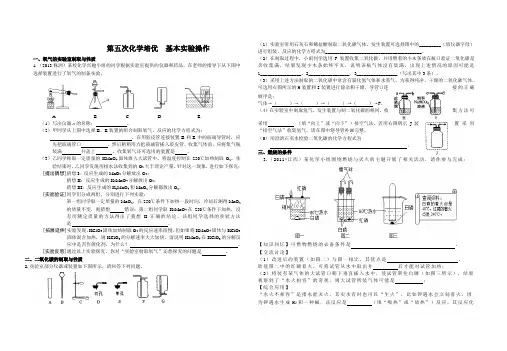
第五次化学培优基本实验操作一、氧气的实验室制取与性质1.(2013株洲)某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验。
A B C D E(1)写出仪器a的名称:。
(2)甲同学从上图中选择B、E装置的组合制取氧气,反应的化学方程式为:。
在用胶皮管连接装置B和E中的玻璃导管时,应先把玻璃管口,然后稍稍用力把玻璃管插入胶皮管。
收集气体前,应将集气瓶装满并盖上。
收集氧气还可选用的装置是。
(3)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2。
实验结束时,乙同学发现用排水法收集到的O2大于理论产量。
针对这一现象,进行如下探究:[提出猜想]猜想I:反应生成的MnO2分解放出O2;猜想II:反应生成的K2MnO4分解放出O2;猜想III:反应生成的K2MnO4和MnO2分解都放出O2。
[实验验证]同学们分成两组,分别进行下列实验:第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜想错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想II正确的结论。
该组同学选择的实验方法是。
[拓展延伸]实验发现,KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快。
请说明KMnO4在KClO3的分解反应中是否作催化剂,为什么?。
.增加适量氯化钠固体11.(2013苏州)下列有关仪器图示与名称吻合的是((1)操作①②③的名称依次是___________、___________、____________,在实施操作①前需先将粗A.锥形瓶B.酒精喷灯C.长颈漏斗D.药匙苏州)下列有关玻璃棒作用的描述错误的是( )应生成的碳酸又很不稳定,可用排水法收集CO2。

化学实验八个探究步骤化学实验是化学学科中非常重要的一部分,通过实验可以帮助学生巩固理论知识,培养实验操作能力,培养动手能力和观察力。
在化学实验中,探究是一种非常重要的实践方法,它能够培养学生的实验思维能力和探究精神。
化学实验的探究步骤可以帮助学生更好地进行化学实验,并获得更好的实验效果。
首先,在进行化学实验时,首先要明确实验的目的和具体内容,明确自己想要探究的问题是什么。
其次,要做好实验前的准备工作,包括准备好实验所需要的物质和仪器设备,检查仪器设备是否完好,确保实验安全。
在实验进行过程中,要按照实验步骤依次进行实验操作,并注意实验的方法和技巧。
在操作过程中要认真观察实验现象,并及时做好记录,包括观察到的现象和实验数据。
同时,要注意实验中可能会出现的问题和风险,并采取相应的措施进行应对,确保实验安全。
实验结束后,要及时整理实验数据,进行数据分析和结果总结,分析实验结果与理论知识的关系,并提出自己的看法和建议。
通过实验探究,学生可以深入理解化学知识,加深对化学实验过程的理解,提高实验技能和实验操作能力。
在化学实验的探究中,要注重培养学生的创新思维和实践能力,激发学生的学习兴趣和学习动力。
通过化学实验的探究,学生可以更好地理解和掌握化学知识,提高自己的实验技能和动手能力,培养良好的实验习惯和科学素养。
梳理一下本文的重点,我们可以发现,化学实验的探究是化学学科教学中非常重要的一环,可以帮助学生更好地理解和掌握化学知识,提高实验技能和实践能力。
教师应该引导学生积极参与化学实验的探究活动,激发学生的学习兴趣和学习动力,促进学生全面发展。
希望未来在化学实验的探究中,学生能够不断提高自己的实验技能和实践能力,培养自己的创新思维和动手能力,为将来的学习和科研打下坚实的基础。


初中化学八个基础实验教案
实验目的:通过测试酸碱中性溶液的性质,了解各种溶液的特点。
实验原理:利用酸碱指示剂的变色性质,对溶液进行酸碱中性测试。
实验器材:酸碱指示剂、试管、试管架、滴管、盐酸、氢氧化钠溶液、红、蓝、紫色试纸等。
实验步骤:
1. 将红、蓝、紫色试纸分别浸入不同的溶液中,观察试纸的变色情况。
2. 将几滴酸碱指示剂滴入试管中的盐酸溶液,观察溶液的颜色变化。
3. 将几滴酸碱指示剂滴入试管中的氢氧化钠溶液,观察溶液的颜色变化。
4. 根据颜色变化情况,判断各溶液的酸碱性质。
实验注意事项:
1. 酸碱指示剂使用时要小心操作,以免误触皮肤。
2. 实验结束后记得及时清洗试管和其他器材。
3. 酸碱中性溶液测试实验应在老师的指导下进行,注意安全防护。
预期结果:盐酸溶液为酸性,颜色会变红;氢氧化钠溶液为碱性,颜色会变蓝;中性溶液颜色保持不变。
实验结论:通过测试各溶液的酸碱性质,我们可以确定它们的性质,并了解酸碱中性溶液的特点。
这有助于我们在化学实验中正确判断不同溶液的pH值,从而进行正确的实验操作。


化学家庭小实验简单一点点
当涉及到在家进行化学实验时,安全是最重要的考虑因素。
以下是一些简单的家庭化学实验,可以在家中使用常见的材料进行:
1. 泡泡实验,你可以制作自己的泡泡液。
混合洗洁精和水,然后用吸管吹出泡泡。
你可以尝试加入食用色素或者尝试用不同比例的洗洁精和水来观察泡泡的变化。
2. 醋和小苏打,将一些小苏打粉倒入杯子中,然后慢慢加入一些醋。
你会看到产生大量的气泡,这是因为醋和小苏打发生了化学反应产生了二氧化碳气体。
3. 酸碱指示剂,用红甘蓝汁或者蓝莓汁做成酸碱指示剂。
将它们滴在醋和苏打水溶液中,观察颜色的变化。
这是因为酸碱指示剂会根据溶液的酸碱性发生颜色变化。
4. 铁和醋,将一些铁钉放入醋中,观察铁钉表面的氧化反应。
这个实验可以帮助你理解金属的腐蚀过程。
这些实验都很简单,但在进行任何实验之前,请确保有成年人
的指导和监督。
同时,注意安全,避免接触到有毒或危险的化学物质。
希望这些实验能够激发你对化学的兴趣!。
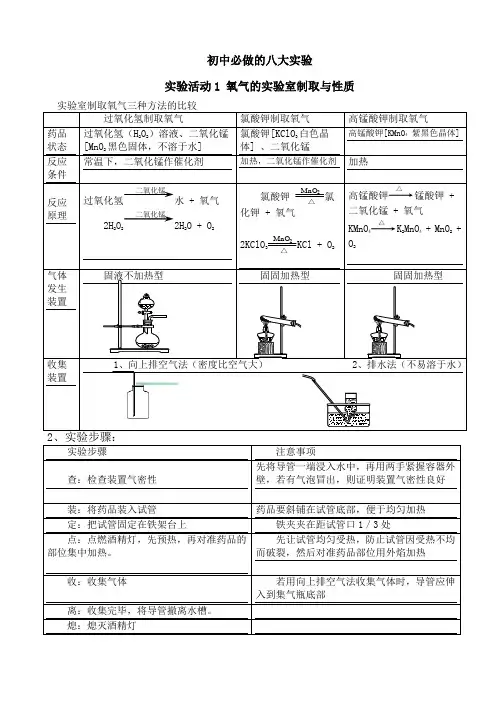
初中必做的八大实验实验活动1 氧气的实验室制取与性质过氧化氢制取氧气 氯酸钾制取氧气 高锰酸钾制取氧气药品状态 过氧化氢(H 2O 2)溶液、二氧化锰[MnO 2黑色固体,不溶于水] 氯酸钾[KClO 3白色晶体] 、二氧化锰高锰酸钾[KMnO 4 紫黑色晶体]反应条件 常温下,二氧化锰作催化剂 加热,二氧化锰作催化剂 加热反应原理过氧化氢水 + 氧气 2H 2O 22H 2O + O 2氯酸钾MnO 2 △氯化钾 + 氧气2KClO 3MnO 2 △KCl + O 2高锰酸钾△锰酸钾 +二氧化锰 + 氧气KMnO 4△K 2MnO 4 + MnO 2 +O 2气体发生装置固液不加热型固固加热型固固加热型收集装置1、向上排空气法(密度比空气大)2、排水法(不易溶于水)实验步骤注意事项查:检查装置气密性 先将导管一端浸入水中,再用两手紧握容器外壁,若有气泡冒出,则证明装置气密性良好 装:将药品装入试管 药品要斜铺在试管底部,便于均匀加热定:把试管固定在铁架台上铁夹夹在距试管口1/3处点:点燃酒精灯,先预热,再对准药品的部位集中加热。
先让试管均匀受热,防止试管因受热不均而破裂,然后对准药品部位用外焰加热收:收集气体若用向上排空气法收集气体时,导管应伸入到集气瓶底部离:收集完毕,将导管撤离水槽。
熄:熄灭酒精灯二氧化锰 二氧化锰3、收集方法:(1)排水法(氧气不易溶于水)(2)向上排空气法(氧气密度比空气大)4、检验方法:将带火星的木条深入到集气瓶中,若木条复燃说明是氧气5、验满方法:(1)用排水法收集时,如果集气瓶口有大气泡冒出时说明收集满(2)向上排空气法,用带火星的木条放在集气瓶口若木条复燃证明集满。
6、放置方法:盖上玻璃片并正放7、操作注意事项a.试管口应略向下倾斜(防止冷凝的水倒流到试管底部,使试管炸裂)b.导管伸入试管内不宜太长(便于气体排出)c.用排水法收集时,应注意当气泡连续均匀冒出时再收集d.停止反应,应先把导管从水槽中撤出,再熄灭酒精灯。
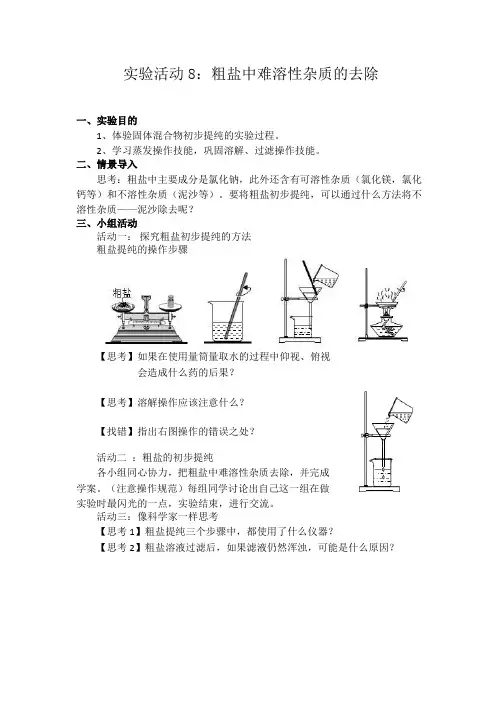
实验活动8:粗盐中难溶性杂质的去除
一、实验目的
1、体验固体混合物初步提纯的实验过程。
2、学习蒸发操作技能,巩固溶解、过滤操作技能。
二、情景导入
思考:粗盐中主要成分是氯化钠,此外还含有可溶性杂质(氯化镁,氯化钙等)和不溶性杂质(泥沙等)。
要将粗盐初步提纯,可以通过什么方法将不溶性杂质——泥沙除去呢?
三、小组活动
活动一:探究粗盐初步提纯的方法
粗盐提纯的操作步骤
【思考】如果在使用量筒量取水的过程中仰视、俯视
会造成什么药的后果?
【思考】溶解操作应该注意什么?
【找错】指出右图操作的错误之处?
活动二:粗盐的初步提纯
各小组同心协力,把粗盐中难溶性杂质去除,并完成
学案。
(注意操作规范)每组同学讨论出自己这一组在做
实验时最闪光的一点,实验结束,进行交流。
活动三:像科学家一样思考
【思考1】粗盐提纯三个步骤中,都使用了什么仪器?
【思考2】粗盐溶液过滤后,如果滤液仍然浑浊,可能是什么原因?
【思考3】本实验提取得到的精盐是否是纯净物?是否可能还含有其他杂质?说出你判断的理由?
请同学们思考:如果我们想进一步除去粗盐中的可溶性物质(MgCl2、CaCl2等),你有什么办法吗?。
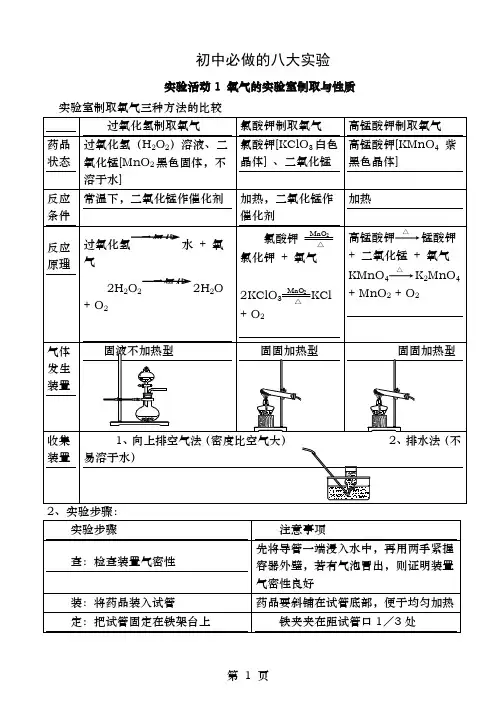
初中必做的八大实验实验活动1 氧气的实验室制取与性质实验室制取氧气三种方法的比较(2)向上排空气法(氧气密度比空气大)4、检验方法:将带火星的木条深入到集气瓶中,若木条复燃说明是氧气5、验满方法:(1)用排水法收集时,如果集气瓶口有大气泡冒出时说明收集满(2)向上排空气法,用带火星的木条放在集气瓶口若木条复燃证明集满。
6、放置方法:盖上玻璃片并正放7、操作注意事项a.试管口应略向下倾斜(防止冷凝的水倒流到试管底部,使试管炸裂)b.导管伸入试管内不宜太长(便于气体排出)c.用排水法收集时,应注意当气泡连续均匀冒出时再收集d.停止反应,应先把导管从水槽中撤出,再熄灭酒精灯。
防止水槽中水倒流,使试管炸裂e.若用高锰酸钾制氧气,试管口要放一团棉花(防止高锰酸钾粉末堵塞导管)实验活动2、二氧化碳的实验室制取与性质实验用品:药品:石灰石、稀盐酸、澄清石灰水仪器:锥形瓶、长颈漏斗、导管、橡皮塞、集气瓶、玻璃片实验室制取二氧化碳的装置:往锥形瓶中装入石灰石,在长颈漏斗中注入盐酸,使盐酸注入锥形瓶中,以浸没石灰石为宜。
石灰石表明出现大量气泡石灰石主要成分是碳酸钙碳酸钙+盐酸→氯化钙+水+二氧化碳用向上排空气法收集气体二氧化碳密度比空气大检验气体是否集满:用燃着的木条放在集气瓶口火焰熄灭说明二氧化碳已经集满注意事项:实验室制取二氧化碳的试剂特点(1)制备二氧化碳的盐酸不宜太浓,否则从盐酸里会挥发出氯化氢气体,使制得的二氧化碳不纯,有时还会影响实验的结果。
(2)不宜使用硫酸与石灰石来制取二氧化碳,因为硫酸与碳酸钙反应后生成溶解性较小的硫酸钙,会覆盖在石灰石表面从而阻止反应的继续进行。
(3)如果使用长颈漏斗,最好不要使用纯净的碳酸钙或碳酸钠。
因为使用纯度高的碳酸钙或碳酸钠会造成反应过快,不宜控制。
但是将长颈漏斗改成分液漏斗(控制速度),就可以使用纯度高的碳酸钙或碳酸钠来制取二氧化碳了。
3.误点评析(1)长颈漏斗下口没有伸入液面下(液封),会导致二氧化碳从长颈漏斗逸出。

初三化学实验操作
在初中化学实验中,我们将学到许多有趣的知识,也能亲自动手进行实验操作,体验科学的魅力。
下面就让我们一起来了解一些初三化学实验操作吧。
1. 铁与硫的化学反应
我们可以进行铁与硫的化学反应实验。
首先将一些铁屑和硫粉混合在一起,然后放入试管中并加热。
在试管口放一块过滤纸,当试管内开始冒出白烟时,将这块过滤纸放在试管口,可以观察到过滤纸变为黑色,这是因为硫与铁发生了化学反应,生成了硫化铁。
2. 酸碱中和反应
另一个常见的实验是酸碱中和反应。
我们可以取一些稀盐酸溶液和氢氧化钠溶液,将它们混合在一起,观察到溶液变为中性,产生氯化钠和水。
这是因为酸和碱之间发生了中和反应。
3. 金属与酸的反应
我们也可以进行金属与酸的反应实验。
比如,取一片锌片放入盛有盐酸的试管中,可以观察到气泡的产生和试管外壁的结露,这是因为锌和盐酸发生了反应,生成了氢气。
4. 氧气的产生
我们还可以通过分解过氧化氢来产生氧气。
只需将过氧化氢溶液倒入装有过氧化铁的烧瓶中,并加入少量的漂白粉,就可以看到氧气气泡不断产生。
5. 气体的性质
我们可以进行气体的性质实验。
比如,可以取一些氢气和氧气,点燃它们,观察到氢氧混合气的爆炸现象,这是因为氢气和氧气发生了激烈的燃烧反应。
通过这些实验操作,我们可以更直观地了解化学反应的过程,加深对化学知识的理解。
同时,实验操作也锻炼了我们的动手能力和实验技巧,让我们更加熟悉科学实验的方法和步骤。
希望大家在化学学习中能够更加努力,不断探索科学的奥秘,培养对科学的兴趣和热爱。
【本文结尾】。

高中化学18个必做实验
1. 能量转化的实验:利用燃烧实验探究化学反应中的能量转化过程。
2. 金属的活动性实验:通过金属之间的置换反应判断金属的活动性顺序。
3. 酸碱指示剂实验:利用酸碱指示剂探究酸碱性质及中和反应。
4. 离子反应实验:通过盐酸与钠的反应,观察氢气生成的情况。
5. 镁烧制氧化物实验:利用镁带烧制氧化物,了解金属氧化物的性质。
6. 硫酸铜结晶实验:用硫酸铜水溶液结晶,探究溶解度与饱和度之间的关系。
7. 电化学实验:通过电化学实验了解化学反应与电能的关系。
8. 汽油的组成实验:通过蒸馏实验分离汽油中的不同组分。
9. 食盐的制备实验:通过盐酸与氢氧化钠的反应制备食盐。
10. 硝酸与铜反应实验:观察硝酸与铜的反应,了解氧化还原
反应。
11. 碳酸氢钠与硫酸反应实验:观察碳酸氢钠与硫酸反应的放
热现象,了解化学反应中的能量变化。
12. 磁铁与硫酸铜实验:观察磁铁在硫酸铜溶液中产生的反应,了解金属与非金属的反应。
13. 单位质量计算实验:通过测量某种物质的体积和质量,计
算出其密度和相对原子质量。
14. 动态平衡实验:通过碳酸氢钠和醋酸的反应,观察反应到
达动态平衡的变化过程。
15. 蜡烛燃烧实验:观察蜡烛燃烧产生的物质变化及气体充满
容器的情况。
16. 碳酸钠溶液的酸碱度实验:通过酸碱滴定实验确定碳酸钠
溶液的酸碱度。
17. 金属的电性实验:通过将金属与盐酸反应,观察电离产生
的氢气和金属离子的性质。
18. 缓冲剂实验:用缓冲溶液控制PH值,了解缓冲剂的作用。
高中化学趣味活动方案
1. 化学实验大挑战:大家一起比一比,看谁能最快又最准确地完成指定实验,就像比赛谁能最快搭好积木一样,那可刺激啦!比如“喷泉实验”,多有意思啊!
2. 化学知识竞赛:哇塞,在紧张激烈的抢答中展现自己的化学知识储备,这不比玩游戏还带劲?像抢答“氧气的性质有哪些”这样的问题。
3. 元素角色扮演:每个人扮演一个元素,通过表演来展现这个元素的特点,这多好玩呀!就像你是活泼的钠,我是稳重的碳。
4. 化学猜谜游戏:嘿,猜那些和化学有关的谜语,不就像解开一个个神秘的小秘密一样有趣吗?比如“像糖不是糖,不能用口尝,帮你改错字,纸上来回忙”,猜一猜是什么呀。
5. 化学魔术表演:哇哦,看着那些神奇的化学变化像魔术一样呈现,简直太神奇了吧!比如酚酞试液变色的魔术。
6. 秘密化学配方探索:大家分组去尝试调配出特定的东西,这不就像探险家寻找宝藏一样令人兴奋吗?比如调配一种特殊颜色的溶液。
7. 化学故事分享会:每个人都来讲讲那些有趣的化学故事,听着就很有意思呀!像居里夫人发现镭的故事。
8. 化学实验创新赛:动动脑筋,设计出独特的实验,这难道不是超级有成就感的事情吗?就像给自己的实验穿上了一件独一无二的外套。
我觉得这些高中化学趣味活动方案真的会让大家对化学的兴趣大大提高,并且能在快乐中学习化学知识呀!。
化学实验趣味活动方案1. 引言在化学学科中,实验是培养学生实践能力和科学思维的重要环节。
然而,传统的化学实验可能显得有些枯燥和难懂,容易导致学生对学科的兴趣和探索欲望的下降。
为了激发学生对化学的兴趣,提高他们对实验的参与度,我们设计了一系列趣味化学实验活动方案。
2. 实验一:色彩变幻乐园实验目的通过实验,让学生了解酸碱中性溶液的颜色变化,并培养他们观察和探究的能力。
实验材料•紫色葡萄酒•小碗•蓝色天然酸性饮料(如蓝莓汁)•碱性溶液(如小苏打水)•酸性溶液(如柠檬汁)实验步骤1.将紫色葡萄酒均匀分配到小碗中。
2.先将一小部分蓝色天然酸性饮料倒入其中一碗,观察颜色变化。
3.再将一小部分碱性溶液倒入另一碗,观察颜色变化。
4.最后将一小部分酸性溶液倒入第三碗,观察颜色变化。
实验结果•蓝色天然酸性饮料与紫色葡萄酒混合后,颜色变为红色。
•碱性溶液与紫色葡萄酒混合后,颜色变为蓝色。
•酸性溶液与紫色葡萄酒混合后,颜色变为粉红色。
实验原理紫色葡萄酒是一种酸性溶液,而蓝色天然酸性饮料与碱性溶液分别为酸性和碱性溶液。
当酸性溶液与紫色葡萄酒混合时,酸性溶液中的酸分子与紫色葡萄酒中的色素分子反应,使溶液呈现出红色。
碱性溶液与紫色葡萄酒混合时,碱性溶液中的氢氧根离子与紫色葡萄酒中的色素分子反应,使溶液呈现出蓝色。
酸性溶液与紫色葡萄酒混合时,酸性溶液中的酸分子与紫色葡萄酒中的色素分子反应,使溶液呈现出粉红色。
3. 实验二:奇妙的摩尔关系实验目的通过实验,让学生了解化学反应中的摩尔关系,培养他们的观察和推理能力。
实验材料•氮气气缸和气体收集瓶•镁粒•烧杯•玻璃棒•水实验步骤1.将烧杯中的水放入气体收集瓶中。
2.在气体收集瓶中加入一些镁粒。
3.将烧杯中的水倒入气体收集瓶中,然后立即将瓶口用塞子封闭。
4.等待一段时间,观察气体收集瓶内的气体。
实验结果在实验过程中,镁粒与水反应生成氢气,氢气充满了气体收集瓶。
实验原理镁与水反应,生成氧化镁和氢气。
必做分组实验合计8个1、1-1水的沸腾2、1-2胆矾的研碎3、1-3硫酸铜溶液中加氢氧化钠溶液4、1-4石灰石与盐酸的反应5、1-5二氧化碳与氧气的性质探究活动1:对蜡烛及其燃烧的探究、对吸入空气与呼出气体的探究(必做分组实验)6、1-6取块状固体7、1-7取粉末固体8、1-8量筒与滴管的使用9、1-9酒精灯的使用探究活动2:给物质加热10、1-10链接仪器并检查装置的气密性11、1-11洗涤玻璃仪器12、2-1测定空气里氧气含量13、2-2木炭燃烧14、2-3硫的燃烧15、2-4铁丝在氧气中燃烧16、2-5过氧化氢溶液制氧气17、2-6 过氧化氢溶液制氧气(二氧化锰催化)18、2-7加热氯酸钾制取氧气探究活动3:加热高锰酸钾制取氧气及氧气的性质实验(必做分组实验)19、3-1水的电解20、3-2品红的扩散探究活动4:分子运动活动探究活动5:水的净化21、3-3用肥皂区分软硬水22、3-4制取蒸馏水探究活动6:质量守恒定律的探究探究活动7:运用蜡烛、镁的燃烧验证质量守恒定律23、6-1木炭的吸附作用24、6-2木炭还原氧化铜探究活动8:制取二氧化碳(必做分组实验)25、6-3制取二氧化碳收集并验满26、6-4二氧化碳使燃着的蜡烛熄灭(阶梯蜡烛实验)27、6-5二氧化碳的溶解性28、6-6二氧化碳与水反应性质的探究29、6-7一氧化碳的燃烧30、6-8一氧化碳还原氧化铜探究活动9:燃烧的条件31、7-1灭火原理探究活动10:灭火器原理32、7-2粉尘爆炸探究活动11:燃料33、7-3甲烷的燃烧34、7-4镁与盐酸反应中的能量变化活动12:酸雨危害的模拟实验35、8-1比较合金和纯金属的硬度探究活动13:金属活动性顺序36、8-2一氧化碳还原氧化铁的实验探究活动14:铁钉锈蚀条件37、9-1蔗糖溶解探究活动15:溶解时的吸热或放热现象38、9-2碘或高锰酸钾分别放入水或汽油中39、9-3水和乙醇能够互溶吗?40、9-4水和油的小实验探究活动16:饱和溶液41、9-5三种不同组成的硫酸铜溶液42、9-6两种溶质质量分数不同的氯化钠溶液43、9-7配制溶质质量分数一定的溶液(必做分组实验)44、10-1向溶液中加入酸碱指示剂探究活动17:自制指示剂45、10-2观察盐酸、硫酸46、10-3浓硫酸的腐蚀性47、10-4浓硫酸的溶解48、10-5浓硫酸稀释的错误操作探究活动18:酸的化学性质(必做分组实验)49、10-6观察氢氧化钠50、10-7生石灰与水反应探究活动19:碱的化学性质(必做分组实验)51、10-8试验物质的导电性探究活动20:中和反应探究活动21:用PH试纸测定一些液体的PH探究活动22:溶液酸碱度对头发的影响探究活动23:粗盐提纯(必做分组实验)52、11-1碳酸钠与盐酸反应53、11-2碳酸钠与石灰水反应探究活动24:复分解反应条件的探究(必做分组实验)探究活动25:探究初步区分氮肥、磷肥和钾肥的方法54、12-1加热聚乙烯塑料碎片。