有机溶剂干燥
- 格式:doc
- 大小:293.50 KB
- 文档页数:20

干燥乙醇的原理干燥乙醇是将液态乙醇转化为无水乙醇(无水酒精)的过程。
乙醇是一种广泛应用的有机溶剂,但如果需要在某些特定的实验室或工业应用中使用无水乙醇,那么对乙醇的干燥处理就显得非常关键。
乙醇的干燥原理主要基于“吸附性脱水”和“共沸法”。
首先,考虑“吸附性脱水”原理。
乙醇中的水分主要以两种形式存在:溶解于乙醇分子内的游离水和与乙醇分子间形成氢键的吸附水。
通过添加干燥剂或吸附剂,可以将这些水分吸附到表面上,从而实现脱水的目的。
常见的干燥剂包括氢氧化钠、氢氧化钙、氢氧化钾、分子筛等。
这些干燥剂具有较高的亲水性,可以吸附乙醇中的游离水,并将其转化为水合物形式。
水合物不易溶于乙醇,因此可以通过过滤或简单的沉淀将其分离出来,从而得到干燥的乙醇。
此外,也可以使用一些气相吸附剂,例如硅胶、活性炭等。
这些吸附剂可以吸附乙醇中的水分,从而实现脱水的目的。
吸附剂可以通过在乙醇中直接搅拌或将其放置在密闭容器中与乙醇接触,从而吸附水分。
最终,通过过滤或简单的沉淀,可以将吸附剂中的水分与乙醇分离。
其次,考虑“共沸法”原理。
共沸是指在一定的压力下,混合物的沸点将保持在常数温度。
在乙醇与水混合物中,当乙醇浓度达到95.6%时,混合物的沸点为78.2。
这被称为共沸点。
在这个共沸点下,乙醇与水的蒸气压相等,可以通过蒸馏的方式将两者分离。
利用共沸法干燥乙醇可以采用以下方法之一:浓缩蒸馏、恒温蒸馏和非平衡蒸馏。
浓缩蒸馏是指通过加热将乙醇与水混合物蒸发,然后将蒸汽冷凝收集。
这种方法通常需要进行多次蒸馏,以逐渐增强乙醇的浓度。
恒温蒸馏是指在共沸点下保持一定的压力和温度,通过连续蒸馏将乙醇与水分离。
非平衡蒸馏也可以通过连续蒸馏的方式实现乙醇与水的分离。
除了上述的干燥原理之外,还可以使用其他特殊的方法来干燥乙醇,如冷凝法和分子筛法。
冷凝法主要通过低温冷凝乙醇中的水分,将水分蒸发掉。
分子筛法是利用具有吸附性能的分子筛将水分吸附并分离出来。
总之,干燥乙醇的原理主要包括吸附性脱水和共沸法。

化学供应商提供的常用试剂仅可满足一般化学反应的需要。
为了确保一些有机合成反应的顺利进行,常常要对试剂进行进一步的纯化处理。
常用的溶剂处理方法是蒸馏。
如果反应要求仅仅是无水,可在冷凝管上加干燥管,油封或充氮气球即可,如果需要达到无水无氧的条件,溶剂则需要脱氧处理。
一般在氮气氛下进行。
试剂级溶剂的纯化无水的试剂级溶剂常有足够的纯度,有时可以不用蒸馏。
为保证充分的干燥度,可在储藏时向其加入活性分子筛。
欲使溶剂脱氧,可利用注射器或玻璃管向其中鼓入氮气约五分钟。
一般溶剂的纯化大多数溶剂,只要在惰性气氛中将其从干燥剂中蒸馏出来,就可以达到足够的纯度。
1. 烷烃如己烷、戊烷等。
首先用浓硫酸洗涤几次以除去烯烃,水洗,CaCl2干燥,必要时用钠丝或P2O5干燥,蒸馏。
存放于带塞的试剂瓶中。
2. 芳香烃类如苯、甲苯、二甲苯等。
CaCl2干燥,必要时用钠丝或P2O5干燥,蒸馏。
存放于带塞的试剂瓶中。
3. 氯代烷烃类如二氯甲烷、氯仿、四氯化碳、二氯乙烷等。
水洗除去醇等,CaCl2干燥,在P2O5,或CaH2中回流蒸出。
绝对不能用钠丝干燥,否则会发生爆炸。
长期储藏应放于密闭的瓶中,并保存于黑暗中。
4. 醚类及呋喃类如乙醚、四氢呋喃等。
许多醚类在和空气接触下会慢慢生成不易挥发且结构不明的过氧化物。
过氧化物在加热下容易分解而爆炸。
因此贮藏过久的醚类和呋喃类化合物在使用前,尤其是在蒸馏前应当检验是否有过氧化物的存在。
检验的方法:用包含一滴淀粉指示剂的1 mL 10% KI 溶液和10 mL 醚液混合,没有颜色变化,则没有过氧化物。
或者用1%硫酸亚铁铵溶液,硫酸亚铁和硫氰化钾溶液测试。
若有,则加入5% FeSO4或偏亚硫酸氢钠溶液于醚中并摇动,使过氧化物分解。
CaCl2预干燥,在钠丝或LiAlH4中回流蒸出。
储藏于密闭的瓶中,并保存于阴凉黑暗中。
常用有机溶剂的纯化-乙醚沸点34.51℃,折光率1.3526,相对密度0.71378。
![实验操作技巧:萃取、洗涤、干燥、抽滤、旋蒸、乳化等操作[修改版]](https://img.taocdn.com/s1/m/f6de76fd162ded630b1c59eef8c75fbfc77d9461.png)
实验操作技巧:萃取、洗涤、干燥、抽滤、旋蒸、乳化等操作萃取、洗涤、干燥、抽滤、旋蒸:1)、选择有机溶剂。
乙醚是最常用的有机溶剂,因为可方便地用旋转蒸发仪将其除去。
乙酸乙酯也是很好的溶剂,但是它相对比较难被除去。
应该尽量避免使用二氯甲烷,因为二氯甲烷比水重,容易形成难以处理的乳状液和复杂的物质。
2)、选择分液漏斗的大小。
通常选用125mL或250mL的分液漏斗,较大量的反应(1~10g)可以用500mL或1L的分液漏斗。
请记住:分液漏斗中要装得下溶剂及洗涤液,两者在漏斗中必须能完全混合。
3)、用所选择的有机溶剂稀释初始反应混合物并将其移入选择好的分液漏斗。
大量的原料需要大量的溶剂。
常规反应(50~500mg产品)可用25~100mL溶剂来稀释。
4)、洗涤有机层以除去杂质。
洗涤相的体积通常是有机相体积的1/10~1/2。
最好重复洗涤2~3次。
酸洗(通常用10%HCl)可以除去胺,碱洗(通常用饱和NaHCO3或10%NaOH)可以除去酸性杂质。
大多数情况下,当杂质既非酸性又非碱性时,可用蒸馏水洗涤,以除去各种无机杂质。
(注意:在摇动分液漏斗中的混合液体时,记住要经常排气,排气时使分液漏斗上沿口朝下,然后上举,在防护罩后面打开活塞。
这样可以释放在摇动液体时产生的气体压力。
此外,在分液漏斗中放出液体之前,记住首先应打开盖子。
)5)、反向萃取回收损失的产品。
如果你的产物有水溶性(含有几个极性基团),你可能需要用乙醚或乙酸乙酯反向萃取水层,以避免过多产物流失在水相中。
可以使用TLC检测是否所有产物已经从水相中被萃取出。
6)、在结束阶段进行盐洗(饱和NaCl溶液)。
此操作有利于干扰乳化,并且可以除去溶于有机相中的水,起到“干燥”有机层的作用。
7)、干燥有机层。
将有机溶液和水相分离之后,在有机相中加入干燥剂以除去微量的水。
通常用高效快速的MgSO4,但MgSO4有轻微的酸性;或用Na2SO4,它的干燥速度稍慢,效率较低,但Na2SO4为中性。

常用有机溶剂的纯化方法1. 甲醇(CH 3OH)工业甲醇含水量在0.5%~1%,含醛酮(以丙酮计)约0.1%。
由于甲醇和水不形成共沸混合物,因此可用高效精馏柱将少量水除去。
精制甲醇中含水0.1%和丙酮0.02%,一般已可应用。
若需含水量低于0.1%,可用3A 分子筛干燥,也可用镁处理(见绝对乙醇的制备)。
若要除去含有的羰基化合物,可在500mL 甲醇中加入25mL 糠醛和60mL10%NaOH 溶液,回流6~12小时,即可分馏出无丙酮的甲醇,丙酮与糠醛生成树脂状物留在瓶内。
纯甲醇b.p. 64.95℃,n D 20 1.3288,d 420 0.7914。
甲醇为一级易燃液体,应贮存于阴凉通风处,注意防火。
甲醇可经皮肤进入人体,饮用或吸入蒸气会刺激视神经及视网膜,导致眼睛失明,直到死亡。
人的半致死量LD 50为13.5g/kg ,经口服甲醇的致死量LD 为1g/kg ,15mL 可致失明。
2. 乙醇(CH 3CH 2OH)工业乙醇含量为95.5%,含水4.4%,乙醇与水形成共沸物,不能用一般分馏法去水。
实验室常用生石灰为脱水剂,乙醇中的水与生石灰作用生成氢氧化钙可去除水分,蒸馏后可得含量约99.5%的无水乙醇。
如需绝对无水乙醇,可用金属钠或金属镁将无水乙醇进一步处理,得到纯度可超过99.95%的绝对乙醇。
(1)无水乙醇(含量99.5%)的制备在500ml 圆底烧瓶中,加入95%乙醇200mL 和生石灰50g, 放置过夜。
然后在水浴上回流3小时,再将乙醇蒸出,得含量约99.5%的无水乙醇。
另外可利用苯、水和乙醇形成低共沸混合物的性质,将苯加入乙醇中,进行分馏,在64.9℃时蒸出苯、水、乙醇的三元恒沸混合物,多余的苯在68.3℃与乙醇形成二元恒沸混合物被蒸出,最后蒸出乙醇。
工业多采用此法。
(2)绝对乙醇(含量99.95%)的制备①用金属镁制备在250mL 的圆底烧瓶中,放置0.6g 干燥洁净的镁条和几小粒碘,加入10mL99.5%的乙醇,装上回流冷凝管。

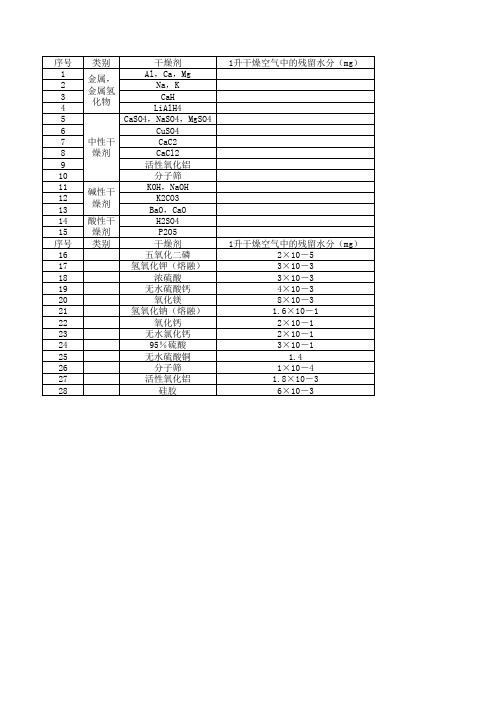
有机溶剂的脱⽔⼲燥有机溶剂的脱⽔⼲燥1、⽤于⼲燥剂脱⽔这是液体溶剂在常温下脱⽔⼲燥最常⽤的⽅法。
(1) ⾦属、⾦属氧化物⼲燥剂铝、钙、镁常⽤于醇类溶剂的⼲燥。
钠、钾适⽤于烃、醚、环⼰胺等溶剂⼲燥。
绝不能⽤于卤代烷,有爆炸危险。
也不能⼲燥甲醇、酯、酸、酮、醛与某些胺类。
醇中含微量⽔分时,可加⼊少量⾦属钠直接蒸馏。
氢化钙 1g氢化钙定量地与0.85g⽔反应。
因此,它⽐碱⾦属、五氧化⼆磷⼲燥效果好。
适⽤于烃、卤代烷、醇、胺、醚等,特别是四氢呋喃等环醚、⼆甲亚砜、六甲氧磷酰胺等溶剂的⼲燥。
LiAlH4常⽤于醚等溶剂的⼲燥。
(2) 中性⼲燥剂CaSO4、Na2SO4、MgSO4适⽤于烃、卤代烷、醚、酯、硝基甲烷、酰胺、腈等溶剂的⼲燥。
CuSO4⽆⽔硫酸铜为⽩⾊,含有5个分⼦结晶⽔时变为蓝⾊,常⽤于检验溶剂中微量的⽔分。
CuSO4适⽤于醇、醚、酯、低级脂肪酸的脱⽔。
甲醇与CuSO4能形成加成物,故不能使⽤。
CaCl2适⽤于⼲燥烃、卤代烃、醚、硝基化合物、环⼰胺、腈、⼆硫化碳等。
CaCl2能与伯醇、⽢油、酚、某些类型的胺、酯等形成加成物,故不适⽤。
活性氧化铝适⽤于烃、胺、酯、甲酰胺等的⼲燥。
分⼦筛与其它⼲燥剂相⽐,分⼦筛在⽔蒸⽓分压低和温度⾼时吸湿容量仍很显著,吸湿能⼒⼤。
各种溶剂⼏乎都可以⽤分⼦筛脱⽔,故⼴泛应⽤。
(3) 碱性⼲燥剂KOH、NaOH 适⽤于⼲燥胺等碱性物质和四氢呋喃。
酸、酚、醛、醇、酮、酯、酰胺等不适⽤。
K2CO3适⽤于碱性物质、卤代烷、醇、酮、酯、腈、溶纤剂等溶剂的⼲燥。
不适⽤于酸性物质。
BaO、CaO 适⽤于⼲燥醇、碱性物质、腈、酰胺。
不适⽤于酮、酸性物质和酯类。
(4) 酸性⼲燥剂H2SO4适⽤于⼲燥饱和烃、卤代烃等。
醇、酚、酮、不饱和烃等不适⽤。
P2O5适⽤于烃、卤代烃、酯、⼄酸、腈、⼆硫化碳的⼲燥。
不适⽤于醚、酮、醇、胺等的⼲燥。
2、分馏脱⽔与⽔的沸点相差较⼤的溶剂,可⽤分馏效率⾼的蒸馏塔进⾏分馏脱⽔,这是常⽤的脱⽔⽅法。
有机溶剂脱水方法一、干燥剂脱水法。
1.1 原理。
干燥剂脱水法是一种比较常见的有机溶剂脱水方式。
干燥剂就像是一个个小小的吸水卫士,它们有着很强的吸水性。
像无水氯化钙这种干燥剂,它就能够通过自身的化学性质,把有机溶剂里的水给吸附过来。
这就好比是干燥剂伸出了无数只小手,把水分子紧紧抓住,让有机溶剂里的水越来越少。
1.2 常用干燥剂。
常见的干燥剂有很多种。
比如说硅胶,它就像一个柔软的吸水海绵,无色透明的它在很多实验室里都是常客。
还有分子筛,这可是个厉害的角色,就如同一个精密的筛子,只允许水分子进入它的孔隙,而把有机溶剂留在外面,从而达到脱水的目的。
不过使用干燥剂的时候也得注意,不同的有机溶剂适合的干燥剂可能不一样,就像不同的锁需要不同的钥匙一样。
二、共沸蒸馏脱水法。
2.1 共沸原理。
共沸蒸馏脱水法有点像找个伙伴一起把水带走。
某些有机溶剂和水会形成共沸物,共沸物就像一对形影不离的好朋友,在特定的温度下一起沸腾,一起变成蒸汽飞走。
比如说乙醇和水,它们就能形成共沸物。
这就好比两个人绑在一起,不管怎样都要一起行动。
2.2 操作要点。
在进行共沸蒸馏的时候,要控制好温度和蒸馏的速度。
如果温度太高,可能会导致有机溶剂也跟着大量损失,那就得不偿失了。
这就像炒菜的时候火不能太大,不然菜就焦了。
而且蒸馏装置也要密封好,要是漏气了,就像气球扎了个洞,整个蒸馏过程就乱套了,水也脱不干净了。
三、膜分离脱水法。
3.1 膜的作用。
膜分离脱水法是一种比较高科技的方法。
膜就像是一道特殊的屏障,它只允许水分子或者有机溶剂分子中的一种通过。
有的膜像一个严格的门卫,只放行有机溶剂分子,把水分子挡在外面;有的膜则相反。
这就好比是在一个只允许特定人群进入的场所,膜就是那个负责检查的保安。
3.2 优点与局限。
膜分离脱水法有它的优点,它比较环保,不需要添加其他的化学物质,不会像使用干燥剂那样可能会有残留。
但是呢,它也有局限性。
膜的成本比较高,就像买一件奢侈品一样,而且膜的使用寿命有限,用着用着可能就像一个人老了干不动活了,需要更换新的膜。
有机化合物的干燥有机化学实验中,为除去原料和粗产品中的少量水分,常需要干燥。
干燥是指除去固体、液体或气体内少量水分的操作,是有机化学实验室中既普通又重要的一项操作。
干燥方法可分为物理方法与化学方法两种。
物理方法有吸附、共沸蒸馏、分馏、冷冻干燥、加热和真空干燥等。
化学方法按去水作用的方式又可分为两类:一类与水能可逆地结合生成水合物,如氯化钙、硫酸钠等;一类与水会发生剧烈的化学反应,如金属钠、五氧化二磷等。
一、固体的干燥为了进行产率计算、结构表征、物理鉴定,固体产物中的水分和有机溶剂必须除尽。
1.晾干将待干燥的固体放在表面皿上或培养皿中,尽量平铺成一薄层、再用滤纸或培养皿覆盖上,以免灰尘沾污,然后在室温下放置直到干燥为止,适用于除去低沸点溶剂。
2.红外灯干燥热稳定性好又不易升华的固体中如含有不易挥发的溶剂时,为了加速干燥,常用红外灯干燥。
3.烘箱烘干烘箱用来干燥无腐蚀、无挥发性、加热不分解的物质。
严禁将易燃、易爆物放在烘箱内烘烤,以免发生危险。
采用红外灯和烘箱干燥有机化合物,要慎之又慎,必须清楚了解化合物的性质,特别是热稳定性。
否则会造成有机化合物分解、氧化、转化等严重问题。
4.真空加热干燥对高温下易分解、聚合和变质以及加热时对氧气敏感有机化合物,可采用专门的真空加热干燥箱进行干燥。
将干燥物料处在真空条件下加热干燥,并利用真空泵进行抽气、抽湿,加快干燥速率。
如果没有特别要求,尽量采用循环水真空泵而不用油泵进行抽湿。
5.真空冷冻干燥对于受热时不稳定物质,可利用特殊的真空冷冻干燥设备,在水的三相点以下,即在低温低压条件下,使物质中的水分冻结后升华而脱去。
但是该方法设备昂贵、运行成本高,普通实验室很少采用。
二、液体的干燥从水溶液中分离出的液体有机物,常含有许多水分,如不干燥脱水,直接蒸馏将会增加前馏分造成损失,另外产品也可能与水形成共沸混合物而无法提纯,影响产品纯度。
有机液体的干燥,一般是直接将干燥剂加入到液体中,除去水分。
溶剂干燥方法一些溶剂因为种种原因总是含有杂质,这些杂质如果对溶剂的使用目的没有什么影响的话,可直接使用。
可是在进行化学实验和进行一些特殊的化学反应时,必须将杂质除去。
虽然除去全部杂质是有困难的,但至少应该将杂质减少到对使用目的没有防碍的限度。
除去杂质的操作称为溶剂的精制,故溶剂的精制几乎都要进行脱水,其次再除去其他的杂质。
1溶剂的脱水干燥:溶剂中水的混入往往是由于在溶剂制造,处理或者由于副反应时作为副产物带入的,其次在保存的过程中吸潮也会混入水分。
水的存在不仅对许多化学反应,就是对重结晶,萃取,洗涤等一系列的化学实验操作都会带来不良的影响。
因此溶剂的脱水和干燥在化学实验中是很重要的,又是经常进行的操作步骤。
尽管在除去溶剂中的其他杂质时有时往往加入水分,但在最好还是要进行脱水,干燥。
精制后充分干燥的溶剂在保存过程中往往还必须加入适当的干燥剂,以防止溶剂吸潮。
溶剂脱水的方法有下列几种:(1)干燥剂脱水这是液体溶剂在常温下脱水干燥最常用使用的方法。
干燥剂有固体,液体和气体,分为酸性物质,碱性物质,中性物质以及金属和金属氢化物。
干燥剂的性质各有不同,在使用时要充分考虑干燥剂的特性和干燥剂的性质,才能有效达到干燥的目的。
在选择干燥剂时首先要确保进行干燥的物质与干燥剂不发生任何反应;干燥剂兼做催化剂时,应不使溶剂发生分解,聚合,并且干燥剂与溶剂之间不形成加合物。
此外,还要考虑倒干燥速度,干燥效果和干燥剂的吸水量。
在具体使用时,酸性物质的干燥最好选用酸性物质干燥剂,碱性物质的干燥用碱性干燥剂,中性物质的干燥用中性干燥剂。
溶剂中有大量水存在的,应避免选用与水接触着火(如金属钠等)或者发热猛烈的干燥剂,可以先选用氯化钙一类缓和的干燥剂进行干燥脱水,使水分减少后再使用金属钠干燥。
加入干燥剂后应搅拌,放置一夜。
温度可以根据干燥剂的性质,对干燥速度的影响加以考虑。
干燥剂的用量应稍有过剩。
在水分多的情况下,干燥剂因吸水吸收水分发生部分或全部溶解生成液状或泥状分为两层,此时应进行分离并加入新的干燥剂。
干燥干燥是有机化学实验室中最常用到的重要操作之一,其目的在于除去化合物中存在的少量水分或其他溶剂。
液体中的水分会与液体形成共沸物,在蒸馏时就有过多的“前馏分”,造成物料的严重损失;固体中的水分会造成熔点降低,而得不到正确的测定结果。
试剂中的水分会严重干扰反应,如在制备格氏试剂或酰氯的反应中若不能保证反应体系的充分干燥就得不到预期产物;而反应产物如不能充分干燥,则在分析测试中就得不到正确的结果,甚至可能得出完全错误的结论。
所有这些情况中都需要用到干燥。
干燥的方法因被干燥物料的物理性质、化学性质及要求干燥的程度不同而不同,如果处置不当就不能得到预期的效果。
1.液体的干燥实验室中干燥液体有机化合物的方法可分为物理方法和化学方法两类。
(1)物理干燥法①分馏法:可溶于水但不形成共沸物的有机液体可用分馏法干燥,如实验4那样。
②共沸蒸(分)馏法:许多有机液体可与水形成二元最低共沸物(见书末附录3),可用共沸蒸馏法除去其中的水分,其原理见第74~77页。
当共沸物的沸点与其有机组分的沸点相差不大时,可采用分馏法除去含水的共沸物,以获得干燥的有机液体。
但若液体的含水量大于共沸物中的含水量,则直接的蒸(分)馏只能得到共沸物而不能得到干燥的有机液体。
在这种情况下常需加入另一种液体来改变共沸物的组成,以使水较多较快地蒸出,而被干燥液体尽可能少被蒸出。
例如,工业上制备无水乙醇时,是在95%乙醇中加入适量苯作共沸蒸馏。
首先蒸出的是沸点为64.85℃的三元共沸物,含苯、水、乙醇的比例为74∶7.5∶18.5。
在水完全蒸出后,接着蒸出的是沸点为68.25℃的二元共沸物,其中苯与乙醇之比为67.6∶32.4。
当苯也被蒸完后,温度上升到78.85℃,蒸出的是无水乙醇。
③用分子筛干燥:分子筛是一类人工制作的多孔性固体,因取材及处理方法不同而有若干类别和型号,应用最广的是沸石分子筛,它是一种铝硅酸盐的结晶,由其自身的结构,形成大量与外界相通的均一的微孔。
常用有机溶剂的纯化方法1. 甲醇(CH 3OH)工业甲醇含水量在0.5%~1%,含醛酮(以丙酮计)约0.1%。
由于甲醇和水不形成共沸混合物,因此可用高效精馏柱将少量水除去。
精制甲醇中含水0.1%和丙酮0.02%,一般已可应用。
若需含水量低于0.1%,可用3A 分子筛干燥,也可用镁处理(见绝对乙醇的制备)。
若要除去含有的羰基化合物,可在500mL 甲醇中加入25mL 糠醛和60mL10%NaOH 溶液,回流6~12小时,即可分馏出无丙酮的甲醇,丙酮与糠醛生成树脂状物留在瓶内。
纯甲醇b.p. 64.95℃,n D 20 1.3288,d 420 0.7914。
甲醇为一级易燃液体,应贮存于阴凉通风处,注意防火。
甲醇可经皮肤进入人体,饮用或吸入蒸气会刺激视神经及视网膜,导致眼睛失明,直到死亡。
人的半致死量LD 50为13.5g/kg ,经口服甲醇的致死量LD 为1g/kg ,15mL 可致失明。
2. 乙醇(CH 3CH 2OH)工业乙醇含量为95.5%,含水4.4%,乙醇与水形成共沸物,不能用一般分馏法去水。
实验室常用生石灰为脱水剂,乙醇中的水与生石灰作用生成氢氧化钙可去除水分,蒸馏后可得含量约99.5%的无水乙醇。
如需绝对无水乙醇,可用金属钠或金属镁将无水乙醇进一步处理,得到纯度可超过99.95%的绝对乙醇。
(1)无水乙醇(含量99.5%)的制备在500ml 圆底烧瓶中,加入95%乙醇200mL 和生石灰50g, 放置过夜。
然后在水浴上回流3小时,再将乙醇蒸出,得含量约99.5%的无水乙醇。
另外可利用苯、水和乙醇形成低共沸混合物的性质,将苯加入乙醇中,进行分馏,在64.9℃时蒸出苯、水、乙醇的三元恒沸混合物,多余的苯在68.3℃与乙醇形成二元恒沸混合物被蒸出,最后蒸出乙醇。
工业多采用此法。
(2)绝对乙醇(含量99.95%)的制备①用金属镁制备在250mL 的圆底烧瓶中,放置0.6g 干燥洁净的镁条和几小粒碘,加入10mL99.5%的乙醇,装上回流冷凝管。
在冷凝管上端附加一只氯化钙干燥管,在水浴上加热,注意观察在碘周围的镁的反应,碘的棕色减退,镁周围变浑浊,并伴随着氢气的放出,至碘粒完全消失(如不起反应,可再补加数小粒碘)。
然后继续加热,待镁条完全溶解后加入100mL 99.5%的乙醇和几粒沸石,继续加热回流1小时,改为蒸馏装置蒸出乙醇,所得乙醇纯度可超过99.95%。
反应方程式为:②用金属钠制备在500mL 99.5%乙醇中,加入3.5g 金属钠,安装回流冷凝管和干燥管,加热回流30分钟后,再加入14g 邻苯二甲酸二乙酯或13g 草酸二乙酯,回流2~3小时,然后进行蒸馏。
金属钠虽能与乙醇中的水作用,产生氢气和氢氧化钠,但所生成的氢氧化钠又与乙醇发生平衡反应,因此单独使用金属钠不能完全除去乙醇中的水,须加入过量的高沸点酯,如邻苯二甲酸二乙酯与生成的氢氧化钠作用,抑制上述反应,从而达到进一步脱水的目的。
反应方程式(C 2H 5O)2Mg +2H 2O 2H 5OH +Mg(OH)2+2C 2H 5OH+2NaOH COOC 2H 5COOC 2H 5COONaCOONa Na +2C 2H 5OH 2C 2H 5ONa +H 2+H 2OC 2H 5OH +NaOH C2H 5ONa为:由于乙醇有很强的吸湿性,故仪器必须烘干,并尽量快速操作,以防吸收空气中的水分。
纯乙醇b.p. 78.5℃,n D20 1.3611,d420 0.7893。
乙醇为一级易燃液体,应存放在阴凉通风处,远离火源。
乙醇可通过口腔、胃壁粘膜吸入,对人体产生刺激作用,引起酩酊、睡眠和麻醉作用。
严重时引起恶心、呕吐甚至昏迷。
人的半致死量LD50为13.7g/kg。
3. 乙醚(CH3CH2OCH2CH3)普通乙醚中常含有一定量的水、乙醇及少量过氧化物等杂质。
制备无水乙醚,首先要检验有无过氧化物。
为此取少量乙醚与等体积的2%碘化钾溶液,加入几滴稀盐酸一起振摇,若能使淀粉溶液呈紫色或蓝色,即证明有过氧化物存在。
除去过氧化物可在分液漏斗中加入普通乙醚和相当于乙醚体积1/5新配制的硫酸亚铁溶液,剧烈摇动后分去水溶液。
再用浓硫酸及金属钠作干燥剂,所得无水乙醚可用于Grignard反应。
在250mL圆底烧瓶中,放置100mL除去过氧化物的普通乙醚和几粒沸石,装上回流冷凝管。
冷凝管上端通过一带有侧槽的软木塞,插入盛有10mL浓硫酸的滴液漏斗。
通入冷凝水,将浓硫酸慢慢滴入乙醚中。
由于脱水发热,乙醚会自行沸腾。
加完后摇动反应瓶。
待乙醚停止沸腾后,折下回流冷凝管,改成蒸馏装置回收乙醚。
在收集乙醚的接引管支管上连一氯化钙干燥管,用与干燥管连接的橡皮管把乙醚蒸气导入水槽。
在蒸馏瓶中补加沸石后,用事先准备好的热水浴加热蒸馏,蒸馏速度不宜太快,以免乙醚蒸气来不及冷凝而逸散室内。
收集约70mL乙醚,待蒸馏速度显著变慢时,可停止蒸馏。
瓶内所剩残液,倒入指定的回收瓶中,切不可将水加入残液中(飞溅)。
将收集的乙醚倒入干燥的锥形瓶中,将钠块迅速切成极薄的钠片加入,然后用带有氯化钙干燥管的软木塞塞住,或在木塞中插入末端拉成毛细管的玻璃管,这样可防止潮气侵入,并可使产生的气体逸出,放置24小时以上,使乙醚中残留的少量水和乙醇转化成氢氧化钠和乙醇钠。
如不再有气泡逸出,同时钠的表面较好,则可储存备用。
如放置后,金属钠表面已全部发生作用,则须重新加入少量钠片直至无气泡发生。
这种无水乙醚可符合一般无水要求。
另外也可用无水氯化钙浸泡几天后,用金属钠干燥以除去少量的水和乙醇。
纯乙醚b.p. 34.51℃,n D20 1.3526,d420 0.71378。
乙醚为一级易燃液体,由于沸点低、闪电低、挥发性大,贮存时要避免日光直射,远离热源,注意通风,并加入少量氢氧化钾以避免过氧化的形成。
乙醚对人有麻醉作用,当吸入含乙醚3.5%(体积)的空气时,30~40min就可失去知觉。
大鼠口服半致死量LD50为3.56g/kg。
4. 丙酮(CH3COCH3)普通丙酮含有少量水及甲醇、乙醛等还原性杂质,可用下列方法精制:在100mL丙酮中加入2.5g高锰酸钾回流,以除去还原性杂质,若高锰酸钾紫色很快消失,须再补加少量高锰酸钾继续回流,直至紫色不再消失为止,蒸出丙酮。
用无水碳酸钾或无水硫酸钙干燥,过滤,蒸馏,收集55~56.5℃馏分。
纯丙酮b.p. 56.2℃,n D20 1.3588,d420 0.7899。
丙酮为常用溶剂,一级易燃液体,沸点低,挥发性大,应置阴凉处密封贮存,严禁火源。
虽丙酮毒性较低,但长时期处于丙酮蒸气中也能引起不适症状,蒸气浓度为4000×10-6时60min后会呈现头痛、昏迷等中毒症状,脱离丙酮蒸气后恢复正常。
5. 乙酸乙酯(CH3COOCH2CH3)一般化学试剂,含量为98%,另含有少量水、乙醇和乙酸,可用以下方法精制:(1) 取100mL 98%乙酸乙酯,加入9mL乙酸酐回流4h ,除去乙醇及水等杂质,然后蒸馏,蒸馏液中加2~3g无水碳酸钾,干燥后再重蒸,可得99.7%左右的纯度。
(2) 也可先用与乙酸乙酯等体积的5%碳酸钠溶液洗涤,再用饱和氯化钙溶液洗涤,然后加无水碳酸钾干燥、蒸馏。
(如对水分要求严格时,可在经碳酸钾干燥后的酯中加入少许五氧化二磷,振摇数分钟,过滤,在隔湿条件下蒸馏。
)纯乙酸乙酯b.p. 77.1℃,n D20 1.3723,d420 0.9903。
乙酯乙酯有果香气味,对眼睛、皮肤和粘膜有刺激性。
乙酸乙酯为一级易燃品。
它与空气混合物的爆炸极限为2.2%~11.4%。
6. 石油醚石油醚是石油的低沸点馏分,为低级烷烃的混合物,按沸程不同分为30~60℃,60~90℃,90~120℃类。
主要成分为戊烷、己烷、庚烷,此外含有少量不饱和烃、芳烃等杂质。
精制方法:在分液漏斗中加入石油醚及其体积1/10的浓硫酸一起振摇,除去大部分不饱和烃。
然后用10%硫酸配成的高锰酸钾饱和溶液洗涤,直到水层中紫色消失为止,再经水洗,用无水氯化钙干燥后蒸馏。
石油醚为一级易燃液体。
大量吸入石油醚蒸气有麻醉症状。
7. 苯(C6H6)普通苯含有少量水(约0.02%)及噻吩(约0.15%)。
若需无水苯,可用无水氯化钙干燥过夜,过滤后压入钠丝。
无噻吩苯可根据噻吩比苯容易磺化的性质,用下述方法纯化。
在分液漏斗中,将苯用相当其体积10%的浓硫酸在室温下一起振摇,静置混合物,弃去底层的酸液,再加入新的浓硫酸,重复上述操作直到酸层呈无色或淡黄色,且检验无噻吩为止。
苯层依次用水、10%碳酸钠溶液、水洗涤,再用无水氯化钙干燥,蒸馏,收集80℃馏分备用。
若要高度干燥的苯,可压入钠丝或加入钠片干燥。
噻吩的检验:取5滴苯于试管中,加入5滴浓硫酸及1~2滴1%靛红(浓硫酸溶液),振摇片刻,如呈墨绿色或蓝色,表示有噻吩存在。
纯苯b.p. 80.1℃,n D20 1.5011,d420 0.87865。
苯为一级易燃品。
苯的蒸气对人体有强烈的毒性,以损害造血器官与神经系统最为显著,病状为白细胞降低、头晕、失眠、记忆力减退等。
8. 氯仿(三氯甲烷)(HCCl3)氯仿露置于空气和光照下,与氧缓慢作用,分解产生光气、氯和氯化氢等有毒物质。
普通氯仿中加有0.5%~1%的乙醇作稳定剂,以便与产生的光气作用转变成碳酸乙酯而消除毒性。
纯化方法有两种:第一种,依次用氯仿体积5%的浓硫酸、水、稀氢氧化钠溶液和水洗涤,无水氯化钙干燥后蒸馏即得;第二种,可将氯仿与其1/2体积的水在分液漏斗中振摇数次,以洗去乙醇,然后分去水层,用无水氯化钙干燥。
除去乙醇的氯仿应装于棕色瓶内,贮存于阴暗处,以避免光照。
氯仿绝对不能用金属钠干燥,因易发生爆炸。
纯氯仿b.p. 61.7℃,n D20 1.4459,d420 1.4832。
氯仿具有麻醉性,长期接触易损坏肝脏。
液体氯仿接触皮肤有很强的脱脂作用,产生损伤,进一步感染会引起皮炎。
但本品不燃烧,在高温与明火或红热物体接触会产生剧毒的光气和氯化氢气体,应置阴凉处密封贮存。
9. N,N-二甲基甲酰胺( HCON(CH3)2 )N,N-二甲基甲酰胺(DMF)中主要杂质是胺、氨、甲醛和水。
该化合物与水形成HCON(CH3)2·2H2O,在常压蒸馏时有些分解,产生二甲胺和一氧化碳,有酸或碱存在时分解加快。
精制方法:可用硫酸镁、硫酸钙、氧化钡或硅胶、4A分子筛干燥,然后减压蒸馏收集76℃/4.79kPa(36mmHg)馏分。
如果含水较多时,可加入10%(体积)的苯,常压蒸去水和苯后,用无水硫酸镁或氧化钡干燥,再进行减压蒸馏。
纯二甲基甲酰胺b.p. 153.0℃,n D 20 1.4305,d 420 0.9487。
精制后的二甲基甲酰胺有吸湿性,最好放入分子筛后,密封避光贮存。