高考化学离子浓度大小比较应用专题练习题
- 格式:doc
- 大小:27.00 KB
- 文档页数:2

校干市掉吃阳光实验学校离子浓度大小比拟1.一温度下,将Cl 2缓慢通入水中。
当通入的Cl 2体积为V 1时到达饱和,溶液中c (H +〕变化如以下图中曲线a 。
Cl 2表达中正确的选项是A .将饱和氯水加水稀释,溶液中c (H +)B .将饱和氯水升高温度,溶液中c (H +)变化如曲线cC .在饱和氯水中参加NaOH 使pH >7,所得溶液中存在以下关系: c (Na +)+c (H +)=c (Cl -)+c (OH -)+c (ClO -)D .在饱和氯水中参加NaOH 使pH =7,所得溶液中存在以下关系:c (Na +)>c (ClO -)>c (Cl -)>c (HClO)2、盐酸、醋酸和碳酸氢钠是生活中常见的物质。
以下表述正确的选项是A 、在NaHCO 3溶液中参加与其物质的量的NaOH ,溶液中的阴离子只有CO 23和OH -B 、NaHCO 3溶液中:c(H +)+c(H 2CO 3)=c(OH -)C 、10 mL0.10 mol·L -1CH 3COOH 溶液参加物质的量的NaOH 后,溶液中离子的浓度由大到小的顺序是:c(Na +)>c(CH 3COO -)>c 〔OH -〕>c(H +)D 、体积与pH 都相同的HCl 溶液和CH 3COOH 溶液所消耗的NaOH 物质的量相同 3、常温下,0.1mol .L -1某一元酸〔HA 〕的pH >1,在0.1mol .L -1某一元碱〔BOH 〕中H +和OH —离子物质的量浓度的关系为:c (H +) / c (OH -)=10-12,将这两种溶液体积混合,所得溶液各离子物质的量浓度关系正确的选项是A 、c (B +)>c (A -)>c (OH -)>c (H +) B 、c (A -)>c (B +)>c (H +)>c (OH -) C 、c (B +)+ c (H +) = c (OH -)+ c (A -) D 、c (B +)>c (A -)>c (H +)>c (OH -)4.某二元酸〔化学式用H 2A 表示〕在水中的电离方程式是:H 2A = H ++ HA -,HAH ++A 2-,又知0.1mol·L -1NaHA 溶液的pH = 2。

利用曲线判断溶液中离子浓度大小题组一浙江卷试题集训1.(2018·浙江11月选考,23)常温下,分别取浓度不同、体积均为20.00 mL的3种HCl溶液,分别滴入浓度为1.000 mol·L-1、0.100 0 mol·L-1和0.010 00 mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00 mL前后pH出现突跃。
下列说法不正确的是()A.3种HCl溶液的c(HCl):最大的是最小的100倍B.曲线a、b、c对应的c(NaOH):a>b>cC.当V(NaOH)=20.00 mL时,3个体系中均满足:c(Na+)=c(Cl-)D.当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大2.(2018·浙江4月选考,23)在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1盐酸,溶液pH随盐酸加入体积的变化如图所示。
下列说法正确的是()A.在a点的溶液中:c(Na+)>c(CO2-3)>c(Cl-)>c(OH-)>c(H+)B.在b点的溶液中:2n(CO2-3)+n(HCO-3)<0.001 molC.在c点的溶液pH<7,是因为此时HCO-3的电离能力大于其水解能力D.若将0.1 mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+) =c(CH3COO-)3.(2017·浙江11月选考,23)25 ℃时,在“H2A—HA-—A2-”的水溶液体系中,H2A、HA-和A2-三者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。
下列说法正确的是()A.在含H2A、HA-和A2-的溶液中,加入少量NaOH固体,α(HA-)一定增大B.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-) C.NaHA溶液中,HA-的水解能力小于HA-的电离能力D.在含H2A、HA-和A2-的溶液中,若c(H2A)+2c(A2-)+c(OH-)=c(H+),则α(H2A)和α(HA-)一定相等4.(2017·浙江4月选考,23)25 ℃时,在含CH3COOH和CH3COO-的溶液中,CH3COOH、CH3COO-二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示。

2020届高三化学专题:离子浓度大小比较1、下列溶液中微粒的物质的量浓度关系或说法正确的是( )A .将等物质的量的KHC 2O 4和H 2C 2O 4溶于水配成溶液:2c(K +)=c(HC 2O 4-)+c(H 2C 2O 4) B .pH 相等的①NH 4Cl 、②(NH 4)2SO 4、③NH 4HSO 4三种溶液中,c(NH 4+)大小:①>②>③C .0.1mol/L 的CH 3COOH 溶液加水稀释,c(H +)/ c(CH 3COO -)的比值将增大D .0.1mol/LCH 3COONa 溶液与0.15mol/LHCl 等体积混合:c(Cl -)>c(H +)>c(Na +)>c(CH 3COO -)>c(OH -) 2、下列说法一定正确的是( )A. c (NH 4+)相等的NH 4Cl 溶液中的c (Cl -)大于(NH 4)2Fe(SO 4)2溶液中c (SO 42-)B. 常温下,pH=1的醋酸与pH=13的NaOH 溶液混合后的溶液中:c (Na +)>c (CH 3COO -)>c (OH -)>c (H +)C. 浓度均为0.1mol·L -1的Na 2CO 3和NaHCO 3混合溶液中:2c (Na +)=3c (CO 32-)+3c (HCO 3-) D. 稀释氯化铵溶液过程中,NH 4+的水解程度和水的电离程度都增大 3、下列叙述正确的是( )A .常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4B .25℃时K sp (AgCl)=1.8×10—10,向AgCl 沉淀的溶解平衡体系中加入NaCl 固体,AgCl 的溶解度可能增大C .浓度均为0.1 mol·L -1的下列溶液,pH 由大到小的排列顺序为:NaOH>Na 2CO 3>(NH 4)2SO 4>NaHSO 4D .为确定H 2A 是强酸还是弱酸,可测NaHA 溶液的pH ,若pH >7,则H 2A 是弱酸;若pH<7,则H 2A 是强酸 4、25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )A .0.1mol•L ﹣1的Na 3PO 4溶液中:c (Na +)=3c (PO 43﹣)+2c (HPO 42﹣)+c (H 2PO 4﹣)B .0.1mol•L ﹣1的NaHS 溶液中:c (H +)+c (H 2S )=c (OH ﹣)+c (S 2﹣)C .0.1mol•L ﹣1的氨水与0.1mol•L ﹣1的NaHSO 4溶液等体积混合:c (Na + )=c (SO 42﹣)=c (NH 4+)>C (H +)>C (OH ﹣)D .0.1mol•L ﹣1的Na 2CO 3溶液与0.1mol•L ﹣1的NaHCO 3溶液等体积混合:c (Na +)>c (CO 32﹣)>c (HCO 3﹣)>c (OH ﹣) 5、关于溶液的下列说法正确的是( )A .2(H )(OH )110c c +--= ∶∶的溶液中223K Ba ClO CO ++--、、、一定能大量存在 B .水电离出来的13(H )10 mol /L c +-=的溶液中3K Cl NO I +---、、、一定能大量存在C .往0.1mol /L 3CH COOH 溶液中通入少量HCl ,醋酸的电离平衡向逆反应方向移动,且溶液中33(CH COOH)(H )(CH COO )c c c +-⋅增大D .等物质的量浓度的下列溶液:①23H CO ②23Na CO ③3NaHCO ④423(NH )CO 中23(CO )c -的大小关系为:②>④>③>①6、下列说法正确的是( )A .常温下0.4 mol·L -1 HB 溶液和0.2 mol·L -1NaOH 溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(Na +)>c (B -)>c (H +)>c (OH -)B .常温时,pH =2的CH 3COOH 溶液和HC1溶液、pH=12的氨水和NaOH 溶液,四种溶液中由水电离的c (H +)相等C .常温下0.1 mol·L -1的下列溶液①NH 4Al (SO 4)2②NH 4Cl ③NH 3·H 2O ④CH 3COONH 4中,c (NH 4+)由大到小的顺序是: ②>①>④>③D .0.lmol·L -1pH 为4的NaHB 溶液中:c (HB -)>c (H 2B )>c (B 2-) 7、25℃时,浓度均为1 mol /L 的AX 、BX 、AY 、BY 四种正盐溶液,AX 溶液的pH=7且溶液中c(X -) =1 mol /L ,BX 溶液的pH=4, BY 溶液的pH=6。
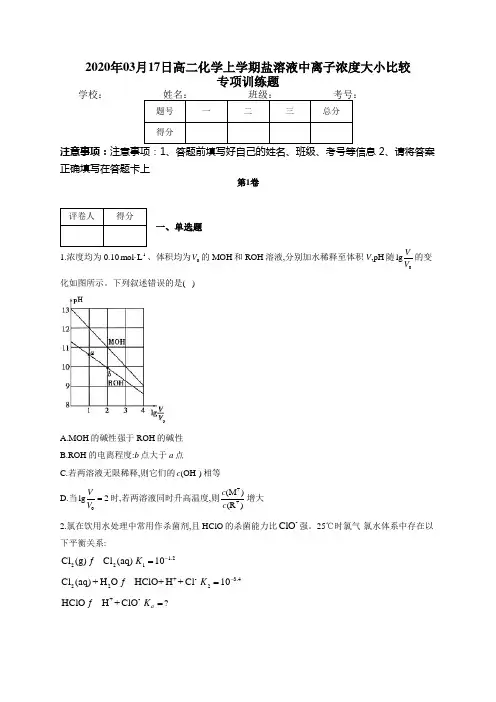
2020年03月17日高二化学上学期盐溶液中离子浓度大小比较专项训练题学校:___________注意事项: 2、请将答案正确填写在答题卡上第1卷一、单选题1.浓度均为0.10-1mol L ⋅、体积均为0V 的MOH 和ROH 溶液,分别加水稀释至体积V ,pH 随0lg VV 的变化如图所示。
下列叙述错误的是( )A.MOH 的碱性强于ROH 的碱性B.ROH 的电离程度:b 点大于a 点C.若两溶液无限稀释,则它们的-(OH )c 相等D.当0lg 2VV =时,若两溶液同时升高温度,则++(M )(R )c c 增大2.氯在饮用水处理中常用作杀菌剂,且HClO 的杀菌能力比-ClO 强。
25℃时氯气-氯水体系中存在以下平衡关系:1.2221Cl (g)Cl (aq)10K -=ƒ+- 3.4222Cl (aq)+H O HClO+H +Cl 10K -=ƒ +-HClO H +ClO a K =ƒ?其中2Cl (aq)、HClO 和-ClO 分别在三者中所占分数(α)随变化的关系如图所示。
下列表述正确的是( )A.+--10.922Cl (g)+H O 2H +ClO +Cl 10K -=ƒB.在氯处理水体系中,-+-(HClO)(ClO )(H )(OH )c c c c +=- C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差 D.氯处理饮用水时,在夏季的杀菌效果比在冬季好3.如图表示水中+(H )c 和-(OH )c 的关系,下列判断错误的是( )A.两条曲线间任意点均有+-w (H )(OH )c c K ⨯=B.M 区域内任意点均有+-(H )(OH )c c < C.图中12T T <D.XZ 线上任意点均有pH=74.某温度下,相同pH 的盐酸和醋酸溶液分别稀释,pH 随溶液体积变化的曲线如图所示。
据图判断正确的是( )A.Ⅱ为盐酸稀释时pH 变化曲线B.b 点溶液的导电性比c 点溶液的导电性强C.a 点w K 的数值比c 点w K 的数值大D.b 点酸的总浓度大于a 点酸的总浓度5.25℃时,用2Na S 沉淀2+Cu 、2+Zn 两种金属离子(用2+M 表示),所需2-S 最低浓度(-1mol L ⋅)的对数值lg c (2-S )与lg c (2+M )的关系如图所示。

高三题型专练题型八-离子浓度大小比较题型八离子浓度大小比较高考真题1. (2016 课标 I )298 K 时,在 20.0mL0.10mol L 1 氨水中滴入0.10 mol L 1的盐酸,溶液的pH 与所加盐酸的体积关系如图所示。
已知0.10 mol L 1氨水的电离度为 1.32%,下列有关叙述正确的是( A. 该滴定过程应该选择酚酞作 剂 B. M 点对应的盐酸体积为20.0 C. M 点处的溶液中 c (NH/) = c (Cl _) = c (H +) = c (OH _)D. N 点处的溶液中pH<12 【答案】D2. (2016天津)室温下,用相同浓度 的NaOH 溶液,分别滴定浓度均为0.1mol • L "1的三种酸(HA 、HB 和 HD ) 溶液,滴定的曲线如图所示,下列判 断错误的是()A. 三种酸的电离常数关系:K HA >K HB >K HD)为指示mLB. 滴定至 P 点时,溶液中:C (B — )>c (NaJ>c (HB)>c (H +)>C (OH )C. pH=7 时,三种溶液中:C (A —)=C (B —)=C (D —)D. 当中和百分数达100%寸,将三种溶液混合后:— +C (HA) + C (HB) + c (HD)=c (OH) — C (H )【答案】C3. (2016江苏)H 2C 2O 为二元弱酸。
20°C 时,配制一组C (H 2C 2O)+ C (HGO )+ c (C 2O2)=0.100 mol ・L -1的HC 2O 和NaOH 昆合溶液,溶 液中部分微粒的物质的量浓度随 pH 的 变化曲线如图所示。
下列指定溶液中 微粒的物质的量浓度关系一定正确的 是()A. pH=2.5 的溶液中:C (H 2C 2O)+C (C 2O ) >C (HC 2O -)B. c(Na +)=0.100 mol ・L -1的溶液中:C (H +)+C (H 2C 2O)=C (OH—2 —)+c (C 2O )C. c (HGO —)=c (C 2O 2 —)的溶液中:c (Na +) >0.100 mol ・ L—1+C (HC 2Q )D. pH=7 的溶液中:c (Na +) >2c (C 2。

2014年高考化学专题训练 离子浓度的大小比较1.常温下a mol·L -1稀氨水和b mol·L -1稀盐酸等体积混合,对混合后溶液判断一定正确的是( )A .若a =b ,则c (NH +4)=c (Cl -)B .若a >b ,则c (NH +4)>c (Cl -)C .若a >b ,则c (OH -)>c (H +)D .若a <b ,则c (OH -)<c (H +)2.醋酸钡[(CH 3COO)2Ba·H 2O]是一种媒染剂,下列是有关0.1 mol·L -1醋酸钡溶液中粒子浓度的比较,其中错误的是 ( )A .c (Ba 2+)>c (CH 3COO -)>c (OH -)>c (H +)B .c (H +)+2c (Ba 2+)=c (CH 3COO -)+c (OH -)C .c (H +)=c (OH -)-c (CH 3COOH)D .2c (Ba 2+)=c (CH 3COO -)+c (CH 3COOH)3.室温时,将V 1 mL c 1 mol·L -1的NaOH 溶液滴加到V 2 mL c 2 mol·L -1的醋酸中,下述结论中正确的是 ( ) A .若混合溶液的pH =7,则c 1V 1>c 2V 2B .若V 1=V 2、c 1=c 2,则混合溶液中c (Na +)=c (CH 3COO -)C .若混合溶液的pH =7,则混合溶液中c (Na +)=c (CH 3COO -)D .若V 1=V 2,且混合溶液的pH >7,则一定有c 1>c 24.下列有关溶液中粒子浓度的关系式中,正确的是 ( ) A .pH 相同的①CH 3COONa 、②NaHCO 3、③ONa 三种溶液中的c (Na +):③>②>①B .0.1 mol·L -1某二元弱酸强碱盐NaHA 溶液中:c (Na +)=2c (A 2-)+c (HA -)+c (H 2A)C .下图中pH =7时:c (Na +)>c (CH 3COO -)>c (OH -)=c (H +)D .上图中a 点溶液中各离子浓度的关系是:c (OH -)=c (H +)+c (CH 3COO -)+2c (CH 3COOH)5.常温下,0.1 mol·L -1氨水溶液中c (H +)c (OH -)1×10-8,下列叙述错误的是( ) A .该溶液中氢离子的浓度:c (H +)=1×10-9 mol·L -1B .0.1 mol·L -1氨水溶液与0.1 mol·L -1 HCl 溶液等体积混合后所得溶液中:c (NH +4)+c(H+)=c(Cl-)+c(OH-)C.0.1 mol·L-1的氨水溶液与0.05 mol·L-1 H2SO4溶液等体积混合后所得溶液中:c(NH+4)+c(NH3·H2O)=2c(SO2-4)D.浓度均为0.1 mol·L-1的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH+4)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)6.20 ℃时向20 mL 0.1 mol·L-1醋酸溶液中不断滴入0.1 mol·L-1 NaOH(aq),溶液pH变化如图所示。

1.【2022年辽宁卷】甘氨酸()22NH CH COOH 是人体必需氨基酸之一、在25℃时,+32NH CH COOH 、+-32NH CH COO 和-22NH CH COO 的分布分数【如()()()()()2-2--2-2c A δA =c H A +c HA +c A 】与溶液pH 关系如图。
下列说法错误的是A .甘氨酸具有两性B .曲线c 代表-22NH CH COOC .+-+-32232NH CH COO +H O NH CH COOH+OH 的平衡常数-11.65K=10D .()()()2+--32322+2c NH CH COO <c NH CH COOH c NH CH COO ⋅ 2.(2021·广东真题)鸟嘌呤(G )是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl 表示)。
已知GHCl 水溶液呈酸性,下列叙述正确的是A .0.001mol/L GHCl 水溶液的pH 3=B .0.001mol/L GHCl 水溶液加水稀释,pH 升高C .GHCl 在水中的电离方程式为:GHCl G HCl =+D .GHCl 水溶液中:--+c(OH )+c(Cl )=c(GH )+c(G)3.(2021·山东真题)赖氨酸[H 3N +(CH 2)4CH(NH 2)COO -,用HR 表示]是人体必需氨基酸,其盐酸盐(H 3RCl 2)在水溶液中存在如下平衡:H 3R 2+1K H 2R +2K HR 3K R -。
向一定浓度的H 3RCl 2溶液中滴加NaOH 溶液,溶液中H 3R 2+、H 2R +、HR 和R -的分布系数δ(x)专题49 溶液中粒子浓度大小比较随pH 变化如图所示。
已知δ(x)=2++32c(x)c(H R )+c(H R )+c(HR)+c(R )-,下列表述正确的是A .21K K >32K K B .M 点,c (Cl -) +c (OH -)+c (R -)=2c (H 2R +)+c (Na +)+c (H +)C .O 点,pH=23-lgK -lgK 2D .P 点,c (Na +)>c (Cl -)>c (OH -)>c (H +)4.(2021.6·浙江真题)取两份10mL 10.05mol L -⋅的3NaHCO 溶液,一份滴加-10.05mol L ⋅的盐酸,另一份滴加10.05L NaOH mol -⋅溶液,溶液的pH 随加入酸(或碱)体积的变化如图。

例1.下列浓度关系正确的是A .氯水中:c (Cl 2)=2c (ClO -)+c (Cl -)+C(HCl);B .氯水中:c (Cl -)>c (H +)>c (OH -)>c (ClO -)C .等体积等浓度的氢氧化钠与醋酸混合:c (Na +)=c (CH 3COO -)D .Na 2CO 3溶液中:c (Na +)>c (CO 32-)>c (OH -)>c (HCO 3-)>c (H +)解析:氯气在水中与水反应是可逆反应,物料守恒不成立,A 错误;Cl 2+H 2O=HCl+HClO ,HCl 中电离的H +与Cl -浓度相等,再加上HClO 会电离出H +,所以H +浓度一定大于Cl -浓度,B错误;等体积等浓度的氢氧化钠与醋酸混合恰好完全反应生成醋酸钠,因CH 3COO -水解,所以Na +浓度大于CH 3COO -的浓度,C 错误。
答案:D 。
例2.下列各溶液中,微粒的物质的量浓度关系正确的是A .0.1mol ·L -1 Na 2CO 3溶液:c (OH -)=c (HCO 3-)+c (H +)+2c (H 2CO 3)B .0.1mol ·L -1NH 4Cl 溶液:c (NH 4+)=c (Cl -)C .向醋酸钠液中加适量醋酸得酸性混合液:c (Na +)>c (CH 3COO -)>c (H +)>c (OH -)D .向硝酸钠溶液中滴加稀盐酸得到的pH =5的混合溶液:c (Na +)=c (NO 3-)解析: A 根据质子守恒,水电离出的H +和OH -的物质的量相等,Na 2CO 3溶液中H +分别以HCO 3-、H +、H 2CO 3形式存在,故A 对,B 中由于NH 4+水解,c (NH 4+与c (Cl -)不等,B 错,C 中电荷守恒有:c (Na +)+ c (H +)==c (OH -)+ c (CH 3COO -),因为c (H +)>c (OH -),故c (CH 3COO -)>c (Na+),C 错。

高中化学离子浓度大小比较练习题一、单选题1.25 °C 时,23H CO ,的-7al K =4. 210´,-11a2K =5. 610´。
室温下向10 mL0. 1-1mol L ×23Na CO 中逐滴加入0. 1 -1mol L ×HCl 。
图是溶液中含C 微粒物质的量分数随pH 降低而变化的图像(2CO 因有逸出未画出)。
下列说法错误的是( ) A.A 点溶液的pH<11 B.B 点溶液:()()()()-2-33+23c Na =c HCO +c +c H O CO C C.A→B 的过程中,离子反应方程式为:2-+33C H HCO O +===D.分步加入酚酞和甲基橙,用中和滴定法可测定23Na CO ,与3NaHCO ,混合物组成2.实验测得0.5mol·0.5mol·L L −1CH 3COONa 溶液、0.5mol·0.5mol·L L −1 CuSO 4溶液以及H 2O 的pH 随温度变化的曲线如图所示。
下列说法正确的是( ) A. 随温度升高,纯水中c(H +)>c(OH −) B. 随温度升高,CH 3COONa 溶液的c(OH −)减小C. 随温度升高,CuSO 4溶液的pH 变化是K w 改变与水解平衡移动共同作用的结果D. 随温度升高,CH 3COONa 溶液和CuSO 4溶液的pH 均降低,是因为CH 3COO −、Cu 2+水解平衡移动方向不同3.25 °C 时,改变0. 1 mol/L 弱酸RCOOH 溶液的pH ,溶液中RCOOH 分子的物质的量分数()δRCOOH 随之改变[已知-c ()δ()c RCOOH RCOOH =RCOOH RC )+c(OO ()],甲酸(HCOOH)与丙酸32CH CH C )OOH (溶液中()δRCOOH 与pH 的关系如图所示。

2020届高考化学二轮题型对题必练——不同溶液中离子浓度大小的比较1.关于水溶液中的离子平衡,下列说法正确的是A. 往稀溶液中加入NaOH固体,溶液中变大B. 等物质的量浓度的、、三种溶液中,的大小顺序为:C. 常温下的溶液和的NaOH溶液等体积混合,溶液中离子浓度大小顺序为:D. 的溶液中:2.下列说法正确的是A. 相同物质的量浓度的下列溶液中,、、、;由大到小的顺序:B. 某物质的溶液中由水电离出的,若时,则该溶液的pH一定为C. 物质的量浓度相等的和NaHS混合溶液中:D. AgCl悬浊液中存在平衡:,往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小3.已知HA的酸性弱于HB的酸性。
时,用NaOH固体分别改变物质的量浓度均为的HA溶液和HB溶液的溶液的体积变化忽略不计,溶液中、的物质的量浓度的负对数与溶液的pH的变化情况如图所示。
下列说法正确的是()A. 曲线Ⅰ表示溶液的pH与的变化关系B.C. 溶液中水的电离程度:D. N点对应的溶液中点对应的溶液中4.某温度下,某二元弱碱的、,向稀溶液中滴加等物质的量浓度的盐酸,、、的物质的量分数与溶液的变化关系如图所示。
下列说法正确的是A. 交点a处对应加入盐酸的体积为B. 当加入盐酸的体积为时,存在C. 交点b处D. 当加入盐酸的体积为时,存在5.剧毒物氰化钠固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。
已知部分弱酸的电离平衡常数如下表:下列选项错误的是A. 向NaCN溶液中通入少量的发生的离子反应为:B. 处理含废水时,如用NaOH溶液调节pH至9,此时C. 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者D. 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者6.下列说法正确的是A. 等物质的量浓度的溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为B. 常温下电离常数为Ka的酸HA的溶液中C. 常温下同浓度的强酸和强碱溶液等体积混合后,由水电离出的D. 已知298K时氢氰酸的,碳酸的、,据此可推测出将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生7.已知常温下氢硫酸的电离平衡常数为,。

专题14电解质溶液中离子浓度的关系疑难突破方向1物料守恒例1在25mL0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是()A.A.B之间任意一点,溶液中一定都有c(Na+)>c(CH3COO−)>c(OH−)>c(H+)B.B点,a>12.5,且有c(Na+)=c(CH3COO−)>c(OH−)>c(H+)C.C点:c(Na+)>c(CH3COO−)>c(H+)>c(OH−)D.D点:c(CH3COO−)+c(CH3COOH)=2c(Na+)【解析】A.本实验是用CH3COOH滴定NaOH,A.B间溶液中溶质为NaOH和CH3COONa,当n(NaOH)>n(CH3COONa),会出现c(Na+)>c(OH−)>c(CH3COO−)>c(H+),故A错误;B.当NaOH和CH3COOH 恰好完全反应时,溶质为CH3COONa,溶液显碱性,B点对应的pH=7,即此时溶液中的溶质为CH3COONa 和CH3COOH,a>12.5,有c(Na+)=c(CH3COO−)>c(H+)=c(OH−),故B错误;C.C点溶液显酸性,即c(H+)>c(OH−),根据电荷守恒,有c(CH3COO−)>c(Na+)故C错误;D.D点时加入25mL醋酸,反应后溶质为CH3COONa和CH3COOH,且两者物质的量相等,依据物料守恒,推出c(CH3COO−)+c(CH3COOH)=2c(Na+),故D正确。
【答案】D方向2电荷守恒例225℃时,将0.1mol NaOH固体加入1.0L浓度为x mol·L−1的HR溶液中(忽略溶液体积、温度变化),充分反应后向混合液中加入HR或NaR固体,溶液中lg()()c Hc OH+-变化如图。
下列叙述正确的是()A .b 点对应的溶液中c(Na +)>c(R −)B .c 点对应的溶液中R -浓度不能确定C .A.B.c 点对应的溶液中,K a (HR)均为70.2100.1x -⨯-D .A.B.c 点对应的溶液中,水的电离程度:a>b>c【解析】b 点时,溶液为0.1mol NaOH 固体加入1.0L 浓度为x mol·L −1的HR 溶液中充分反应后的溶液,lg()()c H c OH+-≈4,25℃时,c(H +)×c(OH −)=10-14,则c(H +)=10−5mol/L ,同理c 点时,溶液呈中性;a 点c(H +)=10−3mol/L 。
离子浓度大小比较精选(选择题30题)1.20 mL1 mol / L醋酸溶液跟40 mL0.5 mol / L氢氧化钠溶液相混合,所得溶液中离子浓度由大到小的顺序是(Ac-代表醋酸根离子)A. c(Na+)>c(Ac-)>c(OH-)>c(H+)B. c(Na+)=c(Ac-),c(Ac-)>c(OH-)>c(H+)C. c(Na+)>c(OH-)>c(Ac-)>c(H+)D. c(Na+)>c(OH-)>c(H+)>c(Ac-)2.将0.2 mol / L CH3COOK与0.1 mol / L盐酸等体积混合后,溶液中下列微粒的物质的量浓度的关系正确的是A. c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)B. c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)C. c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)D. c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)3.将20 mL 0.1 mol / L的醋酸与24 mL 0.1 mol / L的氢氧化钠混合后,溶液中各离子摩尔浓度由大到小的顺序是A. c(Na+)>c(CH3COO-)>c(H+)>c(OH-)B. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)C. c(OH-)>c(Na+)>c(H+)>c(CH3COO-)D. c(Na+)>c(OH-)>c(H+)>c(CH3COO-)4.在氯化铵溶液中,下列关系式正确的是A. c(Cl-)>c(NH4+)>c(H+)>c(OH-)B. c(NH4+)>c(Cl-)>c(H+)>c(OH-)C. c(Cl-)=c(NH4+)>c(H+)=c(OH-)D. c(NH4+)=c(Cl-)>c(H+)>c(OH-)5.明矾溶液中各种离子的物质的量浓度大小关系能够确定的是A.c(K+)>c(Al3+)B.c(K+)=c(Al3+)C.c(H+)=c(OH-)D.c(Al3+)<c(H+) 6.100 mL 0.1 mol / L醋酸与50 mL 0.2 mol / L氢氧化钠溶液混合,在所得溶液中A. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)B. c(Na+)>c(CH3COO-)>c(H+)>c(OH-)C. c(Na+)>c(CH3COO-)>c(H+)=c(OH-)D. c(Na+)=c(CH3COO-)>c(OH-)>c(H+)7.将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是A. c(NH4+)>c(Cl-)>c(H+)>c(OH-)B. c(NH4+)>c(Cl-)>c(OH-)>c(H+)C. c(Cl-)>c(NH4+)>c(H+)>c(OH-)D. c(Cl-)>c(NH4+)>c(OH-)>c(H+)8.物质的量浓度相同的下列溶液中,NH 4+最大的是A. NH 4ClB. NH 4HSO 4C. CH 3COONH 4D. NH 4HCO 39.在物质的浓度均为0.01 mol / L 的CH 3COOH 和CH 3COONa 的混合液中,测得c (CH 3COO -)>c (Na +),则下列关系式正确的是A. c (H +)>c (OH -}B. c (H +)<c (OH -)C. c (CH 3COOH )>c (CH 3COO -)D. c (CH 3COOH )+c (CH 3COO -)=0.02 mol / L10. 0.1 mol ·L -1 NaOH 和0.1 mol ·L -1 NH 4Cl 溶液等体积混合后,离子浓度大小正确的次序是A. c (Na +)>c (Cl -)>c (OH -)>c (H +)B. c (Na +)=c (Cl -)>c (OH -)>c (H +)C. c (Na +)=c (Cl -)>c (H +)>c (OH -)D. c (Cl -)>c (Na +)>c (OH -)>c (H +)11.将0.1 mol 下列物质置于1 L 水中充分搅拌后,溶液中阴离子数最多的是A. KClB. Mg(OH)2C. Na 2CO 3D. MgSO 412.将100 mL 0.1 mol / L 的BaCl 2溶液加入到100 mL 0.2 mol / L 的H 2SO 4溶液中,则溶液中存在的离子浓度关系是A . c (H +)>c (Cl -)>c (Ba 2+)>c (-24SO )B . c (Cl -)>c (H +)>c (-24SO )>c (Ba 2+) C . c (H +)>c (-24SO )>c (Ba 2+)>c (Cl -) D . c (Cl -)>c (H +)>c (Ba 2+)>c (-24SO ) 13.等体积、等浓度的MOH 强碱溶液和HA 弱酸溶液混合后,混合液中有关离子的浓度应满足的关系是A. c (M +)>c (OH -)>c (A -)>c (H +)B. c (M +)>c (A -)>c (H +)>c (OH -)C. c (M +)>c (A -)>c (OH -)>c (H +)D. c (M +)+c (H +)=c (A -)+c (OH -)14.有五瓶溶液分别是:① 10 mL 0.60 mol·L -1 NaOH 水溶液,② 20 mL 0.50 mol·L -1H 2SO 4水溶液,③ 30 mL 0.40 mol·L -1 HCl 水溶液,④ 40 mL 0.30 mol·L -1 HAc 水溶液,⑤ 50 mL 0.20 mol·L -1 蔗糖水溶液。
离子浓度大小的比较专题训练1. 有五瓶溶液分别是①10毫升0.60摩/升NaOH水溶液②20毫升0.50摩/升硫酸水溶液③30毫升0.40摩/升HCl溶液④40毫升0.30摩/升CH3COOH水溶液⑤50毫升0.20摩/升蔗糖水溶液。
以上各瓶溶液所含离子、分子总数的大小顺序是A.①>②>③>④>⑤B.②>①>③>④>⑤C.②>③>④>①>⑤D.⑤>④>③>②>①2.在25℃时,在浓度为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其c(NH4+)分别为a、b、c(单位mol/L)。
下列判断正确的是A. a=b=cB. a>b>cC. a>c>bD. c>a>b3. 在Na2CO3溶液中,下列关系不正确的是A. c(Na+) < c(HCO3-)+2c(CO32-)B. c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)C. c(OH-) - c(H+)= c(HCO3-)+2c(H2CO3)D.c(Na+)> c(CO32-)> c(OH-)>c(HCO3-)>c(H2CO3)4. 在0.1 mol·L-1的NaHCO3溶液中,有关微粒浓度的关系正确的是A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) B.c(Na+)+c(H+) = c(HCO3-)+c(CO32-)+c(OH-)C.c(Na+) = c(HCO3-)+c(CO32-) D. c(HCO3-)+2c(CO32-)+c(OH-) - c(H+) = 0.1 mol·L-15. 草酸是二元弱酸,草酸氢钾溶液pH< 7,在0.1mol/lKHC2O4溶液中,下列关系正确的是A . c (K+)+ c (H+) > c (OH-)+ c (H2C2O4)+ 2c (C2O42-) B. c (HC2O4-)+ c (C2O42-) = 0.1mol/lC. c (C2O42-) : c (H2C2O4) < 1D. c (K+) = c (HC2O4-)+ c (H2C2O4)+2 c (C2O42-) 6.已知NaHSO4在水溶液中的电离方程式为NaHSO4=Na++H++SO42-。
高中化学学习材料金戈铁骑整理制作母题二十:离子浓度大小比较【母题来源】(2013四川卷·5)【母题原题】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:实验编号起始浓度/(mol·L-1)反应后溶液的pH c(HA)c(KOH)①0.1 0.1 9②x 0.2 7下列判断不正确...的是A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=K w1×10-9mol/LC.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)【答案】B【试题解析】根据题目给定的信息可知一元酸HA与一元碱KOH是等浓度等体积混合。
根据酸碱中和反应HA+KOH=KA+H2O。
二者恰好完全反应得到正盐KA。
KOH是强碱。
若HA是强酸,则KA为强酸强碱盐,电离产生的离子不会消耗水电离产生的H+或OH-离子,水的电离平衡不发生移动,C(H+)=C(OH-).溶液的PH=7. 若HA是弱酸,则KA为强碱弱酸盐,电离产生的弱酸根离子A-会与水电离产生的H+结合产生弱酸HA,破坏了水的电离平衡,由于消耗了水的电离水电离产生的H+,C(H+)减小,水的电离平衡正向移动,直至达到新的平衡状态,这时由于C(H+)<C(OH-).所以溶液显碱性,PH>7.A.由表的信息可知实验①的溶液显碱性,则证明HA是弱酸,根据电荷守恒可知c(K+)+c(H+)=c(A-)+c(OH-),而c(H+)<c(OH-),所以c(K+)>c(A-)。
盐水解的程度是很微弱的,盐电离产生的离子浓度原大于水电离产生的离子的浓度,所以c(K+)>c(A-)>c(OH-)>c(H+)。
高中化学离子浓度大小比较练习题一、单选题1.25 C°时, H2 CO3,的 K al =4. 2 10-7 , K a2 =5. 6 10-11。
室温下向 10 mL0. 1 mol L-1 Na 2 CO3中逐滴加入 0. 1 mol L-1 HCl 。
图是溶液中含 C 微粒物质的量分数随 pH 降低而变化的图像( CO2因有逸出未画出)。
下列说法错误的是( )A.A 点溶液的pH<11B.B点溶液: c Na+ =c HCO3- +c CO32- +c H2 CO3C.A →B的过程中,离子反应方程式为:CO23-H +HCO 3D.分步加入酚酞和甲基橙,用中和滴定法可测定Na 2CO 3,与 NaHCO 3,混合物组成- 1- 12.实验测得0.5mol ·L CH 3COONa 溶液、 0.5mol L· CuSO4溶液以及 H 2O 的 pH 随温度变化的曲线如图所示。
下列说法正确的是( )A. 随温度升高,纯水中c(H +)>c(OH - )B.随温度升高, CH3COONa 溶液的 c(OH - )减小C.随温度升高, CuSO4溶液的 pH 变化是 K w改变与水解平衡移动共同作用的结果D.随温度升高, CH3COONa 溶液和 CuSO4溶液的 pH 均降低,是因为 CH 3COO -、 Cu 2+水解平衡移动方向不同3.25 C°时,改变0. 1 mol/L弱酸RCOOH溶液的pH,溶液中RCOOH 分子的物质的量分数δRCOOH 随之改变 [ 已知δ(RCOOH )=c(RCOOH )- ] ,甲酸(HCOOH) 与丙酸c(RCOOH )+c( RCOO )(CH 3CH 2COOH ) 溶液中 δRCOOH 与 pH 的关系如图所示。
下列说法正确的是( )A. 图中 M 、 N 两点对应溶液中的c(OH - ) 比较:前者 >后者B.丙酸的电离常数 K= 104.88C.等浓度的 HCOONa 和 CH 3 CH 2 COONa 两种榕液的pH 比较:前者 > 后者D. 将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶 液 等 体 积 混 合 , 所 得 溶 液中 :c Na >c HCOOH >c HCOO - >c OH ->c H +4.常温下 ,Ksp(CaF 2)=4 × 10 -9,K sp (CaSO 4 )=9.1×10 -6。
第11小题离子共存及离子浓度大小的比较1.常温下,下列各组离子在指定溶液中可能大量共存的是 ( )A. 澄清透明的溶液中:Fe 3+、Mg 2+、SCN –、Cl –B. 由水电离产生的c (H +) = 10-13 mol·L -1的溶液:K +、Na +、CH 3COO -、AlO -2C. c (Fe 2+) = 1 mol·L -1的溶液中:H +、NH +4、NO -3、SO 2-4D. pH = 1的溶液中:Ba 2+、Mg 2+、HCO -3、SO 2-42.下列说法正确的是A .25℃时,在Mg(OH)2的悬浊液中加入少量的NH 4Cl 固体,c (Mg 2+)将减小B .SiO 2(s)+2C(s)=Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H >0C .常温下,NH 4Cl 溶液加水稀释,)NH ()H ()O H NH (423++⋅⋅c c c 增大D .C(s)+H 2O(g)CO(g)+H 2(g)(△H >0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动3.某温度下,水溶液中c (H +)与c (OH -)有如图所示关系。
下列条件下,能够大量共存的一组离子是A .a 点对应的溶液: CO 2-3、Cl -、Al 3+、SO 2-4B .b 点对应的溶液:I -、Mg 2+、K +、ClO -C .c 点对应的溶液:Na +、S 2-、F -、NH +4D .a 点对应的溶液: Na +、K +、SO 2-4、Cl -4. 温下,下列各组离子在指定溶液中一定能够大量共存的是A.无色透明溶液中:Na +、Fe 3+、Cl -、I -B. -pH=12的溶液中:Mg 2+、K +、CH 3COO -、SO 42-C. 1 mol·L -1的AlCl 3溶液中:NH 4+、Ba 2+、H +、NO 3-D. 由水电离出的c (H +) = 1×10-13 mol·L -1的溶液中:Na +、K +、Cl -、CO 32-5.常温时,向20mL 0.1 mol/L 的CH 3COOH 溶液中逐滴滴加0.1 mol/L 的NaOH 溶液,滴入NaOH 溶液的体积与溶液pH 的变化如图所示。
冠夺市安全阳光实验学校第12题离子浓度大小比较单项选择题每小题只有一个选项符合题意1.下列关于电解质溶液的判断正确的是( ) A.60 ℃时,NaCl溶液的pH<7,则溶液中c(OH-)<c(H+)B.将pH=4的CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小C.常温下,CH3COOH分子可能存在于pH>7的碱性溶液中D.相同温度下,1 mol·L-1氨水与0.5 mol·L-1氨水中c(OH-)之比是2∶1答案C解析60 ℃时,NaCl溶液的pH<7,但溶液仍呈中性c(OH-)=c(H+),A不正确;CH3COOH溶液加水稀释,c(H+)减小,根据水的离子积常数可知c(OH-)增大,B不正确;在CH3COONa碱性溶液中,CH3COO-发生水解产生CH3COOH分子,C正确;浓度越稀电离程度越大,所以0.5 mol·L-1氨水电离程度大,溶液中c(OH-)之比小于2∶1,D不正确。
2.下列有关二元弱酸H2A的盐溶液的说法,正确的是( )A.在NaHA溶液中:c(Na+)>c(HA-)>c(OH-)>c(H+)B.在NaHA溶液中:c(Na+)>c(HA-)>c(H+)>c(OH-)C.在Na2A溶液中c(Na+)=c(HA-)+c(OH-)+c(A2-)D.在Na2A溶液中c(OH-)=c(H+)+c(HA-)+2c(H2A)答案D解析若HA-的电离大于水解,则溶液显酸性,如HSO-3;若HA-的水解大于电离,则溶液显碱性,如HCO-3;A、B错。
由电荷守恒知,C错。
由物料守恒知,D对。
3.下列有关溶液中粒子浓度关系的比较中不正确的是( )A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)B.用0.100 0 mol·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,恰好反应时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)C.pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=c(Na+)答案D解析A项符合电荷守恒,正确;B项恰好反应时,溶质只有CH3COONa,CH3COO-水解溶液呈碱性,则离子浓度大小顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H +),正确;C项,反应中HA与MOH无论哪种物质过量,或是两者恰好反应,溶液中的电荷是守恒的,正确;D项,从反应前的物质的量来看,n(CH3COOH)与n(CH3COO-)之和与n(Na+)之比为2∶1,则得物料守恒式:c(CH3COOH)+c(CH3COO-)=2c(Na+),错误。
盐类水解应用练习题
1. 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A. c(NH4+)=c(SO42-)
B. c(NH4+)>c(SO42-)
C. c(NH4+)<c(SO42-)
D. c(OH-)+c(SO42-)=c(H+)+c(NH4+)
2. 室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A. 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B. 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C. pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D. pH=4的盐酸和pH=l0的氨水
3.将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的
是
A. c(HCN)<c(CN-)
B. c(Na+)>c(CN-)
C. c(HCN)-c(CN-)=c(OH-)
D. c(HCN)+c(CN-)=0.1mol/L
4. 将0.2mol/L醋酸钾溶液与0.1mol/L盐酸等体积混合后,溶液中有关离子浓度的关系,正确的是
A. c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
B. c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. c(CH3COO-)>c(Cl-)=c(H+)>c(CH3COOH)
D. c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)
5. 若pH=3的酸溶液与pH=11的碱溶液等体积混合后溶液呈碱性,其原因可能是
A. 生成了一种强碱弱酸盐
B. 强酸溶液和弱碱溶液反应
C. 弱酸溶液和强碱溶液反应
D. 一元强酸溶液和一元强碱溶液反应
6. 常温下在10mL pH=10的KOH溶液中,加入pH=4的一元酸HA溶液至pH刚好等于7(假设反应前
后体积不变),则对反应后溶液的叙述正确的是
A. c(A-)=c(K+)
B. c(H+)=c(OH-) <c(K+)<c(A+)
C. V(总)≥20mL
D. V(总)≤20mL
7. 下列叙述正确的是
A. 0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B. 10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20
mL,则溶液的pH=12
C. 在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D. 0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
8. 叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A. HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B. HN3与NH3作用生成的叠氮酸铵是共价化合物
C. NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯) >c(OH¯)>c(H+)
D. N3¯与CO2含电子数相等
9. 关于小苏打水溶液的表述正确的是
A. c (Na+)=c (HCO3-) + c (CO32-) + c (H2CO3)
B. c (Na+) + c (H+) = c (HCO3-) + c (CO32-) +c (OH-)
C. HCO3-的电离程度大于HCO3-的水解程度
D. 存在的电离有:NaHCO3=Na++HCO3-,HCO3-H+ + CO32- H2O H++OH-
10. 草酸是二元弱酸,草酸氧钾溶液呈酸性。
在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A. c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
B. c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C. c(C2O42-)>c(H2C2O4)
D. c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
11. 下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10mL0.1mol·L-1氨水与10mL0.1mol·L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. 10mL0.1mol/LNH4Cl溶液与5mL0.2mol/LNaOH溶液混合
(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10mL0.1mol/L醋酸溶液与5mL0.2mol/LNaOH溶液混合(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D. 10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合,c(Cl-)c(Na+)>c(OH-)>c(H+)
12、(2006海淀)下列混合溶液中,各离子浓度的大小顺序正确的是()
A.5mL0.2mol/L NH3·H2O和5mL 0.2mol/L HCl混合:
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.15mL 1mol/L CH3COONa溶液和8mL 2mol/L HCl溶液混合:
c(Cl-)>c(Na+)>c(OH-)>c(H+)
C.20mL 0.2mol/L CH3COOH溶液和10mL 0.4mol/L NaOH溶液混合:
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.20mL0.1mol/L NH4Cl溶液和10mL 0.2mol/L NaOH溶液混合:
c(Na+)=c(Cl-)>c(OH-)>c(H+)
13. (1)等体积的下列溶液中,阳离子的总物质的量最大的是:①0.2mol/L的CuSO4溶液,②0.1mol/L 的Na2CO3溶液,③0.2mol/L的KCl溶液,④0.1mol/L的Na2SO4溶液。
_________
(2)浓度为0.100mol/L的下列各物质的溶液中,c(NH4+)由大到小的顺序是_
①NH4Cl ②NH4HSO4③NH3·H2O ④CH3COONH4
14. (1)一种一元强酸HA溶液中加入一种碱MOH后,溶液呈中性,则A-与M+物质的量浓度的大小关
系为:c(A-)___c(M+)。
(填“=”、“<”、“>”、“无法判断”等)
(2)等体积等浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中的各离子浓度的大小关系为:____________________
(3)在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa混合溶液中,测得c(Na+)<c(CH3COO -),则c(CH3COO-)+c(CH3COOH)____0.02mol/L(填“=”、“<”、“>”等),水溶液的酸碱性为_____(填“酸性”、“碱性”、“中性”、“无法判断”)
【试题答案】
1. B
2. BD
3. BD
4. B
5. B
6. AD
7. BC
8. B
9. AD 10. CD
11. B
12. ①②①④③
13. =c(M+)>c(A-)>c(OH-)>c(H+) =酸性
14. ZnCl2·xH2O+xSOCl2=ZnCl2+xSO2↑+2xHCl↑
消耗水,产生SO2、HCl,抑制ZnCl2水解。