第四讲热学部分..(可编辑修改word版)
- 格式:docx
- 大小:228.38 KB
- 文档页数:14



热学第四讲:第12章 热力学基础研究热现象中物态变化和能量守恒及转换定律及应用的学科。
§12.1准静态过程一、准静态过程:始末平衡态之间的一系列中间态,都可近似看成是平衡态的状态,称为准静态过程。
只有准静态过程才能在PV 图中表示出来,而非准静态过程是无法在PV 图中表示出来。
二、内能、功和热量1、内能:表示热力学系统状态的物理量,是态函数。
① 理想气体的内能:()T E E= 是温度的单值函数,仅与始末位置有关。
② 一般气体的内能:()V T E E ,= RT2i E =2、功:系统对准静态过程是由于体积变化而做的功 ① 微功:V P PS F W ∆=∆=∆=∆ P d V dW =② 总功:∑∑∆=∆=V P w W⎰⎰==PdV dwW0W气体体积膨胀,系统对外界做正功;外界对系统做负功。
0W气体体积收缩,系统对外界做负功;外界对系统做正功3、热量:由于外界系统之间存在温度差而传递的能量摩尔热容:是1mol 物质在微小升温dT 过程中所吸收的热量。
()dTdQ C mm =§12.2 热力学第一定律一、 热力学第一定律:系统从外界吸收的热量,一部分用来改变系统的内能;另一部分用来对外做功。
是能量守恒定律在热学中的具体表现。
1、 表达式:()WE E W E Q12+-=+∆=2、 微分式:dW dE dQ+= 微小的变化过程3、 积分式:⎰⎰⎰⎰+-=⇒+==21121122E E QdE dQQ V V V V PdV E E Q PdV4、 第一类永动机是不可能造成的!是违背热力学第一定律的。
第一类永动机是指少耗能多做功;甚至是不消耗能量而做功。
热力学第一定律告诉我们对外做功是以消耗热能为代价的,不消耗能量就可以也要不断的对外做功的机器是不可能制造出来的。
二、 热力学第一定律对理想气体平衡过程的应用 1、 等体过程:12E E dQC V-=−−→−=⎰热一系统所吸收的热量全部用来增加系统的内能。


热学1、物质是由大量分子组成的(注意分子体积和分子所占据空间的区别) 对于分子(单原子分子)间距的计算,气体和液体可直接用3分子占据的空间,对固体,则与分子的空间排列(晶体的点阵)有关【例题1】如图6-1所示,食盐(N a Cl )的晶体是由钠离子(图中的白色圆点表示)和氯离子(图中的黑色圆点表示)组成的,离子键两两垂直且键长相等。
已知食盐的摩尔质量为58.5×10-3kg/mol ,密度为2.2×103kg/m 3,阿伏加德罗常数为 6.0×1023mol -1,求食盐晶体中两个距离最近的钠离子中心之间的距离。
2、物质内的分子永不停息地作无规则运动固体分子在平衡位置附近做微小振动(振幅数量级为0.1A 0),少数可以脱离平衡位置运动。
液体分子的运动则可以用“长时间的定居(振动)和短时间的迁移”来概括,这是由于液体分子间距较固体大的结果。
气体分子基本“居无定所”,不停地迁移(常温下,速率数量级为102m/s )。
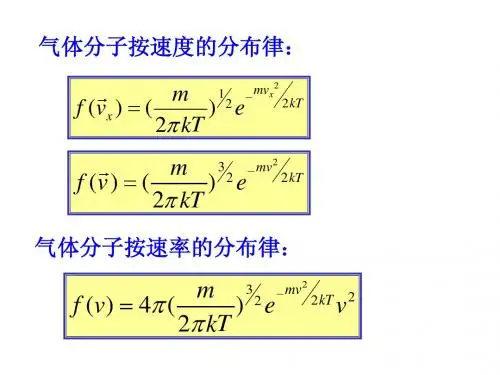
无论是振动还是迁移,都具备两个特点:a 、偶然无序(杂乱无章)和统计有序(分子数比率和速率对应一定的规律——如麦克斯韦速率分布函数,如图6-2所示);b 、剧烈程度和温度相关。
气体分子的三种速率。
最可几速率v P :f(v) =NN ∆(其中ΔN 表示v 到v +Δv 内分子数,N 表示分子总数)极大时的速率,v P =μRT 2=mk T 2 ;平均速率v :所有分子速率的算术平均值,v =πμRT 8=mk T 8π;方均根速率2v :与分子平均动能密切相关的一个速率,2v =μRT 3=mk T 3〔其中R 为普适气体恒量,R = 8.31J/(mol.K)。
k 为玻耳兹曼常量,k = AN R = 1.38×10-23J/K 〕【例题2】证明理想气体的压强P = 32n K ε,其中n 为分子数密度,K ε为气体分子平均动能。
3、分子间存在相互作用力(注意分子斥力和气体分子碰撞作用力的区别),而且引力和斥力同时存在,宏观上感受到的是其合效果。




热学讲义2007年目录第1章热学导论 (1)§1.1 热学 (1)§1.2 热学的研究方法 (2)第2章平衡态和状态方程 (4)§2.1 平衡态状态参量 (4)§2.2 温度和温标热力学第零定律 (8)§2.3 状态方程 (11)§2.3.1 理想气体 (12)§2.3.2 实际气体---范德瓦耳斯气体 (14)§2.3.3 纯物质 (15)第3章气体分子动理论 (16)§3.1 物质的微观理论 (16)§3.2 理想气体的初步微观理论 (17)§3.2.1 微观模型 (17)§3.2.2 压强的统计解释 (17)§3.2.3 温度的统计解释 (19)§3.2.4 道尔顿分压定律 (20)§3.3 近独立子系的麦克斯韦—玻尔兹曼分布 (20)§3.3.1 微观模型与微观描述 (20)§3.3.2 最概然分布 (23)§3.3.3 平衡态的微观理解 (25)§3.3.4 玻尔兹曼熵 (26)§3.4 麦克斯韦速度分布律和速率分布律 (26)§3.4.1 速度分布律与速率分布律 (26)§3.4.2 速率分布律的实验验证 (28)§3.5 玻尔兹曼分布律 (29)§3.5.1 玻尔兹曼分布律 (29)§3.5.2 重力场中微粒按高度的分布 (30)§3.6 能均分定理 (31)§3.6.1 能量按自由度均分定理 (31)§3.6.2 理想气体的内能和定容热容量 (32)§3.6.3 经典理论的缺陷 (33)§3.7 气体分子碰撞和平均自由程 (34)§3.7.1 碰撞及其描述 (34)§3.7.2 分子随自由程的概率分布 (36)§3.8 气体中的输运过程 (36)§3.8.1 宏观规律 (36)§3.8.2 微观规律 (38)第4章热力学第一定律 (41)§4.1 热力学过程 (41)§4.2 热量功内能 (42)§4.2.1 热量 (42)§4.2.2 功 (42)§4.2.3 内能 (43)§4.3 热力学第一定律 (44)§4.4 热力学第一定律对理想气体的应用 (45)§4.4.1 理想气体做功 (45)§4.4.2 理想气体的内能和焓 (45)§4.4.3 理想气体的热容 (46)§4.4.4 热力学过程 (46)第5章热力学第二定律 (47)§5.1 卡诺循环及其效率 (47)§5.2 第二定律的两种表述及其等价性 (49)§5.3 卡诺定理 (50)§5.4 克劳修斯不等式和熵 (50)§5.5 热力学微分方程 (53)§5.5.1 热力学基本微分方程 (53)§5.5.2 热力学势与Maxwell关系 (54)§5.5.3 特性函数 (56)§5.6 热力学第二定律的再讨论 (57)§5.6.1 热力学第二定律的各种表述 (57)§5.6.2 平衡判据、平衡条件和稳定性条件 (58)第6章相变热力学 (62)§6.1 相图 (62)§6.2 克拉珀龙方程相变理论 (64)§6.3 范德瓦耳斯气体 (66)索引 (69)参考文献 (74)第1章热学导论物理研究的基本框架是在一定的背景知识下提出问题,分析问题,解决问题,解决问题之后得到的知识又成为新的背景知识。
热学的知识结构
作者:张汉辉
温度的单位:℃
原理:液体的热胀冷缩
温度计
温度构造,使用方法,读数
体温计的特殊构造和使用方法,读数.
热
现晶体:熔化和凝固特点,图象,熔点和凝固点
象熔化和凝固
非晶体:熔化和凝固特点,图象物态变化
蒸发:特点,影向因素
汽化的两种方式
汽化和液化沸腾:特点,沸腾及其与压强的关系
降低温度
液化的两种方式
压缩体积
升华和凝华
扩散现象
分子热运动引力
分子间的作用力
拆力
物体里所有分子动能与分子势能的总和
内能
物体的温度升高,内能增加
热和能
规律:吸热,内能增加:放热,内能减少
热传递条件:存在温度差
实质:内能的转移
内能热量的概念,单位
内能改变
对物体做功,内能增加
规律
对外做功,内能减少
做功
实质:内能与其他形式能的相互转化
能量守恒定律
概念:反映了不同物质的吸热本领的热学性质
比热容定义:单位质量的某种物质,温度升高或降低1℃时吸热或放出的热量
单位:J/Kg.℃
Q吸=cm(t-t o)
热量吸放热公式:Q=cmΔt
Q放=cm(t o-t)
热量可以量度物体内能改变,单位:J
构造
汽油机
工作原理
热机
构造
柴油机
工作原理
定义
燃料的热值
单位:J/Kg(或J/m³)。
8kTmv 2 l l一. 基础知识第四讲 热 学 部 分1. 分子运动论的基本内容2. 物态的微观解释3. 理想气体的压强设任意分子 a 的速度为 v ,在 x 、y 、z 三个方向的分量为 v x 、v y 、v z ,所以分子 a 在单位时间里与左右壁碰撞的冲量为:v mv 2I = f ⋅ ∆t = 2mv ⋅ x = x 2l 1 l 1mv 2 mv 2 m N F = I + I + = 1x + 2x+ = ∑v 2 1 2 1 1 1 ix i =1FmNmN v 2 + v 2 + v 2 + v 2 mNP = = ∑v 2 = ⋅ 1x 2 x 3x Nx = ⋅ v 2 = nmv 2l 2l 3 l 1l 2l 3 ix i =1 l 1l 2l 3 N l 1l 2l 3v 2 + v 2 + v 2 = v 2∴ v 2 = 1v 2 x y z x3∴ P = 2 n ⋅ 1 mv 2 = 2 neA3 2 3 k 4. 分子平均动能:PV = RT ⇒ e = 3P = 3RT= 3RT= 3RT= 3kT (k =R/N A ,为玻尔兹曼常数)k2n 2nV 2N 2N A 25. 阿伏伽德罗定律: P = nkT (n 为单位体积的分子数)① 分子的平均速率: v == ② 分子的方均根速率: =(μ为 mol 质量,可分子平均自由程推导)= 二. 物体的内能1.自由度:即确定一个物体的位置所需要的独立坐标参数,如自由运动的质点 需要三个独立坐标来描述其运动,故它有三个自由度。
2. 例:He 三个平动自由度 H 2 三个平动自由度,二个转动自由度CO 2 三个平动自由度,二个转动自由度,一个振动自由度。
3.理想气体的内能:E = N i kT = m 2 M ⋅ i RT (i =3 或 i =5) 2 4.物体的势能8RT 3kT m 3RT1 xl A x xV ∆TPVPVPV PV三. 外界对气体做功的计算1. 微元功:W = PS ∆x = P ∆V2.等压过程的功:W = P (V 2 - V 1 ) = R (T 2 - T 1 )3. 等温过程的功:W = ∑ P ∆V =RT ∑ ∆V= RT ln V 2V 14.一般情况下,外界对气体做功,就先画 P —V 图,再根据图象求功等温过程 绝热过程等压过程等容过程四. 热量的计算:(1) 热容、比热容、摩尔热容A. 热容 C 表示系统升高单位温度吸收的热量:C = lim ∆Q∆T →0B. 单位质量的物质的热容称为物质在该过程的比热容,即(m 为质量)c = Cm C. 1mol 物质的热容称为物质在该过程中的摩尔热容,即(为摩尔数)C = C mD. 系统热容与变化过程有关,同一系统从同一状态出发按不同过程变化,其热容不同。
但对固体、液体而言,一般认为定压热容与定容热容相等,统一用比热容表示。
而对气体,其定压摩尔热容 C p 与定容摩尔热容 C V 则不相等,可以证明:C p = C V + R(2) 热量的计算在定容过程中,摩尔气体温度变化(T 2-T 1)所需的热量为:Q = C V (T 2 - T 1 )在定压过程中,摩尔气体温度变化(T 2-T 1)所需的热量为:Q = C p (T 2 - T 1 )质量为 m 的固体、液体变化(T 2-T 1)所需的热量为:Q = mc (T 2 - T 1 )五. 热力学第一定律1. 定律内容: ∆E = W + Q2.热力学第一定律对理想气体特殊变化过程的分析 ① 等温过程: PV = C ② 等容过程:∆E = 0 Q = -W ,P = C∆V = 0W = 0 ∆E = Q = C (T - T )C= iR TV21V2③ 等压过程:V = C W = -P (V - V )= -R (T - T )Q = C (T - T )T∆E = ⋅ iR (T - T )2 2 121Cp2= ( i + 1)R 21p21④ 绝热过程: Q = 0,W = ∆E = ⋅ iR (T - T )2 2 1⑤ 循 环 过 程 (热 机 工 作过程):六. 例题分析:例1. 使装着理想单原子气体的箱子骤然以速度 v 运动起来,求气体温度的变化。
已知一个气体原子的质量为 m 0,箱子的热容量和导热忽略不计。
∆E = 0, Q 吸 > Q 放, Q 吸 - Q 放 = W= W= 1 - Q 放 < 1, 被称作热机工作效率。
Q 吸 Q 吸例2.水平放置一个边长为l =10cm 的正方形扁盒子,在盒内不规则地放着N=1000 个很小的钢球,每个钢球的质量m=0.5mg,盒子以恒定的速度v0=10m/s 沿水平方向运动,经一段时间后,假定这些钢球的运动变得杂乱无章,与气体分子的运动相似。
(1)以地球为参照系,试计算这些球的平均能量为多少?(2)估算钢球作用到侧壁的力多大?设钢球与盒壁及钢球之间的碰撞是完全弹性的。
例3.一密闭容器内盛有水(未满)处于平衡状态,已知水在140C 时的饱和蒸汽压为12mmHg,设水蒸汽分子碰到水面时都变成水,气体分子的平均速率与气体的热力学温度T 的平方根成正比,试近似计算在1000C 和140C 时,单位时间内通过单位面积水面的蒸发变为水蒸汽的分子数之比n100/n14等于多少?x l lⅢⅡⅠl例4. 横截面积为 S 和αS(α>1),长度相同的两圆柱形“对接”的容器内盛有理想气体,每个圆筒中间位置有一个用硬质相连的活塞,如图所示。
这时舱Ⅰ内气体的压强为 P 1,舱Ⅲ内气体的压强为βP 1,活塞处于平衡状态,整个系统吸收 热量 Q ,温度上升,使各舱温度相同。
试求舱Ⅰ内气体压强的变化。
1mol 气体内能为 CT(C 是气体摩尔热容量)圆筒和活塞热容量很小,摩擦不计。
例5. (17 届复)如图所示,在一个大水银槽中竖直插有一根玻璃管,管的上端封闭,下端开口,已知槽中水银液面以上的哪部分玻璃管的长度为 l =76cm ,管内封闭有μ=1.0×10-3mol 的空气。
保持水银槽与玻璃管都 不动,而设法使玻璃管内空气的温度缓慢地降低 100C , 问在此过程中空气放出的热量为多少?已知管外大气压为 76cmHg 水银柱,每摩尔空气的内能 U=C V T ,其中 T 为绝对温度,常量 C V =20.5J/mol ·K ,普适气体恒量 R=8.31J/mol ·K 。
2ln 、Tn 、T例6. 绝热容器 A 经一阀门与另一容积比 A 的容积大很多的绝热容器 B 相连,开始时阀门关闭,两容器中盛有同一种理想气体,温度均为 300C ,B 中气体压强为 A 中的两倍,现将阀门缓慢打开,直至压强相等时关闭,问此时容器 A 气 体的温度为多少?假设从打开到关闭阀门过程中处在 A 中的气体与 B 中的气体之间无热交换,已知每摩尔该气体的内能为 U = 5RT ,式中 R 为普适气体2恒量,T 为热力学温度。
例7. 长度为 2l 的水平圆柱形容器,被不导热的薄活塞分成相等的两部分,每个部分内盛有温度为 T 的μmol 单原子理想气体。
用两根劲度系数均为 K 未形变弹簧将活塞与容器两头相连,如图所示。
右边部分气体吸收了热量 Q ,结果使活 塞向左移动距离 x=l/2。
试求在温度 T 下传给恒温器的热量为 Q ',左边部分气体与恒温器始终保持热接触。
QA B例8. 如图所示的循环中,V 2=2V 1,1→2 为等压,气体与外界交换热量 104J ,做功 7×103J ;2→3 为等容过程,气体与外界交换热量 4×103J ;3→4 过程为等压过程,4→1 为等过程。
试求: (1) 在图上标明各过程吸、放热的热量 (2) 该循环的热效率是多少?p p 12例9. 0.1mol 的理想气体,历经如图所示的过程由初状态 A 沿直线段 AB 膨胀到 B 状态。
求这一过程中:(1) 气体达到最高温度在何处?(2) 气体从外界吸收的(不包括放出的)热量是多少?已知 C V =1.5R ,R=8.31J/mol ·K 。
1.51.00.5-3m 3)A B C第 19 届预赛四、(20 分)如图预 19-4 所示,三个绝热的、容积相同的球状容器 A 、B 、C ,用带有阀门 K 1、K 2 的绝热细管连通,相邻两球球心的高度差 h = 1.00 m .初始时,阀门是关闭的,A 中装有 1mol 的氦 (He ),B 中装有 1mol 的氪(Kr ),C 中装有lmol 的氙(Xe ),三者的温度和压强都相同.气体均可视为理想气体.现打开阀门 K 1、K 2, 三种气体相互混合,最终每一种气体在整个容器中均匀分布,三个容器中气体的温度相同.求气体温度的改变量.已知三种气体的摩尔质量分别为He = 4.003⨯10-3kg ⋅ mol -1Kr = 83.8⨯10-3kg ⋅ mol -1Xe =131.3⨯10-3kg ⋅ mol -1 在体积不变时,这三种气体任何一种每摩尔温度升高 1K ,所吸收的热量均为 3R / 2 , R 为普适气体常量.第 20 届复赛二、(15 分)U 形管的两支管 A 、B 和水平管 C 都是由内径均匀的细玻璃管做成的,它们的内径与管长相比都可忽略不计.己知三部分的截面积分别为S = 1.0 ⨯10-2 cm 2,S = 3.0 ⨯10-2 cm 2, S = 2.0 ⨯10-2 cm 2,在 C 管中有一段空气柱,两侧被水银封闭.当温度为t 1 = 27 ℃时,空气柱长为l =30 cm (如图所示),C 中气柱两侧的水银柱长分别为 a =2.0cm , b =3.0cm ,A 、B 两支管都很长,其中的水银柱高均为h =12 cm .大气压 强保持为 p 0 =76 cmHg 不变.不考虑温度变化时管和水银的热膨胀.试求气柱中空气 温度缓慢升高到 t =97℃时空气的体积.zhangli P (105N/m 2) 4 B3C2D V (10-3m 3)A成都七中嘉祥外国语学校物理竞赛 ng例10.(1)已知每摩尔单原子理想气体温度升高 1K 时,内能增加 1.5R ,现有 2.00mol8.31的单原子理想气体,经历 ABCDA 循环过程,在 P —V 图上是一个圆。
① 循环过程中哪一点的温度最高,温度是多少?② 从 C 到 D ,气体内能的增加量、外界对气体所做的功、气体吸收的热量各为多少?(2) 可否设计一个过程,使 nmol 单原子理想气体从图(2)的初态 A (P A 、V A 、TA )到 终态 B (P B = P A 、V B = 2V A 、T B )气体净吸热刚好等于内能的增量。