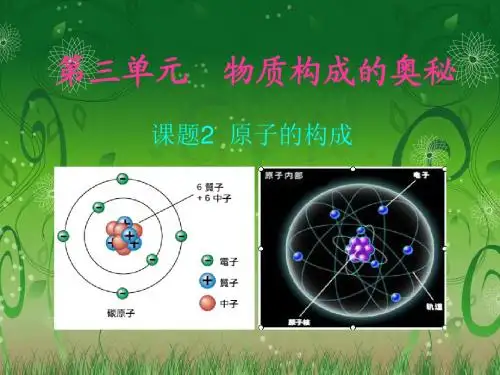
观察表格(表3-1),思考下列问题
原子种类 质子数 中子数 核外电子数 核电荷数 原子序数
1 0 1 1 1 氢 6 6 6 6 6 碳 8 8 8 8 8 氧 11 12 11 11 11 钠 17 18 17 17 17 氯 1.以氧原子为例,说明原子的构成, 氧原子为什么不显电性 2.不同原子之间有哪些区别?
质子数不一定等于中子数。
5.质子数、电子数、核电荷数、原子序数有什么联系?
质子数=核外电子数=核电荷数=原子序数
1. 填写下表中的空格。
原子种类 核电荷数 质子数 氧 硫 8 16 12 中子数 核外电子数 8 16
8
16 12
8
16
镁
12
12
一 原子是怎样构成的? 【智慧阅读】结合原子结构的探索历
氢H
这三大类元素的原子最外层 电子数有什么规律?
氦He
金 属 锂 Li 元 素
铍 Be 硼 B
碳C
非 金 属 氮N 元 氧O 素
硫S
氟F
稀 有 气 氖 Ne 体 元 素
氩Ar
3.原子结构示意图
画法:画圆圈,标核电, 弧线呈扇面,数字一条线。
Na
【亲手尝试】根据氧原子的结构图画出结构示意图
第一层(2个) 第二层(6个) (最外层)
+8
2 6
【思考】我们只需知道原子的什么就可画出该原子结
构示意图
下列原子结构示意图书写正确的是( +3 A 3 6 2 4 B
+10
C)
+14 2 7 5
原子里质子数不同,原子种类也不同。
3.所有原子都是由质子、中子、电子构成的吗?
不是所有的原子都有中子。如氢原子