2020年高中物理竞赛辅导课件★★熵 熵增加原理
- 格式:pdf
- 大小:345.06 KB
- 文档页数:17

2020高中物理竞赛江苏省苏州高级中学竞赛讲义第四章热力学基础§4.6 熵熵增加原理一、热力学第二定律的微观意义从微观上说,热力学第二定律是反映大量分子运动的无序程度变化的规律。
1 功热转换功→热机械能内能有序运动无序运动可见,在功热转换的过程中,自然过程总是沿着使大量分子从有序状态向无序状态的方向进行。
2 热传导初态:两物体温度不同,此时尚能按分子的平均动能的大小来区分两物体。
末态:两物体温度相同,此时已不能按分子的平均动能的大小来区分两物体。
这说明,由于热传导,大量分子运动的无序性增大了。
3 气体绝热自由膨胀初态:分子占据较小空间末态:分子占据较大空间,分子的运动状态(分子的位置分布)更加无序了。
综上可见,一切自然过程总是沿着无序性增大的方向进行,这就是自然过程方向性的微观意义。
比喻:从守纪律状态→自由散漫状态可以自动进行,相反的过程却需要加强思想教育、纪律约束。
注意:热力学第二定律是统计规律,只适用于由大量分子构成的热力学系统。
以上从概念上讨论了;状态的无序性;过程的方向性,怎样定量地描写它们是下面要解决的问题。
二、熵熵(entropy) (以S 表示)是一个重要的状态参量。
在热力学中以熵的大小 S 描述状态的无序性,以熵的变化 ∆S 描述过程的方向性。
下面讨论熵的引进、计算等问题。
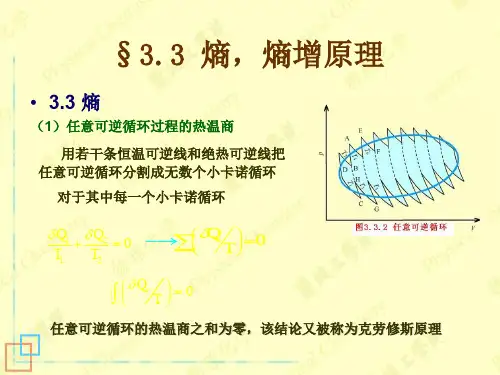
1 克劳修斯熵等式对于卡诺循环(是可逆循环)其效率 有热温比:系统从每个热源吸收的热量与相应热源的温度的比值。
结论:可逆卡诺循环中,热温比总和为零。
上式说明,对任一系统,沿任意可逆循环过程一周,d Q /T 的积分为零。
2 熵两确定状态之间的任一可逆过程的热温比的积分相等,与过程的具体情况无关。
右图为一任意可逆循环, 由上式有任一微小可逆卡诺循环110i i i i Q Q T T ++∆∆+=对所有微小循环求和10nii iQ T =∆=∑d 0Q n T →∞=⎰Ñ当时,则任意的可逆循环可视为由许多可逆卡诺循环所组成结论:对任一可逆循环过程,热温比之和为零。