最新大学物理化学1-热力学第一定律课后习题及答案说课讲解
- 格式:doc
- 大小:124.50 KB
- 文档页数:7
![[理学]物理化学答案——第一章-热力学第一定律](https://uimg.taocdn.com/61a935d34a7302768f993939.webp)
第一章 热力学第一定律一、基本公式和基本概念 基本公式1. 功 'W W W δδδ=+体积,W 体积:体积功;'W :非体积功 热力学中体积功为重要的概念: W p dV δ=-外体积 本书规定:系统对环境做功为负,相反为正。
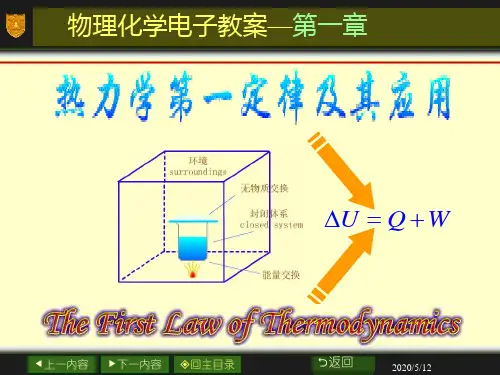
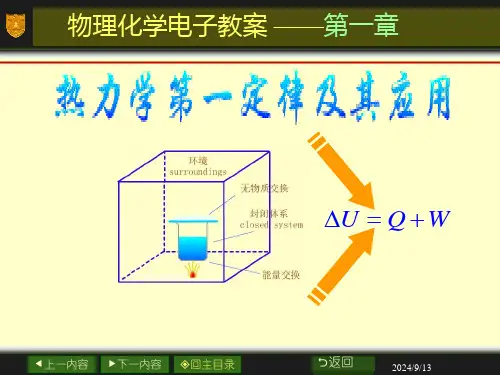
如果p 外的变化是连续的,在有限的变化区间可积分上式求体积功d W p V =-⎰外在可逆过程中,可用系统的压力p 代替外压p 外,即p p =外 d W p V =-⎰一些特定条件下,体积功计算如下: 恒外压过程 W p V =-∆外 定容过程 d 0W p V =-=⎰外 理想气体定温可逆过程 212112lnln V V V p W pdV nRT nRT V p =-=-=-⎰理想气体自由膨胀(向真空膨胀)过程 0W = 2. 热力学第一定律 U Q W ∆=+ 3. 焓 H U pV ≡+焓是状态函数,容量性质,绝对值无法确定。
理想气体的热力学能和焓只是温度的单值函数。
4. 热容 QC dTδ=(1)定压热容 ()pp p Q H C dTTδ∂==∂ 注意:()p p HC T∂=∂的适用条件为封闭系统,无非体积功的定压过程。
而对于理想气体无需定压条件。
(2) 定容热容 ()d VV V Q U C TTδ∂==∂ 同样,()V V UC T∂=∂的适用条件为封闭系统,无非体积功的定容过程。
对于理想气体来说,则无需定容条件。
任意系统:p V T pU V C C p V T ⎡⎤∂∂⎛⎫⎛⎫-=+⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦ 理想气体:p V C C nR -= 摩尔热容与温度的经验公式2,p m C a bT cT =++ 2,''p m C a b T c T -=++5. 热定容热: d ;V V Q U Q U δ==∆ 条件为封闭系统无其他功的定容过程 定压热: d ;p p Q H Q H δ==∆ 条件为封闭系统无其他功的定压过程相变热: p H Q ∆= 条件为定温定压条件下系统的相变过程 6. 热力学第一定律在理想气体中的应用 (1) 理想气体,U ∆ H ∆的计算定温过程:0,U ∆= 0,H ∆= 2112ln ln V p Q W nRT nRT V p -==-=- 无化学变化、无相变的任意定温过程21,d T V m T U nC T ∆=⎰,21,d T p m T H nC T ∆=⎰(2) 理想气体绝热可逆过程方程绝热可逆过程方程:11pV TVp T γγγγ--===常数;常数;常数 (p VC C γ=)理想气体绝热功: 1211221()()1V W C T T p V p V γ=--=--- 理想气体绝热可逆或不可逆过程:21,0,d d T V m T Q U W p V nC T =∆==-=⎰外理想气体绝热可逆过程:2212,,,1121lnln ,lnln V m p m V m V T V pR C C C V T V p =-= 7. 热力学第一定律在化学变化中的应用 反应进度:(0)B B Bn n ξν-=mol(1) 化学反应热效应化学反应摩尔焓变:,B r m p m BHH H Q n νξ∆∆∆===∆∆ 当1mol ξ∆=时的定压热 化学反应摩尔热力学能变化:,B r m V m BUU U Q n νξ∆∆∆===∆∆ 当1mol ξ∆=时的定容热 (2) 化学反应的r m H ∆与r m U ∆的关系无气相物质参与的化学反应系统:,,,r m T r m T r m T H U pV U ∆=∆+∆≈∆ 有气相物质(理想气体)参与的化学反应系统:,,,,r m T r m T r m T B g H U pV U RT ν∆=∆+∆=∆+∑(3) 化学反应定压热效应的几种计算方法 利用标准摩尔生成焓值:(298.5)()r m Bf m B H K H B θθν∆=∆∑利用标准摩尔燃烧焓值:(298.5)()r m Bc m BH K H B θθν∆=-∆∑(4) 化学反应焓变与温度的关系---基尔霍夫方程2121,()()()d T r m r m Bp m T BH T H T C B T ν∆=∆+∑⎰基本概念1. 系统和环境热力学中,将研究的对象称为系统,是由大量微观粒子构成的宏观系统。

第一章 热力学第一定律一、 填空题1、一定温度、压力下,在容器中进行如下反应:Zn(s)+2HCl(aq)= ZnCl 2(aq)+H 2(g)若按质量守恒定律,则反应系统为 系统;若将系统与环境的分界面设在容器中液体的表面上,则反应系统为 系统。
2、所谓状态是指系统所有性质的 。
而平衡态则是指系统的状态 的情况。
系统处于平衡态的四个条件分别是系统内必须达到 平衡、 平衡、 平衡和 平衡。
3、下列各公式的适用条件分别为:U=f(T)和H=f(T)适用于 ;Q v =△U 适用于 ;Q p =△H 适用于 ; △U=dT nC 12T T m ,v ⎰适用于 ; △H=dT nC 21T T m ,P ⎰适用于 ; Q p =Q V +△n g RT 适用于 ;PV r=常数适用于 。
4、按标准摩尔生成焓与标准摩尔燃烧焓的定义,在C (石墨)、CO (g )和CO 2(g)之间, 的标准摩尔生成焓正好等于 的标准摩尔燃烧焓。
标准摩尔生成焓为零的是 ,因为它是 。
标准摩尔燃烧焓为零的是 ,因为它是 。
5、在节流膨胀过程中,系统的各状态函数中,只有 的值不改变。
理想气体经节流膨胀后,它的 不改变,即它的节流膨胀系数μ= 。
这是因为它的焓 。
6、化学反应热会随反应温度改变而改变的原因是 ;基尔霍夫公式可直接使用的条件是 。
7、在 、不做非体积功的条件下,系统焓的增加值 系统吸收的热量。
8、由标准状态下元素的 完全反应生成1mol 纯物质的焓变叫做物质的 。
9、某化学反应在恒压、绝热和只做膨胀功的条件下进行, 系统温度由T 1升高到T 2,则此过程的焓变 零;若此反应在恒温(T 1)、恒压和只做膨胀功的条件下进行,则其焓变 零。
10、实际气体的μ=0P T H〈⎪⎭⎫ ⎝⎛∂∂,经节流膨胀后该气体的温度将 。
11、公式Q P =ΔH 的适用条件是 。
12、若某化学反应,只做体积功且满足等容或等压条件,则反应的热效应只由 决定,而与 无关。

热力学第一定律课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的∆f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 )。
3. pVγ = 常数(γ = C p,m/C V,m)适用的条件是:( )(A)绝热过程;( B)理想气体绝热过程;( C )理想气体绝热可逆过程;(D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒;( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少。
7. 已知反应H2(g) +12O2(g) ==== H2O(g)的标准摩尔反应焓为∆r H(T),下列说法中不正确的是:()。

物理化学课后答案解析_热⼒学第⼀定律第⼆章热⼒学第⼀定律【复习题】【1】判断下列说法是否正确。
(1)状态给定后,状态函数就有⼀定的值,反之亦然。
(2)状态函数改变后,状态⼀定改变。
(3)状态改变后,状态函数⼀定都改变。
(4)因为△U=Q v, △H =Q p,所以Q v,Q p是特定条件下的状态函数。
(5)恒温过程⼀定是可逆过程。
(6)汽缸内有⼀定量的理想⽓体,反抗⼀定外压做绝热膨胀,则△H= Q p=0。
(7)根据热⼒学第⼀定律,因为能量不能⽆中⽣有,所以⼀个系统若要对外做功,必须从外界吸收热量。
(8)系统从状态Ⅰ变化到状态Ⅱ,若△T=0,则Q=0,⽆热量交换。
(9)在等压下,机械搅拌绝热容器中的液体,使其温度上升,则△H = Q p = 0。
(10)理想⽓体绝热变化过程中,W=△U,即W R=△U=C V△T,W IR=△U=C V△T,所以W R=W IR。
(11)有⼀个封闭系统,当始态和终态确定后;(a)若经历⼀个绝热过程,则功有定值;(b)若经历⼀个等容过程,则Q有定值(设不做⾮膨胀⼒);(c)若经历⼀个等温过程,则热⼒学能有定值;(d)若经历⼀个多⽅过程,则热和功的代数和有定值。
(12)某⼀化学反应在烧杯中进⾏,放热Q1,焓变为△H1,若安排成可逆电池,使终态和终态都相同,这时放热Q2,焓变为△H2,则△H1=△H2。
【答】(1)正确,因为状态函数是体系的单质函数,体系确定后,体系的⼀系列状态函数就确定。
相反如果体系的⼀系列状态函数确定后,体系的状态也就被惟⼀确定。
(2)正确,根据状态函数的单值性,当体系的某⼀状态函数改变了,则状态函数必定发⽣改变。
(3)不正确,因为状态改变后,有些状态函数不⼀定改变,例如理想⽓体的等温变化,内能就不变。
(4)不正确,ΔH=Qp,只说明Qp 等于状态函数H的变化值ΔH,仅是数值上相等,并不意味着Qp 具有状态函数的性质。
ΔH=Qp 只能说在恒压⽽不做⾮体积功的特定条件下,Qp的数值等于体系状态函数 H 的改变,⽽不能认为 Qp 也是状态函数。


热力学第一定律课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的∆f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 )。
3. pVγ = 常数(γ = C p,m/C V,m)适用的条件是:( )(A)绝热过程;( B)理想气体绝热过程;( C )理想气体绝热可逆过程;(D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒;( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少。
7. 已知反应H2(g) +12O2(g) ==== H2O(g)的标准摩尔反应焓为∆r H(T),下列说法中不正确的是:()。



第二章 热力学第一定律2-1 1mol 理想气体于恒定压力下升温1℃,试求过程中气体与环境交换的功W 。
解:体系压力保持恒定进行升温,即有P 外=P ,即反抗恒定外压进行膨胀,JT nR nRT nRT pV pV V V p W amb 314.8)(121212-=∆-=+-=+-=--= 2-2 系统由相同的始态经过不同途径达到相同的末态。
若途径a 的Q a =2.078kJ ,W a = -4.157kJ ;而途径b 的Q b = -0.692kJ 。
求W b 。
解:应用状态函数法。
因两条途径的始末态相同,故有△U a =△U b ,则 b b a a W Q W Q +=+ 所以有,kJ Q W Q W b a a b 387.1692.0157.4078.2-=+-=-+=2-3 4mol 某理想气体,温度升高20℃,求△H -△U 的值。
解: 方法一: 665.16J208.3144 )20()( 2020,,20,20,=⨯⨯=-+==-=-=∆-∆⎰⎰⎰⎰++++T K T nR nRdT dT C C n dT nC dT nC U H KT T K T T m V m p K T T m V KT Tm p方法二:可以用△H=△U+△(PV)进行计算。
2-4 某理想气体, 1.5V m C R =。
今有该气体5 mol 在恒容下温度升高50℃,求过程的W ,Q ,△H 和△U 。
解:恒容:W=0;根据热力学第一定律,:W=0,故有Q=△U=3.118kJ2-5 某理想气体, 2.5V m C R =。
今有该气体5 mol 在恒压下温度降低50℃,求过程的W ,Q ,△H 和△U 。
解: kJ J K nC T K T nC dT nC U m V m V KT T m V 196.55196503145.8255)50( )50(,,50,-=-=⨯⨯⨯-=-⨯=--==∆⎰-2-6 1mol 某理想气体,R C m P 27,=。
第一章 热力学第一定律与热化学1. 一隔板将一刚性决热容器分为左右两侧,左室气体的压力大于右室气体的压力。
现将隔板抽去左、右气体的压力达到平衡。
若以全部气体作为体系,则ΔU 、Q 、W 为正?为负?或为零?解:0===∆W Q U2. 试证明1mol 理想气体在衡压下升温1K 时,气体与环境交换的功等于摩尔气体常数R 。
证明:R T nR V V p W =∆=-=)(123. 已知冰和水的密度分别为:0.92×103kg·m -3,现有1mol 的水发生如下变化: (1) 在100o C ,101.325kPa 下蒸发为水蒸气,且水蒸气可视为理想气体; (2) 在0 o C 、101.325kPa 下变为冰。
试求上述过程体系所作的体积功。
解:(1) )(m 1096.11092.010183633--⨯⨯⨯==冰V )(m 1096.1100.110183633--⨯⨯⨯==水V )(10101.3373314.81)(3J nRT V V p W e ⨯=⨯⨯===冰水- (2) )(16.0)108.11096.1(101325)(55J V V p W e =⨯-⨯⨯=-=--水冰4. 若一封闭体系从某一始态变化到某一终态。
(1) Q 、W 、Q -W 、ΔU 是否已经完全确定。
(2) 若在绝热条件下,使体系从某一始态变化到某一终态,则(1)中的各量是否已完全确定?为什么?解:(1) Q -W 与ΔU 完全确定。
(2) Q 、W 、Q -W 及ΔU 均确定。
5. 1mol 理想气体从100o C 、0.025m 3 经过下述四个过程变为100o C 、0.1m 3: (1) 恒温可逆膨胀; (2) 向真空膨胀;(3) 恒外压为终态压力下膨胀;(4) 恒温下先以恒外压等于气体体积为0.05m 3时的压力膨胀至0.05 m 3,再以恒外压等于终态压力下膨胀至0.1m 3。
第一章 热力学第一定律与热化学1. 一隔板将一刚性决热容器分为左右两侧,左室气体的压力大于右室气体的压力。
现将隔板抽去左、右气体的压力达到平衡。
若以全部气体作为体系,则ΔU 、Q 、W 为正?为负?或为零?解:0===∆W Q U2. 试证明1mol 理想气体在衡压下升温1K 时,气体与环境交换的功等于摩尔气体常数R 。
证明:R T nR V V p W =∆=-=)(123. 已知冰和水的密度分别为:0.92×103kg·m -3,现有1mol 的水发生如下变化: (1) 在100o C ,101.325kPa 下蒸发为水蒸气,且水蒸气可视为理想气体; (2) 在0 o C 、101.325kPa 下变为冰。
试求上述过程体系所作的体积功。
解:(1) )(m 1096.11092.010183633--⨯⨯⨯==冰V )(m 1096.1100.110183633--⨯⨯⨯==水V )(10101.3373314.81)(3J nRT V V p W e ⨯=⨯⨯===冰水- (2) )(16.0)108.11096.1(101325)(55J V V p W e =⨯-⨯⨯=-=--水冰4. 若一封闭体系从某一始态变化到某一终态。
(1) Q 、W 、Q -W 、ΔU 是否已经完全确定。
(2) 若在绝热条件下,使体系从某一始态变化到某一终态,则(1)中的各量是否已完全确定?为什么?解:(1) Q -W 与ΔU 完全确定。
(2) Q 、W 、Q -W 及ΔU 均确定。
5. 1mol 理想气体从100o C 、0.025m 3 经过下述四个过程变为100o C 、0.1m 3: (1) 恒温可逆膨胀; (2) 向真空膨胀;(3) 恒外压为终态压力下膨胀;(4) 恒温下先以恒外压等于气体体积为0.05m 3时的压力膨胀至0.05 m 3,再以恒外压等于终态压力下膨胀至0.1m 3。
第二章 热力学第一定律2-1 1mol 理想气体于恒定压力下升温1℃,试求过程中气体与环境交换的功W 。
解:体系压力保持恒定进行升温,即有P 外=P ,即反抗恒定外压进行膨胀,JT nR nRT nRT pV pV V V p W amb 314.8)(121212-=∆-=+-=+-=--=2-2 系统由相同的始态经过不同途径达到相同的末态。
若途径a 的Q a =2.078kJ ,W a = -4.157kJ ;而途径b 的Q b = -0.692kJ 。
求W b 。
解:应用状态函数法。
因两条途径的始末态相同,故有△U a =△U b ,则 bb a a W Q W Q +=+所以有,kJQ W Q W b a a b 387.1692.0157.4078.2-=+-=-+=2-3 4mol 某理想气体,温度升高20℃,求△H -△U 的值。
解: 方法一: 665.16J208.3144 )20()( 2020,,20,20,=⨯⨯=-+==-=-=∆-∆⎰⎰⎰⎰++++T K T nR nRdT dT C C n dTnC dT nC U H K T TKT Tm V m p KT Tm V KT T m p 方法二:可以用△H=△U+△(PV)进行计算。
2-4 某理想气体。
今有该气体5 mol 在恒容下温度升高50℃,求过, 1.5V m C R =程的W ,Q ,△H 和△U 。
解:恒容:W=0;kJJ K nC T K T nC dT nC U m V m V K T Tm V 118.33118503145.823550 )50(,,50,==⨯⨯⨯=⨯=-+==∆⎰+kJJ KR C n T K T nC dT nC H m V m p KT Tm p 196.55196503145.8255 50)()50(,,50,==⨯⨯⨯=⨯+==-+==∆⎰+根据热力学第一定律,:W=0,故有Q=△U=3.118kJ2-5某理想气体。
第二章热力学第一定律2.5 始态为25 ︒C,200 kPa的5 mol某理想气体,经途径a,b两不同途径到达相同的末态。
途经a先经绝热膨胀到 -28.47 ︒C,100 kPa,步骤的功;再恒容加热到压力200 kPa的末态,步骤的热。
途径b为恒压加热过程。
求途径b的及。
解:先确定系统的始、末态对于途径b,其功为根据热力学第一定律2.6 4 mol的某理想气体,温度升高20 ︒C,求的值。
解:根据焓的定义2.10 2 mol某理想气体,。
由始态100 kPa,50 dm3,先恒容加热使压力体积增大到150 dm3,再恒压冷却使体积缩小至25 dm3。
求整个过程的。
解:过程图示如下由于,则,对有理想气体和只是温度的函数该途径只涉及恒容和恒压过程,因此计算功是方便的根据热力学第一定律2.13 已知20 ︒C液态乙醇(C2H5OH,l)的体膨胀系数,等温压缩率,密度,摩尔定压热容。
求20 ︒C,液态乙醇的。
解:由热力学第二定律可以证明,定压摩尔热容和定容摩尔热容有以下关系2.14 容积为27 m3的绝热容器中有一小加热器件,器壁上有一小孔与100 kPa的大气相通,以维持容器内空气的压力恒定。
今利用加热器件使器内的空气由0 ︒C加热至20 ︒C,问需供给容器内的空气多少热量。
已知空气的。
假设空气为理想气体,加热过程中容器内空气的温度均匀。
解:在该问题中,容器内的空气的压力恒定,但物质量随温度而改变注:在上述问题中不能应用,虽然容器的体积恒定。
这是因为,从小孔中排出去的空气要对环境作功。
所作功计算如下:在温度T时,升高系统温度 d T,排出容器的空气的物质量为所作功这正等于用和所计算热量之差。
2.15 容积为0.1 m3的恒容密闭容器中有一绝热隔板,其两侧分别为0 ︒C,4 mol 的Ar(g)及150 ︒C,2 mol的Cu(s)。
现将隔板撤掉,整个系统达到热平衡,求末态温度t及过程的。
已知:Ar(g)和Cu(s)的摩尔定压热容分别为及,且假设均不随温度而变。
热力学第一定律课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的∆f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 )。
3. pVγ = 常数(γ = C p,m/C V,m)适用的条件是:( )(A)绝热过程;( B)理想气体绝热过程;( C )理想气体绝热可逆过程;(D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒;( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少。
7. 已知反应H2(g) +12O2(g) ==== H2O(g)的标准摩尔反应焓为∆r H(T),下列说法中不正确的是:()。
(A)∆r H(T)是H2O(g)的标准摩尔生成焓;(B)∆r H(T)是H2O(g)的标准摩尔燃烧焓;(C)∆r H(T)是负值;(D)∆r H(T)与反应的∆r U数值不等。
三、计算题习题110 mol理想气体由25℃,1.0 MPa膨胀到25℃,0.1 MPa,设过程为:( 1 )自由膨胀;( 2 )对抗恒外压力0.1 MPa 膨胀;( 3 )定温可逆膨胀。
试计算三种膨胀过程中系统对环境作的功。
习题2298 K 时,将0.05 kg 的N 2由0.1 MP a 定温可逆压缩到2 MPa ,试计算此过程的功。
如果被压缩了的气体在反抗外压力为0.1 MPa 下做定温膨胀再回到原来状态,问此过程的功又是多少?习题3某理想气体,其C V ,m = 20 J·K -1·mol -1,现有该气体10 mol 处于283 K ,采取下列不同途径升温至566 K 。
试计算各个过程的Q ,W ,∆U ,∆H ,并比较之。
( 1 )体积保持不变;( 2 )系统与环境无热交换;( 3 )压力保持不变。
习题4试求下列过程的∆U 和∆H :已知液体A 的正常沸点为350 K ,此时的汽化焓:∆Vap m 蒸气的平均定压摩尔热容C p ,m = 30 J·K -1·mol -1 。
(蒸气视为理想气体)习题5根据下列数据,求乙烯C 2H 4(g)的标准摩尔生成焓与标准摩尔燃烧焓:(1)C 2H 4(g) + H 2(g) == C 2H 6(g) , ∆r H m , l = -137 kJ·mol -1 ;(2)C 2H 6(g) + (7/2)O 2(g) == 2CO 2(g) + 3H 2O(l) ,∆r H m , 2 = -1560 kJ·mol -1 ;(3)C(石墨) + O 2(g) == CO 2(g) , ∆r H m , 3 = -393.5 kJ·mol -1 ;(4)H 2(g) + (1/2)O 2(g) == H 2O(l) , ∆r H m , 4 = -285.8 kJ·mol -1 。
习题6求下列反应在393 K 的反应的∆r H m (393 K) :C 2H 5OH(g) + HCl(g) == C 2H 5Cl(g) + H 2O(g)已知:习题7已知反应CH 3COOH(l)+C 2H 5OH(l)= CH 3COOC 2H 5(l)+H 2O(l)∆r H m (298.15K)=-9.20kJ.mol -1CH 3COOH(l)的∆c H m (298.15K)= -874.54kJ.mol -1C 2H 5OH(l)的∆c H m (298.15K)= -1366kJ.mol -1CO 2(g)的∆f H m (298.15K)= -393.51kJ.mol -1H 2O(l)的∆f H m Θ(298.15K)= -285.83kJ.mol -1求算Δf H m (CH 3COOC 2H 5,l,298.15K)=?热力学第一定律课后习题答案一、是非题1. ⨯ 2 √ 3. ⨯ 4 ⨯ 5√二、选择题1.(D)2.(A)3.(C)4.(C)5.(B)6.(D) 7(B)三、计算题习题1[题解] 体积功的计算公式 W = -⎰p su d V( 1 ) W = 0 (p su =0)( 2 ) W = -p su ∆V = -p su nRT (1/p 1 -1/p 2)= -0.1 MPa ×10 mol ×8.314 J·mol -1·K -1×298.15 K ×(1/0.1MPa -1/1.0MPa)= -22.30 kJ( 3 ) W = -nRT ln( V 2 / V 1 ) = nRT ln(p 2 / p 1) = -57.05 kJ[导引]由计算结果可知,虽然三个过程的初终态相同,但不同过程中的功不相等。
这是因为W不是状态函数,其值与过程有关。
习题2[题解] n = 50 g / 28 g·mol -1 = 1.79 mol定温可逆压缩若反抗外压力0.1 Mpa ,[导引]封闭系统由一个过程从始态(A )到达终态(B ),再由另一个过程从终态(B )回到同一个始态(A ),整个循环过程状态函数的改变量应为零;本题中,系统经历两个不同途径组成的循环过程由始态经过终态又回到同一个始态,功的加和不为零,说明功是过程量,其112112MPa ln =1.79 mol 8.314 J mol K 298 Kln 0.1MPa 13.29kJ p W nRT p --==×··×kJ21.4)MPa21MPa 1.01(K 298K mol J 314.8mol 79.1Pa 101.0)()(11622su 22su 2-=-⨯⨯⨯⨯⨯-=-'-=-'-=--··p nRT p nRT p V V p W值与过程有关。
习题3[题解] ( 1 )d V = 0,W = 0。
Q V = ∆U = nC V ,m ( T 2-T 1 )= 10mol ×20 J·K -1·mol -1×(566-283 ) K = 56.6 kJ∆H = nC p,m ( T 2-T 1 )= 10mol ×(20+8.314) J·K -1·mol -1×(566-283)K = 80.129 kJ( 2 )Q = 0,∆U 2 = ∆U 1 = 56.6 kJ ,∆H 2 = ∆H 1 = 80.129 kJW = ∆U 2 = 56.6 kJ( 3 )d p = 0,∆U 3 = ∆U 1 = 56.6 kJQ p = ∆H = 80.129 kJ[导引]热力学能U 和焓H 是状态函数,只要系统变化前后的始、终态一定,则不论经历何种过程,其∆U 和∆H 一定。
本题中虽然始终态不明确,但理想气体的U 和H 都只是温度的函数,即对理想气体只要始终态温度一定,则不同过程的∆U 和∆H 相同。
而W 和Q 不是状态函数,其值与过程有关,所以上述三个不同过程的W 和Q 分别不同。
习题4[题解] 设计变化途径如下:∆H 1 = nC p ,m ( T 2-T 1 )= 2 mol ⨯ 30 J·K -1·mol -1 ⨯ ( -50 ) K=-3.00 kJ∆H 2 = n ⨯ ∆Vap H m =-2 mol ⨯ 38 kJ·mol -1 =-76 kJ∆H = ∆H 1 + ∆H 2 = (-76-3.0 ) kJ =-79 kJ∆U = ∆U 1+∆U 2= nC V ,m ( T 2-T 1 )+∆H 2-∆( pV )= nC V ,m ( T 2-T 1 )+∆H 2+ nRT 2≈ 2 mol ⨯ (30 -8.314)J·K -1·mol -1 ⨯ ( 350-400 ) K -76 ⨯103J +2 mol ⨯8.314J·K -1·mol -1 ⨯ 350K=-72.35 kJ或∆U = ∆H -∆( pV ) ≈ ∆H -(-pV g,1 )= ∆H + nRT 1=-79 kJ + 2 ⨯ 8.314 ⨯ 400 ⨯ 10-3 kJ=-72.35 kJ[导引]本题的变化过程既包括pVT 变化又包括相变化,两种变化过程交织在一起,难以求出21212112d ()=()= 23.529 kJ V V W p V p V V nRT nRT nR T T =-=+=--⎰---变化过程的∆U 和∆H 。
为此将该变化过程分解为两步,一步为单纯的pVT 变化,一步为单纯的定温定压下的可逆相变化,从而利用状态函数的改变量与过程无关的特性,求得∆U = ∆U1(pVT 变化)+∆U 2(相变化);∆H = ∆H 1(pVT 变化)+∆H 2(相变化)。
习题5[题解] (3)式×2+(4)式×3 -(1)式 -(2)式 得2H 2(g) +2C(石墨)−→−C 2H 4(g)∆f H m = 2∆r H m ,3+3∆r H m ,4-∆r H m ,1-∆r H m ,2 = 52.6 kJ·mol -1;(1)式+(2)式 -(4)式 得C 2H 4(g) +3O 2 (g)−→−2CO 2 + 2H 2O(l)∆r H m = ∆r H m ,1+∆r H m ,2-∆r H m ,4 = -1 411.2 kJ·mol -1;[导引] 本题为利用盖斯定律,即方程式的线性组合,求得化学反应的标准摩尔反应焓。