基因工程制胰岛素(生工版).
- 格式:ppt
- 大小:2.69 MB
- 文档页数:4

生物技术制药参考资料基因工程制备胰岛素一、胰岛素的定义胰岛素是由胰岛β细胞受内源性或外源性物质如葡萄糖、乳糖、核糖、精氨酸等的刺激而分泌的一种蛋白质激素。
二、目前临床使用的胰岛素来源1、动物胰岛素:从猪和牛的胰腺中提取,两者药效相同,但与人胰岛素相比,猪胰岛素中有1个氨基酸不同,牛胰岛素中有3个氨基酸不同,因而易产生抗体。
2、半合成人胰岛素:将猪胰岛素第30位丙氨酸,置换成与人胰岛素相同的苏氨酸,即为半合成人胰岛素。
3、重组人胰岛素(现阶段临床最常使用的胰岛素):利用生物工程技术,获得的高纯度的生物合成人胰岛素,其氨基酸排列顺序及生物活性与人体本身的胰岛素完全相同。
三、目前,国际上生产医用重组人胰岛素(recombi—nant human insulin,rhI)的方法1、用基因工程大肠杆菌escherichia coli,E.CO一)分别发酵生产人胰岛素(human insulin,hi)的A、B链,然后经化学再氧化法,使两条链在一定条件下重新形成二硫键,得到hI。
这一方法缺点较多,目前已较少使用;2、用基因工程E.coli发酵生产人胰岛素原(hu—man peoinsulin,hPI),后经加工形成hI。
E.coli系统表达量高,但缺点是不利于表达hI这样的小蛋白,产物易降解,故常采用融和蛋白形式将hPI连接在一个较大的蛋白质后,表达产物需经过一系列复杂的后加工才能形成有活性的hi;3、通过基因工程酵母菌发酵生产hPI,经后加工形成hI。
酵母系统下游后加工比细菌表达系统简单,但缺点是生产慢,生产周期长,且重组蛋白分泌量少(1~50 mg/L),产量低。
因此,虽然rhI投放市场已久,但人们一直在努力寻求和探索更加有效的表达系统和高效的表达策略I2 J,尤其是对E.CO一尻表达系统的研究更是越来越深入,用E.coli系统表达hPI的策略也越来越多。
另一方面,在胰岛素的基因工程生产中,下游处理非常复杂,复杂的下游处理极大地降低了胰岛素的最终收率。

《基因工程大肠杆菌发酵生产重组人胰岛素的研究》一、引言基因工程技术的发展为生物医药领域带来了革命性的变革,其中重组DNA 技术作为一种能够改变生物体基因组的技术,为生产重组蛋白素(包括重组人胰岛素)提供了可行性。
本文将从深度和广度两个方面来探讨基因工程大肠杆菌发酵生产重组人胰岛素的研究。
二、基因工程大肠杆菌发酵生产重组人胰岛素的原理在基因工程大肠杆菌发酵生产重组人胰岛素的研究中,首先需要获取重组人胰岛素的基因序列,然后以质粒或病毒为载体将其转染至大肠杆菌的体内,经过培养和发酵,大肠杆菌体内合成重组人胰岛素,并通过纯化后得到最终的产品。
三、基因工程大肠杆菌发酵生产重组人胰岛素的研究进展1. 基因克隆技术的应用基因克隆技术的应用是基因工程大肠杆菌发酵生产重组人胰岛素的关键技术之一。
利用限制酶切剪切 DNA,然后重组连接,将重组的DNA 导入质粒内,再将质粒导入大肠杆菌细胞内,实现外源基因的表达。
2. 基因工程大肠杆菌的选择为了高效地生产重组人胰岛素,研究者需要筛选高产重组蛋白素的大肠杆菌菌株,并进行相关的改造以提高其产量。
3. 发酵工艺的优化发酵工艺的优化对于提高重组人胰岛素的产量至关重要。
包括对培养基成分、厌氧发酵条件、发酵时间等因素的优化。
四、基因工程大肠杆菌发酵生产重组人胰岛素的意义基因工程大肠杆菌发酵生产重组人胰岛素具有重要的生物医药意义。
大肠杆菌是一种广泛存在于自然界中的细菌,其发酵生产成本低、抗污染能力强,适用于大规模工业化生产。
另重组人胰岛素与天然胰岛素具有相同的生物活性,可以作为治疗糖尿病的药物,在临床上有着重要的应用前景。
五、个人观点和理解基因工程大肠杆菌发酵生产重组人胰岛素的研究是基因工程技术的一个重要应用方向,其有着较高的生产效率和较低的成本,为生物医药领域带来了巨大的潜力和机遇。
但是,需要注意的是,基因工程技术在应用过程中也存在一些伦理和社会问题,例如生物安全性、环境影响等方面,需要引起足够的重视。

基因工程胰岛素生产流程首先呢,得有合适的基因来源。
一般来说,我们会从人类细胞里找到产生胰岛素的基因。
这一步很关键哦!要是基因找错了,后面可就全乱套了。
不过呢,这个找基因的过程也不是那么死板的,不同的实验室或者公司可能会有自己的小窍门。
我觉得只要能准确找到那个产生胰岛素的基因就好啦。
接下来就是把这个基因提取出来。
这就像是从一大把钥匙里挑出一把特定的钥匙一样。
怎么提取呢?这就涉及到一些生物技术手段啦,但咱们不用纠结太多技术细节。
简单说,就是利用一些化学试剂和特殊的仪器设备把基因从细胞里弄出来。
根据经验,这个过程要特别小心,动作稍微大一点可能就会破坏基因的完整性,那可就糟糕了!然后呢,要把提取出来的胰岛素基因放到一个载体里。
这个载体就像一个小卡车,可以把基因运到我们想要的地方。
载体的选择也有不少呢,像质粒就是比较常用的一种。
不过你也可以根据实际情况选择其他合适的载体哦。
这一步呀,我觉得就像是给基因找个舒适的“座驾”,好让它顺利到达目的地。
再接下来就是把带有胰岛素基因的载体送到宿主细胞里。
宿主细胞就像是一个小工厂,基因进去之后就可以在里面开始工作啦。
这个宿主细胞可以是细菌,比如大肠杆菌就经常被用到。
为什么选择大肠杆菌呢?因为它繁殖快呀,就像一个勤劳的小工人,能快速大量地生产我们想要的东西。
当然啦,选择大肠杆菌也有一些小麻烦,不过只要处理得当就没问题啦。
在宿主细胞里,胰岛素基因就开始指挥细胞合成胰岛素啦。
这个过程有点像在工厂里按照设计图纸生产产品一样。
但是呢,这个环节可能不会那么顺利,有时候细胞可能会不听话,生产出一些不合格的产品。
这时候该怎么办呢?这就需要我们不断地监测和调整啦。
小提示:可别小看这个监测过程哦!等胰岛素在宿主细胞里合成得差不多了,就要把胰岛素从细胞里分离出来。
这就像从工厂的产品堆里把我们想要的产品挑出来一样。
这个过程也不是那么容易的,不过只要有合适的方法就可以做到。
我觉得这一步可以更灵活一点,根据自己现有的设备和技术来选择合适的分离方法就好啦。

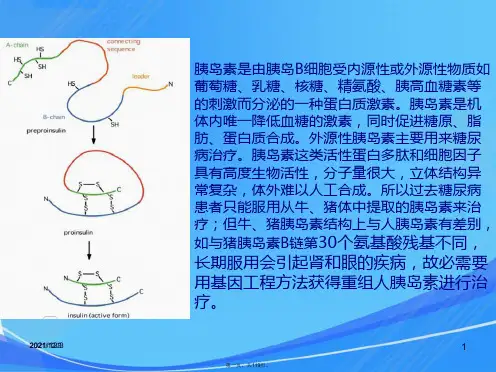
基因重组技术生产胰岛素介绍胰岛素是一种由胰岛细胞分泌的蛋白质激素,它在调节血糖水平中起着重要的作用。
胰岛素的生产曾经面临着供应不足的挑战,然而通过基因重组技术,科学家们成功地生产了大量的胰岛素,从而满足了临床需求。
本文将介绍基因重组技术生产胰岛素的过程和意义。
胰岛素的生产过程对基因重组技术生产胰岛素的理解首先需要了解传统的生产过程。
传统方法中,胰岛素是从猪和牛的胰腺中提取得到的。
这种方法存在着供应不稳定、产品纯度不高以及与人体胰岛素之间存在差异等问题。
而基因重组技术生产胰岛素则是通过将人类胰岛素基因导入到大肠杆菌等微生物中进行生产。
下面是具体的步骤:1.获得胰岛素基因:从人类胰岛细胞中获得胰岛素基因的DNA序列。
2.构建基因重组载体:将胰岛素基因插入到合适的基因重组载体中,如质粒或病毒。
3.转导宿主细胞:将构建好的基因重组载体导入到宿主细胞中,如大肠杆菌。
4.培养和表达:在适当的培养条件下,促使宿主细胞进行复制和转录,从而表达胰岛素基因并产生胰岛素蛋白质。
5.纯化和提取:通过分离和纯化的步骤,得到纯度较高的胰岛素。
基因重组技术的意义基因重组技术生产胰岛素具有许多优势和意义:1.提供稳定供应:通过基因重组技术生产的胰岛素能够提供更加稳定的供应,解决了传统生产方法中供应不足的问题。
2.提高纯度:基因重组技术可以实现胰岛素的高纯度生产,减少了杂质的存在,从而提高了产品质量。
3.与人体胰岛素相似:基因重组技术生产的胰岛素与人体胰岛素在结构和功能上更为接近,减少了在使用过程中出现的副作用和风险。
4.降低成本:基因重组技术可以实现胰岛素的大规模生产,从而降低了生产成本和售价,使胰岛素更加可负担。
应用领域和前景基因重组技术生产的胰岛素在医药领域有着广泛的应用。
主要包括:1.糖尿病治疗:胰岛素是糖尿病治疗中必不可少的药物,通过基因重组技术生产的胰岛素可以满足糖尿病患者的需求。
2.研究工具:基因重组技术生产的胰岛素可以作为研究工具,用于研究胰岛素的生物学功能以及与糖尿病等疾病的关系。


基因工程--胰岛素胰岛素能降低人体血糖的含量。
糖尿病患者是由于胰腺的β细胞不能分泌胰岛素,使患者血糖过高,继而带来吃得多、喝得多、尿得多、体重减少(即三多一少)的一系列临床症状。
糖尿病的死亡率仅次于心脏病和癌症。
19世纪以前,糖尿病像妖魔一样肆意夺走人们的生命,那时糖尿病患者的平均生存时间仅4.9年,面对这旷日持久的大浩劫,人类一筹莫展。
1921年,加拿大医生班廷(Banding)取两条狗的胰脏,将之搅碎过滤,并收集少量液体注射到一只已经出现糖尿病昏迷的小狗身上,奇迹发生了,昏迷的小狗血糖开始下降,当液体注射完毕,世界上第一只从糖尿病昏迷状态下苏醒过来的小狗就站起来跑开了。
从狗胰脏收集的“神奇”液体,就是我们现在使用的胰岛素。
1922年1月班廷第一次使用从牛胰脏中提取的胰岛素,对一个患糖尿病2年,已被医生放弃的男孩进行治疗,结果“药到病除”。
全世界为这个划时代的医学成果而欢呼!班廷也由此荣获1923年诺贝尔生理学和医学奖。
胰岛素治疗糖尿病至今仍然是临床上最有效的方法。
过去,胰岛素主要靠从猪等大家畜胰腺中提取。
从一头猪的胰腺中只能提取出300单位胰岛素,而一个病人每天就需要40单位胰岛素,因此远远不能满足需要。
图7-1 胰岛素生成图大肠杆菌说:给我一个基因,我将源源不断给你药物”基因工程技术一问世,科学家就想到利用该技术来解决胰岛素药源不足的问题。
他们首先要找到胰岛素基因,在人的胰岛细胞里有一段特定结构的DNA分子指挥着胰岛素的合成,然后又找到在人的大肠里存在对人体无害的大肠杆菌。
把人的胰岛素基因转入到大肠杆菌的细胞中,随着大肠杆菌的繁殖,胰岛素基因也一代代的遗传下去。
大肠杆菌繁殖速度相当快,大约20分钟就能繁殖一代,把它放到大型的发酵罐里进行人工培养,就可以大量繁殖,并且生产出大量人的胰岛素(图7.1)。
实际上这种大肠杆菌是经过改造已经带上新的遗传性状的细菌,称为基因工程菌。
1978年美国的吉尔伯特研究组用此方法成功地生产了鼠胰岛素,随后依塔库拉研究组用相同方法生产出了人的胰岛素。

胰岛素制备 Prepared on 22 November 2020生物技术制药参考资料基因工程制备胰岛素一、胰岛素的定义胰岛素是由胰岛β细胞受内源性或外源性物质如葡萄糖、乳糖、核糖、精氨酸等的刺激而分泌的一种蛋白质激素。
二、目前临床使用的胰岛素来源1、动物胰岛素:从猪和牛的胰腺中提取,两者药效相同,但与人胰岛素相比,猪胰岛素中有1个氨基酸不同,牛胰岛素中有3个氨基酸不同,因而易产生抗体。
2、半合成人胰岛素:将猪胰岛素第30位丙氨酸,置换成与人胰岛素相同的苏氨酸,即为半合成人胰岛素。
3、重组人胰岛素(现阶段临床最常使用的胰岛素):利用生物工程技术,获得的高纯度的生物合成人胰岛素,其氨基酸排列顺序及生物活性与人体本身的胰岛素完全相同。
三、目前,国际上生产医用重组人胰岛素(recombi—nant human insulin,rhI)的方法1、用基因工程大肠杆菌escherichia coli,E.CO一)分别发酵生产人胰岛素(human insulin,hi)的A、B链,然后经化学再氧化法,使两条链在一定条件下重新形成二硫键,得到hI。
这一方法缺点较多,目前已较少使用;2、用基因工程E.coli发酵生产人胰岛素原(hu—man peoinsulin,hPI),后经加工形成hI。
E.coli系统表达量高,但缺点是不利于表达hI这样的小蛋白,产物易降解,故常采用融和蛋白形式将hPI连接在一个较大的蛋白质后,表达产物需经过一系列复杂的后加工才能形成有活性的hi;3、通过基因工程酵母菌发酵生产hPI,经后加工形成hI。
酵母系统下游后加工比细菌表达系统简单,但缺点是生产慢,生产周期长,且重组蛋白分泌量少(1~50 mg/L),产量低。
因此,虽然rhI投放市场已久,但人们一直在努力寻求和探索更加有效的表达系统和高效的表达策略I2 J,尤其是对E.CO一尻表达系统的研究更是越来越深入,用E.coli系统表达hPI的策略也越来越多。

基因工程胰岛素生产流程首先呢,得有合适的基因源。
这个基因源啊,要包含能产生胰岛素的基因片段。
从哪儿找呢?一般是从能产生胰岛素的生物体里获取啦,像人体细胞或者某些微生物之类的。
我觉得在这一步,选择基因源的时候要特别小心谨慎!毕竟这是整个生产流程的基础呀。
接下来就是提取基因了。
这个过程需要一些特殊的工具和技术哦。
不过具体的工具和技术呢,就看各个实验室或者生产厂家自己的条件和习惯啦,这个环节可以根据实际情况自行决定。
提取的时候可不能马虎,要尽可能保证基因的完整性。
为什么要这样呢?因为如果基因不完整,后面生产出来的胰岛素可能就会有问题呀!然后呢,要把提取出来的胰岛素基因导入到载体里。
这个载体就像是一辆小卡车,负责把基因运到合适的地方去。
载体的选择也挺重要的,有很多种载体可以选择呢。
我记得有一次,我们在选择载体的时候就纠结了好久,最后根据经验,选了那种比较稳定而且容易操作的载体,效果还不错呢!再之后就是把带有胰岛素基因的载体导入到宿主细胞里啦。
宿主细胞就像一个小工厂,会根据基因的指令开始生产胰岛素。
这个过程有点像给小工厂下达生产任务一样。
导入的方法也有不少,不过每种方法都有它的优缺点,得根据实际情况来选择哦。
刚开始可能会觉得这个步骤有点麻烦,但习惯了就好了!当宿主细胞接收到任务后,就开始大量生产胰岛素啦。
这个时候要密切关注细胞的生长状态和生产情况哦。
这一步要特别注意!要是细胞状态不好,可能就生产不出足够的胰岛素了。
最后呢,就是把生产出来的胰岛素从宿主细胞或者培养液里分离和纯化出来。
这就像是从一堆杂物里把宝贝挑出来一样。
纯化的方法也有好多种,具体用哪种就看你的需求和实际情况啦。
小提示:别忘了最后一步哦!。
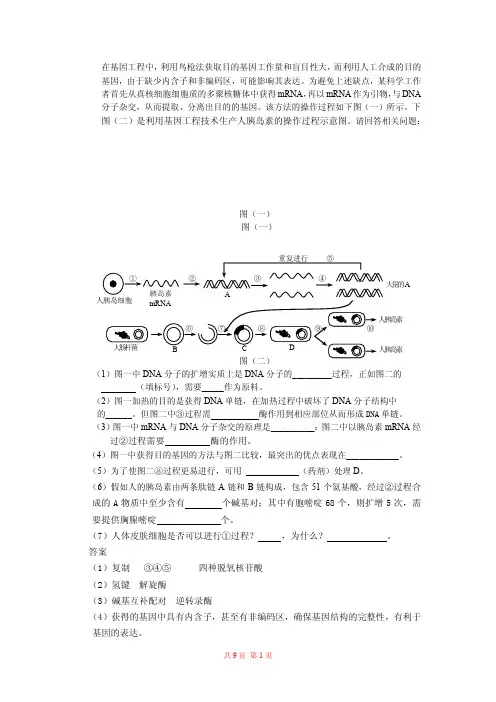
岛素 岛素 大量的A 在基因工程中,利用鸟枪法获取目的基因工作量和盲目性大,而利用人工合成的目的基因,由于缺少内含子和非编码区,可能影响其表达。
为避免上述缺点,某科学工作者首先从真核细胞细胞质的多聚核糖体中获得mRNA ,再以mRNA 作为引物,与DNA分子杂交,从而提取、分离出目的的基因。
该方法的操作过程如下图(一)所示。
下图(二)是利用基因工程技术生产人胰岛素的操作过程示意图。
请回答相关问题:图(一)图(一)(1)图一中DNA 分子的扩增实质上是DNA 分子的_________过程,正如图二的(填标号),需要_____作为原料。
(2)图一加热的目的是获得DNA 单链,在加热过程中破坏了DNA 分子结构中的______。
但图二中③过程需 酶作用到相应部位从而形成DNA 单链。
(3)图一中mRNA 与DNA 分子杂交的原理是__________;图二中以胰岛素mRNA 经过②过程需要 酶的作用。
(4)图一中获得目的基因的方法与图二比较,最突出的优点表现在____________。
(5)为了使图二⑧过程更易进行,可用 (药剂)处理D 。
(6)假如人的胰岛素由两条肽链A 链和B 链构成,包含51个氨基酸,经过②过程合成的A 物质中至少含有 个碱基对;其中有胞嘧啶68个,则扩增5次,需要提供胸腺嘧啶 个。
(7)人体皮肤细胞是否可以进行①过程? ,为什么? 。
答案(1)复制 ③④⑤ 四种脱氧核苷酸(2)氢键 解旋酶(3)碱基互补配对 逆转录酶(4)获得的基因中具有内含子,甚至有非编码区,确保基因结构的完整性,有利于基因的表达。
(5)CaCl 2(6)153 2635(7)不能 因为皮肤细胞不能表达胰岛素基因(编者:菱湖中学史菊琴)已知某植物光合作用和呼吸作用的最适温度分别为25℃和30℃.下图表示该植物在25℃时光合强度与光照强度的关系.若将温度提高到30℃的条件下(原光照强度和CO 2浓度等不变),从理论上讲,图中相应点的移动应该是 ( )A 、a 点上移,b 点左移,m 值增加B 、a 点不移,b 点左移,m 值不变C 、a 点下降,b 点右移,m 值下降D 、a 点下降,b 点不移,m 值上升答案:C(编者:菱湖中学史菊琴)下丘脑在人体生理调节过程中发挥着重要作用。

【题目】利用基因工程生产人胰岛素有两种方法。
方法一:将胰岛素基因转入细菌细胞,进行微生物培养,提取胰岛素;方法二:将胰岛素基因转入高等哺乳动物的受精卵,培养成转基因动物并从其乳汁中提取胰岛素。
(1)使用方法一时,在细菌细胞中合成的胰岛素原需在______(填“蛋白酶”“DNA酶”或“脂肪酶”)的作用下才能变成具有活性的胰岛素;为使胰岛素基因能顺利进入细菌细胞,应用____________处理细菌细胞,被处理后的细胞称为____________细胞。
(2)方法二将目的基因导入受体细胞常用的方法是____________要确保人胰岛素基因只在牛的乳腺动物中表达,应该采取的措施是在人胰岛素基因的首端加上____________。
转基因动物进入泌乳期后,可以通过分泌的乳汁来生产所需要的药品,因而称为____________。
(3)用基因工程生产的胰岛素被注射到患者血液中容易被分解,治疗效果会受到影响。
科学工作者以胰岛素的结构规律为基础,对胰岛素基因进行修饰,从而对传统胰岛素进行改造,生产出不易被分解的高效胰岛素,这属于生物工程中____________的范畴。
【答案】蛋白酶 Ca2+(或CaCl2)感受态显微注射法乳腺蛋白基因的启动子等调控组件乳腺生物反应器(或乳房生物反应器)蛋白质工程【解析】基因工程技术的基本步骤:(1)目的基因的获取:方法有从基因文库中获取、利用PCR技术扩增和人工合成。
(2)基因表达载体的构建:是基因工程的核心步骤,基因表达载体包括目的基因、启动子、终止子和标记基因等。
(3)将目的基因导入受体细胞:根据受体细胞不同,导入的方法也不一样.将目的基因导入植物细胞的方法有农杆菌转化法、基因枪法和花粉管通道法;将目的基因导入动物细胞最有效的方法是显微注射法;将目的基因导入微生物细胞的方法是感受态细胞法。
(4)目的基因的检测与鉴定:分子水平上的检测:①检测转基因生物染色体的DNA是否插入目的基因--DNA分子杂交技术;②检测目的基因是否转录出了mRNA--分子杂交技术;③检测目的基因是否翻译成蛋白质--抗原-抗体杂交技术.个体水平上的鉴定:抗虫鉴定、抗病鉴定、活性鉴定等。
生物技术制药参考资料基因工程制备胰岛素一、胰岛素的定义胰岛素是由胰岛β细胞受内源性或外源性物质如葡萄糖、乳糖、核糖、精氨酸等的刺激而分泌的一种蛋白质激素。
二、目前临床使用的胰岛素来源1、动物胰岛素:从猪和牛的胰腺中提取,两者药效相同,但与人胰岛素相比,猪胰岛素中有1个氨基酸不同,牛胰岛素中有3个氨基酸不同,因而易产生抗体。
2、半合成人胰岛素:将猪胰岛素第30位丙氨酸,置换成与人胰岛素相同的苏氨酸,即为半合成人胰岛素。
3、重组人胰岛素(现阶段临床最常使用的胰岛素):利用生物工程技术,获得的高纯度的生物合成人胰岛素,其氨基酸排列顺序及生物活性与人体本身的胰岛素完全相同。
三、目前,国际上生产医用重组人胰岛素(recombi—nant human insulin,rhI)的方法1、用基因工程大肠杆菌escherichia coli,E.CO一)分别发酵生产人胰岛素(human insulin,hi)的A、B链,然后经化学再氧化法,使两条链在一定条件下重新形成二硫键,得到hI。
这一方法缺点较多,目前已较少使用;2、用基因工程E.coli发酵生产人胰岛素原(hu—man peoinsulin,hPI),后经加工形成hI。
E.coli系统表达量高,但缺点是不利于表达hI这样的小蛋白,产物易降解,故常采用融和蛋白形式将hPI连接在一个较大的蛋白质后,表达产物需经过一系列复杂的后加工才能形成有活性的hi;3、通过基因工程酵母菌发酵生产hPI,经后加工形成hI。
酵母系统下游后加工比细菌表达系统简单,但缺点是生产慢,生产周期长,且重组蛋白分泌量少(1~50 mg/L),产量低。
因此,虽然rhI投放市场已久,但人们一直在努力寻求和探索更加有效的表达系统和高效的表达策略I2 J,尤其是对E.CO一尻表达系统的研究更是越来越深入,用E.coli系统表达hPI的策略也越来越多。
另一方面,在胰岛素的基因工程生产中,下游处理非常复杂,复杂的下游处理极大地降低了胰岛素的最终收率。