初三化学:铁的冶炼
- 格式:docx
- 大小:42.71 KB
- 文档页数:1

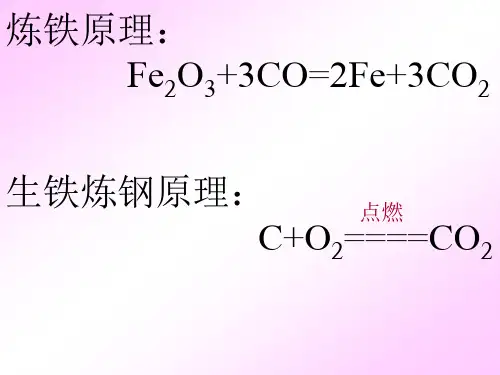

冶炼生铁的化学反应方程式嘿,朋友们!今天咱们来聊聊冶炼生铁这个超酷的化学过程,那方程式就像魔法咒语一样神奇呢!首先,最常见的就是用一氧化碳来冶炼生铁啦,那反应方程式是Fe₂O₃+3CO =高温= 2Fe+3CO₂。
你看这个氧化铁啊,就像一个超级顽固的大堡垒,里面住着铁原子这个小宝贝。
一氧化碳就像一群英勇的小战士,在高温这个大战场上,“冲啊”,然后就把氧化铁这个大堡垒给攻破啦,把铁原子给解救出来,同时还产生了二氧化碳这个小跟班。
还有呢,要是用氢气来冶炼生铁,方程式是Fe₂O₃+3H₂ =高温=2Fe+3H₂O。
这氧化铁又像一个装满宝藏(铁)的大箱子,氢气就像一群小巧灵活的小贼,在高温这个掩护下,偷偷摸摸地把铁从箱子里偷出来,还留下了水蒸气这个小尾巴,就好像小贼走的时候留下的脚印一样。
再说说用碳来冶炼生铁吧,2C+O₂ =点燃= 2CO,这第一步就像是给碳这个小火柴棒点了一把火,让它变成一氧化碳这个厉害的家伙。
然后Fe₂O₃+3CO =高温= 2Fe+3CO₂,一氧化碳这个刚被制造出来的“武器”就去攻打氧化铁这个大怪兽,最后把铁给抢出来啦。
要是从磁铁矿(Fe₃O₄)来冶炼生铁,反应方程式是Fe₃O₄+4CO =高温= 3Fe+4CO₂。
这磁铁矿啊,就像一个有着超级吸力的大磁铁,但是一氧化碳可不管这些,像一群无畏的敢死队,高温的时候就冲上去把铁原子从这个大磁铁的吸力下拽出来,还带着二氧化碳跑了。
你再想象一下,用铝来进行铝热反应冶炼生铁,2Al+Fe₂O₃ =高温= Al₂O₃+2Fe。
这铝就像一个超级英雄,氧化铁是个大反派。
在高温这个决斗场里,铝超级英雄一下子就把氧化铁大反派给打败了,把铁原子给拯救出来,自己变成了氧化铝这个“战衣”上的一部分,是不是超级酷呢?要是从菱铁矿(FeCO₃)冶炼生铁呢,首先FeCO₃ =高温=FeO+CO₂↑,这菱铁矿就像一个小包裹,一加热就把里面的氧化亚铁这个小礼物和二氧化碳这个小彩带给放出来了。

初中化学铁的冶炼原料教案
主题:铁的冶炼原料
目标:学生能够了解铁的冶炼原料及其特点。
一、导入(5分钟)
让学生观察周围的物品,了解哪些物品是由铁制成的。
引出问题:铁是我们生活中常见的金属,那么铁是如何得到的呢?
二、探究(15分钟)
1. 铁的冶炼原料有哪些?主要包括什么?
2. 铁的冶炼过程是怎样的?从原料到最终产品的经过是什么?
3. 举例说明铁的冶炼原料的特点及其应用,比如铁矿石和焦炭。
三、总结(10分钟)
让学生总结铁的冶炼原料的主要特点,并帮助他们理解铁的冶炼过程及其重要性。
四、拓展(10分钟)
邀请学生分组进行讨论,探究其他金属的冶炼原料及过程,拓展学生的化学知识。
五、小结(5分钟)
让学生复述本节课学到的内容,并提出问题,帮助学生巩固知识。
六、作业(5分钟)
布置作业:让学生查阅资料,了解其他金属的冶炼原料及过程,并写一份简短的报告。
七、反馈(5分钟)
让学生交流他们对本课内容的理解和感悟,及时 feedback 学生的学习情况。
教学设计说明:
本课程旨在让学生了解铁的冶炼原料及其特点,通过引导学生探究的方式,促使他们深入理解铁的冶炼过程,并拓展至其他金属的冶炼知识。
同时,通过作业和反馈环节,帮助学生巩固和应用所学知识。

初中化学铁的冶炼教案主题:铁的冶炼一、教学目标:1. 了解铁的冶炼的基本原理和过程。
2. 学习制备铁的基本方法和条件。
3. 观察铁的物理性质。
4. 学习化学实验操作技能。
二、教学准备:1. 实验器材:生铁粉末、碳粉、石墨舟、点燃器、试管、钳子、铁网、玻璃棒、黄色磷酸铁铵溶液。
2. 实验辅助材料:PPT课件、实验指导书、实验报告模板。
三、教学步骤:1. 引入:通过PPT课件介绍铁的冶炼的背景和重要性,激发学生对本实验的兴趣。
2. 实验操作:(1)将生铁粉末和碳粉混合放入石墨舟中,加热至800℃左右。
(2)使用点燃器点燃混合物,观察产生的反应现象。
(3)将试管放置在反应产物上方,用钳子将反应产物收集到试管中。
(4)用铁网将试管中的铁块冷却。
3. 实验观察:观察试管中收集到的铁块的物理性质,如颜色、硬度等。
4. 实验讨论:通过实验观察结果,讨论铁的冶炼过程中发生的化学反应,分析反应的原理和条件。
5. 实验总结:总结本实验的目的、过程和结果,让学生进一步理解铁的冶炼过程及其意义。
四、课堂练习:1. 铁的冶炼是属于()过程。
A. 物理变化B. 化学变化C. 热力学变化2. 下列哪种物质不参与铁的冶炼反应?A. 生铁粉末B. 碳粉C. 氧气五、实验报告:要求学生根据实验过程和观察结果,撰写简洁、清晰的实验报告。
六、拓展延伸:引导学生进一步思考铁的冶炼反应与其他化学反应的联系和区别,拓展实验内容。
七、板书设计:铁的冶炼1. 实验目的2. 实验原理3. 实验步骤4. 实验观察5. 实验讨论以上为初中化学铁的冶炼实验教案,欢迎提出意见和建议。

初中化学铁的冶炼铁的冶炼这事儿,说起来其实挺有意思的,感觉像是一次“地球大作战”,铁矿石就像是一个大宝藏,而冶炼,就是我们打怪升级的过程。
你想啊,咱们每天见到的铁制品,比如铁锅、钢铁大楼,甚至是汽车,都是从这些不显眼的矿石中炼出来的。
听着有点神奇对吧?但其实它并不难懂,反正你就记住一个大概的流程就行了。
今天我们就来聊聊,这个铁的冶炼是咋回事儿。
你得知道,铁矿石这玩意儿其实就在地底下埋着。
它看起来不太起眼,颜色也暗淡,像是一块黑乎乎的石头,但它其实是铁的“家”。
不过,要从这些矿石里得到铁,咱得给它点“热情”。
而这“热情”,就是高温,得烧得特别热,像烧烤似的。
不过烧烤的温度咱还不够,得在一千多度以上,铁矿石才能乖乖地释放出铁来。
咋做到的呢?得靠高炉。
这个高炉,看起来就像个超级大的烟囱,里面全是火,简直就是一个火山口,一天到晚冒烟冒火,啥也不怕,铁矿石进去了,就能被高温给搞定。
进到高炉里,铁矿石就开始“变身”了。
铁矿石里有一大堆氧气和铁,咱需要“打破”它们的关系,让氧气走掉,留下铁。
这时候,咱就要加入煤炭和石灰石这俩好伙伴。
煤炭呢,是提供热量的好帮手,石灰石则帮忙吸附矿石里的杂质。
你要知道,这杂质可不能随便让它在铁里混着,它就像是调皮的小孩子,搅乱了整个大家庭。
石灰石就像是那个保姆,能把这些不听话的家伙抓住,带走,给铁留个清净。
等到这些反应完毕,铁矿石中的氧气和其他杂质全被“赶走”,你就能看到铁水了。
铁水是熔化了的铁,像一锅热腾腾的汤,红彤彤的。
别小看这个铁水,它虽然看起来没啥特别的,但一旦冷却下来,它就能变得又硬又强,变成你常见的铁制品。
所以说,高炉就像是一个魔法工厂,铁矿石经过这一番折腾,终于变得有了用处。
再说说冶炼过程中的一个小秘密。
铁矿石虽然能冶炼成铁,但这些铁有时候并不是咱们想要的“纯铁”。
要知道,纯铁虽然听起来很厉害,但其实它很软,啥都能弯曲。
说白了,纯铁就像个软乎乎的豆腐脑,稍微一碰就容易碎。




以下是一些常见金属冶炼的化学方程式示例:
1.铁的冶炼(高炉法):
Fe2O3 + 3CO →2Fe + 3CO2
2.铜的冶炼(闪速炉法):
2Cu2S + 3O2 →2Cu2O + 2SO2
Cu2O + FeS →Cu2S + FeO
3.铝的冶炼(氧化铝电解法):
2Al2O3 →4Al + 3O2
4.锌的冶炼(热还原法):
ZnO + C →Zn + CO
5.镁的冶炼(熔融法):
MgO + C →Mg + CO
6.铅的冶炼(焙烧还原法):
2PbS + 3O2 →2PbO + 2SO2
PbO + C →Pb + CO
7.钢的冶炼(平炉法):
Fe2O3 + 3C →2Fe + 3CO
FeO + C →Fe + CO
这些方程式代表了一些金属冶炼过程中的化学反应。
请注意,实际的冶炼过程可能还涉及其他辅助剂、温度控制等因素,并且会因不同的冶炼方法和工艺而有所不同。
因此,在实际应用中,最好参考相关的冶金学文献或咨询专业人士以获取准确的化学方程式和冶炼过程信息。

冶炼铁的原理化学方程式《冶炼铁的原理化学方程式:Fe₂O₃+3CO =高温= 2Fe+3CO₂》同学们,今天咱们来聊聊这个冶炼铁的化学方程式背后的那些化学小秘密。
首先呢,咱们得说说这里面涉及到的化学键。
化学键就像是原子之间的小钩子,把原子们连接在一起。
在这个反应里,三氧化二铁(Fe₂O₃)中的铁原子和氧原子之间是离子键,这离子键啊,就像带正电和带负电的原子像超强磁铁般吸在一起。
你看,铁原子失去电子带正电,氧原子得到电子带负电,然后就紧紧地吸在一块儿了。
一氧化碳(CO)里的碳原子和氧原子之间是共价键,就好比是它们共用小钩子连接着。
再说说这个反应中的氧化还原反应部分。
这氧化还原反应就像一场电子的交易。
在这个方程式里,一氧化碳(CO)是还原剂,三氧化二铁(Fe₂O₃)是氧化剂。
就像锌和硫酸铜反应中锌原子把电子给铜离子那样,这里面一氧化碳的碳把电子给了三氧化二铁中的铁。
一氧化碳的碳从 +2价变成 +4价,就像一个人从有点小钱变成更穷了(失去电子被氧化);而三氧化二铁中的铁从 +3价变成0价,就像一个穷人一下子变得富有了(得到电子被还原)。
咱们再看看这个反应的化学平衡。
化学平衡就好比是一场拔河比赛。
不过呢,这个反应因为是冶炼铁,高温条件下反应几乎进行到底,不太容易观察到平衡状态。
但是咱们可以想象一下,如果是一个类似的反应有化学平衡的情况。
反应物和生成物就像两队人,在反应过程中,正反应和逆反应一直在进行。
当正反应的速率和逆反应的速率相等的时候,就像两队人拔河谁也拉不动谁了,这时候整个体系里各种物质的浓度就不再变化了,这就是化学平衡状态。
接着说说分子的极性。
分子的极性就像小磁针一样。
比如说水(H₂O)是极性分子,就像小磁针,氧一端像磁针南极带负电,氢一端像北极带正电。
而二氧化碳(CO₂)呢,它是直线对称的非极性分子,就像一个两边完全一样的东西,没有像小磁针那样有正负电分布不均的情况。
在这个冶炼铁的反应里,一氧化碳(CO)也是极性分子,这种极性对它和三氧化二铁(Fe₂O₃)之间的反应也是有一定影响的,就像带磁性的东西之间的相互作用一样。
第 1 页 共 1 页 初三化学:铁的冶炼
1. 原料:
铁矿石、石灰石、焦炭、空气。
2. 反应原理:
在高温条件下,用还原剂CO 将铁从铁矿石中还原出来。
3. 化学方程式:
Fe 2O 3+3CO 2Fe+3CO 2
4. 现象: 红色固体逐渐变成黑色粉末,澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。
5. 设备:高炉。
6. 冶炼过程中发生的化学反应:
C+O 2 CO 2 CO 2+C 2CO Fe 2O 3+3CO 2Fe+3CO 2 CaCO 3 CaO+CO 2↑ CaO+SiO 2 CaSiO 3
石灰石的主要作用是将矿石中的二氧化硅变为炉渣CaSiO 3。
7. 纯净物与含有杂质物质的换算关系
纯净物的质量=混合物的质量×物质的纯度=混合物的质量×(1-杂质的质量分数)
高温高温高温点燃高温高温一氧化碳还原氧化铁。
第1课时 铁的冶炼【学习目标】1.知道一些常见金属(铁、铝等)矿物,知道可用铁矿石炼铁。
2.用实验方法将氧化铁中的铁还原出来。
3.会利用化学方程式对含有某些杂质的反应物或生成物进行有关计算。
【学习重点】了解炼铁的原理和实验室用一氧化碳还原氧化铁的装置,能写出相关化学方程式。
【学习难点】写出有关金属冶炼的化学方程式。
【学习过程】一、自主学习1.默写金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 2.写出下列化学方程式:碳还原氧化铁:3C+2Fe 2O 3=====高温4Fe+3CO 2↑,碳还原氧化铜: C+2CuO=====高温2Cu+CO 2↑, 一氧化碳还原氧化铜:CO+CuO=====△Cu+CO 2,氢气还原氧化铜:H 2+CuO=====△Cu+H 2O 。
二、新知导学知识点一 金属资源概况【引导自学】请学生自主阅读教材P14~P15,了解金属资源。
1.金属资源的存在形式:地球上的金属资源广泛地存在于地壳和海洋中,除金、银等少数很不活泼的金属有单质形式存在外,其余都以化合物形式存在。
2.金属矿石:工业上从含有金属元素并有开采价值的矿石中提炼金属。
常见的金属矿石有: 矿石 赤铁矿 磁铁矿 菱铁矿 黄铁矿 铝土矿 黄铜矿 辉铜矿 主要成分Fe 2O 3Fe 3O 4FeCO 3FeS 2Al 2O 3CuFeS 2Cu 2S知识点二 铁的冶炼【师生合作】完成实验“一氧化碳还原氧化铁”。
1.铁的冶炼原理(一氧化碳还原氧化铁) 实验药品氧化铁粉末、澄清石灰水、一氧化碳气体实验装置实验步骤 ①检查装置气密性;②装入药品并固定;③点燃酒精灯;④向玻璃管中通入CO ;⑤点燃酒精喷灯;⑥反应完全后熄灭酒精喷灯;⑦试管冷却后停止通入CO ;⑧熄灭酒精灯实验现象①红棕色粉末逐渐变为黑色,②生成的气体能使澄清的石灰水变浑浊;③尾气燃烧并产生蓝色火焰化学 方程式 酒精喷灯处:3CO+Fe 2O 3=====高温2Fe+3CO 2;试管中:CO 2+Ca(OH)2=== CaCO 3↓+H 2O酒精灯处:2CO+O 2=====点燃2CO 2实验结论 红棕色的氧化铁被一氧化碳还原成单质铁;一氧化碳具有还原性,作还原剂【引导自学】请学生自主阅读教材P15~16,了解铁的冶炼。
第 1 页 共 1 页 初三化学:铁的冶炼
1. 原料:
铁矿石、石灰石、焦炭、空气。
2. 反应原理:
在高温条件下,用还原剂CO 将铁从铁矿石中还原出来。
3. 化学方程式:
Fe 2O 3+3CO 2Fe+3CO 2
4. 现象:
红色固体逐渐变成黑色粉末,澄清石灰水变浑浊,尾气燃烧产生蓝色火焰。
5. 设备:高炉。
6. 冶炼过程中发生的化学反应:
C+O 2 CO 2 CO 2+C 2CO Fe 2O 3+3CO 2Fe+3CO 2 CaCO 3 CaO+CO 2↑ CaO+SiO 2 CaSiO 3
➢石灰石的主要作用是将矿石中的二氧化硅变为炉渣CaSiO 3。
7. 纯净物与含有杂质物质的换算关系
纯净物的质量=混合物的质量×物质的纯度=混合物的质量×(1-杂质的质量分数)
高温高温高温点燃高温高温一氧化碳还原氧化铁。