氮族元素知识结构图
- 格式:doc
- 大小:41.00 KB
- 文档页数:4
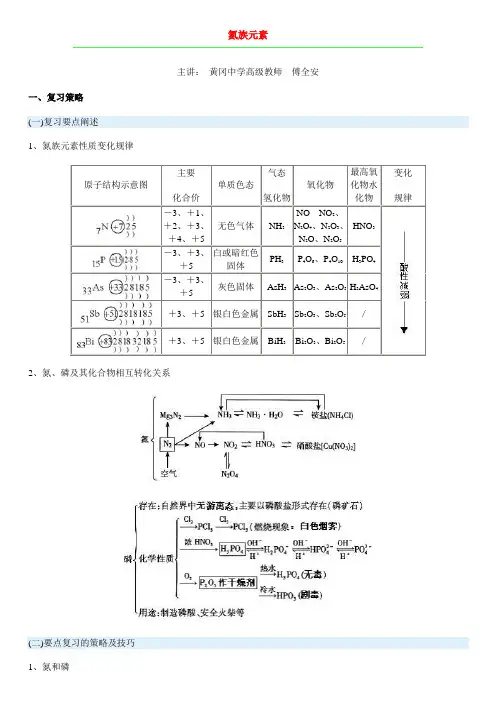
氮族元素主讲:黄冈中学高级教师傅全安一、复习策略(一)复习要点阐述1、氮族元素性质变化规律2、氮、磷及其化合物相互转化关系(二)要点复习的策略及技巧1、氮和磷(1)氮气a.物理性质:纯净的N2是一种无色无味的气体,难溶于水,在空气中约占总体积的78%。
b.结构:电子式为,结构式为N≡N,氮氮叁键键能:946kJ·mol-1,键能大,分子结构稳定,化学性质不活泼。
c.化学性质练1、为什么在常温下N2不容易跟其它物质起反应而在高温下却能和许多物质起反应?N≡N键很稳定,键能为945.8kJ·mol-1,比O=O键(键能为497kJ·mol-1)、H—H键(键能为436kJ·mol-1)键能大,故N2在常温下化学性质不活泼。
在高温高压或放电等情况下N2获得足够能量使N≡N断裂时氮原子很活泼故能和H2、O2等许多物质化合。
2NO+O2=2NO2NO2+H2O=HNO3+HNO2①3HNO2=HNO3+2NO+H2O②①×3+②:3NO2+H2O=2HNO3+NO在密闭容器中NO2和N2O4存在下列平衡:2NO2N2O4故置于密闭容器中NO2即可理解为NO2和N2O4组成的混和物。
d.NOx 和O2溶于水的计算①NO和O2溶于水的计算练2、在一定条件下将等体积的NO和O2组成的混和气体置于试管中并将试管倒立于水中充分反应后残余气体体积约为原总体积的()练3、将盛有10mL由NO2和O2组成的混和气体的大试管倒立于水中充分反应后残余1mL无色气体求原混和气体可能有的体积组成。
解:若残留1mL是O2,则:4NO2+2H2O+O2=4HNO34mL1mL4x x4x+x+1=10x=1.8mLV(NO2)=7.2mLV(O2)=1.8mL若残留1mL是NO,则由:3NO2+H2O=2HNO3+NO3mL1mL知有3mL NO2没有转化为HNO3,则转化为HNO3的NO2和O2为10mL-3mL=7mL。






氮族元素知识结构图氮族元素知识结构图一.氮族元素的通性(一)基本性质(价电子构型,主要氧化数,半径,第一电离能,电子亲合能(第二周期的特殊性),次周期性(原因))(二)氮和磷的成键情况(氮氮键,磷磷键的比较,单键与三键)二.氮族元素单质(一)氮气A.物性B.分子结构(1)价键理论(VB)(2)分子轨道理论(MO)(对比氮与氧,分子轨道能级次序)C.氮气的化学性质(1)保护气体与化学活泼性(2)固氮工程(原因)三.磷(一)磷的同素异形体(白磷(黄磷),红磷,黑磷(结构,空间构型)) (二)强还原性(能量转化的特殊形式,工业制火柴,置换重金属离子)(三)在在热碱溶液中歧化四.砷、锑、铋(一)结构A.砷(黄砷(分子晶体)、灰砷(金属晶体层状))B.锑(黄锑(分子晶体),灰锑(金属晶体层状))C.铋(金属晶体,(层状))D.存在形式(硫化物)五.氮族元素氢化物(一)主要氢化物的比较(成键轨道的区别)A.还原性(酸性,碱性)AsH3>SbH3>PH3>NH3(二)氨及其衍生物A.氨(分子结构与水的比较)(1)化学性质《1》强还原性(利用图像分析)《2》Lewis碱性(络合作用)《3》液氨的自偶电离(导电性,溶解性)*补充知识点:金属液氨溶液(导电性,高浓度的强还原性,产生电子的试剂)《4》取代反应(两种类型:氨中的氢被取代;氨解反应B.铵盐(酸性,热稳定性,还原性)(1)水解(2)鉴定(与碱共热,强氧化性的酸的铵盐受热分解)(3)热分解分为三种类型C.氨的衍生物(1)联氨,羟氨氧化还原性的比较(看图分析)(2)联氨,羟氨的结构与状态(3)氨,联氨,羟氨的酸碱性碱性:NH3 >N2H4 >NH2OH (4)联氨(肼)(制备,弱碱性,配位作用,氧化还原性)(5)羟氨(结构,不稳定,易分解,还原性)(6)氢叠氮酸(无色液体或气体)(逆歧化产生,结构,性质(受撞击易爆炸)(7)叠氮化物(碱金属叠氮酸盐稳定,重金属的叠氮化物(引爆剂),叠氮离子为拟卤素离子(三)膦(PH3)A.强还原性B.极弱碱性C.Lewis碱(四)AsH3 SbH3 BiH3均为无色,恶嗅,有毒气体,且△fG m >0A.制备B.热分解(不稳定性)C.强还原性(硫化砷的自燃)D.砷的检验(马氏,古氏,区别砷镜与Sb镜)四.氮族元素氧化物(一)一氧化氮(NO)A.分子结构(MO)B.物理性质C.化学性质(1)还原性(检测一氧化氮)(2)氧化性(3)配位性质(棕色环反应:鉴定硝酸根和亚硝酸根)(4)鉴定《1》硝酸根的鉴定《2》亚硝酸根的鉴定《3》鉴定硝酸根,消除亚硝酸根的干扰(二)二氧化氮A.分子结构(影响键角的因素四点)B.化性(氧化性,还原性,易歧化(酸碱介质均如此))(三)磷的氧化物(P4O6、P4O10)A.P4O6(1)物性:无色,挥发性(2)化性:《1》冷水中生成H3PO3《2》热水中歧化《3》进一步氧化(每个P仍有一对孤对电子)B.P4O10(1)物性(2)化性《《1》各种+5价的含氧酸酐《2》极强吸水性,脱水性五.氮族元素含氧酸及盐(一)亚硝酸(HNO2)A.制备(冷冻条件逆歧化,复分解)B.结构C.化学性质(酸介质氧化性显著,碱介质还原性为主)(1)亚硝酸氧化性(定量检测亚硝酸根)(亚硝酸根与一氧化碳的中毒机理(2)亚硝酸根的致癌作用(3)还原性(4)歧化(自发歧化)(5)配位性质(二)硝酸及盐A.分子结构B.化性(强的一元质子酸,氧化性)*补充知识点:还原产物多样化,影响硝酸还原产物的因素(5点)C.硝酸与其他酸的混合酸(1)王水(浓硝酸:浓盐酸=1:3)(具有强酸性,强氧化性(氧化重金属))(2)HNO3-HF混合酸(强氧化性,强酸性,配位作用)D.硝酸盐:未酸化的硝酸盐溶液几乎无氧化性,但氢离子浓度上升,氧化性增强)——磷的各种含氧酸(次,亚,正,焦)(三)次磷酸A.结构B.还原性(四)亚磷酸及其盐A.分子结构B.化学性质(1)二元中强质子酸(2)还原性,但弱于次磷酸(3)歧化(酸碱介质,均峰点位置)(五)磷酸及其盐A.制备(实验室)B.化性(1)三元、中等质子酸(2)非氧化性酸(3)磷酸根的配位性质(Lewis碱性)(4)形成3种类型的盐(5)结构含反馈π键(六)焦磷酸,聚磷酸,偏磷酸A.多聚偏磷酸盐作软水剂B.鉴别正磷酸,焦磷酸和偏磷酸(七)Bi的强氧化性Bi(V)强氧化性——6s2惰性电子对效应83Bi[Xe]4f145d106s26p3Bi3+[Xe]4f145d106s2Bi(V)[Xe]4f145d106s01.4f、5d电子云发散,对核电荷的屏蔽作用弱,使作用于6s的有效核电荷Z*↑↑;2.6s电子钻穿作用强,1、2两个因素场使E6s↘3.自上而下E(V)氧化能力增强六.氮族元素卤化物(一)NF3和NCl3A.NF3(物性,不水解的原因)B.NCl3(物性,强烈水解(亲电))(二)PCl3与PCl5A.五氯化磷气体时,单体存在,固体时:离子型结构PCl6-和PCl4+(三)砷,锑,铋的卤化物A.MX3存在B.卤化物的水解。


氮知识点总结框架图一、氮的基本性质1. 原子结构和周期表位置2. 物理性质:颜色、气味、密度等3. 化学性质:化合价、化合物种类等4. 合成方法:工业制备、实验室制备等二、氮的存在形式1. 大气中的氮- 氮气的成分和性质- 大气中氮的循环与影响2. 地壳中的氮- 氮的矿物存在形式- 土壤中的氮- 生物体内的氮三、氮的化合物1. 氮的氧化物- 亚硝酸盐、硝酸盐等的性质和用途- 氮的氧化物在环境中的作用2. 氨和氮化物- 氨的性质和用途- 氮化物的特点和应用3. 氮的有机化合物- 蛋白质、核酸等有机物中的氮- 氨基酸、氨基糖等有机分子结构和功能四、氮在生物过程中的作用1. 氮的进入生物体- 氮固定作用- 植物对氮的吸收- 动物摄入氮的途径2. 生物中的氮转化- 氮在植物体内的代谢- 氮在动物体内的代谢- 微生物对氮的利用和转化3. 生态循环- 生物体内的氮循环- 土壤中的氮循环- 水体中的氮循环五、氮对环境和生态系统的影响1. 农业生产中的氮污染- 化肥对土壤和水体的影响- 农田氮排放的环境问题2. 氮对大气和水体的影响- 大气中氮氧化物和氨排放引发的环境问题 - 水体中氮污染的影响3. 氮对生态系统的影响- 植物群落结构和功能的变化- 动植物的生存和繁衍受到的影响六、氮的应用1. 工业利用- 合成氨的工业生产- 氮气的工业应用- 其他氮化合物的工业用途2. 农业利用- 化肥的类型和应用- 生物有机肥料的作用- 氮肥的施用原则和注意事项3. 医药和生物技术中的应用- 氮在医药中的用途- 氮在生物技术中的作用- 氮的应用前景和发展趋势以上是氮知识点的总结框架图,通过这个框架图可以系统地了解氮的基本性质、存在形式、化合物、在生物过程中的作用、对环境和生态系统的影响以及其应用等方面的知识。
氮是生物体内重要的元素之一,对于生命的存在和发展起着重要的作用,同时也在工业、农业、医药和生物技术等领域有着广泛的应用。
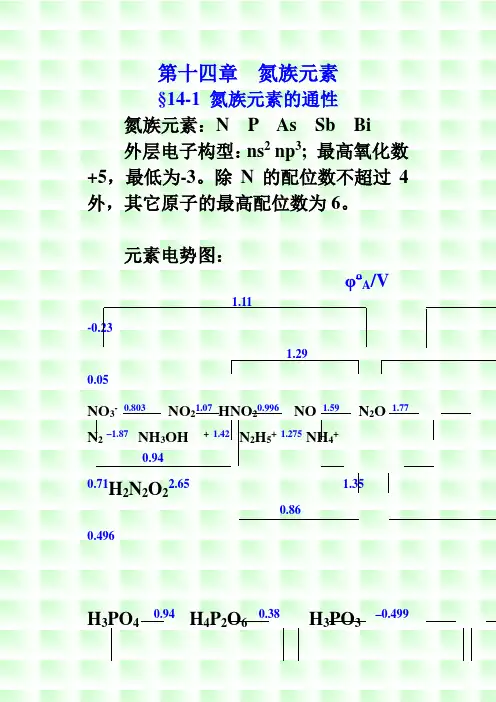
氮族元素§14-1 氮族元素的通性氮族元素:N P As Sb Bi外层电子构型:ns2 np3; 最高氧化数+5,最低为-3。
除N的配位数不超过4外,其它原子的最高配位数为6。
元素电势图:φo A/V1.11-0.231.290.05NO3-0.803NO21.07HNO20.996NO 1.59 N2O 1.77 N2–1.87 NH3OH +1.42 N2H5+1.275NH4+0.940.71HN2O22.65 1.3520.860.496H3PO40.94H4P2O60.38H3PO3–0.499PO2 –0.508 P (-0.1) P2H40.0PH33-0.276 -0.05 -0.063H3AsO40.56HAsO2 0.247As -0.60AsH3Sb2O50.58SbO+0.152Sb-0.51SbH3Bi2O5 1.6 BiO+0.32Bi-0.3BiH3φo B/V-1.160.151.05NO3-0.86 NO20.88 NO2-0.46 NO0.76N2O 0.94 N2–3.04NH2OH 0.73 N2H40.11NH3.H2O0.15N2O22-1.52 0.420.01 -0.14 -0.76 –0.73-1.18PO43- ?H2P2O62-?HPO32-–1.565 H2PO2-–2.05 P (-0.9) P2H4-0.8 PH3-1.12 -0.73 -0.89AsO43--0.68AsO2--0.675As (-1.43)AsH3H3SbO64-(-0.40)SbO2--0.66 Sb (-1.34) SbH3Bi2O4-0.56 Bi2O3-0.46 Bi ?BiH3+5价的化合物在酸性溶液是氧化剂,O5及HNO3均为强氧化剂,但在2碱性溶液中氧化性弱●+3价的化合物中HNO2具明显的氧化性,亚磷酸及其盐为强还原剂,其它元素的+3价化合物为弱还原剂●单质磷在酸、碱性溶液中均歧化,其它单质不歧化●-3价的化合物,除NH3及NH4+为弱还原剂外,其它为强还原剂§14-2 氮和它的化合物一、氮的成键特征和价键结构1. 形成离子键如Li3N、Mg3N2、Ca3N2(极易水解成相应的氢氧化物及NH3)2. 形成共价键(1)SP3不等性杂化,形成三个共价单键。

氮族元素知识结构图
一.氮族元素的通性
(一)基本性质(价电子构型,主要氧化数,半径,第一电离能,电子亲合能(第二周期的特殊性),次周期性(原因))
(二)氮和磷的成键情况(氮氮键,磷磷键的比较,单键与三键)
二.氮族元素单质
(一)氮气
A.物性
B.分子结构
(1)价键理论(VB)
(2)分子轨道理论(MO)(对比氮与氧,分子轨道能级次序)
C.氮气的化学性质
(1)保护气体与化学活泼性
(2)固氮工程(原因)
三.磷
(一)磷的同素异形体(白磷(黄磷),红磷,黑磷(结构,空间构型)) (二)强还原性(能量转化的特殊形式,工业制火柴,置换重金属离子)(三)在在热碱溶液中歧化
四.砷、锑、铋
(一)结构
A.砷(黄砷(分子晶体)、灰砷(金属晶体层状))
B.锑(黄锑(分子晶体),灰锑(金属晶体层状))
C.铋(金属晶体,(层状))
D.存在形式(硫化物)
五.氮族元素氢化物
(一)主要氢化物的比较(成键轨道的区别)
A.还原性(酸性,碱性)AsH3>SbH3>PH3>NH3
(二)氨及其衍生物
A.氨(分子结构与水的比较)
(1)化学性质
《1》强还原性(利用图像分析)
《2》Lewis碱性(络合作用)
《3》液氨的自偶电离(导电性,溶解性)
*补充知识点:金属液氨溶液(导电性,高浓度的强还原性,产生电子的试剂)《4》取代反应(两种类型:氨中的氢被取代;氨解反应
B.铵盐(酸性,热稳定性,还原性)
(1)水解
(2)鉴定(与碱共热,强氧化性的酸的铵盐受热分解)
(3)热分解分为三种类型
C.氨的衍生物
(1)联氨,羟氨氧化还原性的比较(看图分析)
(2)联氨,羟氨的结构与状态
(3)氨,联氨,羟氨的酸碱性碱性:NH3 >N2H4 >NH2OH
(4)联氨(肼)(制备,弱碱性,配位作用,氧化还原性)
(5)羟氨(结构,不稳定,易分解,还原性)
(6)氢叠氮酸(无色液体或气体)(逆歧化产生,结构,性质(受撞击易爆炸)(7)叠氮化物(碱金属叠氮酸盐稳定,重金属的叠氮化物(引爆剂),叠氮离子为拟卤素离子
(三)膦(PH3)
A.强还原性
B.极弱碱性
C.Lewis碱
(四)AsH3 SbH3 BiH3均为无色,恶嗅,有毒气体,且△fG m>0
A.制备
B.热分解(不稳定性)
C.强还原性(硫化砷的自燃)
D.砷的检验(马氏,古氏,区别砷镜与Sb镜)
四.氮族元素氧化物
(一)一氧化氮(NO)
A.分子结构(MO)
B.物理性质
C.化学性质
(1)还原性(检测一氧化氮)
(2)氧化性
(3)配位性质(棕色环反应:鉴定硝酸根和亚硝酸根)
(4)鉴定
《1》硝酸根的鉴定
《2》亚硝酸根的鉴定
《3》鉴定硝酸根,消除亚硝酸根的干扰
(二)二氧化氮
A.分子结构(影响键角的因素四点)
B.化性(氧化性,还原性,易歧化(酸碱介质均如此))
(三)磷的氧化物(P4O6、P4O10)
A.P4O6
(1)物性:无色,挥发性
(2)化性:
《1》冷水中生成H3PO3
《2》热水中歧化
《3》进一步氧化(每个P仍有一对孤对电子)
B.P4O10
(1)物性
(2)化性《
《1》各种+5价的含氧酸酐
《2》极强吸水性,脱水性
五.氮族元素含氧酸及盐
(一)亚硝酸(HNO2)
A.制备(冷冻条件逆歧化,复分解)
B.结构
C.化学性质(酸介质氧化性显著,碱介质还原性为主)
(1)亚硝酸氧化性(定量检测亚硝酸根)(亚硝酸根与一氧化碳的中毒机理(2)亚硝酸根的致癌作用
(3)还原性
(4)歧化(自发歧化)
(5)配位性质
(二)硝酸及盐
A.分子结构
B.化性(强的一元质子酸,氧化性)
*补充知识点:还原产物多样化,影响硝酸还原产物的因素(5点)
C.硝酸与其他酸的混合酸
(1)王水(浓硝酸:浓盐酸=1:3)(具有强酸性,强氧化性(氧化重金属))(2)HNO3-HF混合酸(强氧化性,强酸性,配位作用)
D.硝酸盐:未酸化的硝酸盐溶液几乎无氧化性,但氢离子浓度上升,氧化性增强)
——磷的各种含氧酸(次,亚,正,焦)
(三)次磷酸
A.结构
B.还原性
(四)亚磷酸及其盐
A.分子结构
B.化学性质
(1)二元中强质子酸
(2)还原性,但弱于次磷酸
(3)歧化(酸碱介质,均峰点位置)
(五)磷酸及其盐
A.制备(实验室)
B.化性
(1)三元、中等质子酸
(2)非氧化性酸
(3)磷酸根的配位性质(Lewis碱性)
(4)形成3种类型的盐
(5)结构含反馈π键
(六)焦磷酸,聚磷酸,偏磷酸
A.多聚偏磷酸盐作软水剂
B.鉴别正磷酸,焦磷酸和偏磷酸
(七)Bi的强氧化性
Bi(V)强氧化性——6s2惰性电子对效应
83Bi[Xe]4f145d106s26p3
Bi3+[Xe]4f145d106s2
Bi(V)[Xe]4f145d106s0
1.4f、5d电子云发散,对核电荷的屏蔽作用弱,使作用于6s的有效核电荷Z*↑↑;
2.6s电子钻穿作用强,1、2两个因素场使E6s↘
3.自上而下E(V)氧化能力增强
六.氮族元素卤化物
(一)NF3和NCl3
A.NF3(物性,不水解的原因)
B.NCl3(物性,强烈水解(亲电))
(二)PCl3与PCl5
A.五氯化磷气体时,单体存在,固体时:离子型结构PCl6-和PCl4+(三)砷,锑,铋的卤化物
A.MX3存在
B.卤化物的水解。