溶液的基本概念
- 格式:doc
- 大小:336.01 KB
- 文档页数:5
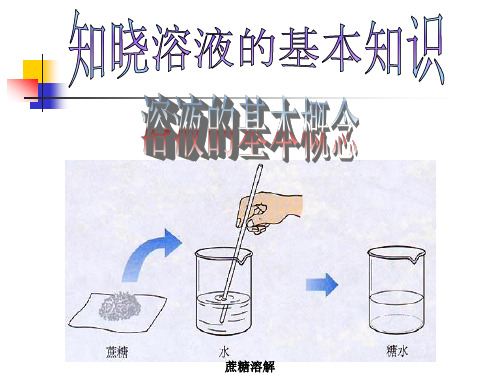
蔗糖溶解溶液具有广泛的用途你知道什么叫溶液吗?事例怎样形成的?用途食盐水将食盐溶于水配制生理盐水于医疗中举出你所知道的溶液的事例,并说出这些溶液是怎样形成的以及有什么用?物质在水中的分散物质在水中的分散情况:物质在水中的分散被分散物质分散后现象分散微粒分散特征食盐溶液呈无色Na+、Cl-均一、稳定蔗糖溶液呈无色蔗糖分子均一、稳定高锰酸钾溶液呈紫红色K+、MnO4-均一、稳定硫酸铜溶液呈蓝色Cu2+、SO42-均一、稳定氯化铁溶液呈黄色Fe3+、Cl-均一、稳定植物油液体浑浊液体小液滴不均一、不稳定泥土不溶解固体小颗粒不均一、不稳定一、溶液的组成结论:1、溶液、悬浊液、乳浊液的概念a.溶液:物质以分子或离子的形式,分散到另一种物质中,形成均一的、稳定的混合物b.悬浊液:物质以固体小颗粒的形式分散到另一物质中,形成不均一、不稳定的混合物c.乳浊液:物质以液体小液滴的形式分散到另一物质中,形成不均一、不稳定的混合物一、溶液的组成2、溶液的特征:均一性、稳定性a.均一性:是指溶液各部分的组成、性质(包括物理性质和化学性质)完全一样。
b.稳定性:是指在温度等外部因素不改变的情况下,无论放置多久,溶液也不会出现分层或沉淀现象一、溶液的组成溶液的组成{溶质:溶剂:被溶解的物质溶解其他物质的物质溶液质量= 溶质质量+ 溶剂质量观察下列生活中常见的溶液,说出其中的溶剂和溶质食醋碘酒硫酸铜溶液葡萄糖注射液盐酸溶液溶质溶剂碘酒碘酒精葡萄糖注射液葡萄糖水食醋醋酸水硫酸铜溶液硫酸铜水盐酸HCl气体水一、溶液的组成1、当固体、气体和液体互溶时,一般是固体、气体作为溶质,液体作为溶剂。
2、当两种液体互相溶解时,一般是量少的作为溶质,量多的作为溶剂。
3、如果其中一种是水,一般水是溶剂。
4、汽油、乙醇、三氯甲烷也是常用溶剂。
5、把气体混合物称为气态溶液,简称气体,如空气。
彼此呈分子分散的固体混合物称为固态溶液,简称固溶体,如合金。

溶液知识点公式总结一、溶液的基本概念1. 溶液的定义:溶液是由溶质和溶剂混合在一起而形成的一种均匀的物质。
2. 溶解度:溶质在一定温度和压力下溶解在溶剂中的最大量称为溶解度。
3. 饱和溶液:当溶质在溶剂中溶解的速率等于溶质从溶液中析出的速率时,称为饱和溶液。
4. 浓度:溶液中溶质的含量称为溶液的浓度,通常用质量分数、摩尔浓度、体积分数等表示。
5. 稀释:将一定浓度的溶液加入适量的溶剂,使溶质浓度减少的过程称为稀释。
二、溶液的描述1. 质量分数:溶质质量与溶液质量之比称为质量分数。
质量分数(%) = (溶质的质量 / 溶液的质量) × 100%2. 摩尔浓度:单位体积溶液中溶质的物质的量与溶液体积之比称为摩尔浓度,通常用M表示。
摩尔浓度(M)= 溶质的物质的量(mol)/ 溶液的体积(L)3. 体积分数:溶质体积与溶液体积之比称为体积分数。
体积分数(%)= (溶质的体积 / 溶液的体积) × 100%三、溶解度相关公式1. 饱和溶液中溶质的质量分数质量分数(%)= (溶质的质量 / 溶剂 + 溶质的质量) × 100%2. 溶质的溶解度溶质的溶解度 = (溶质的质量 / 溶剂的质量) × 100%3. 溶质在溶剂中的溶解度溶质在溶剂中的溶解度 = (溶质的质量 / 溶剂的质量) × 100%四、稀释相关公式1. 稀释后的溶质的摩尔浓度稀释后的溶质的摩尔浓度 = 稀释前的溶质的摩尔浓度 × 稀释前的溶液的体积 / 稀释后的溶液的体积2. 稀释后的溶质的体积分数稀释后的溶质的体积分数 = 稀释前的溶质的体积分数 × 稀释前的溶液的体积 / 稀释后的溶液的体积五、相关实例1. 已知溶质的摩尔质量、溶质的质量分数和溶液的质量,求溶质的质量溶质的质量 = 溶质的质量分数 × 溶液的质量2. 已知溶质和溶剂的摩尔质量,求溶液的摩尔浓度溶液的摩尔浓度 = 溶质的物质的量 / 溶液的体积3. 已知溶质的质量、溶质的密度和溶液的体积,求溶质的质量分数溶质的质量分数 = (溶质的质量 / 溶质的密度) / 溶液的体积六、总结溶液是化学中常见的一种物质状态,它的基本组成是溶质和溶剂。


中考化学溶液知识点总结【考点1】溶液的概念和基本特征一、溶液的概念1.溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
2.溶液的组成:溶液是混合物,由溶质和溶剂组成。
溶液的质量=溶质的质量+溶剂的质量;溶液的体积≠溶质体积+溶剂体积溶质:被溶解的物质。
可以是固体、液体或气体。
一种溶液中的溶质可以是一种或多种物质。
溶剂:能溶解其他物质的物质。
水是最常见的溶剂。
汽油、酒精也可以作为溶剂。
二、溶液的基本特征①均一性:指溶液形成以后,溶液各部分的组成、性质完全相同。
如溶液中部分的浓度、密度和颜色完全一样。
②稳定性:外界条件不变是溶液长期放置,溶质不会从溶液中分离出来。
③是混合物。
【规律】溶液的判别(1)澄清透明不代表是无色的。
(2)均一稳定的液体不一定是溶液,如水。
【举例】硬水、空气、纯净水属于溶液;泥水,油水,蒸馏水不是溶液。
【技巧】溶质、溶剂的判定①通常不指明溶剂的溶液,一般是水溶液。
②当固体、气体溶于液体时,固体、气体做溶剂,液体做溶剂。
③当两种液体互相溶解时,量多的叫做溶剂,量少的叫做溶质。
④当物质溶解发生化学变化时,一定要正确判断溶质。
⑤溶质和溶剂是溶液所特有的概念,悬浊液和乳浊液不存在溶质和溶剂。
⑥溶质质量是指溶液中已溶解溶质的质量。
【拓展】影响物质溶解能力的因素:1、相似相容,溶质和溶剂的性质相似,溶解能力越强。
如:氯化钠易溶于水,难溶于油,碘易溶于汽油,那溶于水。
1、大部分物质稳定越高,溶解能力越强。
对于气体,压强越大溶解能力越强。
【考点2】溶液和浊液1、浊液:包括乳浊液和悬浊液。
2、乳浊液:小液滴分散到液体里形成不均一的、不稳定的混合物叫乳浊液。
悬浊液:固体颗粒分散到液体里形成不均一的、不稳定的混合物叫悬浊液。
3、溶液和浊液的区别【考点3】乳化现象1.乳浊液:小液滴分散到液体里形成不均一的、不稳定的混合物叫乳浊液。
2.乳化现象:使植物油分散成无数细小的液滴,而不聚集成大的油珠,这些细小的液滴能随着水流走,这个现象叫乳化现象。


溶液理论知识点总结一、溶液的基本概念1. 溶液的定义溶液是由溶质和溶剂组成的稳定的混合物,溶质是被溶解的物质,溶剂是溶解溶质的物质。
通常情况下,溶质的量较少,溶剂的量较多,它们之间的物理状态可以是固体、液体或气体。
2. 溶解度溶解度是指在一定温度和压力下,溶质在溶剂中溶解的最大量。
溶解度与温度和压力有关,通常情况下,随着温度的升高,溶解度会增加;而随着压力的升高,气体的溶解度会增加。
3. 饱和溶液当溶质在溶剂中达到了最大溶解度时,所得到的溶液称为饱和溶液。
饱和溶液的物质不再溶解,处于溶解与析出的平衡状态。
二、溶解过程溶解过程是指溶质分子或离子被溶剂分子包围,并逐渐被溶剂分子分散均匀的过程。
溶解过程是一个动态平衡的过程。
1. 溶质与溶剂之间的相互作用溶质与溶剂之间的相互作用是决定溶解过程的关键因素。
通常来说,溶质与溶剂之间有两种主要的相互作用力:溶质与溶剂之间的吸引力和溶质分子内部之间的作用力。
2. 溶解过程的动力学溶解过程是一个动力学过程,其速率受到温度、溶质颗粒大小和形状、溶剂的种类和温度等因素的影响。
一般来说,温度越高,溶解过程的速率越快;溶质颗粒越小,溶解过程的速率也越快。
三、溶液的性质1. 溶液的物理性质溶液的物理性质包括密度、折射率、电导率等。
这些性质与溶质和溶剂的种类、浓度、温度等因素有关。
2. 溶液的化学性质溶液的化学性质是指在溶液中的溶质分子或离子所表现出的化学行为,比如电离、水解、络合反应等。
3. 溶液的溶解热溶解过程伴随着吸热或放热,其溶解热与溶质与溶剂之间的相互作用力有关。
当溶质与溶剂之间的相互作用力较大时,溶解过程会放热;反之,溶解过程则会吸热。
四、溶解度平衡与溶解度积1. 溶解度平衡溶解度平衡是指溶液中的溶质在溶解与析出之间达到平衡状态。
在溶解度平衡状态下,溶液中的溶质溶解和析出的速率相等。
2. 溶解度积溶解度积是指在一定温度下,饱和溶液中溶质与溶剂之间的活度积。
根据溶解度积的定义可知:\[K_{sp}=[A^+]^m[B^-]^n\]其中,\[K_{sp}\]为溶解度积常数,\[A^+\]和\[B^-\]分别为溶液中的离子浓度。
知识点一:溶液和浊液的定义
如下图所示:同学们结合自己的生活经验想一下A、B、C、D四支试管各有什么现象?
A试管中蔗糖固体逐渐消失,最终形成了澄清透明的液体混合物。
B试管在震荡的过程中,形成了混合物,但是在静置的过程中,混合物逐渐分层,最终我们发现,植物油和水之间有一个非常明显的界限。
换句话说,植物油和水可以形成混合物,但是混合物非常的不稳定,一段时间之后两种液体最终会以分层的形式分离。
C试管在震荡的过程中,也形成了混合物,我们通常会称之为泥浆,但是在静置的过程中,泥土颗粒本身逐渐的下降,水留在了上边。
也就是说,泥土和水也可以形成混合物,但是混合物本身也不稳定,最终会以分层的形式存在。
D情况和A类似,固体逐渐消失,最终形成了澄清透明的液体混合物。
溶液:一种或几种物质分散到另外一种物质中所形成的均一的、稳定的混合物。
(像上面的A和D)
浊液:不溶性固体颗粒或不溶性小液滴分散到液体中形成的混合物。
其中,固体颗粒分散到液体中形成的我们叫做悬浊液(像上面的C),小液滴分散到液体中形成的混合物我们叫做乳浊液(像上面的B)。
注意事项:
⑴溶液一定是混合物。
因为它至少是由两种物质组成的。
⑵溶液是均一的,也就是说溶液中各部分的性质完全相同。
⑶溶液是稳定的,也就是说当外界条件不变时,溶液不会随着时间的变化而发生分离。
【例题1】
将少量下列物质分别加入到足量水中,充分搅拌后,属于溶液的是()
A.植物油B.泥沙C.纯净的冰块D.氯酸钾
【例题2】
溶液的基本特征是( )
A.无色透明B.无色均一C.均一、稳定D.纯净的液体
【例题3】
下列液体不属于溶液的是( )
A.氯化钠投入水中B.冰投入水中
C.碘酒D.二氧化碳通入水中
溶液的基本概念
下列关于溶液的说法正确的是( )
A.混合物一定是溶液
B.均一、稳定、透明的液体一定是溶液
C.溶液一定是混合物
D.一杯溶液中各部分的性质是不同的
【例题5】
溶液是一种( )
A.化合物B.混合物
C.纯净物D.无色透明液体
知识点二:溶液的组成
溶质:被溶解的物质
溶剂:溶解溶质的物质
【例】
蔗糖溶解在水当中形成糖水:那么被溶解的物质( )叫做溶质;能溶解其他物质的物质( )叫做溶剂。
注意事项:溶剂的判断
1.固体和液体,气体和液体形成的溶液规定:液体物质为溶剂2.液体和液体形成的溶液规定:量多的物质为溶剂
3.溶液中只要有水,无论量多量少一律认为水是溶剂
【例题1】
指出下列溶液中的溶质和溶剂
食盐水
溶质:食盐( )
溶剂:水( )
二氧化碳溶于水后形成的溶液
溶质:碳酸
溶剂:水
碘酒
溶质:碘
溶剂:酒精
生石灰( )溶于水后形成的溶液
溶质:氢氧化钙
溶剂:水
下列对于溶质的说法,正确的是( )
A.溶质只能是固体
B.溶质只能是液体
C.溶质只能是气体
D.溶质可以是固体,液体或气体
【例题3】
当把一满勺的糖加入到热茶中时,糖在这里可称做( )
A.溶液B.溶剂C.合金D.溶质
【例题4】
下列关于溶液的叙述错误的是( )
A.碘酒溶液中碘是溶质酒精是溶剂
B.溶液中各部分的性质是相同的
C.一种溶剂只能溶解一种溶质
D.食盐溶液与蔗糖溶液混合后仍是溶液
【例题5】
向50g稀盐酸中加入2g铁粉,最后所得溶液的质量( )
A.大于52g B.等于52g
C.小于52g D.无法确定
知识点三:溶液的分类
饱和溶液和不饱和溶液
1.定义
饱和溶液:在一定温度下,在一定量的溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下,在一定量的溶剂里,还能继续溶解某溶质的溶液,叫做这种溶质的不饱和溶液。
2.理解
⑴指明一定温度,一定的溶剂量。
⑵有对应性,需指明“对某种溶质而言”,也就是说某溶质的饱和溶液不是不能再溶解其
它任何物质。
3.饱和溶液和不饱和溶液的相互转化关系
一般规律:
特殊规律【适用于Ca(OH)2】:
4.溶解度
在一定的温度下,某固态物质在100克溶剂中达到饱和状态时所溶解的质量,叫做该物质在这种溶剂里的溶解度。
注意事项:抓住四个要点
①一定温度下②在100克溶剂中③饱和状态④所溶解溶质的质量——单位为克
【例题1】
欲使接近饱和的KNO3溶液转化成饱和溶液可以采用三种方法
⑴__________,⑵____________,⑶_____________。
【例题2】
将40℃时硝酸钾饱和溶液冷却到20℃时,温度变化前后,保持不变的是( )
A.溶质质量B.溶液质量
C.溶剂质量D.溶质的质量分数
【例题3】
现有一瓶NH4Cl不饱和溶液,下列操作不能使其成为饱和溶液的是( )
A.加NH4Cl晶体B.蒸发溶剂
C.升高温度D.降低温度
【例题4】
在一定温度下,下列溶液一定是不饱和溶液的是( )
A.一杯还能溶解蔗糖的食盐水
B.一杯还能溶解食盐的食盐水
C.一杯恒温蒸发掉一部分水后有硝酸钾析出的硝酸钾溶液
D.一杯溶质含量很少的澄清石灰水
知识点四:溶液组成的表示方法
------溶质的质量分数
溶液组成的表示方法很多,初中化学阶段我们重点介绍溶质的质量分数:
浓溶液的稀释
浓溶液的质量×浓溶液中溶质的质量分数=稀溶液的质量×稀溶液中溶质的质量分数
称量15克的氯化钠,放入烧杯后,再用量筒量取了85毫升的水,倒入烧杯中,用玻璃棒搅拌,直至氯化钠溶解。
(水的密度近似看作1克/毫升)
【例题1】
有一瓶20g的氯化钾溶液,蒸干后得到了2.8g氯化钾固体。
请问这一溶液中溶质的质量分数。
【例题2】
t℃时从200克饱和氯化钠溶液中取出20克溶液,剩下的溶液中不变的是( )
A.溶液质量B.溶剂质量
C.溶质质量D.溶质的质量分数
【例题3】
在60克KOH溶液中含有KOH 24克,则KOH溶液中溶质的质量分数是( ) A.28.6%B.24%C.45%D.40%
【例题4】
要使W克10%的A物质的溶液浓度增大一倍,可采用的方法是( )
A.加入W克A物质固体
B.蒸发浓缩成W/2克溶液
C.加热蒸发掉一半溶剂
D.加入W克10%的A物质的溶液。