无机化学:氧化还原与电极电势
- 格式:ppt
- 大小:3.29 MB
- 文档页数:20


实验四氧化还原与电化学
一、实验目的
1. 了解原电池的电动势和电极电势的测定方法
2. 掌握电极电势和氧化还原反应的关系
3. 掌握反应物浓度,介质对氧化还原反应的影响
二、实验原理
1. 电极电势代数值越大,其氧化态的氧化能力越强,还原态的还原能力越弱;反之,代数值越小,其氧化还原能力越弱,还原态的还原能力越强。
2. 根据氧化剂和还原剂所对应电极电势的相对大小,可以判断氧化还原反应进行的方向。
当氧化剂所对应电对的电极电势与还原剂所对应的电极电势的差值:
( 1 )大于0 时,反应能自发进行;
( 2 )等于0 时,反应处于平衡状态
( 3 )小于0 时,反应不能进行。
3. 通常用标准电极电势进行比较,当差值小于0.2 时,则考虑反应物浓度,介质酸碱性的影响,用能斯特方程计算。
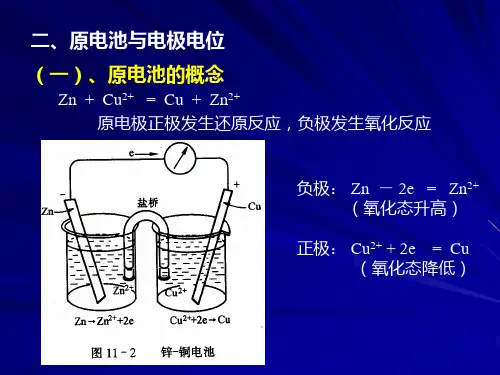
4. 原电池是通过氧化还原反应将化学能转化为电能的装置,负极发生氧化反应,给出电子,正极发生还原反应,得到电子,电子通过导线由负极流向正极。
三、仪器和药品
仪器:数字式万用表、温度计、量筒、烧杯、NO2平衡仪
药品:
固体MnO2
酸HCl,H2SO4,
碱NaOH
盐KIO3、KClO3、Na2SO3、KMnO4、CuSO4、ZnSO4
其他KI-淀粉试纸,铜片,锌片
四、实验内容
五、问题、讨论
1. 介质的酸度变化时H2O2、Br2、Fe3+的氧化性有无影响?试从电极电势予以说明。
?。

无机化学中的氧化还原反应和电化学无机化学是研究无机物质结构、性质和变化规律的科学分支。
其中,氧化还原反应和电化学是无机化学中重要且广泛应用的领域。
本文将探讨氧化还原反应和电化学的基本概念、应用和未来发展。
一、氧化还原反应的基本概念氧化还原反应是指物质中电子的转移过程。
在氧化还原反应中,被氧化的物质失去电子,而被还原的物质获得电子。
这种电子的转移导致了物质的化学变化。
氧化还原反应可以通过氧化态的变化来描述。
在反应中,氧化剂接受电子,其氧化态减少,而还原剂失去电子,其氧化态增加。
例如,氯气(Cl2)和氢气(H2)的反应可以表示为:Cl2 + 2e- -> 2Cl- (氯气被还原,氧化态减少)H2 -> 2H+ + 2e- (氢气被氧化,氧化态增加)氧化还原反应在生活和工业中有广泛的应用。
例如,电池的工作原理就是基于氧化还原反应。
电池中的正极和负极之间发生氧化还原反应,产生电流。
此外,氧化还原反应还可以用于金属的防锈和清洁等领域。
二、电化学的基本概念电化学是研究电与化学反应之间相互关系的学科。
它主要研究电解过程和电化学反应的机理。
在电化学中,电解是指通过外加电压将化学反应逆转的过程。
电解可以分为电解质溶液和电解固体两种情况。
在电解质溶液中,电解质分子或离子在电场的作用下发生氧化还原反应。
而在电解固体中,固体物质通过电子转移发生氧化还原反应。
电化学反应是指在电化学过程中发生的化学反应。
电化学反应可以是氧化还原反应,也可以是非氧化还原反应。
电化学反应的速率和方向可以通过电极电势来控制。
正电势的电极是发生氧化反应的位置,负电势的电极是发生还原反应的位置。
电化学在能源存储和转换、电解水制氢、电镀和电解池等领域有着广泛的应用。
例如,锂离子电池和燃料电池是电化学能源存储和转换的重要设备。
它们利用氧化还原反应将化学能转化为电能,实现能源的高效利用。
三、氧化还原反应和电化学的应用氧化还原反应和电化学在生活、工业和环境保护等领域有着广泛的应用。



编号: 119060141011内蒙古民族大学化学化工学院本科生学年论文题目:浅谈对电极电势的理解和应用专业:化学年级: 2011级姓名:郭学良指导教师:赵玉英导师完成日期: 2013 年 6 月 1 日浅谈对电极电势的理解和应用郭学良摘要化学反应可以分为两大类:氧化还原反应和非氧化还原反应,因此可以说氧化还原反应是无机化学学习中最重要的一类反应;而标准电极电势是氧化还原反应很好的定量标度,因此我们就有必要对标准电极电势进行必要的解析和研究。
而对于初入门的化学学习者来说,深入的了解电极电势可以从电极电势与电动势的关系、电极电势的能特斯方程、影响电极电势的因素、电极电势的图示法……这几方面入手,接下来我们就从这几方面展开讨论。
关键词:标准电极电势氧化还原反应拉提莫图能特斯方程引言标准电极电势是氧化还原反应很好的定量标度,氧化还原反应是无机化学学习中最重要的一类反应,对了解各种元素及其物质的性质及其联系有着重要的意义。
因此我们就有必要对标准电极电势进行必要的解析和研究。
而对于初入门的化学学习者来说,深入的了解电极电势可以从电极电势与电动势的关系、电极电势的能特斯方程、影响电极电势的因素、电极电势的图示法……这几方面入手,接下来我们就从这几方面展开讨论。
浅谈对电极电势的理解和应用一、电极电势与电动势的关系要想了解电极电势与电动势的关系,首先需要明白这两者的概念;1)电动势:大小等于非静电力把单位正电荷从电源的负极,经过电源内部移到电源正极所作的功。
如设W为电源中非静电力(电源力)把正电荷量q从负极经过电源内部移送到电源正极所作的功,则电动势大小为E=W/q。
2)电极电势:当金属放入盐溶液中,溶液中的金属离子受到金属表面电子的吸引而在金属表面面积形成双电层,双电层之间的电势差就是相应电极的电极电势。
3)标准电极电势:单个电极的的电极电势是无法测定的,根据IUPAC建议采用标准氢作为标准电极,给定电极电势与标准电极电势所组成的原电池的电动势即为该电极的标准电极电势。




《无机化学》学习笔记四第四章氧化还原反应与应用电化学1.了解氧化数的概念,初步会用氧化数法和离子电子法配平氧化还原反应式。
2.了解原电池的构成及表示方法。
熟悉氧化还原平衡和理解电极电势的概念,能通过计算说明分压、浓度(含酸度)对电极电势的影响。
3.会用电极电势来判断氧化剂(或还原剂)的相对强弱,计算原电池的电动势。
会用∆r G m、E判断氧化还原反应进行的方向。
4.熟悉元素的标准电极电势图的应用。
知识点:1.氧化还原反应参加反应的物质之间有电子转移的化学反应−−称为氧化还原反应。
电化学是研究化学能与电能之间相互转换的一门科学,这些转换也是通过氧化还原反应实现的。
氧化还原反应中的电子转移包括电子得失或电子偏移。
2.氧化数1970年国际纯粹和应用化学联合会(IUPAC)定义,元素的氧化数是元素的一个原子的形式荷电数,这个荷电数可由假设把每个键中的电子指定给电负性较大的原子而求得。
氧化数可以是正数、负数、整数、分数、零。
3.氧化还原的概念一个氧化还原反应包含氧化和还原两个半反应(两个过程)。
氧化数升高的过程叫氧化,氧化数降低的过程叫还原。
氧化数升高的物质被氧化,氧化数降低的物质被还原。
氧化数升高的物质叫还原剂,氧化数降低的物质叫氧化剂。
在一个氧化还原反应中,氧化和还原两个过程总是同时发生,4.氧化还原电对同种元素的不同氧化数的两种物质均可构成一个氧化还原电对,简称电对。
电对的写法:高氧化数(态)物质在前,低氧化数(态)物质在后,中间划一左斜线。
如:Cu2+/Cu,Cr2O72-/Cr3+,Fe3+/Fe2+,Fe2+/Fe。
高氧化数(态)物质叫氧化型物质,低氧化数(态)物质叫还原型物质。
5.氧化还原反应方程式的配平用氧化数法和离子电子法配平氧化还原反应方程式。
6.原电池一种把化学能转变成电能的装置。
7.原电池符号用原电池符号表示原电池。
原电池符号写法的一些规定: 1.负极写在左边,并注明(-);正极写在右边,并注明(+);盐桥在中间,用“||”表示;用“|”表示相与相之间的界面。
氧化还原反应一、教学目的1、理解电极电势与氧化还原反应的关系和介质、浓度对氧化还原反应的影响。
2、加深理解氧化态或还原态物质浓度变化对电极电势的影响。
3、学会装配原电池。
二、实验题要氧化还原过程也就是电子的转移过程。
氧化剂在反应中得到了电子,还原剂失去了电子。
这种得、失电子能力的大小或者说氧化、还原能力的强弱,可用它们的氧化态—还原态(例如Fe3+-Fe2+,I2-I-,Cu2+-Cu)所组成的电对的电极电势的相对高低来衡量。
一个电对的电极电势(以还原电势为准)代数值愈大,其氧化态的氧化能力愈强,其还原态的还原能力愈弱。
反之亦然。
所以根据其电极电势(φ)的大小(可从附录中查得),便可判断一个氧化还原反应的进行方向。
根据热力学原理△r G mӨ<0,反应自发进行,对于氧化还原反应:△r G mӨ=-n FEӨ可见,若φӨ + >φӨ -,反应正向进行;φӨ +=φӨ -反应处于平衡状态;φӨ +<φӨ-反应逆向进行。
如果两电对的标准电极电位相差不太大,则应考虑浓度对电极电位的影响。
非标准状态下的电极电势可以用能斯特方程求出。
φ=φӨ + ·lg{[氧化态]/[还原态]}改变物质的浓度会引起电极电势的变化,有时甚至可以改变反应的方向。
影响氧化还原反应的主要因素有:电极电势、介质酸度、反应物浓度等。
三、实验用品仪器:低压电源、盐桥、伏特计药品:0.5 mol·L-1 Pb(NO3)2、(0.5、1 mol·L-1 )CuSO4、0.5 mol·L-1 ZnSO4、0.1 mol·L-1 KI、0.1 mol·L-1 FeCl3、0.1 mol.L-1 KBr、0.1 mol·L-1 FeSO4、(1、3 mol·L-1)H2SO4、6 mol·L-1 HAc、(2 mol·L-1、浓)HNO3、(0.01、0.1 mol·L-1 )KMnO4、6 mol·L-1 NaOH、0.1 mol·L-1 K2Cr2O7、饱和KCl、浓NH3·H2O、饱和氯水、I2水、Br2水、CCl4、酚酞溶液、Na2S2O3、红石蕊试纸材料:导线、砂纸、电极(铁钉、铜片、锌片、碳棒)四、实验内容㈠电极电势与氧化还原反应1、取1支试管,加入0.5cm3 0.1mol·dm-3KI和2滴0.1mol·dm-3FeCl3摇匀后陇南师专生化系·无机化学实验加入CCl4,观察CCl4层颜色有何变化。
化学氧化还原反应的电位差与标准电极电势化学氧化还原反应是化学中一种重要的反应类型,常常涉及电子的转移与传递。
在反应过程中,电位差起着至关重要的作用,而标准电极电势则是评价电位差大小的基准。
本文将从电位差与标准电极电势的定义、计算与应用等方面进行探讨。
一、电位差与标准电极电势的定义电位差,简称电势差,是指两个电极之间电势的差值。
在化学氧化还原反应中,电位差代表了反应的驱动力大小。
具体而言,电位差正值表明反应可进行,即有利于产生氧化反应;电位差负值则表明反应不可进行,即有利于产生还原反应。
标准电极电势是指在标准状态下,与标准氢电极之间的电势差。
标准氢电极被规定为电极电势为0V。
其他电极的标准电势则通过相对于标准氢电极的测量得到。
标准电极电势的正负值表明了相应电极与标准氢电极之间的电位关系。
二、电位差与标准电极电势的计算电位差的计算需要确定两个参与反应的电极的电势差。
电位差的计算公式如下所示:电位差 = 电极1的电势 - 电极2的电势其中,电极1和电极2分别代表反应中的两个电极。
标准电极电势的计算需要考虑以下几个因素:1. 标准状态下,电极溶液中气体的分压;2. 溶液中各物质活性的影响。
计算标准电极电势的方法有多种,最常用的方法是根据能量差计算。
具体方法通常基于测量相对于标准氢电极的电势差,以及与已知标准电极电势之间的差值。
三、电位差与标准电极电势的应用电位差与标准电极电势在化学领域有着广泛的应用。
以下是几个具体的应用示例:1. 氧化还原反应倾向性的预测:通过比较不同物质参与的电极电势,可以预测某个物质的氧化还原性质。
电极电势高的物质表明具有较强的氧化性,电极电势低的物质则具有较强的还原性。
2. 电子传递机制的研究:通过测定反应的电位差,可以了解电子在反应中的传递机制。
电位差越大,电子传递过程中的能量损失越小,说明反应过程中电子传递效率较高。
3. 电化学储能技术的开发:电位差与电流密度之间存在一定的关系,利用反应中产生的电位差可以实现电荷的存储与释放,从而促进电化学储能技术的发展。