总酸度和游离酸度
- 格式:doc
- 大小:36.00 KB
- 文档页数:3

酸度测定操作方法一. 总酸度的测定本法采用酸碱滴定法。
取试样10ml,用0.1mol/L氢氧化钠标准溶液滴定,所消耗的毫升数用点数表示。
A.1 试剂氢氧化钠:0.1mol/L标准溶液按GB/T 601规定;酚酞指示剂:1.0/L 按GB/T 603规定。
A.2 试验方法吸取10ml试液于250ml锥形烧瓶中,加50ml蒸馏水,加3~4滴酚酞指示剂。
用0.1mol/L氢氧化钠标准溶液滴至溶液由无色变为粉红色为终点。
记下消耗氢氧化钠标准溶液毫升数V1。
A.3 计算方法总酸度点数按下列公式计算:总酸度(点)= 10V1 c/ 0.1V式中:V1 —滴定时耗去氢氧化钠标准溶液毫升数,mL;c—氢氧化钠标准溶液实际浓度,mol/L;V—取样毫升数,mL。
二. 游离酸度的测定本法采用酸碱滴定法。
取试样10ml,用0.1mol/L氢氧化钠标准溶液滴定,所消耗的毫升数用点数表示。
A.1试剂氢氧化钠:0.1mol/L标准溶液按GB/T 601规定;溴酚蓝指示剂:0.4mol/L 按GB/T 603规定。
A.2试验方法吸取10ml试液于250ml锥形烧瓶中,加50ml蒸馏水,加2~3滴溴酚蓝指示剂。
用0.1mol/L氢氧化钠标准溶液滴至溶液由黄色变至蓝紫色为终点。
记下消耗氢氧化钠标准溶液毫升数A。
A.3计算方法游离酸度点数按下列公式计算:游离酸度(点)= 10Ac/ 0.1V式中:A —滴定时耗去氢氧化钠标准溶液毫升数,mL;c—氢氧化钠标准溶液实际浓度,mol/L;V—取样毫升数,mL。
编制苏辉审核韩娟批准山东金泰机械制造有限公司。

游离酸度、总酸度及酸比
磷化液试样的的取样时间:1.刚收工或上班未加料时,
2.加料后磷化1~2根时。
1、游离酸度的测定
用移液管吸取10 ml试液于250ml锥形瓶中,加50ml蒸馏水,加2—3滴甲基橙指示剂(或溴酚蓝指示剂)。
用0.1mol/l氢氧化钠标准液滴定至溶液呈橙色(或用溴酚蓝指示剂滴定至由黄变蓝紫色)即为终点,记下的耗氢氧化钠标准液毫升数即为滴定的游离酸度点数。
游离酸度一般控制在4~8
2、总酸度的测定
用移液管吸取10 ml试液于250ml锥形瓶中,加50ml蒸馏水,加2—3滴酚酞指示剂。
用0.1mol/l氢氧化钠标准液滴定至粉红色即为终点,记下的耗氢氧化钠标准液毫升数即为滴定的总酸度点数。
总酸度一般控制在35~60
3.酸比的计算
总酸度(点数)
酸比= —————————一般控制在6~10之间
游离酸(点数)
4.标准液的配制
0.1mol/l氢氧化钠标准液:
用天平称取2克氢氧化钠,在烧杯中加蒸馏水溶解,转移入500ml的容量瓶中加水至刻度,摇匀后转移入玻璃瓶中待用。
甲基橙指示剂:1g·L-1水溶液
酚酞指示剂:(1) 0.1g指示剂溶于100mL60%乙醇中
(2) 1g酚酞溶于100mL90%乙醇中
溴酚蓝指示剂:0.1g指示剂溶于100mL20%乙醇中
盐酸的检测:
(稀释100倍后,用0.1N的氢氧化钠标准溶液滴定)
计算公式:N酸V酸=N碱V碱
加入氟化钠掩蔽高铁离子,可选用用甲基红,甲基橙,溴酚蓝,溴甲酚绿做指示剂,用标准氢氧化钠溶液测定,在pH4左右变色,亚铁离子不会有干扰,不可选用酚酞,那样终点的pH太高,亚铁离子有干扰。

总酸度、游离酸度的测定方法
本法采用的是酸碱滴定法。
取试样10ml,用0.1用0.1mol/L氢氧化钠标准溶液滴定,所消耗的毫升数用点数表示。
A1 试剂
氢氧化钠:0.1mol/L的标准溶液(按GB601配制和标定)
酚酞指示剂:0.10g溶于80ml乙醇中,稀释至100ml。
溴酚兰指示剂:溴酚蓝0.10g溶于1.5 ml 0.1mol/L氢氧化钠溶
液中,稀释至100ml。
A2 试验方法
A2.1游离酸度的测定
用移液管吸取10ml工作液于250ml锥形瓶中,加50ml去离子水,加入溴酚蓝指示剂2滴,以0.1mol/L的NaOH标准溶液滴定至由黄到紫蓝色为终点,此时所消耗0.1mol/L的NaOH标准溶液的毫升数V1称为游离酸度,用“点”来表示。
A2.2总酸度的测定
用移液管吸取10ml工作液于250ml锥形瓶中,加50ml去离子水,加入3-4滴酚酞指示剂,以0.1mol/L氢氧化钠滴定至溶液呈粉红色,且10s不褪色即为终点,此时所消耗0.1mol/L的NaOH标准溶液的毫升数V1称为总酸度,用“点”来表示。
A3密度(g/mL):
用量筒量取VmL磷化液于天平上称量,记下读数Mg。
计算式:p(g/mL) = M / V
A4 pH值:
用pH精密试纸来检测。
主要规格及技术参数金属除油除锈剂DY-110A
磷化剂PD-304
中和剂NA-502:
钝化剂FP-1101:。

总酸度、总碱度检测方法总酸度、总碱度检测方法一、术语及定义游离酸度:是指滴定10mL试液至溴酚兰指示剂终点时所耗用0.1mol/L氢氧化钠溶液的毫升数,称之为游离酸度或游离酸度的点数。
总酸度:是指滴定10mL试液至酚酞指示剂终点时所耗用0.1mol/L氢氧化钠溶液的毫升数,称之为总酸度或总酸度的点数。
游离碱度:是指滴定10mL试液至酚酞指示剂终点时所耗用0.1mol/L盐酸溶液的毫升数,称之为游离碱度或游离碱度的点数。
总碱度:是指滴定10mL试液至溴酚兰指示剂终点时所耗用0.1mol/L盐酸溶液的毫升数,称之为总碱度或总碱度的点数。
促进剂浓度:是指在发酵管内(U形管)所装试液与氨磺酸反应所产生气体的体积(mL)数,称之为促进剂浓度或促进剂浓度的点数。
二、化验用试剂及制品的制备 1、氢氧化钠标准溶液:c(NaOH)=0.5mol/L,按GB/T 601制备; 2、盐酸标准溶液:c(HCl)=0.5mol/L,按GB/T 601制备; 3、溴酚兰指示剂:1g/L,称取1.0g溴酚兰溶于1000mL20%乙醇溶液中; 4、酚酞指示剂:10g/L,称取10g酚酞溶于1000mL乙醇中。
三、指标检测方法 1、总碱度的测定用移液管取10mL试样溶液于250mL锥形瓶中,加100mL蒸馏水和4滴溴酚兰指示剂。
用盐酸标准溶液滴定至溶液由蓝紫色变为黄色即为终点,记下消耗盐酸标准溶液毫升数A。
然后根据(1)式计算所测试样溶液的总碱度。
总碱度(点)= 10Ac ……………………………(1) 0.1V 式中: A——滴定时耗去盐酸标准溶液毫升数,mL; c——盐酸标准溶液实际浓度,mol/L; V——取样毫升数,mL。
2、游离碱度的测定用移液管吸取10mL试样溶液于250mL 锥形瓶中,加100mL蒸馏水和3滴酚酞指示剂。
用盐酸标准溶液滴定至溶液由粉红色变为无色即为终点,记下消耗盐酸标准溶液毫升数B。
然后根据(2)式计算所测试样溶液的游离碱度。

磷化液的游离酸度及总酸度的测定方法一、游离酸度的测定:
用移液管吸取10ml磷化槽槽液于250ml三角烧瓶中,加50ml 纯水,加2—3滴甲基橙指示剂,用0.1N或0.1mol/1的NaOH标准液滴定到溶液呈橙色,即为终点。
记下消耗NaOH标准液毫生数即为滴定的游离酸度点数。
二、总酸度的测定:
用移液管吸取10ml磷化槽槽液于250ml三角烧瓶中,加50ml 纯水,加2—3滴酚酞指示剂,用0.1N或0.1mol/1的NaOH标准液滴定到溶液呈粉红色,即为终点。
记下消耗NaOH标准液毫生数即为滴定的总酸度点数。
三、促进剂浓度的测定:
以发酵管盛装20ml槽液,放入3—5g的A.C试药,用手将发酵管入口堵住,使之倾倒,待发酵管内的试药抵达管端时立即将发酵管摆正,并将堵住发酵管入口的手松开,待气体发生终止时,发酵管顶端之毫升数即为槽液内促进剂的浓度,1ml=1点。

3 酸度的测定3.1 概述(1)酸度的概念①总酸度总酸度是指食品中所有酸性成分的总量。
它包括未离解的酸的浓度和已离解的酸的浓度,其大小可借碱滴定来测定,故总酸度又可称为“可滴定酸度”,以食品中主要的有机酸表示。
②有效酸度有效酸度是指被测液中H+的浓度,准确地说应是溶液中H+的活度,所反映的是已离解的那部分酸的浓度,常用pH值表示。
其大小可借酸度计(即pH计)来测定。
③挥发酸挥发酸是指食品中易挥发的有机酸,如甲酸,醋酸及丁酸等低碳链的直链脂肪酸。
其大小可通过蒸馏法分离,再借标准碱滴定来测定。
一种食品的挥发酸含量是一定的,挥发酸的含量是某些食品的一项质量控制指标。
④牛乳酸度牛乳酸度有如下两种酸度:外表酸度又叫固有酸度,是指刚挤出来的新鲜牛乳本身所具有的酸度,主要来源于鲜牛乳中酪蛋白、白蛋白、柠檬酸盐及磷酸盐等酸性成分。
外表酸度在酸牛乳中约占0.15~0.18%(以乳酸计)。
真实酸度又叫发酵酸度,是指牛乳放置过程中在乳酸菌作用下乳糖发酵产生了乳酸而升高的那部分酸度。
若牛乳的含酸量超过了0.15~0.20%即认为有乳酸存在。
习惯上把含酸量在0.20%以上的牛乳列为不新鲜牛乳。
外表酸度和真实酸度之和即为牛乳的总酸度,其大小可通过标准碱滴定来测定。
(2)测定酸度的意义食品中的酸不仅作为酸味成分,而且在食品的加工贮运及品质管理等方面被认为是重要的成分,测定食品中的酸度具有十分重要的意义。
有机酸影响食品的色、香、味及稳定性;食品中有机酸的种类和含量是判断其质量好坏的一个重要指标;利用有机酸的含量与糖的含量之比,可判断某些果蔬的成熟度。
(3)食品中有机酸的种类与分布①食品中常见的有机酸食品中酸的种类很多,可分为有机酸和无机酸两类,但是主要为有机酸,而无机酸含量很少。
通常有机酸部分呈游离状态,部分呈酸式盐状态存在于食品中;而无机酸呈中性盐化合态存在于食品中。
食品中常见的有机酸有柠檬酸,苹果酸,酒石酸,草酸,琥珀酸,乳酸及醋酸等,这些有机酸有些是食品所固有的,如果蔬制品中的有机酸,有的是在食品加工中加入的,如汽水中的有机酸;有的是在生产、加工、储藏过程中产生的,如酸奶、食醋中的有机酸;有机酸在食品中的分布极不均衡,果蔬中所含有机酸种类较多,但不同果蔬中所含的有机酸种类也不同,酿造食品(如酱油,果酒,食醋)中也含有多种有机酸。


无沦高、中、低温磷化液均以游离酸和总酸度作为控制磷化液的工艺参数。
(1)游离酸表示磷化液的游离磷酸含量的参数。
游离酸的高低表示磷化液对钢铁的浸蚀强度。
游离酸高,则使铁溶解加快,易形成磷化膜的晶核。
使磷化膜结晶细致。
但过高则使已生成的膜溶解,反映在膜生成速度慢,膜粗且多孔。
游离酸低,则成膜慢,甚至不成膜。
(2)总酸表示磷化液中磷酸二氢盐[Me(H2P04)2]含量和游离酸含量之和的参数。
它的高低反映磷化液动力值的大小。
总酸大,磷化成膜速度快,低则成膜慢。
过高易产生泥渣,磷化膜上生成白色附着物。
以1molNaOH标准溶液滴定l0mL磷化液,以甲基橙为指示剂。
所消耗的氢氧化钠溶液的毫升数,为游离酸的“点”。
继续以1molNaOH标准溶液滴定已有的溶液,以酚酞为指示剂。
所消耗的氢氧化钠溶液的总毫升数,为总酸的“点”.总酸度是溶液中活性酸和潜在酸的总和。
其存在形式有:①自由扩散于溶液中的氢离子,称为活性酸,通常用pH值表示;②存在于液体上吸附的氢离子或铝离子,由它们所引起的酸度称为潜在酸度酸度=lg[C(H+)/C(OH-)]碱度=lg[C(OH-)/C(H+)]溶液中的酸=没有电离部分+电离部分(溶液的PH受到这部分的影响)--总酸度-------------------游离酸度使用PH试纸测出的是游离酸度(如果是100%电离的酸,PH试纸可以测出总酸度),总酸度需要使用滴定的方法去测出。
------------------------------------------PH试验纸测为3,3表示什么?氢离子浓度为10-3=0.001mol/L氢氧根离子浓度为10-11游离酸度=lg(10-3/10-11)=8总酸度,需要滴定实验去测量磷化工作液总酸及游离酸度测定方法1总酸及游离酸度测定方法:•游离酸度(FA)的测定:取处理液10ml,用溴酚蓝(或甲基橙或甲基橙与二甲苯酚混合液)作指示剂,以0.1N氢氧化钠滴定到终点时所需要的氢氧化钠毫升数称为游离酸度,用度或“点”来表示。
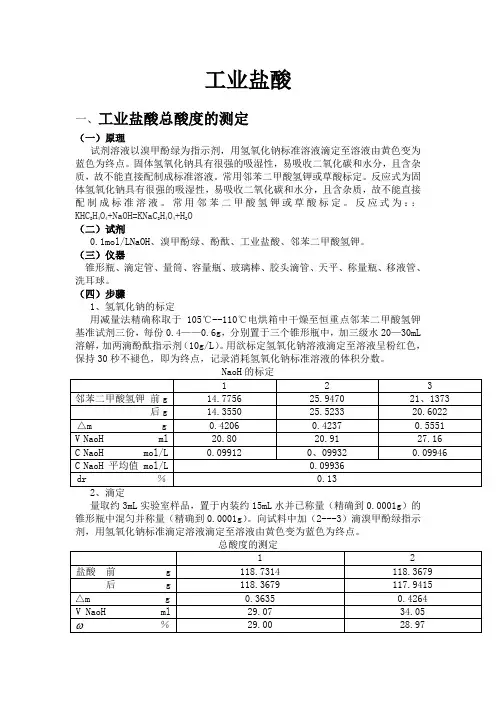
工业盐酸一、工业盐酸总酸度的测定(一)原理试剂溶液以溴甲酚绿为指示剂,用氢氧化钠标准溶液滴定至溶液由黄色变为蓝色为终点。
固体氢氧化钠具有很强的吸湿性,易吸收二氧化碳和水分,且含杂质,故不能直接配制成标准溶液。
常用邻苯二甲酸氢钾或草酸标定。
反应式为固体氢氧化钠具有很强的吸湿性,易吸收二氧化碳和水分,且含杂质,故不能直接配制成标准溶液。
常用邻苯二甲酸氢钾或草酸标定。
反应式为::KHC8H4O4+NaOH=KNaC8H4O4+H2O(二)试剂0.1mol/LNaOH、溴甲酚绿、酚酞、工业盐酸、邻苯二甲酸氢钾。
(三)仪器锥形瓶、滴定管、量筒、容量瓶、玻璃棒、胶头滴管、天平、称量瓶、移液管、洗耳球。
(四)步骤1、氢氧化钠的标定用减量法精确称取于105℃--110℃电烘箱中干燥至恒重点邻苯二甲酸氢钾基准试剂三份,每份0.4——0.6g,分别置于三个锥形瓶中,加三级水20—30mL溶解,加两滴酚酞指示剂(10g/L)。
用欲标定氢氧化钠溶液滴定至溶液呈粉红色,保持30秒不褪色,即为终点,记录消耗氢氧化钠标准溶液的体积分数。
NaoH的标定1 2 3邻苯二甲酸氢钾前g 14.7756 25.9470 21、1373 后g 14.3550 25.5233 20.6022 △m g 0.4206 0.4237 0.5551 V NaoH ml 20.80 20.91 27.16 C NaoH mol/L 0.09912 0、09932 0.09946 C NaoH 平均值 mol/L 0.09936dr %0.132、滴定量取约3mL实验室样品,置于内装约15mL水并已称量(精确到0.0001g)的锥形瓶中混匀并称量(精确到0.0001g)。
向试料中加(2---3)滴溴甲酚绿指示剂,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
总酸度的测定1 2盐酸前 g 118.7314 118.3679 后 g 118.3679 117.9415△m g 0.3635 0.4264V NaoH ml 29.07 34.05%29.00 28.97平均值%28.99允差%0.03二、工业盐酸中灼烧残渣的测定(一)原理蒸发好一份称好的试料,用硫酸处理,使盐类转变为硫酸盐,在(800±50)℃下灼烧后,称量。

食品检验技术之酸度的测定一、概念及分类有不同概念的酸度:有总酸度、有效酸度、挥发酸、牛乳酸度1、总酸度总酸度——食品中所有酸性成分的总量。
又可称为滴定酸度。
包括已离解的和未离解的酸的浓度2、有效酸度有效酸度——被测溶液中H+的浓度(准确说是H+的活度)。
即已离解的酸的浓度,用酸度计(pH计)测定3、挥发酸挥发酸——易挥发的有机酸(甲、乙、丁酸等)4、牛乳酸度①固有酸度(外表酸度)新鲜牛乳的酸度(酪、白蛋白;柠檬酸、磷酸盐),一般占0.15~0.18%(以乳酸计)②发酵酸度(真实酸度)牛乳放置后,酸度升高的那部分酸度(乳糖发酵→乳酸)发酵酸度=总酸度-固有酸度含酸量>0.2%为不新鲜牛乳二、测定意义1、有机酸与食物的色、香、味及稳定性有关色:叶绿素、花青素与酸度有关香:挥发酸给予食品特定香气味:甜酸比适当——各自独特味道稳定性:pH低抑制细菌生长,防止Vc氧化2、判断质量好坏的重要指标挥发酸种类及含量可判断腐败程度发酵制品:甲酸↑细菌性腐败↑水果发酵品:>0.1%醋酸(挥发酸)腐败↑牛乳(啤酒)乳酸↑>0.2%腐败↑油脂(酸价)游离脂肪酸↑腐败↑3、判断果蔬成熟程度确定加工工艺条件;果蔬酸度↓甜度↑则成熟度↑加工工艺与酸度有关三、总酸度的测定1、直接滴定法a 样液制备固→ 碎→ 液→ 定容→ 过滤→ 取液(含酸0.035~0.07g)使耗0.1mol/L NaOH>5ml,一般最好10~25mL (除CO2)b 滴定取制备液50ml,酚酞3~4d,以0.05mol/L或者0.1mol/L NaOH滴定2、电位滴定法(适用于颜色深的样品)以电位突变确定终点,pH=(E0-E)/0.059总酸度(%)= (VCK×100)/[m×(V/ V o)]K—主要酸换算系数3、说明①各类食品的酸度常以主要酸表示K为中和1mmol NaOH相当于酸的克数葡萄及制品酒石酸K=0.075柑橘及制品柠檬酸K=0.064苹果苹果酸K=0.067乳、肉乳酸K=0.090酒类、调味品HAc K=0.060②乳品、面包等食品以°T表示即中和100g(ml)样品所需0.1mol/L NaOH的毫升数一般新鲜牛乳16~18°T; 面包3~9°T标准:婴儿配方乳粉Ⅱ(GB10766-89)优级一级合格乳酸度<14°T <15°T <16°T四、有效酸度的测定1、电位法(1)样品处理①液态样品:除CO2后测定②固态样品:捣碎,10g样品/100ml水,过滤后测定(1→10)③含油量较高的样品:先分离油后再测定(2)测定①预热、调零②校正(以接近的标准缓冲溶液校正)③测定2、比色法(1)试纸法:快,不准确(2)标准管比色法:要求色度低0.1pH标准酸色管系列(加指示剂),不准确五、挥发酸的测定正常食品挥发酸含量较稳定,糖的发酵可使挥发酸含量增加,降低品质,所以是质量控制指标。

常规参数:温度:常温比重:1.38-1.50颜色:绿色配槽参数:磷化液:2.4%-4.8% 促进剂:0.06%总酸度:14-30点游离酸:0.6-1.4点促进剂:0.8-4点 P H 值:2.5-3.5磷化时间:8-20分钟检测方法:总酸度:取工作液10ml至250ml的锥形瓶内,滴入3-5滴的酚酞试剂,用0.1N的氢氧化钠滴定,滴至粉红为止,读取0.1N氢氧化钠的耗用量即总酸度数。
游离酸:取工作液10ml至250ml的锥形瓶内,加入蒸馏水至50ml,滴入3-5滴的溴酚兰试剂, 用0.1N的氢氧化钠滴定,滴至浅蓝色为止,读取0.1N氢氧化钠的耗用量即游离酸度数。
促进剂:用发酵管装满工作液,往发酵内加入3-4克的氨基磺酸,至到不在反应为止,准确的读取参数。
PH值: 建议用精密试纸测定。
配槽:(以1000L例)先向磷化槽内注入1/4的水,再加入计算好的促进剂0.06kg,再继续注入水,当水加至3/4时,再向里面加入计算好的磷化液48kg,最后补水至1000L。
检测总酸度与游离酸度,并用氢氧化钠或碳酸钠调整总酸度与游离酸至标准参数内。
注意:用氢氧化钠或碳酸钠调整时,先用水与计算好的氢氧化钠或碳酸钠溶解完全后,一边搅拌,一边慢慢的把氢氧化钠或碳酸钠溶液加入磷化槽内。
添加方法与日常维护:每m3槽液中添加2kg磷化液,总酸度上升一个点,游离酸度上升0.2点,添加促进剂0.3kg,促进浓度上升0.1点。
为了更好保证产品品质,建议每两个小时对磷化槽的参数进行化验一次,具体由客户自行安排。
每天开班时对槽液的浓度检测一下,并进行相应的添加。
常见的磷化质量问题及解决方法质量问题:无磷化膜或磷化膜不易形成外观现象:工件整体或局部无磷化膜,有时发蓝或有空白片产生原因:(1)工件表面有硬化层;(2)总酸度不够;(3)处理温度低;(4)游离酸太低;(5)脱脂不净或磷化时间偏短;(6)工件表面聚集氢气;(7)磷化槽液比例失调,如P2O5含量过低;(8)工件重叠或工件之间发生接触。
涂装前处理槽液检验标准1.涂装前处理工艺:脱脂一水洗一表调一磷化一水洗一烘干2.日常检验标准:表13.进厂检验标准:表24.4.1 脱脂液的检验:4.1.1 使用仪器及药品:锥形瓶、移液管、洗耳球、酸式滴定管、酚酞指示剂、0.1mol/L硫酸标准溶液4.1.2 检验方法:4.121总碱度用移液管吸取10ml待检溶液置于150ml锥形瓶中,加入2~3滴溴酚蓝指示剂,用用0.1mol/L硫酸标准溶液滴定,颜色由黄色变为粉红色即为终点。
所消耗的硫酸标准溶液毫升数即为总碱度。
4.1.2.2游离碱度:用移液管吸取10ml待检溶液置于150ml锥形瓶中,滴2~3滴酚酞指示剂,用0.1mol/L硫酸标准溶液滴定,颜色由粉红色变为无色即为终点。
所消耗的硫酸标准溶液毫升数即为游离碱度。
4.2 表调液的检验:4.2.1 使用仪器及药品:pH试纸4.2.2 检验方法:取pH试纸一条浸入待测的表调溶液中,1秒后取出与pH试纸上的准色板比较,即得出表调溶液的pH值。
4.3磷化液的检验:4.3.1 使用仪器及药品:锥形瓶、移液管、洗耳球、碱式滴定管、发酵管、溴酚蓝指示剂、酚酞指示剂、0.1mol/L氢氧化钠标准溶液、氨基磺酸4.3.2 检验方法:4.3.2.1游离酸度:用移液管吸取10ml待检磷化液置于150ml锥形瓶中,滴2~3滴溴酚蓝指示剂,用0.1mol/L氢氧化钠标准溶液滴定,颜色由黄绿色变为蓝紫色即为终点。
所消耗的氢氧化钠标准溶液毫升数即为游离酸度;4.322总酸度:用移液管吸取10ml待检磷化液置于150ml锥形瓶中,滴2~3滴酚酞指示剂,用0.1mol/L氢氧化钠标准溶液滴定,颜色由无色变为粉红色即为终点。
所消耗的氢氧化钠标准溶液毫升数即为总酸度;4.323促进剂浓度:取100ml磷化液注入发酵管中,加入2~3克氨基磺酸,用掌心堵住开口处,倒置一次使氨基磺酸与药液充分反应,静止1分钟,发酵管顶部气量的毫升数即为促进剂浓度。
游离酸度的取值范围
(最新版)
目录
1.游离酸度定义
2.游离酸度取值范围
3.游离酸度对环境和生物的影响
4.游离酸度控制方法
正文
一、游离酸度定义
游离酸度,又称为酸解离度,是指水溶液中酸分子或离子的浓度。
它是表征水溶液酸碱性强弱的一个重要指标,通常用来衡量水体的污染程度。
二、游离酸度取值范围
游离酸度的取值范围一般在0-100umol/L之间。
其中,游离酸度小于10umol/L的水体,通常被认为是清洁的;游离酸度在10-50umol/L之间
的水体,属于中等污染程度;游离酸度超过50umol/L的水体,则被认为
是严重污染的。
三、游离酸度对环境和生物的影响
游离酸度对环境和生物的影响主要表现在以下几个方面:
1.对水体的影响:游离酸度高的水体,其酸碱性强,对水生生物的生长和繁殖产生不利影响,同时也会影响水质,进一步影响人类的生活和健康。
2.对土壤的影响:游离酸度高的土壤,会影响土壤的肥力和结构,导致土壤贫瘠,影响农作物的生长。
3.对生物的影响:游离酸度高的环境,会影响生物的生长和繁殖,严
重时可能导致生物死亡。
四、游离酸度控制方法
针对游离酸度过高的问题,我国采取了一系列的控制措施,包括:
1.加强环保法规的制定和实施,从法律层面上规范和约束企业的排污行为。
2.推广清洁生产技术,减少生产过程中酸的生成和排放。
3.加强环保设施的建设和运行,对产生的酸性废水进行有效处理,降低其对环境的影响。
4.加强环境监测,定期对水体、土壤的游离酸度进行监测,及时发现和处理问题。
总酸度,游离酸度的测定方法确定磷化液的总酸度和游离酸度的酚酞指示剂和溴酚蓝指示剂该如何配制?浓度是多少,用什么做溶剂,酒精还是蒸馏水?
酚酞:酚酞 1g,加乙醇 100ml 溶解即得溴酚蓝:取溴酚蓝 0.1g,加 0.05mol/L 氢氧化钠溶液 3.0ml 溶解,水稀释至 200ml,即得.
本法采用酸碱滴定法.取试样 10mL,用 0.1mol/L 氢氧化钠标准溶液滴定, 所消耗的毫升数用点数表示. A1 试剂氢氧化钠:0.5mol/L 标准溶液(按 GB601 配制和标定); 酚酞指示剂:1%乙醇溶液; 甲基橙指示剂:0.1%水溶液; 溴酚兰指示剂:1g 溶于 1000mL20%乙醇中. A2 试验方法 A2.1 游离酸度的测定用移液管吸取 10mL 试液于 250mL 锥形烧瓶中, 加 50mL 蒸馏水, 加 2-3 滴甲基橙指示液 (或溴酚兰指示液).用氢氧化钠标准液滴定至溶液呈橙色(或用溴酚兰指示液滴定至由黄变为蓝紫色)即为终点,记下消耗氢氧化钠标准液毫升数 A. A2.2 总酸度的测定用移液管吸取 10mL 试液于 250mL 锥形烧瓶中, 加 50mL 蒸馏水, 加 2-3 滴酚酞指示液. 用氢氧化钠标准液滴定至溶液呈粉红色, 即为终点.记下消耗氢氧化钠标准液毫升数 B. A3 计算方法酸度点数按下列公式计算: 游离酸度(点)= ……………….(A1) 总酸度(点)= ………………….(A2) 式中:A,B——滴定时耗去氢氧化钠标准液毫升数,mL; C——氢氧化钠标准液实际浓度,mol/L; V——取样毫升数,mL. 磷化液中总酸与游离酸的定义与皮膜品质关系按照检验的方法可以测试出总酸度(TA)与游离酸度(FA),而酸比(AR) =总酸度(TA)/游离酸度(FA). 因此,总酸度和游离酸的关系的表示方式就是"酸比". 一,总酸与游离酸的关系是的, 总酸和游离酸的关系的简单表示方式就是"酸比".可是仅仅谈酸比这样的指针性问题的同时, 还有很多的意义是必须让大家了解,因为这是品质与管理的直接关系. 大家都知道酸比是浓度管理的依据,实际上除了浓度外,还有温度和时间也是同时必须管理的, 这三个因素是整体磷化的反应机构中不可或缺的.一般磷化的场合, 温度和时间基本是固定的控制着, 所以直接影响磷化品质的因素就只有浓度. 然而浓度的稳定性是由原料和制造工艺来决定的, 在浓度里大做文章就会产生很不一样的磷化品质, 甚至会产生不一样的磷化成本.最近有很多的朋友问过这样的问题真是不胜枚举,全部都是根本的问题,所以对于总酸度(TA)与游离酸度 (FA)的定义,必须使大家都能明确了解才行. 二,酸比的作用酸比的作用是和温度及皮膜有关,一般在讨论酸比时
是以固定的总酸度而言,随着游离酸度的变化而产生不同的酸比.正确的酸比是:酸比大(10~30)则温度低(50℃~常温),酸比小(5~7)则温度高(70~90℃).而酸比大温度高或酸比小温度低时,则磷化反应无法顺利完成.除了特殊的场合外,基本上酸比大时则皮膜薄,酸比小时则皮膜厚. 皮膜的重量,厚度和总酸度呈正比关系,但是必须考虑所有物质的平衡性,所以并不是无限制的皮膜量,不是因为总酸度高或处理时间长就可以得到重的皮膜. 因为在磷化皮膜生成的过程中,主要是溶液的酸碱度(PH 值)达到平衡时,反应就会逐渐停止, 这可以从反应的气泡由大变小的过程得知,因此皮膜的生成就会逐渐完成. 一般处理物为钢铁时,其反应机构如下: 1.化学反应(化) 铁+磷酸(游离酸)→磷酸二氢铁(铁分)+氢气(气泡) ......(1) ↓↓ ↓〔促进剂〕↓〔促进剂〕↓└→水 (2)
└→磷酸铁(淡黄色沉渣).........(3) 2.皮膜生成反应(成) 磷酸二氢锌→磷酸锌(H皮膜)+磷酸...............(4) 铁(离子)+磷酸二氢锌→磷酸锌铁(P皮膜)+磷酸........(5) 三,磷化液的制作原理这里是要谈到磷化液的制作过程,其实并不是很难的.有的家庭作坊仍旧使用磁器的水缸以人工生产;好点的使用塑料桶,小桶的用人工,大桶的用搅拌机;而生产量比较大的使用不锈钢反应釜.总之,先不论制作品质,大家应该知道磷化液的制作是很简单的, 而且发现除了国际知名的大公司外,从事这种工作的大都没有化工基础,只会偷工减料大赚黑心钱,所以磷化液的品质一直为人所诟病. 制作磷化液的三大基础原料是 1.磷酸(70~85%)2.硝酸(40~98%)3.氧化锌(99.5~99.7%) 依混合酸化学反应的先后顺序,则磷化液的化学反应式为: 1. 硝酸+氧化锌→硝酸锌+水2.磷酸+氧化锌→磷酸+磷酸二氢锌+磷酸锌 +水所以磷化液的组成=磷酸+磷酸二氢锌+磷酸锌+硝酸锌+水注:按《化工产品物性辞典》解释 1.磷酸二氢锌为白色结晶或黏稠状液体,溶于水和酸,水溶液呈酸性.为磷化皮膜剂的主要成分,用于钢铁的防腐蚀.
2.磷酸锌为无色斜方结晶或白色微晶粉末,溶于无机酸(盐酸,硫酸,硝酸, 磷酸);不溶于乙醇;水中几乎不溶,其溶解度随温度上升而减少. 要先知道磷化液的制作原理, 才能推演总酸和游离酸的定义.大家从磷化液的组成(磷酸+磷酸二氢锌+磷酸锌+硝酸锌+水)里可以得知游离酸和总酸了. 没错,游离酸就是——磷酸,真的很简单!那么,总酸呢? 四,总酸与游离酸的定义其实,游离酸的定义除了99%来自磷酸外,还有 1%来自磷酸二氢锌,不过只用磷酸来定义游离酸也是可以
的. 现在大家应该可以知道总酸的定义=磷酸+磷酸二氢锌+磷酸锌+硝酸锌,为什么?一一解释如下:(化学常识) 1.磷酸→有游离酸和总酸,而且酸比约为 2 2.磷酸二氢锌→主要是总酸,几乎没有游离酸 3.磷酸锌→只有总酸 4.硝酸锌→只有总酸再接再厉的来谈谈这些总酸所延伸出来的作用, 那么对磷化液就更可以清晰如纯净水了. 五,皮膜品质整个磷化的反应过程里, 处理温度和处理时间的管理可以说是物理性质,而浓度的管理是和皮膜品质产生直接性密切关系的化学性质,这是众所周知的事实.因此, 特别要剖析浓度的奥妙给大家知道,因为这样的磷化技术已经开始普及到每个地区,甚至于普及到每个工厂.原因是现行环境的趋势,为了将磷化工艺成本 (磷化液的危险品运输+包装=1000~2000 元/吨)降至最低(零),所以由每个使用单位自行制作磷化液的机制开始运作起来, 所以必须了解磷化液的制作技术以及基本原理. ◎制作技术:按照使用量分别是锌锭法与氧化锌法或锌钙法. 1.氧化锌法——磷化液(指比重为 1.54)的使用量为每月 15 吨以下的适用. 2.锌锭法——磷化液(指比重为 1.54)的使用量为每月 15 吨以上的适用. 3.锌钙法——磷化液(指比重为 1.54)的使用量为每月 10 吨以上且拉拔变形小的适用. ◎基本原理:总酸与皮膜品质关系 1.磷酸→与钢铁反应产生氢离子消费,带动反应的酸碱值上升. 2. 磷酸二氢锌→为磷化皮膜的唯一成分, 因反应的酸碱值上升而生成皮膜结晶. 直接对皮膜的厚薄及品质发生唯一的变化, 所以是考虑加工适用性 (加工变形量) 的重点. 3.磷酸锌→为无效成分,因此必须在制作过程中避免产生,以减少损失. 4.硝酸锌→在反应过程中担任安定的作用,稳定磷化工作液的组成,兼具初级的氧化平衡,防止磷酸二氢锌因反应过程变成磷酸锌的悬浮沉渣(异常沉渣). 有关现场操作问题是比较复杂的,要以个案的类别不同而有许多的讨论空间,所以不能在此提出解释.。